Introducción
Los áfidos son plagas agrícolas a nivel mundial, que causan daños económicos a muchos cultivos —directamente— por la actividad de alimentación e —indirectamente— por la transmisión de virus a plantas (Blackman & Eastop, 2000). Myzus persicae (Sulzer) (Hemiptera: Aphididae) es uno de los áfidos más polífagos, pudiéndose desarrollar en más de 400 especies de plantas (Blackman & Eastop, 2000). Este insecto se reproduce por partenogénesis cíclica, que alterna varias generaciones provenientes de la reproducción asexual que ocurre sobre una gran diversidad de plantas hospederas secundarias durante la primavera y el verano (Blackman & Eastop, 2007). El pulgón verde del duraznero —como se le conoce vulgarmente— tiene un ciclo de vida anual, que presenta una generación sexual en Prunus persica (L.) Batsch (Rosaceae), hospedante primario, en el que se producen huevos de hibernación sexual en otoño y se alterna con muchas generaciones asexuales (hembras únicamente) durante primavera-verano en varias plantas herbáceas (hospedantes secundarios) (Charaabi et al., 2008).
Rouger, Reichel, Malrieu, Masson y Stoeckel (2016) señalan que la diversidad genética de la población en especies con ciclos de vida complejos es difícil de anticipar; el modelo desarrollado por dichos autores demostró que la partenogénesis cíclica tiene efectos específicos en la diversidad genética neutral y son diferentes de otros modos reproductivos (es decir, sexualidad completa, clonalidad completa). En este sentido, y como lo sustentan diferentes estudios, las poblaciones de M. persicae que se reproducen mediante partenogénesis cíclica presentan una mayor variabilidad genética que las poblaciones con partenogénesis obligada y alternancia entre el hospedante primario y secundarios (Blackman, Malarky, Margaritopoulos, & Tsitsipis, 2007).
La distancia geográfica entre dos sitios de muestreo no influye en la variabilidad genética, pero sí puede ser determinante en las diferencias genéticas entre las poblaciones analizadas. Se ha observado que poblaciones de M. persicae presentan mayor diferenciación genética en sitios separados por 120 km o más (Fenton, Malloch, Navajas, Hillier, & Birch, 2003; Guillemaud, Mieuzet, & Simon, 2003; Vorburger, Lancaster, & Sunnucks, 2003; Wilson, Sunnucks, Blackman, & Hales, 2002; Zamoum et al., 2005). Sin embargo, la variabilidad genética de una población de M. persicae puede ser influenciada por otros factores, tales como el flujo génico entre poblaciones de una localidad a otra, que a su vez puede depender de las condiciones ambientales de dichas localidades (Vorbuguer et al., 2003); la presencia de individuos especializados sobre algún hospedante, y la alternancia entre el hospedante primario y los secundarios (Blackman et al., 2007; Kasprowicz, Malloch, Pickup, & Fenton, 2008; Margaritopoulos, Malarky, Tsitsipis, & Blackman, 2007). No obstante, varios estudios indican que la disponibilidad de P. persica como hospedante primario influye más sobre la variabilidad genética de persicae (Fenton, Kasprowicz, Malloch, & Pickup, 2010; Guillemaud et al., 2003; Margaritopoulos, Malarky, et al., 2007; Wilson et al., 2002; Zamoum et al., 2005) que la distancia geográfica que pueda existir entre dos o más localidades de estudio (Sánchez, Spina, Guirao, & Cánovas, 2013).
El principal método para el control de las poblaciones de áfidos a nivel mundial es el uso de insecticidas químicos (Dewar, 2007). Pero ya se ha registrado resistencia a diferentes productos químicos en diversos países (Devonshire et al., 1998; Fenton, Margaritopoulos, Malloch, & Foster, 2010; Voudouris et al., 2016). Para el control de M. persicae en la agricultura chilena, se utilizan productos de los grupos carbamatos, organofosforados, piretroides y neonicotinoides (Servicio Agrícola y Ganadero, 2012). Los estudios en Chile sobre resistencia a insecticidas en M. persicae se han realizado con genotipos colectados esporádicamente en amplios rangos geográficos (Castañeda et al., 2011; Fuentes-Contreras et al., 2013), pero sin tener en cuenta variables como la planta hospedera, las diferentes localidades y regiones geográficas analizadas, o las interacciones entre estas. Aunque se ha evaluado la variabilidad genética y la presencia de mecanismos de resistencia de M. persicae a una escala espacial de huerto, considerando los hospedantes primario y secundario durante una temporada agrícola (Rubiano-Rodríguez et al., 2014), hasta la fecha no hay estudios que permitan relacionar la variabilidad genética neutral y la frecuencia de mecanismos de resistencia a una escala regional, teniendo en cuenta los disímiles hospedantes (primarios y secundarios) y las diferentes localidades.
El presente estudio tuvo como objetivo evaluar la diversidad genética neutral y la presencia de mutaciones en el canal de sodio (kdr y super kdr) y la acetilcolinesterasa ( mace ) que confieren resistencia a insecticidas en M. persicae, provenientes de huertos de duraznero (hospedante primario), campos de pimentón Capsicum annuum var. grossum (L.) Sendtn. y algunas de las arvenses asociadas (hospedantes secundarios) en 12 localidades en Chile central: seis en la región de O'Higgins y seis en la región del Mau
Materiales y métodos
Lugar del estudio y toma de muestras
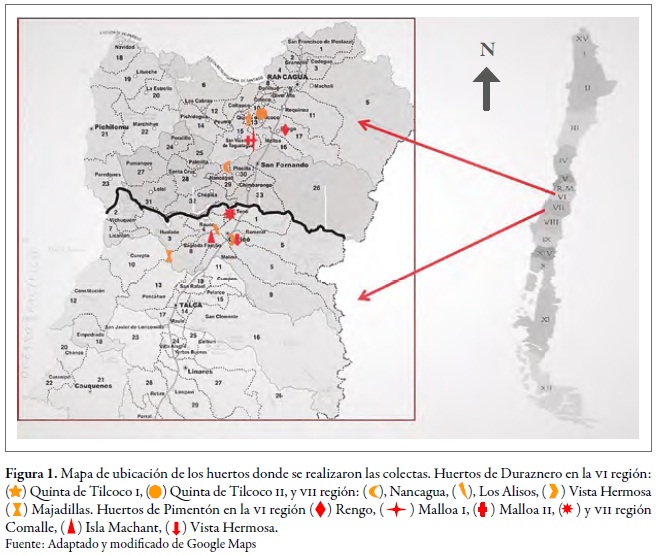
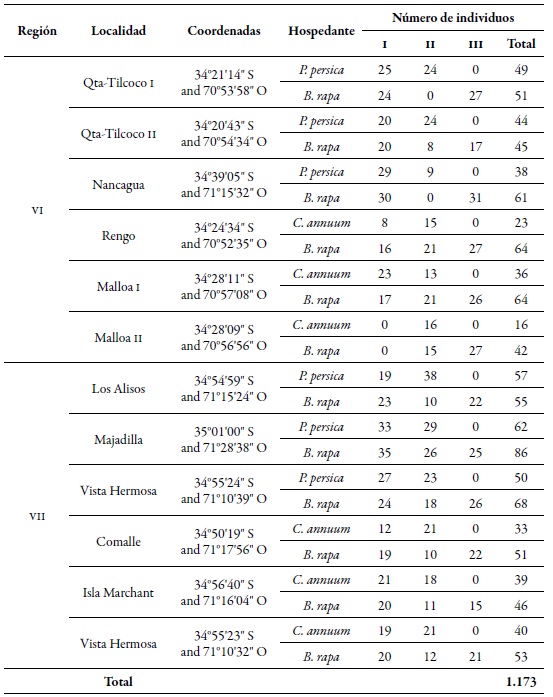
El trabajo se realizó en las regiones de O'Higgins (VI) y del Maule (VII), en Chile central; en cada una de estas regiones se seleccionaron seis huertos: tres de duraznero y tres con cultivos de pimentón, bajo un sistema de manejo de plagas convencional (aplicación regular de insecticidas). La distancia más cercana de los huertos entre regiones fue entre Comalle, de la región del Maule, y Nancagua, de la región de O'Higgins, separadas aproximadamente por 21 km. Los huertos de Majadilla, en la región del Maule, y Qta- Tilcoco II, en la región O'Higgins, fueron los más distanciados entre sí, con 90 km entre ellos aproximadamente (figura 1). En cada sitio se tomaron muestras al azar en 20 puntos; en cada punto, se colectaron cinco individuos ápteros o alados del pulgón verde del duraznero en tres momentos de muestreo: primavera (I), verano-otoño (II) e invierno (III), durante la temporada agrícola 20102011 (tabla 1). Además, se colectó el mismo número de individuos en Brassica rapa L. (Brassicaceae), asociada en cada uno de los huertos. Las muestras se conservaron en alcohol al 90 %, y los individuos fueron identificados mediante la clave para M. persicae descrita por Blackman y Eastop (2007).
Genotipifación
El análisis de genotipificación fue realizado en el laboratorio del Instituto de Ecología y Evolución, de la Universidad Austral de Chile. En total se genotipificaron 1.010 individuos con la técnica de marcadores microsatélites. Se utilizaron siete loci microsatelite (Myz2, Myz3, Myz9, Myz25, M35, M37 y M40), que se han descrito y utilizado ampliamente para estudios de genética de poblaciones de M. persicae (Fuentes-Contreras, Figueroa, Reyes, Briones, & Niemeyer, 2004; Kasprowicz et al., 2008; Malloch et al., 2006; Margaritopoulos, Malarky et al., 2007; Vorburger, 2006; Wilson et al., 2002). El adn genómico (ADNg) se obtuvo a partir de cada individuo mediante el método salting-out (Sunnucks & Hales, 1996). El ADNg extraído fue cuantificado mediante espectrofotometría (Nanodrop ND-1000) y se evaluó su calidad mediante electroforesis en geles de agarosa 0,8 %, teñidos con bromuro de etidio, con lo que se pudo observar la intensidad de las bandas bajo luz ultravioleta ( uv ). Cuando la calidad del ADNg fue deficiente, se tomaron individuos de la misma muestra que se habían almacenado y se extrajo nuevo ADNg para tal fin.
La genotipificación de los individuos se realizó mediante la técnica de marcaje con fluoróforo (Schuelke, 2000), y la determinación de los tamaños alélicos se desarrolló mediante análisis de fragmentos en un secuenciador automático en Macrogen Inc. (Corea). Para determinar el ancho de las bandas, los datos fueron analizados por medio de electroferogramas, con el programa Genemarker V.1.3 (Borodovsky & McIninch, 1993). Posteriormente, se evaluó la presencia de alelos nulos o errores de genotipificación con el software Micro-Cheker V.2.2.3 (Van Oosterhout, Hutchinson, Oills, & Shipley et al., 2004).
Tabla 1. Ubicación de las localidades, número de individuos de M. persicae por hospedante y momento de muestreo de colecta, en las regiones de O'Higgins (VI) y Maule (VII), durante la temporada agrícola 2010-2011Momentos de muestreo: primavera (I), verano-otoño (II), e invierno (III).
Fuente: Elaboración propia
Detección de mutaciones de resistencia
La identificación de mutaciones se realizó usando la tecnología de PCR en momento de muestreo real (qRT-PCR), mediante ensayos de discriminación alélica ABI Taqman. Las mutaciones kdr y súper kdr se identificaron mediante el método descrito por Anstead, Williamson, Eleftherianos y Denholm (2004), mientras que la identificación de la mutación mace se realizó según el protocolo descrito por Anstead, Williamson y Denholm (2008). Ambos métodos hacen uso de la actividad 5'-exonucleasa de la Taq polimerasa para cuantificar secuencias específicas en una muestra. Para cada mutación se utilizaron dos sondas diferentes (con y sin mutación), marcadas con un fluoróforo en el extremo 5'' (fam o hex) y un apagador (quencher) en el extremo 3'. La hidrólisis de la sonda separa al fluoróforo de esta, que al estar separado del apagador emite una fluorescencia característica, representando la secuencia presente en el adn al cual se alineó (cADN).
La reacción de pcr se desarrolló en un volumen total de 11,9 μL por individuo constituido por 6,25 μL de TaqMan® Universal pcr Master Mix (Applied Biosystems), 1,5 μL de cebador F, 1,5 μL de cebador R, 0,5 μL de sonda S (condición de susceptibilidad), 0,5 μL de sonda R (mutación de resistencia), 0,5 μL de dna (25 μg/μL) y 1,75 μL de H2O ultrapura. Tanto para las mutaciones kdr como para las súper kdr, las sondas de susceptibilidad fueron marcadas con el fluoróforo fam, que posee una longitud de onda de excitación de 492 nm y una longitud de onda de emisión de 517 nm, por lo que se lo considera un emisor verde, mientras que las de resistencia se marcaron con el fluoróforo hex, que posee una longitud de onda de excitación de 535 nm y una longitud de onda de emisión de 556 nm, por lo que se lo considera un emisor amarillo. En cambio, para la mutación mace la sonda de susceptibilidad fue marcada con hex y la de resistencia con fam. Las reacciones de PCR se llevaron a cabo en un termociclador Stratagene Mx 3000 P, usando un perfil térmico que consistió en una etapa inicial de 2 min a 50 °C, 16 min-40 seg a 95 °C, seguidos de 40 ciclos consistentes en 15 seg a 92 °C y 1 min a 60 °C; finalmente, 15 seg a 72 °C, midiéndose en esta última etapa la fluorescencia de cada reacción.
Análisis de datos
Todos los individuos colectados se analizaron como genotipos multilocus (mlg), es decir, fueron genotipos que amplificaron los siete loci utilizados en la genotipificación. La diversidad genética se calculó usando la diversidad genética gruesa (dgg), basada en la proporción n/N, donde n representa el número total de mlg y N, el número total de individuos analizados en las muestras. Los análisis se realizaron utilizando una sola copia de cada mlg para todas las variables evaluadas (localidad, periodo y hospedante), debido a que la “amplificación” clonal no es igual en todos los genotipos y puede llevar a desviaciones del equilibrio de Hardy-Weinberg (hwe) dentro de las muestras, distorsionando así las estimaciones de las frecuencias alélicas (Sunnucks, De Barro, Lushai, Maclean, & Hales, 1997). Por ejemplo, cuando el análisis se hizo para la variable localidad se dejó una copia por localidad del mismo mlg y, así, sucesivamente con todas las variables. Las frecuencias alélicas, la proporción de alelos nulos, la heterocigocidad observada (Ho) y esperada (He), las desviaciones del equilibrio de Hardy-Weinberg (hwe) y el desequilibrio de ligamiento (Fis) entre el conjunto de datos, se analizaron con la prueba exacta de Fisher, implementada en Genepop V.3.2A (Raymond & Rousset, 1995). La riqueza alélica (Rs = número de alelos independientemente del tamaño de la muestra), se calculó usando el programa FStat V.2.9.3.2 (Goudet, 1995). Además, se realizó un análisis molecular de varianza (Amova), utilizando el programa Arlequin V.2.0 (Schneider, Roessli, & Excoffier, 2000).
La estructura genética del set de datos se realizó mediante un análisis de clúster bayesiano mediante el programa Structure V.2.3.2 (Pritchard, Stephens, & Donnelly, 2000). El número de poblaciones (k) utilizadas estuvo en un rango de 1 a 10, con 10 corridas para cada k, 100.000 burn in y 106 iteraciones en la cadena de Markov Monte Carlo. El número de grupos genéticos se determinó basado en el criterio de ΔK de Evanno, Regnaut y Goudet (2005), usando Structure Harvester.1
Con el fin de identificar si había grupos genéticos que se compartían entre las diferentes variables, se realizaron cuatro análisis por separado en cada una de las mimas así: i) región, ii) momentos de muestreo, iii) hospedante/región, y iv) hospedante/momento de muestreo. Los individuos fueron asignados a cada grupo cuando su probabilidad de pertenencia fue >0,8. La diferencia en la frecuencia de mutaciones de resistencia a insecticidas (kdr, súper kdr y MACE) entre mlg (usando tanto copias únicas como múltiples) provenientes de diferentes regiones, hospedantes y momento de muestreo, se evaluó a través del empleo de tablas de contingencia y la prueba de chi cuadrado (χ2). Las comparaciones múltiples entre las frecuencias de mlg se realizaron mediante la prueba de Marascuilo con el empleo del programa estadístico XLStat-Pro 7.5 (Addinsoft, Nueva York, EE. UU.).
Resultados y discusión
Distribución de genotipos y diversidad genética
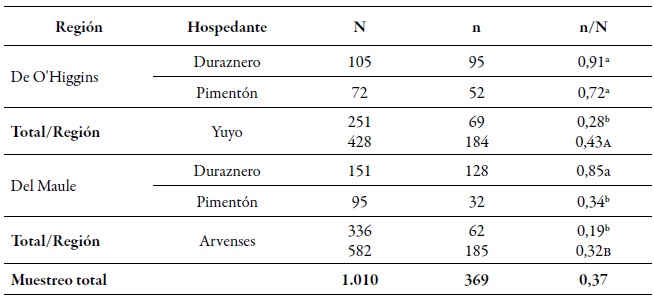
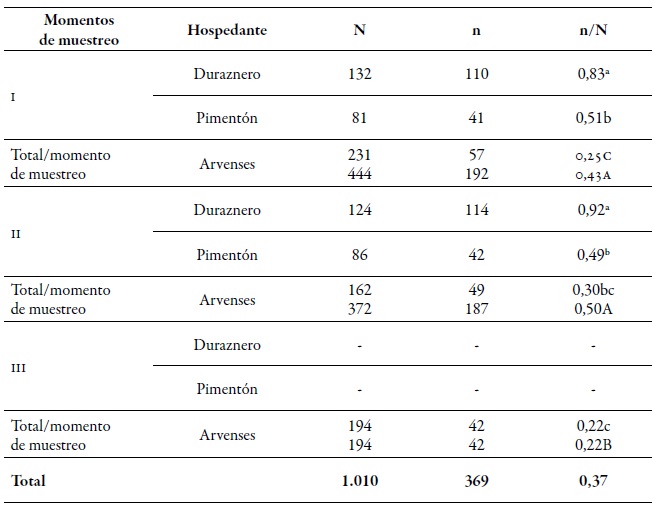
Del total de individuos analizados, se encontraron 368 genotipos multilocus (mlg). A nivel espacial, la diversidad genética gruesa (dgg) fue estadísticamente superior en la región de O'Higgins (0,43) que en la región del Maule (0,32) (tabla 2). Estos resultados son consistentes a los informados por Rubiano-Rodríguez et al. (2014), quienes evaluaron la diversidad genética a nivel de huerto en las mismas regiones de colecta. A nivel temporal, la dgg de los periodos I y II (0,43 y 0,50, respectivamente) fue mayor que la del periodo III (tablas 2-3). La DGG de P. persicae fue estadísticamente superior en su hospedante primario, tanto espacial como temporalmente a la de los otros dos hospedantes (tablas 2-3), lo que se puede explicar de dos maneras. En primer lugar, este fenómeno pudiera estar relacionado con el ciclo reproductivo holocíclico-heteroico del pulgón verde del duraznero, en el que a inicios de la primavera se congregan individuos que provienen de diferentes orígenes, tales como la eclosión de fundatrices, migración de algunos mlg que pasaron el invierno en hospedantes secundarios y el regreso de las hembras virginóparas que darán origen a las hembras ovíparas ápteras para la reproducción sexual (Blackman & Eastop, 2007). Es por eso que, al presentarse la reproducción sexual, existe mayor flujo genético, dando como resultado mayor presencia de genotipos diferentes sobre el duraznero.
Un segundo análisis pudiera estar orientado a una menor abundancia de M. persicae sobre duraznero en comparación con C. annuum y B. rapa. Los datos de abundancia poblacional no son directamente comparables entre un árbol (P. persica) y plantas herbáceas de menor tamaño (C. annuum y B. rapa), debido a que sobre el duraznero solo es posible encontrar individuos del pulgón a mediados de primavera y finales de otoño, mientras que en los hospedantes secundarios se pueden encontrar durante todo su ciclo vegetativo, y en el caso de las arvenses, como B. rapa, durante todo el año.
Tabla 2. Número de áfidos analizados (N), número de mlg (n) y el índice de diversidad genética gruesa (dgg) de Myzus persicae (n/N) en las regiones de O'Higgins y Maule, sobre los diferentes hospedantes durante la temporada agrícola 2010-2011Letras minúsculas diferentes indican diferencias significativas según la prueba de χ2 en comparación múltiple de Marascuilo entre todas las proporciones. Letras mayúsculas diferentes indican diferencias significativas según la prueba de χ2 en comparación múltiple de Marascuilo entre las proporciones totales regionales.
Fuente: Elaboración propia
Tabla 3. Número de áfidos analizados (N), número de mlg (n) y el índice de diversidad genética gruesa (dgg) de Myzus persicae (n/N) en los tres momentos de muestreo sobre los diferentes hospedantes durante la temporada agrícola 2010-2011Letras minúsculas diferentes indican diferencias significativas según la prueba de χ2 en comparación múltiple de Marascuilo entre todas las proporciones. Letras mayúsculas diferentes indican diferencias significativas según la prueba de χ2 con comparación múltiple de Marascuilo entre las proporciones totales de los momentos de muestreo.
Fuente: Elaboración propia
A nivel espacial, la región de O'Higgins presentó la mayor dgg, lo que puede estar relacionado con que esta región posee mayor área cultivada con duraznero que la región del Maule. Hay varios reportes que indican que la mayor diversidad genética de M. persicae se encuentra en aquellas zonas o áreas donde predomina el cultivo de su hospedante primario, siendo esta la única especie vegetal donde este áfido presenta la reproducción sexual (Fenton, Kasprowicz et al., 2010; Guillemaud et al., 2003; Margaritopoulos, Malarky et al., 2007; Wilson et al., 2002; Zamoum et al., 2005). Del total de mlg encontrados, 71 genotipos eran múltiples, es decir, genotipos que se encuentran más de una vez en diferentes localidades y diferentes momentos de muestreos, de los cuales el 42 % estaba presente en las dos regiones. De todos los mlg, se encontraron 10 que se denominan comunes, ya que son los más frecuentes y se hallan en las dos regiones, en los tres momentos de muestreo evaluados y en los tres hospedantes (tabla 4). Estos mlg más frecuentes en su mayoría no presentaron los mecanismos de resistencia evaluados, a excepción de los mlg G039 y G239 que fueron heterocigotos resistentes (rs) para kdr, el G272 que fue rs para mace, y el G119 RS para los tres mecanismos (tabla 4).
El número de mlg encontrados en este estudio a nivel regional es algo superior a los resultados del estudio a nivel de huerto (Rubiano-Rodríguez et al., 2014), lo que se puede adjudicar a que en este estudio se incluyó un mayor número de huertos (tres de cada cultivo por región). Si hacemos una comparación con estudios en otros países, el número de mlg encontrados en nuestro estudio es mayor, por ejemplo: en España, estudios sobre pimentón, arvenses, almendro y una pocas muestras de durazneros encontraron 289 (Sánchez et al., 2013); en Australia, se encontraron 72 en brócoli (Vorburger, 2006); en Nueva Zelanda, en papa, se encontraon 23 (Van Toor et al., 2008), y en Escocia, sobre cultivos de papa y brócoli, se encontraron 21 (Kasprowicz et al., 2008). Esto también se debe a que en la mayoría de estos estudios los individuos analizados provenían principalmente de hospedantes secundarios, en los que la diversidad genética es generalmente baja.
En estudios realizados por Guillemaud et al. (2003) en Francia, con áfidos procedentes de árboles de duraznero, se encontraron 100 mlg, siendo estos resultados menores al informado en este estudio. Este resultado se puede deber a que, al utilizar trampas de succión en las colectas, se puede capturar individuos provenientes de diferentes hospedantes; también pudiera estar asociado al tamaño de la muestra, pues fue relativamente bajo en comparación con el tamaño de la muestra del presente estudio. Cuando los muestreos o colectas se hacen en el hospedante primario, podemos encontrar resultados similares, tal como sucedió en un estudio realizado en Grecia e Italia en zonas con y sin producción de duraznero, en el que el número de mlg fue similar al de nuestro estudio con 482 mlg (Blackman et al., 2007).
Tabla 4. Detalle de los diez mlg más comunes encontrados en el presente estudio y su respectivo perfil de resistencia. Número de áfidos caracterizados para determinado mlg (N) en las Regiones de O'Higgins y Maule en los tres momentos de muestreo sobre los diferentes hospedantes durante la temporada agrícola 2010-20111 Hospedantes: Durazno (D), Pimentón (P), y Arvenses (M). 2 Momentos de muestreo: primavera (I), verano-otoño (II) e invierno (III).
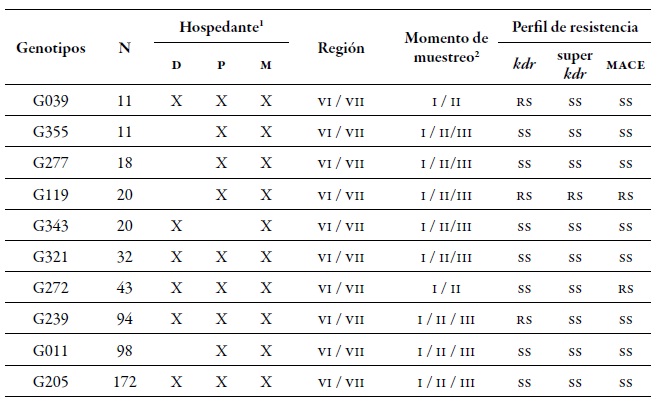
Fuente: Elaboración propia
Los siete loci microsatélite en este estudio fueron polimórficos, con un número promedio de alelos que van de 5,7 a 7,7, en la región de O'Higgins, y de 6,4 a 6,9, en la región del Maule. La He y Ho fueron muy similares en todas las poblaciones de las dos regiones (tabla 5), lo que indica que estas poblaciones se encontraban en hwe. Los valores de Fis fueron significativos, pero relativamente bajos, lo que indicó un bajo nivel de endogamia entre las poblaciones (tabla 5). Aunque estos resultados suelen ser frecuentes en poblaciones con reproducción sexual o con partenogénesis cíclica, también es posible observar valores de Fis fuertemente positivos para especies altamente clónales (lo que ocurre en M. persicae durante la mayor parte de su ciclo de vida), si la mutación domina sobre la deriva genética (Rouger et al., 2016). En el caso de desequilibrio de ligamiento, pocos pares de loci fueron significativos en las muestras de P. persica y C. annuum en las dos regiones. Algo similar ocurrió cuando se analizó la variable “momento de muestreo”. En las muestras provenientes de Brassica rapa hubo mayor número de pares de loci con desequilibrio de ligamiento significativo (tabla 5). La presencia de hwe y los bajos niveles de endogamia (Fis), así como los bajos niveles de desequilibrio de ligamiento, apoyan la teoría e importancia de la reproducción sexual en Chile.
Tabla 5. Índice de diversidad genética por región. Promedio del número de alelos (N), riqueza alélica (Rs = número de alelos independiente del tamaño de la muestra), heterocigocidad observada (Ho) y esperada (He), valor Fis y la proporción de pares que fueron significativos en la prueba de desequilibrio de ligamiento (DL)* Valores significativos para p < 0,01.
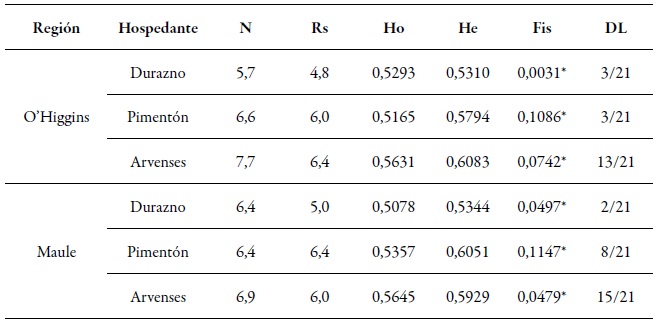
Fuente: Elaboración propia
Otros estudios realizados en Chile demuestran que las poblaciones de M. persicae están en hwe, sospechando la presencia de reproducción sexual (Fenton, Margaritopoulos et al., 2010; Rubiano-Rodríguez et al., 2014). Además, durante este estudio se logró observar la presencia de morfos sexuales y huevos, que fueron recolectados y observados en laboratorio, donde se pudo observar la cópula y, posteriormente, la emergencia de fundatrices. Lo anterior ratifica la relación positiva que existe entre la diversidad genética del pulgón verde del duraznero y su hospedante primario P. persica. Según Fenton, Margaritopoulos et al. (2010), la diversidad genética de M. persicae se puede mantener durante la dispersión hacia hospedantes secundarios en invierno y el regreso a su hospedante primario en primavera.
Nuestros resultados difieren con algunos otros estudios realizados a nivel mundial con M. persicae, en los que informan que las poblaciones estudiadas no están en hwe, por ejemplo, en Francia (Fenton et al., 2003; Guillemaud et al., 2003), Australia (Wilson et al., 2002) y en Grecia (Margaritopoulos, Malarky et al., 2007). Esto podría deberse a que las poblaciones analizadas en estos estudios fueron colectadas sobre hospedantes secundarios principalmente, donde no ocurre la reproducción sexual, siendo este tipo de reproducción uno de los supuestos para que una población se encuentre en hwe.
Diferenciación genética entre las poblaciones
Los resultados del Amova entre regiones mostraron que hay diferenciación genética significativa (0,28%) entre las dos regiones evaluadas (tabla 6), pero no hay diferencias genéticas significativas de las poblaciones, entre las localidades de la misma región. Sin embargo, sí se encontró diferenciación genética significativa de los individuos dentro de las localidades (6,97 %), mientras que la mayor variación genética se encontró dentro de los individuos (92,67 %). Los resultados del Amova, cuando los hospedantes fueron considerados como el componente principal del análisis (tabla 6), indicaron un bajo pero significativo porcentaje de variación genética entre hospedantes (1,37 %). Cuando se analiza la contribución de las localidades teniendo en cuenta el mismo hospedante, el porcentaje de variación en este nivel no fue estadísticamente significativo. Se observó un porcentaje de diferenciación genética (6,31 %) altamente significativa entre individuos dentro de las localidades, y la mayor variación genética se sigue presentando dentro de los individuos (92,34 %). Según los resultados obtenidos durante el estudio, la variación genética entre las poblaciones de M. persicae que se presenta en Chile está más determinada por la especie de la planta (hospedante) y no por el lugar o la distancia geográfica que pueda existir entre los sitios de colectas.
El bajo pero significativo porcentaje de variación genética encontrado en este estudio a nivel de región puede indicar algún grado de especialización logrado por algunos genotipos de M. persicae sobre ciertas plantas. Estudios precedentes en Chile habían informado algún grado de especialización de M. persicae sobre tabaco (Fuentes-Contreras et al., 2004; Margaritopoulos, Skouras et al., 2007). También en España Sánchez et al. (2013) registraron la abundancia de un genotipo de M. percicae sobre Solanum physalifolium.
Los valores de fst en este estudio indican que las poblaciones que se recolectaron sobre las arvenses en las dos regiones fueron genéticamente diferentes a las poblaciones recolectadas en los cultivos (duraznero y pimentón), lo que concuerda con lo registrado por Vialatte, Dedryver, Simon, Galman y Plantegenest (2005), quienes indican que las poblaciones del áfido de la espiga Sitobion avenae Fabricius (Hemiptera: Aphididae), recolectadas sobre plantas no cultivables, generalmente son genéticamente diferentes a las recolectadas sobre plantas cultivables.
En el análisis de diferenciación genética por pares de poblaciones, considerando regiones y hospedantes, se encontraron algunas diferencias significativas (tabla 7). Es así como las poblaciones colectadas sobre duraznero en las dos regiones (D-VI y D-VII) y sobre pimentón de la región de O'Higgins (P-VI) mostraron una diferenciación genética por pares (fst) significativa con respecto a poblaciones colectadas sobre las arvenses (M-VI y M-VII) de las dos regiones (tabla 7). Además, el fst entre las poblaciones colectadas sobre durazno en la región del Maule (D-VII) también fue significativo, comparado con las poblaciones colectadas sobre pimentón (P-VI) de la región de O'Higgins (tabla 7). El análisis bayesiano de la estructuración genética de las poblaciones reveló que, cuando se consideraron las variables momentos de muestreo, hospedante/región y hospedante/momentos de muestreo, la mejor partición del conjunto de datos fue de dos grupos genéticos (K = 2) (figuras 2a, b, c); sin embargo, cuando los datos se analizaron según las regiones se encontraron tres grupos genéticos (K = 3) (figura 2d).
Tabla 6. Análisis de la varianza molecular de M. persicae comparando muestras entre regiones y hospedantesFCT: coeficiente de diferenciación genética entre regiones; FSC: coeficiente de diferenciación genética entre poblaciones en las regiones; FST: coeficiente de diferenciación genética entre todas poblaciones; FIS: grado de endogamia; FIT: diferenciación genética entre subpoblaciones.
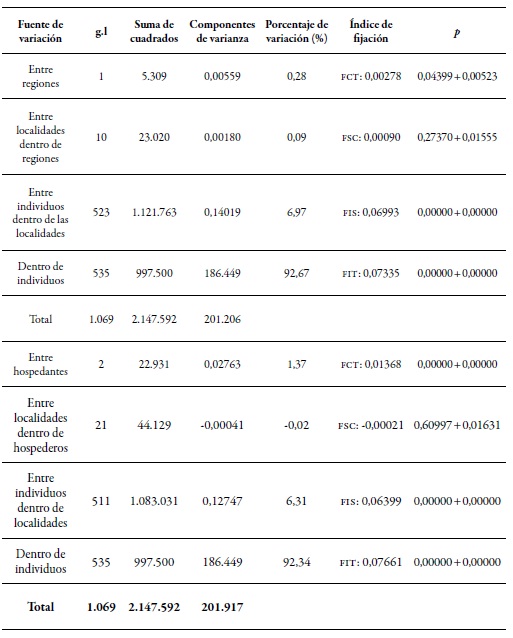
Fuente: Elaboración propia
Tabla 7. Diferenciación genética por pares (FST) entre las muestras de M. persicae según región y hospedante1 Durazno (D) y Pimentón (P), Arvenses (M), Región de O'Higgins (VI) y Región del Maule (VII). Los valores FST se muestran bajo la diagonal. Los valores de probabilidad basados en 999 permutaciones se muestran sobre la diagonal.
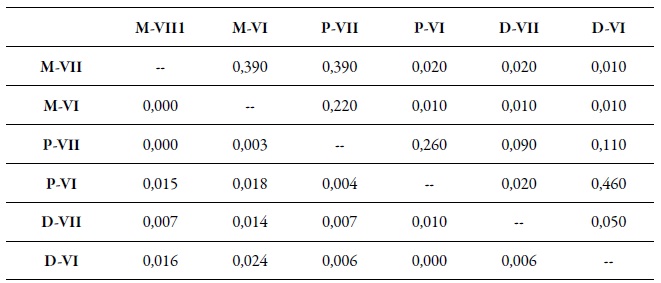
Fuente: Elaboración propia
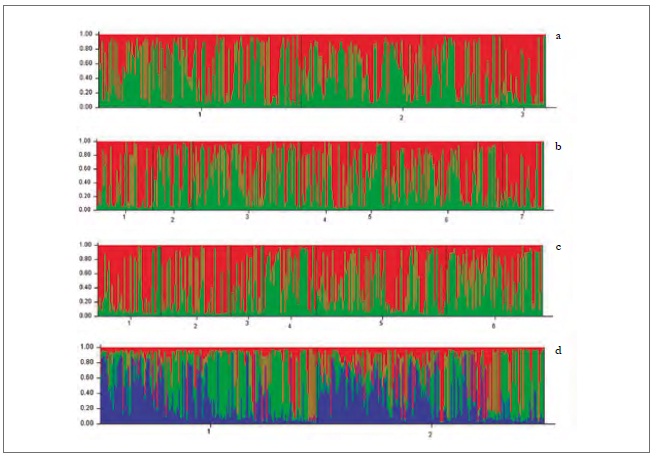
Fuente: Elaboración propia
Figura 2. Grupos genéticos de M. persicae en Chile central, detectados por Structure, según las variables momentos de muestreo (a) y hospedante/momentos de muestreo (b), hospedante/región (c) y región (d).
No se pudieron asociar todos los grupos genéticos identificados para los análisis realizados a ninguna de las variables evaluadas y sus combinaciones posibles (momentos de muestreo, hospedante/momentos de muestreo y hospedante/región), lo que podría deberse, en primer lugar, a que M. persicae es la especie de áfido con mayor número de hospedantes secundarios informados, que juegan un papel importante como fuente de migración hacia los cultivos, permitiendo así que el insecto se pueda trasladar de un hospedante a otro en busca de alimento y mejores condiciones (Margaritopoulos, Tsourapas, Tzortzi, Kanavaki, & Tsitsipis, 2005).
En segundo lugar, la existencia de la reproducción sexual en las poblaciones del áfido en Chile contribuye a un alto flujo génético entre las poblaciones de M. persicae, tanto en hospedantes secundarios como en regiones a través del momento de muestreo (Fenton, Margaritopoulos et al., 2010). Al parecer puede existir mayor número de grupos genéticos en poblaciones con bajo flujo génico y menos en poblaciones con alto flujo génico (Guillemaud et al., 2003; Vialatte et al., 2005; Vorbuger, 2006). Esto se debe a que el flujo génico se da cuando hay reproducción sexual, resultando progenie con diferenciación genética, mientras que la progenie proveniente de reproducción asexual es de bajo flujo, generando clones idénticos con igual información genética. Por lo tanto, podríamos inferir que estos grupos de poblaciones encontrados no tienen mlg con propiedades biológicas diferentes y no proporcionan ningún significado biológico evidente.
Tabla 8. Proporción de MLG y su perfil de resistencia en los tres mecanismos evaluados en las regiones de O'Higgins (VI) y Maule (VII) durante primavera (I), verano-otoño (II), e invierno (III) de la temporada agrícola 2010-2011.
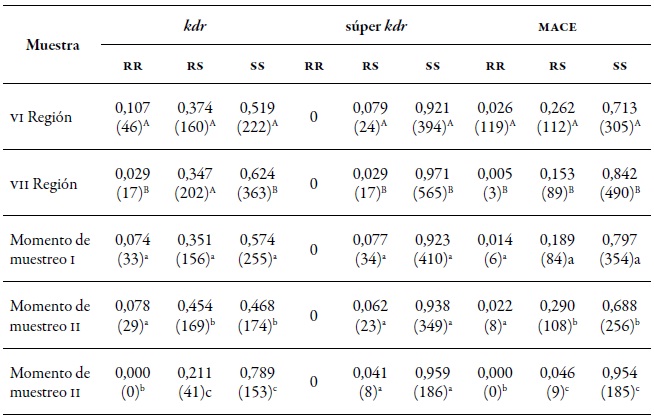
Nota:En paréntesis el número de MLG. Letras mayúsculas diferentes indican diferencias significativas según la prueba de χ2 en comparación múltiple de Marascuilo entre las regiones. Letras minúsculas diferentes indican diferencias significativas según la prueba de χ2 en comparación múltiple de Marascuilo entre los momentos de muestreo.
Fuente: Elaboración propia
Resistencia a insecticidas
En las dos regiones estuvieron presentes los tres mecanismos de resistencia evaluados (kdr, súper kdr y mace). En la región de O'Higgins, los tres mecanismos tuvieron frecuencias levemente superiores a las de la región del Maule (tabla 8), destacándose kdr con 10,9 % de homocigotos (rr) y 29,4 % de heterocigotos (rs). La mutación súper kdr solamente se presentó en forma rs en un 6 % del total de los mlg identificados y, en el caso de mace, fue un 2,2 % rr y 18,5 % rs (figura 3A). A nivel espacial, los mlg de la región de O'Higgins tienden a presentar mayor frecuencia de genotipos con resistencia heterocigota en los tres mecanismos evaluados y resistencia homocigota en kdr y mace que en la región del Maule (figura 3a, tabla 8); mientras que en primavera (I) y verano-otoño (II), las frecuencias de los mlg y los diferentes mecanismos de resistencia fueron similares en forma homocigota (rr), siendo estadísticamente diferentes a las frecuencias en invierno (III).
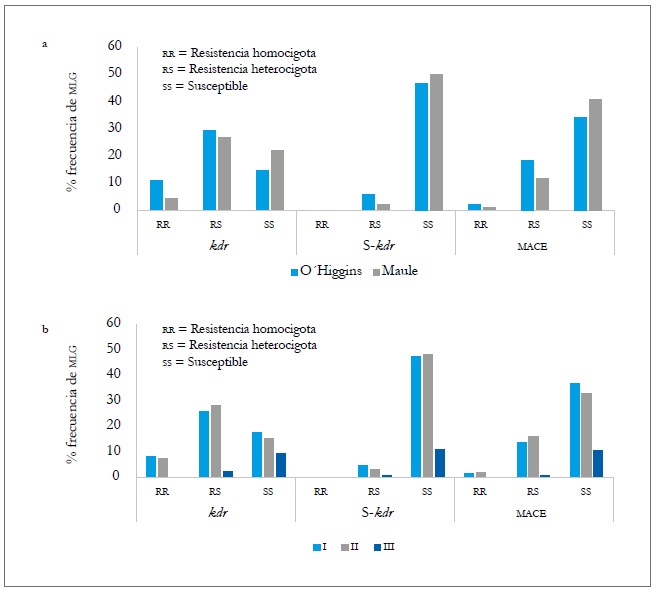
Fuente: Elaboración propia
Figura 3. Frecuencias de MLG con los tres mecanismos de resistencia evaluados según región (a) y momentos de muestreo (b) durante la temporada agrícola 2010-2011. I = Primavera-verano, II = Verano-Otoño, y III = Invierno.
En el caso de la forma heterocigota (rs), las frecuencias en los tres momentos de muestreo presentaron diferencias significativas en los tres mecanismos evaluados (figura 3b y tabla 8). A nivel de hospedante, las poblaciones colectadas sobre los cultivos principales (durazno y pimentón) fueron las que presentaron mayor frecuencia de genotipos con algún mecanismo de resistencia, ya sea en forma heterocigota u homocigota, tanto temporal como espacialmente. De estos dos hospedantes, el duraznero es el que tiende a presentar con más frecuencia de forma general genotipos con algún mecanismo de resistencia, sin llegar a ser significativo (figura 4a y b). La presencia de los tres mecanismos de resistencia evaluados, ya sea de forma homocigota o heterocigota en varios de los mlg, podría deberse a las aplicaciones de insecticidas en la parte aérea de las plantas, a las que están sometidas las plantaciones para el control de plagas agrícolas. De ahí que, en los huertos de duraznero, exista mayor presión de selección por el número de aplicaciones de insecticidas (entre 9 y 12) para el control de M. persicae y otras plagas, mientras que en el cultivo de pimentón oscilan entre cuatro y seis.
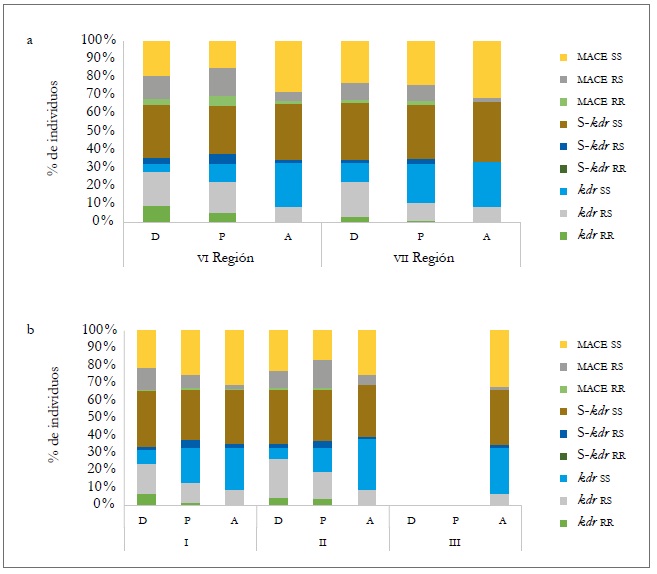
Fuente: Elaboración propia
Figura 4. Composición porcentual de los individuos en los diferentes mecanismos de resistencia entre regiones (a) y momento de muestreo (b) para los diferentes hospedantes: durazno (D), pimentón (P), y arvenses (A) en la temporada agrícola 2010-2011.
Los grupos de insecticidas mayormente utilizados en dichos campos y que están relacionados con estos mecanismos de resistencia son piretroides, relacionado con kdr y súper kdr (Eleftherianos, Foster, Williamson & Denholm, 2008; Martínez-Torres, Foster, Field, Devonshire & Williamson, 1999), y carbamatos, relacionados con mace (Moores, Devine & Devonshire, 1994; Nabeshima, Kozaki, Tomita, & Kono, 2003). También se realizan aplicaciones de neonicotinoides; de acuerdo con Bass et al. (2011), la resistencia a este tipo de insecticida está asociada a una mutación en la subunidad beta del receptor nicotínico de la acetilcolina. Aunque este mecanismo de resistencia no fue evaluado en este estudio, es importante tenerlo en cuenta en futuras investigaciones.
Los tres mecanismos estudiados han sido identificados con anterioridad en poblaciones de M. persicae en Chile (Castañeda et al., 2011) y en otros países tales como Grecia (Margaritopoulos, Skouras et al., 2007), EE. UU. (Srigiriraju, Semtner, Anderson & Bloomquist, 2010), Francia (Fontaine et al., 2011) y Nueva Zelanda (van Toor, Malloch, Anderson, Daoson, & Fenton, 2008). La mínima presencia de mlg con el mecanismo de resistencia súper kdr se puede deber a que este mecanismo únicamente se manifiesta en algunos genotipos que presentan el mecanismo de resistencia tipo kdr (Anstead et al., 2008), que fue baja en este estudio. La mayor presencia de genotipos rs, principalmente en mace y kdr, se puede deber a la influencia de la forma holocíclica de reproducción del pulgón verde del duraznero, en la que la reproducción sexual disminuye la proporción de homocigotos y heterocigotos resistentes (Fenton, Kasprowicz et al., 2010).
La disminución de genotipos con presencia de algún mecanismo de resistencia al final de la temporada agrícola puede estar relacionada a los costos de la resistencia. Tal como lo indican Fenton, Margaritopoulos et al. (2010), genotipos de M. persicae con presencia de algún mecanismo de resistencia bajan su potencial reproductivo. Además, existen evidencias de que varias especies de insectos con resistencia a insecticidas reducen su supervivencia y su habilidad reproductiva, además de ser más vulnerables a enemigos naturales (Abbas, Khan & Shad 2015; Castellanos et al., 2019; Guedes, Smagghe, Stark, & Desneux 2016; van Toor et al., 2013). De acuerdo con la prueba de χ2, la frecuencia de los tres mecanismos de resistencia fue dependiente de la región de estudio, estando más asociados a la región de O'Higgins para kdr (copias únicas χ2=15,9 y df=2, p < 0,001 y copias múltiples χ2 = 29,4 y df = 2, p < 0,001), súper kdr (copias únicas χ2 = 7,5 y df = 1, p < 0,01 y copias múltiples χ2 = 12,9 y df = 1, p < 0,001) y mace (copias únicas χ2 = 9,9 y df = 2, p < 0,01 y copias múltiples χ2 = 27,4 y df = 2, p < 0,001). Con respecto al momento de muestreo, súper kdr no fue dependiente del momento de muestreo en el análisis con copias únicas (χ2 = 1,7 y df = 2, p = 0,4221), pero sí fue del momento de muestreo con copias múltiples, estando asociados principalmente a verano-otoño (II) (χ2=13,5 y df=2, p < 0,005), al igual que en los otros dos mecanismos, kdr copias únicas (χ2 = 40,8, df = 4, p < 0,001 y copias múltiples χ2 = 55,9, df = 4, p < 0,001) y MACE (copias únicas χ2 = 13,2 y df = 4 y p < 0,05, copias múltiples χ2 = 56,1 y df = 4, p < 0,001).
Un conjunto de 13 mlg fueron considerados importantes debido a la combinación de mecanismos de resistencia que presentaron (tabla 9). Entre ellos se destacó el G119, ya que fue encontrado en las dos regiones, en los tres momentos de muestreo y sobre hospedantes secundarios (pimentón y B. rapa) en forma heterocigota (rs) para los tres mecanismos de resistencia evaluados. Este mismo genotipo fue destacado entre los 10 mlg más comunes (tabla 4). Otro genotipo que es importante destacar por su nivel de resistencia es G276, que fue homocigoto resistente (rr) en kdr y mace, aunque fue colectado únicamente sobre pimentón en primavera. Los genotipos G26, G65, G128 y G353 fueron rr, rs y rs en kdr, súper kdr y mace, respectivamente (Tabla 9).
Estos resultados indican la importancia de implementar en Chile estrategias de manejo que eviten el incremento de la frecuencia de individuos con algún mecanismo de resistencia, dentro de las cuales la rotación de insecticidas con diferentes modalidades de acción tiene un rol importante.
Tabla 9. Detalle de los genotipos con mayor presencia de mecanismos de resistencia encontrados en este estudio en las regiones de O'Higgins (VI) y Maule (VII)1 Hospedantes: Durazno (D), Pimentón (P), y Arvenses (M). 2 Momentos de muestreo: primavera (I), verano-otoño (II), e invierno (III).
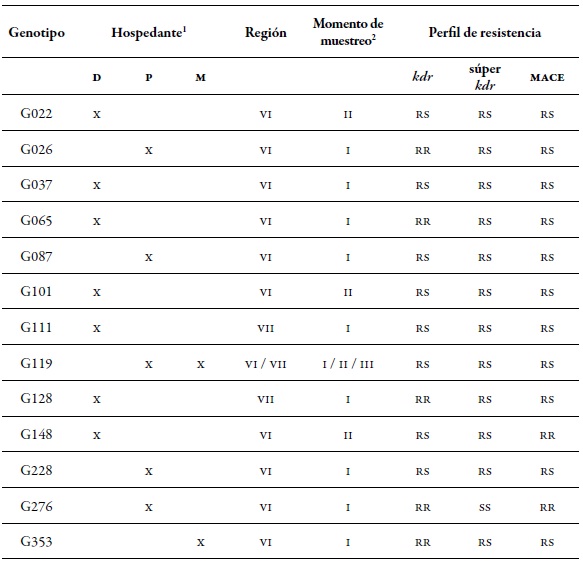
Fuente: Elaboración propia
De igual forma, en la implementación de manejo integrado de plagas (mip) racional, se deben regular las aplicaciones de insecticidas de acuerdo con el monitoreo, disminuyendo así el número de aplicaciones. El uso de insecticidas verdes y el mantenimiento de plantas hospederas que alberguen individuos susceptibles libres de la acción de los insecticidas puede disminuir el nivel de resistencia cuando migran al hospedante primario y participan de la reproducción sexual. Por último, pero no menos importante, es conveniente aumentar la fauna benéfica, mediante la conservación de enemigos naturales en corredores biológicos, ya que los áfidos con mutaciones que confieren resistencia se convierten en presas fáciles para sus enemigos naturales.
Conclusiones
La diversidad genética neutral de M. persicae, tal como lo ha registrado la literatura, sigue siendo más alta en poblaciones colectadas sobre su hospedante primario P. persica que en las colectadas sobre otros hospedantes secundarios (pimentón y arvenses). Este resultado está ligado estrechamente a la ocurrencia de la reproducción sexual del insecto sobre el hospedante primario. Por la gran disponibilidad de su hospedante primario por área sembrada en la región de O'Higgins, fue en esta región donde se presentó mayor diversidad genética. Esto permite inferir que varios de los genotipos encontrados están estrechamente relacionaos con su hospedante primario. En Chile central existen genotipos con los tres mecanismos de resistencia evaluados, pero en forma predominantemente heterocigota. El hospedante principal (duraznero) de M. persicae alberga la mayor cantidad de genotipos con al menos un mecanismo de resistencia. Esto se debe principalmente al uso generalizado de insecticidas químicos para el control del pulgón verde del duraznero, que imponen una presión de selección superior a la natural; de ahí que estén altamente asociados a los mecanismos de resistencia evaluados.











 text in
text in