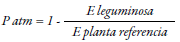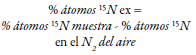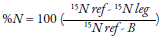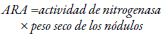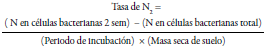Introducción
Las moléculas nitrogenadas que tienen importancia en la nutrición de las plantas son el nitrato y el amonio, cuya disponibilidad se relaciona con la aplicación de fertilizantes químicos y orgánicos, y por las transformaciones del nitrógeno en el suelo por efectos físicos, químicos y biológicos. La fijación de este elemento (N) la realiza un grupo de bacterias simbióticas (como rizobios formadores de nódulos de la raíz) y diazótrofos no simbióticos (de vida libre) (Angel et al., 2018). No obstante, es posible que la eficiencia en su fijación se pierda por factores ambientales, de manejo, integridad y número de los nódulos de las plantas, y por el tipo de microorganismo asociado a la raíz (Chalk & Craswell, 2018). Por ello, surge la necesidad de analizar la dinámica de este elemento desde su fijación para el diseño e implementación de estrategias que permitan aprovechar el proceso biológico y reducir la aplicación de fertilizantes sin sacrificar el rendimiento productivo de los cultivos. Sin embargo, existen varias limitantes para cuantificar la fijación del nitrógeno, por ejemplo, el grado de complejidad del proceso, costos y sensibilidad de las técnicas, equipos de alta tecnología, mano de obra calificada, disponibilidad de reactivos, entre otros.
Dentro de los métodos utilizados se destacan las técnicas de última generación como identificación de genes nifH, 16S rRNA (Rampadarath, Bandhoa, Puchooa, Jeewon, & Bal, 2017); los métodos de dilución de isótopos de nitrógeno; uso de espectros de reflactancia hoja/dosel para identificar 15N, y técnicas menos precisas como diferencia del N total, balance del N en el sistema, diferencia de N total en las plantas, masa nodular, suministro de carbohidratos a la raíz, contenido de ureidos, reducción de acetileno, modificaciones del Kjeldahl (Yan et al., 2017), contenido de Leg-hemoglobina en nódulos y el ensayo GlnLux a partir de sensores que detectan glutamina (Thilakarathna & Raizada, 2018). No obstante, en campo la forma práctica de relacionar la absorción eficiente de nitrógeno es con la producción de materia seca (Mondal, Datta, & Mondal, 2017), el número de hojas/tallos (Bilal, Ayub, Tariq, Tahir, & Nadeem, 2017) y la producción de biomasa verde (Bionda, Babini, Martino, Salas, & Lajmanovich, 2018; Dutta, Datta, & Mandal, 2017).
El interés en el análisis del ciclo del nitrógeno y los agentes que intervienen en su emisión y fijación mediante el uso de técnicas de laboratorio se relaciona con el alto costo de la urea y fertilizantes utilizados en campo para la siembra y la pérdida de moléculas nitrogenadas tanto por lixiviación como por volatización, que contribuyen a la contaminación de la atmósfera y el agua. Esto ha impulsado el estudio de procedimientos más eficientes para el análisis de los flujos de la entrada y salida del nitrógeno en los sistemas agropecuarios, aunque también se han utilizado en otros sectores económicos, principalmente en la industria. El objetivo de este trabajo fue presentar una revisión de las principales técnicas utilizadas para cuantificar la fijación del nitrógeno con énfasis en los antecedentes, procedimientos, expresiones matemáticas que se usan y escenarios futuros.
Materiales y métodos
Búsqueda en bases de datos
Se hizo una búsqueda sistemática de artículos, libros, series de libros y conferencias publicados en la base de datos Scopus a nivel mundial, mediante la ruta de búsqueda: TITLE-ABS-KEY (techniques fixation of nitrogen and bacteria), que incluye los documentos en cuyo título, resumen y palabras clave aparecen los descriptores de interés separados por los conectores booleanos “of ” y “and”.
Procesamiento y análisis de los datos
El número de publicaciones se organizó en Microsoft Office Excel® por año y se analizaron los principales países y áreas en las que se ha trabajado el tema desde 1967 hasta el 2018. La evaluación de la tendencia mundial de publicación por año se realizó con el sofware SigmaPlot12®, mediante la predicción de curvas de regresión no lineal, en el que la variable independiente correspondió al tiempo y la variable dependiente al número de publicaciones; los modelos empleados fueron los siguientes: sigmoidal 3-4 parámetros, logístico 4, gompertz 3, hill 3-4 parámetros con un p-valor < 0,05. Se corroboró la independencia de los datos con el estadístico Durbin Watson y normalidad con Shapiro-wilk. Para determinar las técnicas que continúan vigentes y las tendencias a nivel mundial, solo se tuvieron en cuenta artículos publicados en el periodo comprendido entre 2016 y 2018, a partir de la metodología de revisiones sistemáticas (Pai et al., 2004), en la que los criterios de inclusión de los artículos fueron los siguientes: artículos publicados con una antigüedad no mayor a tres años, en revista indexada con la descripción y nombre genérico de la técnica, mientras que el criterio de exclusión fue literatura no indexada y generalidad de los métodos utilizados. En total se analizaron 50 artículos.
Resultados y discusión
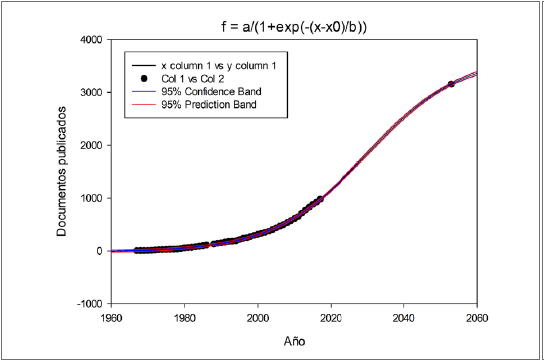
Se encontró que existen 1.016 documentos publicados en la base de datos Scopus distribuidos en artículos (967), libros (22), series de libros (22) y conferencias (5) desde 1967 y hasta el 2018. Además, las técnicas de fijación de nitrógeno se han aplicado desde 1967 con tendencia regular y su máximo uso fue en el 2017. La pertinencia de estas radica en su utilidad para analizar la eficiencia del uso del nitrógeno por los diferentes emisores y captadores en el ecosistema, como estrategia para hacer más eficientes los sistemas productivos y empresariales desde el punto de vista ambiental. Por ello, hacen parte de una tecnología que tiene un crecimiento que se ajusta a un modelo sigmoidal y cuyo punto declive se estima hacia el 2053 (R2 = 0,99; p < 0,01) por ser el punto de inflexión con mayor ajuste (R2) y cuyo valor Durbin Watson estuvo más cercano a 2; sin embargo, puede ser antes o después de dicha fecha, debido a la poca diferencia entre los valores de R2, ya que hay una complejidad en la dinámica de evolución de cualquier tecnología como resultado de la rápida madurez o el desarrollo de innovaciones (tabla 1).
Tabla 1 Modelos de regresión no lineal para la ecuación “techniques fixation of nitrogen and bacteria” analizados desde 1967
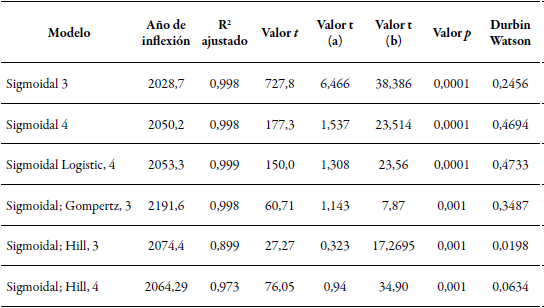
Nota: el estadístico t y los valores a y b pertenecen a los diferentes modelos logísticos.
Elaboración propia
Esta variación en el punto de declive que tiende a prolongarse indica que estas técnicas se encuentran en una fase de innovación, que se caracteriza por una curva en la que la mayoría de los datos se agrupan al inicio del modelo, de acuerdo con la interpretación que se le da a la curva en S como herramienta para el análisis del ciclo de vida de un producto. Por esa razón, los esfuerzos de las empresas deben ir encaminados a fortalecer sus técnicas, realizar inversiones masivas para conservar el mercado y mantener su posicionamiento frente a nuevos competidores (Aguilar et al., 2012) (figura 1), de modo que las técnicas utilizadas para cuantificar la fijación de nitrógeno aún no han llegado a un punto de equilibrio durante el tiempo, y la difusión de sus procedimientos se realiza desde los países desarrollados, que es en donde se ostenta su propiedad; sin embargo, las técnicas más aplicadas en los países menos desarrollados corresponden a las más económicas y sencillas por la menor disponibilidad de recursos.
Elaboración propia
Figura 1. Curva de predicción de publicaciones, programa Sigmaplot (SigmoidalLogistic4).
El modelo de predicción en curvas en S muestra un rápido crecimiento, es decir que las técnicas utilizadas para cuantificar la fijación de nitrógeno se encuentran en pleno desarrollo y es posible que surjan nuevos competidores con novedades en los procesos más económicos y de fácil adopción (Aguilar et al., 2012), debido a que la mayor limitante en su aplicación es el alto costo y la poca adaptabilidad directa en campo. De este modo, los países que usan con mayor frecuencia las técnicas de última generación son los países desarrollados, mientras que en países menos desarrollados como los latinoamericanos siguen implementando las técnicas más antiguas, porque su aplicación está limitada por la tecnología (tabla 2); por ejemplo, Colombia cuenta con una participación de tan solo el 0,68 % a nivel mundial.
Tabla 2. Países destacados por la mayor publicación de investigaciones en las que se han aplicado técnicas para cuantificar la fijación de nitrógeno
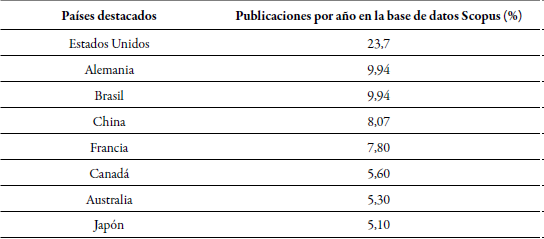
Elaboración propia
Sin embargo, su uso no se limita solo al área de agricultura y ciencias biológicas (32,02 %), sino también se han utilizado en inmunología y microbiología (24,60 %), química y genética (19,20 %), ciencias ambientales (9,79 %), medicina (5,01 %), ciencias de la tierra (2,02 %) entre otras (7,26 %). Lo anterior demuestra el creciente interés en la economía del nitrógeno y en determinar los agentes más eficientes en su fijación para reemplazar el uso de productos químicos e innovar con técnicas no destructivas. Se estima que a partir del año 2029 (predicho por el modelo Sigmoidal 3), que es el tiempo más cercano al periodo de análisis de las publicaciones (1967-2018), se pueda presentar un proceso de madurez en su desarrollo, por la cantidad de avances y productos en el mercado, de acuerdo con el ciclo de vida de las tecnologías que se resume en etapa de difusión inicial, etapa de crecimiento temprano, etapa de crecimiento tardío y etapa de conocimiento público (Aguilar et al., 2012).
Técnicas utilizadas para estimar la fijación del nitrógeno
Los métodos más antiguos para verificar la eficiencia del uso del nitrógeno en los cultivos se relacionan con la estimación de la producción de materia seca y la fijación de nitrógeno en las diferentes partes de la planta. Con el tiempo, los estudios se han enfocado en el análisis específico de los agentes que intervienen en el ciclo del nitrógeno, en especial el suelo (capas de diferente profundidad), las plantas (análisis de Rhizobium, nódulos, contenido de ureidos, medición de leghemoglobina) (Sainju, 2017) y los microorganismos, debido a que el proceso de fijación está directamente relacionado con acción biológica (diazótrofos de vida libre y en simbiosis). Las principales técnicas se resumen a continuación.
Tecnica de dilucion isotopica 15N
Se basa en la detección de isótopos en las fuentes de nitrógeno disponible para el crecimiento de las plantas (N-suelo, N- fertilizante y nitrógeno), a partir de la diferencia entre los isótopos que abundan naturalmente (15N) o que han sido adicionados o empobrecidos en el suelo o en el sustrato, lo que permite identificar en la planta el nitrógeno proveniente de las distintas fuentes (marcadas y no marcadas con el trazador 15N) (Braun et al., 2018).
La técnica de dilución isotópica 15N fue reportada por McAuliffe para estimar la proporción de nitrógeno fijado en las leguminosas por acción biológica (FBN), mediante la comparación con una planta de referencia que no fija, a partir de la diferencia en la concentración de átomos isotópicos cuando estas crecen en un suelo que ha sido enrriquecido con isótopos 15N (Chalk & Craswell, 2018), que son agregados en soluciones de 1 a 10 % de exceso al suelo o en el fertilizante (Kg N/ ha) (15NH4 y 15NO3), previo a la siembra en la misma cantidad para la planta que fija y la que no fija (Braun et al., 2018; Wambeke et al., 2018). De modo que en el método clásico se utiliza la siguiente ecuación para calcular el nitrógeno de origen atmosférico que ha sido fijado:
En donde E representa el porcentaje de átomos isotópicos 15N que han sido agregados en exceso (Chalk & Craswell, 2018). Esta técnica es costosa por el uso de espectrómetros de masas para la obtención de los gases y la identificación de los isómeros. Para ello, es común que se utilicen sistemas acoplados que consisten en un espectofotómetro conectado a un sistema de combustión (horno) (Hamawaki & Kantartzi, 2018). Sin embargo, como alternativa se ha optado por el uso de espectros de reflactancia hoja/dosel para identificar el isómero 15N (Thilakarathna, Moroz, & Raizada, 2017). El método se resume en la aplicación de soluciones con 1 a 10 % de exceso de átomos 15N al suelo (Braun et al., 2018; Wambeke et al., 2018) o en el fertilizante (Kg N/ha) previo a la siembra, y se estima la relación de isótopos en las plantas, en el suelo, en los microrganismos y en el aire. En plantas se cuantifica el 15N en muestras que se han secado, por ejemplo: en soya muestras de raíces, nódulos y semillas se han dejado a 70 °C por 72 horas (Hamawaki & Kantartzi, 2018). La detección del isótopo 15N es posible debido a su mayor peso (15 masa atómica) en comparación con los átomos de nitrógeno que se encuentran en la atmósfera (14 masa atómica), lo que permite que durante el proceso se separen y, posteriormente, sean colectados y cuantificados en el espectofotómetro. Para estimar el porcentaje de isótopos se puede utilizar la siguiente fórmula, en la que se tiene en cuenta el aporte de isótopos en el aire (0,3663 % átomos 15N) (Hamawaki & Kantartzi, 2018):
En cambio, para la evaluación de la masa microbiana se hacen aislamientos y se establecen modelos matemáticos (Hamawaki & Kantartzi, 2018). También es posible que se haga una incubación in situ para raíces y suelos en parafilm, a partir de la inyección de gas enriquecido con 15N, se reporta de 4,5 a 20 mL de gas 15N en relación con el aire del ambiente (Ritchie & Raina, 2016) y, al finalizar la incubación, las muestras se secan, se muelen y se pesan para luego determinar la concentracion de 15N. Sin embargo, existe la posibilidad de sobreestimar la fijación si no se tienen en cuenta cambios potenciales en la concentración del nitrógeno, como resultado de la desnitrificación, y si la forma comercial de isótopos utilizados se encuentra contaminada con otros gases que pueden ser absorbidos por plantas y microrganismos (Roley et al., 2018), aunque en un estudio, en el que se utilizó un marcador de 15N-NH4 + en cantidad de 10 % de átomos en la atmósfera para corroborar esta hipótesis, no se encontró ninguna relación, si bien no se descarta que la cantidad aplicada haya sido leve (Braun et al., 2018).
Algunas desventajas de la técnica son las siguientes:
1. Lixiviación del trazador 15N en las soluciones enriquecidas que se aplican al suelo, de modo que se necesita su reincorporación diaria, lo que incrementa costos de mano de obra.
2. En sistemas cerrados se pueden presentar fugas.
3. La distribución homogénea del material enriquecido (15N) en el suelo es difícil.
4. La asincronía en la captación de nitrógeno mineral por la leguminosa y la planta de referencia contribuyen a la obtención de resultados variantes (Chalk & Craswell, 2018)
5. El costo de los medios enriquecidos con isótopos 15N y de los equipos es elevado.
6. Consumo del trazador 15N-NH4 en muestras de suelo por efecto de la fijación en minerales arcillosos y sustancias húmicas, o por la absorción microbiana, lo que puede alterar los resultados (Braun et al., 2018)
7. Variación en el contenido de 15N en la planta durante las diferentes etapas de crecimiento (Hamawaki & Kantartzi, 2018) y fácil contaminación de medios artificiales como soluciones hidropónicas y el material soporte (arena, perlita o vermiculita o mezclas de estas, p.ej. 70 % de turba, 20 % de perlita y 10 % de vermiculita) (Hamawaki & Kantartzi, 2018).
Sin embargo, es el método recomendado para analizar la dinámica del nitrógeno en el suelo, de modo que según el enfoque del estudio se marca el producto objetivo en el análisis que en el caso de la mineralización es el NH4 con el trazador enriquecido (15N – NH4) (Braun et al., 2018).
Tecnica de abundancia natural (δ 15N)
Esta técnica se basa en la cuantificación de 15N disponible de forma natural en las plantas y en el suelo, derivado de la fijación atmosférica (De Carvalho et al., 2017), debido a que el fraccionamiento de 15N y el nitrógeno orgánico se observa durante la nitrificación (Chalk & Craswell, 2018); es decir, por baja absorción de nitrato debe haber una mayor concentración de isótopos en el suelo. Para ello, se establece la diferencia en el porcentaje de átomos de 15N entre el material evaluado y la abundancia natural de la atmósfera (0,3663 átomos %15N) (Fuertes-Mendizábal et al., 2018). Se utiliza la siguiente ecuación para estimar la proporción del nitrógeno fijado por la leguminosa derivado de la atmósfera (P atm) (Chalk & Craswell, 2018):
En donde β representa la abundancia de isótopos (15N) en la planta leguminosa, dependiente únicamente del proceso de fijación biológica del nitrógeno, 15N ref es la abundancia del isótopo 15N en la planta de referencia, y 15N leg es la abundancia del isótopo 15N en la leguminosa (Van Vugt, Franke, & Giller, 2018). Las muestras usadas son generalmente brotes que se secan a 65 °C durante 72 h o hasta alcanzar un peso constante. Posterior al secado se pesan, se mulen y se cuantifica el 15N en un espectrofotómetro de masas (De Carvalho et al., 2017), pero también se ha validado el uso de tejido de grano (2,5 mg), de modo que la eficiencia del nitrógeno fijado se puede estimar como kilogramo de grano producido por kilogramo de absorción de nitrógeno de brotes en la etapa de crecimiento (Polania, Poschenrieder, Rao, & Beebe, 2016). Algunas plantas fijadoras de nitrógeno tienen un valor de referencia (B): para fríjol de soya se reporta -2 ‰ (Van Vugt et al., 2018), -3,09 ‰ en brote, -2,44 ‰ en grano para los genotipos con hábito etapa de crecimiento II (Polania et al., 2016), aunque tambien se ha observado -0,80 ‰ (Van Vugt et al., 2018), y en gramíneas por lo general se usa como valor 0 (De Carvalho et al., 2017). Dichas diferencias en la misma especie ocurren porque dentro de la planta hay discriminación en la distribución de 15N en sus órganos (Polania et al., 2016). El método de abundancia natural solo funciona si el 15N de la leguminosa esta entre el valor ‘B’ y el 15N de la planta de referencia (Van Vugt et al., 2018). Además, es posible calcular la cantidad de nitrógeno acumulado por las plantas multiplicando el nitrógeno total por su biomasa, respectivamente (De Carvalho et al., 2017).
Por otra parte, también es posible establecer la cantidad de nitrógeno fijado por acción biológica, para lo cual se usan medios hidropónicos, arena u otro soporte esterilizado que no contenga nitrógeno, en ensayos controlados para establecer la abundancia de isótopos 15N, que son fijados y no tienen un origen diferente. También se han hecho ensayos en campo abierto en parcelas sin marcar y marcadas con el trazador 15N, con el objetivo de establecer la concentración de isótopos en las plantas en relación con su disponibilidad en el aire (Van Vugt et al., 2018). El 15N fijado por microorganismos varía en las leguminosas (Chalk & Craswell, 2018), debido a las diferentes especies de Rhizobium y el soporte utilizado que puede contribuir al grado de error, por la presencia de moléculas que aporten iones de amonio. En general, la técnica, tiene varios inconvenientes:
1. Se debe utilizar una planta de referencia que permita conocer la disponibilidad del isótopo 15N derivado del suelo para hacer estimaciones adecuadas.
2. Es necesario determinar el valor B, ya que difiere por especie y por el tipo de cepa asociada a la leguminosa, por lo que asumir valores de referencia no garantiza la exactitud de los resultados.
3. El tipo de planta y la muestra utilizada también son factores que influyen en esta técnica (Chalk & Craswell, 2018).
4. La abundancia del isótopo 15N en el suelo es variable, ya que factores como la lluvia influyen en su concentración debido a que es un mecanismo de reincorporación de este elemento al suelo (Polania et al., 2016).
Por ello, al aplicarse es ideal el uso de otras técnicas como la dilución isotópica y variaciones como rastrear el isótopo 15N en ARN microbiano con el uso de microespectectroscopía SIP-Raman, a partir de muestras incubadas durante tres días con bacterias diazótrofas y 15N; posteriormente, se hace la identificación de los microrganismos que fijan nitrógeno en su biomasa de una manera altamente sensible en entornos diversos. Si bien esta técnica no tiene la misma sensibilidad en todas las cepas microbianas que fijan nitrógeno en simbiosis y de vida libre (Angel et al., 2018), tiene como ventaja la alta precisión para estimar isótopos en el material evaluado por la sensibilidad de los equipos; además, como no es necesaria la aplicación de fertilizantes marcados con isótopos, es relativamente más económica que la técnica de dilución isotópica.
Metodo ARA (reduccion de acetileno)
A partir del descubrimiento de Schoöllhorn, Burris, y Dilworth en 1966 (Dilworth, 1966; Schoöllhorn & Burris, 1967) acerca de que la nitrogenasa reduce el acetileno (C2H2) a etileno (C2H4), se sugirió que la tasa de reducción de acetileno se puede usar como índice de la tasa de fijación de nitrógeno (Stewart, Fitzgerald, Burris, & Nov, 1967). Desde entonces, se utiliza esta técnica en la que se requiere de un cromatógrafo de gases y se reemplaza 10-20 % (Chauhan et al., 2017) del volumen del aire por acetileno en una cámara de incubación que se deja a 28-30 °C durante 2 a 5 días (Chauhan et al., 2017; Das & De, 2018; Yong et al., 2018). Asimismo, se pueden analizar plantas completas, suelo, muestras de nódulos y de bacterias (Camelo-Rusinque, Moreno-Galván, Romero-Perdomo, & Bonilla- Buitrago, 2017). Cuando se usan nódulos la fijación de nitrógeno se calcula con la siguiente ecuación (mL/h/planta) (Yong et al., 2018):
Cuando la muestra corresponde a bacterias, las cepas se cultivan en medios semisólidos (Nfb) en viales (García et al., 2017) por 5 días a 28 °C y se exponen a atmósferas con 10 % de acetileno durante 2 a 5 días; posteriormente, se hace la extracción de 1 mL de muestra y se analiza por cromatografía de gases (Chauhan et al., 2017). Una de las mayores limitantes en esta técnica se relaciona con la integridad de los nódulos de la planta para que no se altere la actividad de la nitrogenasa (Chalk & Craswell, 2018). Incluso el acetileno es considerado un tóxico para algunos microorganismos (Angel et al., 2018) y se requiere alta disponibilidad de plantas y suelo para que el análisis sea más confiable; sin embargo, dentro de las ventajas que ofrece esta técnica se destacan los siguientes aspectos: 1) es más económica que los métodos de dilución isotópica y abundancia natural; 2) el cromatógrafo de gases es un equipo menos complejo que un espectrofotómetro de masas, y 3) se pueden tener resultados más rápidos, reportándose reducciones de acetileno a etileno después de cinco segundos a 30 minutos (Stewart et al., 1967). Pero como desventajas se encuentran los siguientes: 1) es menos sensible y no se recomienda aplicarla en muestras donde la actividad diazotrófica es baja o esporádica, y 2) además se puede presentar fuga de gases durante la incubación (Angel et al., 2018).
Bioensayo microbiano
Esta técnica se desarrolló como alternativa a la técnica de reducción de acetileno por Das y De (2018), quienes aplican un enfoque directo para la cuantificación de nitrógeno fijado a partir del cultivo de bacterias diazotrofas en medio Jensen (composición: sacarosa 20 g/L, fosfato de dipotasio 1 g/L , sulfato magnésico 0,5 g/L , cloruro sódico 0,5 g/L, sulfato ferroso 0,1 g/L, molibdato sódico 0,005 g/L, carbonato cálcico 2 g/L, agar 15 g/L).
Para ello, se toman muestras de suelo de los primeros 5 cm en el área que se va a analizar y se transportan en refrigeración; luego, son tamizadas y una parte es secada en estufa hasta obtener su peso constante y 10 g de muestra representativa se lava con solución isotónica de tampón fosfato y se filtra. A partir de esta suspensión, se hace una dilución en serie hasta 10-4 y 1 mL se inocula en medio Jensen y se incuba durante dos semanas a 30 °C, procedimiento que se repite 10 veces para garantizar la obtención de colonias puras; después, la cantidad de nitrógeno de las células microbianas se determina por el método de oxidación catalítica a alta temperatura (HTCO) y la tasa de fijación de nitrógeno se estima con la siguiente ecuación:
En donde las células bacterianas totales se calculan a partir de la multiplicación entre el número de colonias y la cantidad de bacterias encontradas (Das & De, 2018). Los autores indican que existe una correlación positiva entre este método y el ensayo ARA, pero también observaron que, al ser una técnica directa, la cuantificación de nitrógeno fijado es mayor en comparación con ARA, aunque aún faltan más ensayos que corroboren su sensibilidad. Otras ventajas de esta técnica son las siguientes: 1) menor costo, ya que no se utilizan equipos complejos, y 2) sirve para analizar cualquier tipo de suelo (Das & De, 2018). Sin embargo, la mayor limitante es que es una técnica demorada, ya que los resultados se obtienen después de 140 días aproximadamente, y pueden presentarse problemas de contaminación; además, es posible que no toda la masa microbiana fijadora de nitrógeno se pueda recuperar en este medio (Das & De, 2018).
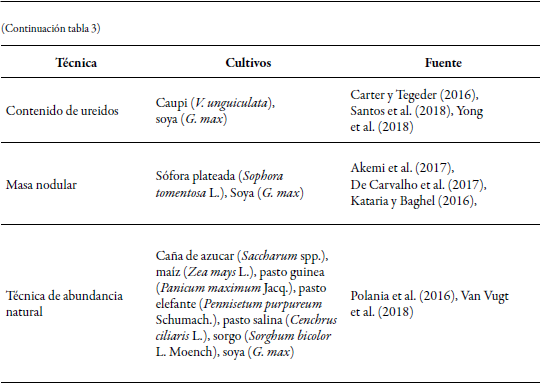
Contenido de ureidos
En las leguminosas exportadoras de ureido, el nitrógeno fijado por los rizobios dentro de los nódulos radiculares se asimila en el aminoácido glutamina (Gln) y se metaboliza en los ureidos alantoina y ácido alantóico, cuya importación hacia el xilema se hace a partir de ureido permeazas (UPS1) (Carter & Tegeder, 2016; Santos et al., 2018); luego, se distribuyen en la planta, pero se acumulan en mayor proporción en tallos (Carter & Tegeder, 2016; Thilakarathna & Raizada, 2018), en especial en el estado vegetativo de las leguminosas, aunque durante el estado reproductivo son transferidos de los tallos a las vainas y a las semillas (Yong et al., 2018), por lo que para la toma de muestras se debe tener en cuenta el estado de desarrollo de la planta.
Esta técnica es una forma indirecta de evaluar la fijación biológica de nitrógeno, debido a que una reducción en el contenido de ureidos indica menor fijación de los compuestos nitrogenados (Santos et al., 2018), de modo que por no ofrecer resultados exactos de la fijación de nitrógeno está en desuso a corto y mediano plazo (Thilakarathna & Raizada, 2018). Las muestras generalmente corresponden a hojas, tallos, vainas y granos. Se pesa 0,4 g del material a evaluar y se mezcla con tampón fosfato (80 °C) durante cinco minutos; posteriormente, se centrifuga (5.000 rpm) el doble de tiempo, y el sobrenadante se recoge y se almacena (-20 °C); depués, se toma 1,5 mL de esta solución y se expone a NaOH (0,5 mL), HCl (0,5 mL) y clorhidrato de fenilhidrazina (0,5 mL) (Tai-wen et al., 2018) para romper los tejidos y, a continuación, se mide la cantidad de ureidos en un espectofotómetro (Kataria & Baghel, 2016). Este método tiene las siguientes ventajas: 1) es más económico en comparación con las técnicas de dilusión isotópica, abundancia natural y reducción de acetileno, 2) y es relativamente rápido, aunque se require alto número de muestras para incrementar la confiabilidad de los resultados.
Ensayo GlnLux
La glutamina (Gln) es una forma de transporte primario del nitrógeno una vez es absorbido por la raíz de la planta (Thilakarathna et al., 2017). En el ensayo GlnLux, la glutamina es detectada por biosensores que son células enteras que emiten luz cuando entran en contacto con este aminoácido. Dichas células corresponden a cepas de Escherichia coli auxótrofas para Gln y que expresan un operón lux constitutivo (Thilakarathna et al., 2017), de modo que la fijación de nitrógeno se asocia con el gasto de luz que puede medirse con ayuda de un luminómetro; en general, el ensayo se basa en medir la salida de Gln utilizando el biosensor GlnLux (Thilakarathna et al., 2017). Además, se ha logrado comprobar que su sensibilidad es comparable con estudios hechos en cromatografía líquida de alto rendimiento (HPLC) según un estudio en el que se analizaron hojas de maíz (Zea mays L.).
El procedimiento consiste en tomar muestras de la primera a la tercera hoja en orden de emergencia con un disco de perforación manual para tejido foliar (6,35 mm de diámetro) y almacenarlas inmediatamente en nitrógeno líquido; luego, se homogeneizan agregando arena esteril y 20 μL de proteasa (0,1 %) y se centrifugan. El sobrenadante se diluye 100 veces y se refrigera (-20 °C); después, 10 μL de extracto de la planta se mezclan con 10 μL de células GlnLux y 80 μL de medio M9, y se incuban por dos horas para la activación del biosensor; posteriormente, se cuantifica la salida de Gln con el luminómetro (Thilakarathna et al., 2017), pero las proporciones mencionadas pueden cambiar.
La mayor limitante de este método es que solo informa la cantidad relativa de Gln y no la cantidad absoluta (Thilakarathna et al., 2017). Pero tiene las siguientes ventajas: 1) es una técnica rápida, en la que no se requiere alta cantidad de muestras (hojas jóvenes); 2) el biosensor GlnLux tiene alta sensibilidad; 3) permite el procesamiento de varias muestras, y 4) facilita el análisis de la dinámica de absorción, asimilación y redistribución del nitrógeno en la planta a partir de la detección de Gln (Thilakarathna et al., 2017).
Tecnicas PCR identificacion de los genes nifH
Las técnicas PCR se han utilizado para identificar bacterias diazótrofas que se aíslan de raíces (Castanheira et al., 2017), suelos, hojas y tallos. Por lo general se toman entre 0,25 g a 0,5 g de muestra para el ensayo y se realiza el protocolo de extracción de ADN, en el que se utilizan solventes para lisar la pared de las células y dejar libre el ADN que se precipita y se conserva en viales refrigerado; posteriormente, se corrobora la calidad del ADN por electroforesis en gel de agarosa y se continua con la amplificación del ADN mediante PCR en un termociclador con cebadores específicos para el gen nifH (por ejemplo: ATGCCTGCAGGTCGACTCTAG (cebador directo) y CCTTGTACTTGGTCGTGTTTGAC) (Ritchie & Raina, 2016; Roley et al., 2018; Tchuisseu, Berger, Patz, Fankem, & Ruppel, 2018). Los genes nifH se encuentran diversificados y su transcripción está controlada por la ARN polimerasa, que es una holoenzima alternativa, y también necesita una proteína activadora nifA (Satyanarayana, Krishna, Pavan, & Jeereddy, 2018). Otros genes identificados por PCR son 16S rRNA (Akemi et al., 2017; Jaiswal, Msimbira, & Dakora, 2017; Tahon & Willems, 2017), porque permite una clasificación filogenética más detallada a nivel de especie (Osei, Abaidoo, Ahiabor, & Boddey, 2018; Ribeiro et al., 2018), genes rec A, atpD, gln II y nod C con análisis de secuencia multilocus (MLSA) (Leite et al., 2017; Mwenda, Hara, De Meyer, Howieson, & Terpolilli, 2018; Rigonato et al., 2017). Con esta técnica, se ha logrado identificar el gen nifH en géneros Paenibacillus, Enterobacter, Klebsiella y Pantoea (Ndungu et al., 2018), que no son reconocidos por fijar nitrógeno, de modo que es posible que hayan obtenido la capacidad de fijación de nitrógeno a través de la transferencia lateral de genes; sin embargo, las fuerzas evolutivas de la transferencia lateral de genes no son bien conocidas (Khalifa & AlMalki, 2018).
Aunque es una técnica específica, es necesario que cuando se utilice se haga la caracterización morfológica y bioquímica de los microorganismos (Liu et al., 2017). Tiene las siguientes ventajas: 1) permite la caracterización ampliada de los microorganismos a partir de la identificación del gen nifH; 2) es una prueba rápida y se pueden utilizar kits de extracción de ADN para agilizar el procedimiento, y 3) es altamente sensible en la detección del gel nifH (Leite et al., 2017). Sin embargo, algunas limitantes de la técnica son las siguientes: 1) alto costo en el procedimiento; 2) la calidad de la plantilla del cebador determina la sensibilidad y amplificación confiable del ADN, por lo que se requiere corroborar el estado del material genético por electroforesis, y 3) no admite ningún grado de contaminación tanto en el procedimiento como en los reactivos (Tahon & Willems, 2017).
Masa nodular
La masa nodular es un método indirecto en el que se relaciona el número de nódulos, su masa (Arshi, 2017), distribución en el sistema radicular (Thilakarathna & Raizada, 2018) y características estructurales (Akemi et al., 2017), con la capacidad de la planta para fijar nitrógeno, ya que los nódulos se desarrollan como consecuencia de la asociación simbiótica entre planta y bacterias, de modo que alta actividad de la nitrogenasa se asocia a un buen estado nodular. En esta técnica se recolectan muestras de plantas completas o solamente el sistema radicular en bolsas herméticas y se transportan en condiciones de refrigeración (4 °C); posteriormente, se realiza un análisis físico de la estructura de los nódulos que incluye color, integridad, tamaño y número total por planta; luego, los nódulos son separados de la raíz, se lavan con agua destilada, se desinfectan con peróxido de hidrógeno (30 %) por tres minutos y nuevamente se lavan con agua esterilizada; finalmente, se secan a 70 °C hasta alcanzar un peso constante, y después se pesan (Argaw & Mnalku, 2017; Yong et al., 2018). Sin embargo, cabe resaltar que el número y masa de los nódulos cambia de acuerdo con la edad de los cultivos leguminosos y factores como la sequía (Hashem et al., 2018), el manejo y la salinidad del suelo, que a su vez influyen en las funciones de simbiosis (De Andrade Albenísio, Bonifacio, Cerqueira, & Barreto, 2018) y modifican el desarrollo nodular. De este modo, la técnica tiende a ser poco precisa al requerirse muestras en todos los estados de las plantas y mantenerlas bajo las mismas condiciones con el objetivo de disminuir el error de muestreo, pero tiene las siguientes ventajas: 1) es un método económico, que no requiere de equipos complejos; 2) no necesita personal altamente calificado; 3) se obtienen resultados rápidos, y 4) es una forma indirecta de estimar la simbiosis efectiva de bacterias Rhizobium que se inoculan en los cultivos (De Andrade et al., 2018).
Medición de leghemoglobina
El proceso de fijación biológica de nitrógeno es catalizado por el complejo enzimático nitrogenasa que es altamente susceptible a la presencia de oxígeno, de modo que un mecanismo de protección para evitar su inactivación es la expresión de la proteína leghemoglobina que se encuentra dentro de los nódulos y capta el oxígeno que entra a la célula; así, esta hemoproteína (Santos et al., 2018) evita la oxidación de la nitrogenasa y garantiza la fijación eficiente del nitrógeno (Kataria & Baghel, 2016). El procedimiento consiste en tomar entre 1,25 g y 2 g de nódulos radiculares frescos, que se lavan y se mezclan homogéneamente con cinco volúmenes de solución buffer fosfato (5 °C; pH 6,8; 6,8 mol/L); las muestras se centrifugan a 100 rpm por 15 min a 15 °C; posteriormente, se descarta el sedimento y se vuelve a centrifugar a 39.000 rpm por 20 min a 15 °C, cuyo sedimento rojo luego se mide con un espectrofotómetro (Yong et al., 2018). Cabe destacar que existe una estrecha relación entre el contenido de SeO en el suelo y la concentración de leghemoglobina en los nódulos, que fue comprobado en un ensayo en el que se agregó 0,1 y 1 mg/kg de suelo en forma de Na2SeO4 para el cultivo de soya, lo que se debe a que este actúa como un antioxidante que reduce la peroxidación de lípidos, de modo que suministrado en bajas concentraciones estimula el crecimiento, la fotosíntesis y la producción de leghemoglobina en los nódulos (Kataria & Baghel, 2016).
Algunas ventajas de esta técnica son las siguientes: 1) genera resultados rápidos que permiten analizar la actividad de la nitrogenasa de forma indirecta, y 2) tiene un menor costo, ya que el único equipo que se requiere es un espectofotómetro (Yong et al., 2018). Sin embargo, no es exacto y laceraciones en los nódulos pueden afectar los resultados; por ello, el muestreo se debe realizar con precaución y no debe pasar mucho tiempo entre su recolección y procesamiento (Kataria & Baghel, 2016).
Técnicas usadas en diferentes sistemas productivos
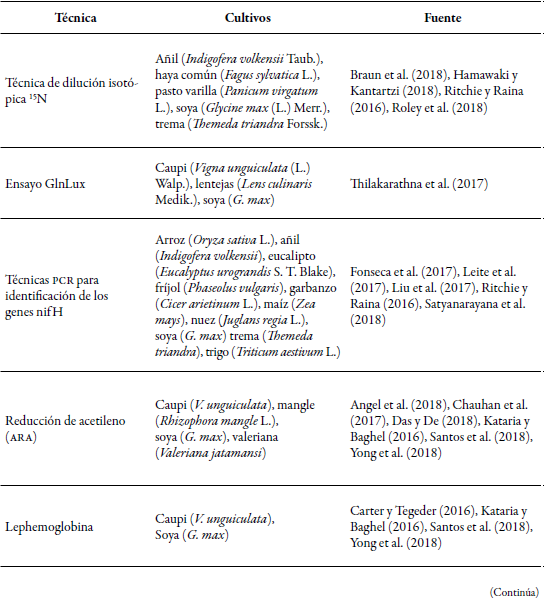
Los cultivos en los que más se han realizado estudios de identificación de microorganismos fijadores de nitrógeno que hacen simbiosis, de vida libre y endófitos corresponden en su mayoría a especies que tienen importancia económica como recurso alimentario y pecuario (gramíneas y leguminosas) y por su uso forestal (por ejemplo, en eucalipto la identificación de endófitos con el gen nifH) (Fonseca et al., 2017) (tabla 3). En estas técnicas, la aplicación de fertilizantes sintéticos suele ser alta para garantizar la producción que se demanda a nivel mundial. Esto favorece la tendencia a estudios enfocados en el uso eficiente del nitrógeno por el alto costo de los fertilizantes, y debido a que su aplicación indiscriminada puede alterar la calidad biológica de los cultivos y el rendimiento, así como contaminar los mantos freáticos (Bilal et al., 2017; Yong et al., 2018). Esto se lleva a cabo para el diseño de estrategias que permitan reducir su dosificación y frecuencia de aplicación, así como hacer más eficientes los sistemas productivos desde una perspectiva económica y ambiental.
La preferencia entre una técnica y otra depende de la sensibilidad que pueden tener al momento de detectar diferentes concentraciones de nitrógeno en las muestras, el costo, la rapidez para la obtención de resultados, el acceso a los equipos y la complejidad del procedimiento. Por lo general, se utilizan muestras de rizósfera y de las raíces de las plantas para aislar microorganismos asociados en simbiosis, pero cuando se trata de organismos fijadores de nitrógeno de vida libre se utilizan muestras de suelo (Angel et al., 2018). La sensibilidad de las técnicas está relacionada con la disponibilidad de nitrógeno en la muestra, que a su vez depende de la capacidad fijadora de nitrógeno del microorganismo presente en asociación con la planta o de vida libre, de tal manera que si es alta resulta fácilmente detectable, tal como se ha observado al utilizar reducción de acetileno y dilución isotópica 15N (Angel et al., 2018). Pero puede diferir por cultivo evaluado, por ejemplo: con la técnica de bundancia natural se ha observado distinto porcentaje de nitrógeno derivado de la atmósfera, reportándose valores de 12,8 % a 19,4 % para caña de azúcar, 22,4 % para maíz, 20,9 % para pasto guinea y 24,7 % a 31,2 % para sorgo (De Carvalho et al., 2017). Con respecto a cultivos de leguminosas como la soya, con valores hasta de 65 % en especies locales y de 53 % en variedades mejoradas (Van Vugt et al., 2018), lo que se debe a la alta actividad de la nitrogenasa en especies que nodulan; esto mismo se ha observado en ensayos con fríjol común, destacándose diferencias en el porcentaje de nitrógeno fijado en muestras de raíces y de grano por genotipo (Polania et al., 2016).
Estas técnicas, al igual que la prueba de detección del gen nifH, son utilizadas para detectar diazótrofos y analizar su actividad en el suelo asociado a cultivos permanentes y transitorios (tabla 3). Sin embargo, ARA no es tan sensible en muestras donde la actividad diazotrofica es baja o esporádica, pero sí lo es la dilución isotópica (Angel et al., 2018); por dicha variabilidad, es común que se prefiera corroborar la capacidad diazotrófica mediante detección del gen nifH, independiente del cultivo origen de las muestras o su naturaleza con una caracterización morfológica complementaria.
Por supuesto, características de la planta como la capacidad de producir ureidos y la presencia de nódulos únicamente en leguminosas limitan la aplicación de algunas técnicas para plantas que las presenten o en su defecto obligan a realizar modificaciones que consisten en utilizar reactivos más agresivos, aumentar o disminuir su concentración o el tiempo de exposición. De este modo, en cultivos permanentes como el eucalipto, que se caracteriza por tener mayor dureza en las raíces por su ciclo productivo, se reporta la modificación en el tratamiento de las muestras de raíz para análisis de microorganismos endófitos (Fonseca et al., 2017).
Dicha modificación incluye exposición a luz UV durante 5 min, lavado con etanol al 70 % durante 1 min e hipoclorito de sodio al 2 % durante 2 min para la preparación de las muestras de raíz antes de aislar microorganismos endófitos (Fonseca et al., 2017), prueba adaptada de un ensayo en muestras de cítricos, mientras que en muestras de raíces de gramíneas como el pasto varilla (Panicum virgatum L.) tan solo se reporta esterilización de superficie con hipoclorito de sodio al 1,5 % (Roley et al., 2018). Esto indica que la preparación de la muestra es un paso decisivo que suele adaptarse según las características del material evaluado.
Conclusiones
Desde 1967 ha incrementado el uso de técnicas para estimar la tasa de fijación de nitrógeno en la investigación agrícola con mínimo una publicación al año, ajustándose a un modelo de crecimiento sigmoidal con punto de declive hacia el año 2053. De este modo, esta tecnología se encuentra en una fase de rápido crecimiento que se caracteriza por la aparición de modificaciones, innovaciones y nuevos métodos como el bioensayo microbiano, el ensayo GlnLux y técnicas moleculares de última generación, para analizar la dinámica del nitrógeno en los sistemas agrícolas y los factores que intervienen en el ciclo. Esto refleja el esfuerzo económico para fortalecer su mercado y difusión desde los países desarrollados, que es donde se ostenta su posesión, así como para lograr el reconocimiento de sus productos a partir de su adaptación a las necesidades de la investigación por las desventajas que han surgido durante su aplicación. Los procedimientos y sensibilidades de las técnicas utilizadas para determinar la tasa de fijación de nitrógeno en el suelo difieren, lo que se relaciona con su rusticidad y capacidad de detección, pero también influye el tipo de muestra y el procedimiento de su colecta. En general, las técnicas indirectas como el número de nódulos y la masa nodular son poco confiables, y se puede sobrestimar o subestimar la fijación del nitrógeno porque la tasa de detección es baja; no obstante, existe una estrecha relación entre la masa nodular y el contenido de nitrógeno fijado. Por lo anterior, el método más sensible en la actualidad se considera que es de dilución isotópica, debido a que con este es posible identificar bajas tasas de 15N, lo que no se logra con los métodos ARA o masa nodular. A pesar de ello, es difícil controlar todos los factores externos y los agentes involucrados en el ciclo del nitrógeno, ya que suele ser episódico como cualquier proceso biogeoquímico, por lo que la acción de microrganismos fijadores de nitrógeno puede presentarse solo cuando tienen suficiente humedad, y elementos minerales.
Todo esto explica los resultados de máxima respuesta agronómica de cultivos que se establecen en condiciones de buena fertilidad. Por ello, existe probabilidad de error en todas las técnicas y quizás la más confiable sea la identificación de genes, pero la mayor limitante es el costo y la tecnología necesaria para su aplicación, aunque por efecto de la competencia en el mercado estas pruebas han reducido su precio comercial; sin embargo, y a pesar de su especificidad, es necesario que vayan acompañadas de alguna prueba mencionada.
Como escenarios futuros se prevé que las tecnologías de fácil uso en campo sean utilizadas con mayor frecuencia, ya que las pruebas que se realizan en condiciones controladas no siempre reflejan la dinámica natural, debido a que el nitrógeno varía en el cultivo y en el suelo por factores edafoclimáticos y de manejo. Se propone la implementación de técnicas que permitan determinar las transformaciones del nitrógeno después de su aplicación en función de las características del suelo, el clima y el cultivo para el uso eficiente del nitrógeno, en conjunto con tecnologías de punta con software para prever la fertilidad de los suelos a partir del análisis de resultados históricos de la dinámica del nitrógeno en el sistema agrícola, su modelamiento y predicción de la cantidad de fertilizante que se debe aplicar. No obstante, las técnicas antiguas seguirán utilizándose por su difusión en países en desarrollo en especial aquellas que son más económicas.











 texto en
texto en