Introducción
El jengibre rojo (Alpinia purpurata (Vieill) K. Schum.) es una especie de planta ornamental que pertenece a la familia botánica Zingiberaceae. Es originario de las islas del Pacífico asiático y se conoce mundialmente por sus flores tropicales exóticas que tienen un color rojo intenso y una larga vida útil (Criley, 1989; Hansen, 1993). Las plantas de A. purpurata crecen con mayor frecuencia en ambientes húmedos con al menos 1 200 mm de precipitación al año, a una temperatura promedio superior a 20 °C y en altitudes hasta de 600 m s. n. m. (De la Peña & Illsley, 2001). Esta especie es herbácea con tallos múltiples de 0,8-2,5 m de largo que crecen desde un solo punto (Criley, 1989; Hansen, 1993). Las hojas son elípticas, estrechas, con un ápice agudo y una base cuneada, de 20-50 cm de largo y 3,5-15,0 cm de ancho, y de color verde (Criley, 1989; Hansen, 1993). Las flores crecen en una inflorescencia determinada, en forma de espiga, es decir, un cincino con 1 a 5 flores cada una, obovadas, de 3-5 cm de largo, rojas, obtusas o agudas, con brácteas glabras y bracteola tubular, y de 20-40 mm de largo (Criley, 1989; Hansen, 1993). Los pedicelos tienen 2 mm de largo y el cáliz tiene entre 10 y 20 mm de largo; la corola tiene 30-50 mm de largo, es glabra y con forma de pétalo (Criley, 1989; Hansen, 1993). El fruto es una cápsula de hasta 30 mm de diámetro, subglobosa y con semillas rojas cuando maduran (Criley, 1989; Hansen, 1993; De la Peña & Illsley, 2001).
Las plantas de A. purpurata se propagan naturalmente a través de métodos clonales y sexuales (Hoyos, 1998). La propagación clonal se produce a partir de brotes que crecen en la inflorescencia: las flores envejecidas forman nuevos brotes que emergen de las axilas de la bráctea roja; cuando estas caen, los brotes que han emergido tocan el sustrato y producen raíces adventicias que les permiten crecer como una nueva planta (Hoyos, 1998). Alternativamente, la formación de rizomas produce brotes subterráneos que emergen y se desarrollan en nuevos tallos, de modo que se convierten en nuevas plantas unidas en la base (Hoyos, 1998). La propagación sexual es menos frecuente, pues las semillas pueden demorar de tres meses a tres años en germinar (De la Peña & Illsley, 2001; Neal, 1965). Los porcentajes de germinación son bajos debido a la latencia que presentan las semillas. Las plántulas generalmente son menos vigorosas que los brotes propagados clonalmente, y se encuentra variabilidad en individuos nuevos provenientes de una sola planta (Hoyos, 1998; Neal, 1965).
En Colombia, particularmente en la costa norte (región Atlántica), el jengibre rojo crece naturalmente en suelos húmedos y áreas lluviosas (Suárez et al., 2008). Aunque Colombia es un fuerte competidor mundial en el comercio de flores frescas, el jengibre rojo no está incluido entre las flores exportadas por el país, y tampoco se comercializa ampliamente a nivel local (“Estas son las flores…”, 2018; Procolombia, 2018). Las flores tropicales y el follaje son un elemento importante en el comercio mundial de flores, y el jengibre rojo tiene un gran potencial debido a su color rojo intenso y su larga vida útil (Builes, 2003; Suárez, 2008). Sin embargo, no se encuentra material vegetal de alta calidad para cultivar comercialmente para la producción masiva de flores (Builes, 2003; Suárez et al., 2008). De hecho, las plantas comerciales de jengibre rojo para la producción y comercialización de tallos, flores o follaje no son comunes, y las que se comercializan en las ciudades generalmente se extraen de las poblaciones naturales en las zonas rurales (Procolombia, 2018). La propagación clonal natural para la obtención de grandes cantidades de propágulos es un proceso lento y la calidad de las plántulas dificulta la expansión del cultivo (Cassells, 2012). La micropropagación es un método de mutiplicación clonal que permite la producción masiva de material vegetal en condiciones ambientales controladas, espacios reducidos y libre de contaminación microbiana y por plagas (Cardoso et al., 2018; Kane, 1996). Estudios sobre micropropagación de A. purpurata a través del cultivo de explantes con meristemos preexistentes han sido reportados previamente (Kochutressia et al., 2010; Vijaykuma et al., 2015). El crecimiento de los brotes y el tamaño de los órganos son críticos para la supervivencia y recuperación de la planta cuando se transfieren a condiciones ex vitro (Kane 1996). Las giberelinas se han asociado con el alargamiento del internodo del brote y el aumento de la longitud del brote in vitro, mientras que la sacarosa promueve el crecimiento de los órganos vegetales (Ayano et al., 2014; Camara et al., 2018; Gabryszewska, 2011; Han et al., 2011; Rizza et al., 2017). Sin embargo, no se han reportado estudios en que se intenten aumentar el tamaño de las plantas de A. purpurata micropropagadas mediante el uso de ácido giberélico (GA3) o sacarosa. En este estudio, las plantas de A. purpurata se micropropagaron y se evaluó el efecto de diferentes concentraciones de GA3 y sacarosa en el tamaño de las plantas.
Materiales y métodos
Desinfección de material vegetal y explantes
Se obtuvieron en el invernadero de la Universidad de Córdoba (Montería, Colombia) explantes de brotes cultivados en inflorescencias de plantas viejas que fueron mantenidas en el campo. Se cortaron las hojas y los tejidos necróticos, y las secciones, de 2-3 cm de largo, se lavaron con jabón bacteriológico y agua del grifo, luego de 1 h de inmersión en benzoimidazol al 0,2 %. Posteriormente, los explantes se sumergieron en una solución de NaClO al 1,25 % con dos gotas de Tween 20Ⓡ , en un vaso de precipitado, y se utilizó una barra agitadora para mezclar continuamente durante 15 min. Posteriormente, en una campana de flujo laminar, los explantes se lavaron tres veces con agua estéril y se eliminaron los extremos basales de los explantes decolorados usando una cuchilla quirúrgica estéril.
Establecimiento in vitro y multiplicación
Los implantes se establecieron en matraces de borosilicato de 200 cm3 que contenían 30 mL de medio semisólido ms (Murashige & Skoog, 1962) suministrado con mioinositol (100 mg/L), sacarosa (30 000 mg/L), tiamina HCl (0,4 mg/L) y Phytagel® (3000 mg/L) (Sigma Co.). Se dispuso un solo explante por recipiente; luego, cada uno se cubrió con dos capas de papel de aluminio resistente y se selló con Nescofilm®. Los cultivos se almacenaron a 25 °C con un fotoperiodo de 12 h (40 μmol m-2 s-1) utilizando lámparas fluorescentes que proporcionan luz blanca fría. Los cultivos se transfirieron a un medio nuevo con la misma formulación cada cuatro semanas, por cinco meses. Después de que se llevaron a cabo cuatro subcultivos, los explantes establecidos in vitro se transfirieron al medio de la misma formulación, pero se les suministró 1,0 mg/L de bencilaminopurina (BAP) para la multiplicación de los brotes. Los explantes se subcultivaron y multiplicaron cuatro veces para proliferar suficiente material para la evaluación del tratamiento.
Evaluación de ácido giberélico y sacarosa en el rendimiento del brote
Para evaluar el efecto del ácido giberélico (GA3) y la sacarosa en el crecimiento y desarrollo del brote, los brotes proliferados se colocaron individualmente en tubos de ensayo de borosilicato de 150 mm × 25 mm con 20 mL de medio MS líquido suministrado como se indica para el establecimiento de brotes y las etapas de multiplicación, pero sin Phytagel®. El experimento desarrollado fue un diseño factorial bidireccional con 15 tratamientos, consistentes en cinco niveles de ácido giberélico (0,0; 0,25; 0,5; 0,75 y 1,0 mg/L) combinados independientemente, con tres concentraciones de sacarosa (30, 45 y 60 g/L). Cada tratamiento se repitió 15 veces para un total de 150 unidades experimentales distribuidas con un diseño completamente al azar. Los cultivos se almacenaron a 25 °C con un fotoperíido de 12 h (40 μmol m-2 s-1) utilizando lámparas fluorescentes que proporcionan luz blanca fría. Después de cinco semanas, se registraron y analizaron variables como el número y a longitud de los brotes, el número de raíces, su longitud y el número de hojas por tratamiento.
Los datos fueron analizados con un Anova (α = 0,05) (S. A. S. versión 9.2) basado en el modelo Yij = μ + ai + bj + Єij , donde μ es la media general, i es el efecto de GA3, j es el efecto de la sacarosa y Єij es el efecto del error experimental. Las medias se separaron usando la prueba de Tukey (α = 0,05).
Resultados y discusión
Evaluación de ácido giberélico y sacarosa en el rendimiento del brote
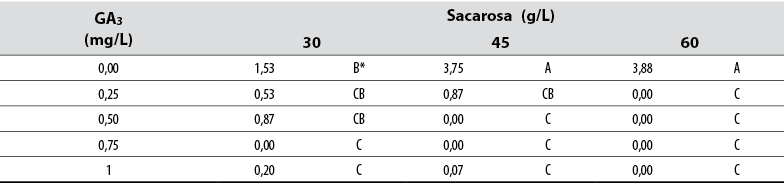
Número de brotes
El Anova permitió detectar diferencias estadísticas (Pr ≤ 0,05) entre todos los tratamientos en relación con el número de nuevos brotes formados in vitro. Los datos mostraron que cada explante cultivado en medios suministrados con 45 y 60 g/L de sacarosa privados de GA3 produjomás brotes en comparación con cualquier otro tratamiento (tabla 1). En contraste, la presencia de GA3 en el medio afectó negativamente la formación de brotes, y una concentración de ≥ 0,5 GA3 evitó la formación de brotes de manera independiente de la concentración de sacarosa (tabla 1).
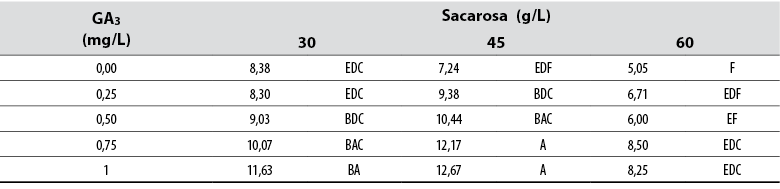
Longitud del brote
El Anova permitió detectar diferencias estadísticas (Pr≤ 0,05) entre todos los tratamientos en relación con la variable de longitud del brote. Los datos recopilados mostraron que los brotes cultivados en medios con ≥ 0,5 mg/L de GA3 produjeron brotes más largos en comparación con los cultivados en otros medios de cultivo (tabla 2). Además, el aumento de la concentración de sacarosa a > 45 g/L produjo brotes más cortos independientemente de la concentración de GA3. Aunque la prueba de Tukey agrupó varios tratamientos, los datos mostraron que los brotes más largos se produjeron cuando se cultivaron en medios suministrados con 0,75 y 1 mg/L de GA3 combinados con 45 mg/L de sacarosa (tabla 2).
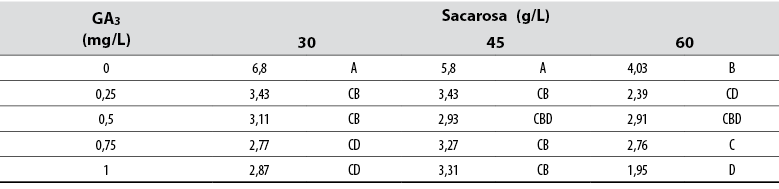
Número de raíces
El Anova permitió detectar diferencias estadísticas (Pr≤ 0,05) entre todos los tratamientos con respecto a la variable de número de raíces adventicias formadas. La prueba de Tukey indicó que los brotes cultivados en medios suministrados con 30 y 45 mg/L de sacarosa, en ausencia de GA3, formó el mayor número de raíces adventicias; sin embargo, estos no fueron diferentes de otros tratamientos suministrados con GA3 (tabla 3). Los datos generales recopilados y analizados no mostraron un patrón definido sobre el efecto del GA3 o de la sacarosa y sus concentraciones.
Tabla 3. Efecto del ácido giberélico (GA3) y la sacarosa en la cantidad de raíces adventicias formadas en explantes de jengibre rojo (A. purpurata) cultivados in vitro
*Los números con la misma letra no son diferentes según la prueba de Tukey (α ≤ 0,05)
Fuente: Elaboración propia
El Anova aplicado a los datos de enraizamiento permitió detectar diferencias estadísticas entre todos los tratamientos (Pr≤ 0,05). La prueba de separación de medias de Tukey mostró que los brotes cultivados en medios suministrados con 30 y 45 mg/L de sacarosa y sin GA3 formaron raíces más largas en comparación con los cultivados con otras combinaciones de sacarosa y GA3. Los datos generales indicaron que las raíces son propensas a reducir su longitud a medida que aumentan las concentraciones de GA3 y sacarosa en los medios.
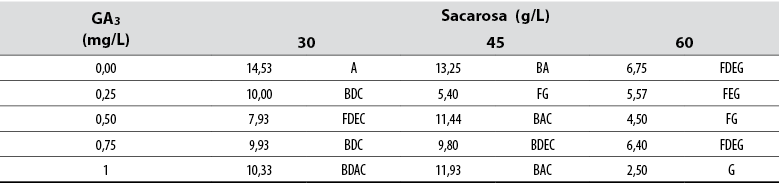
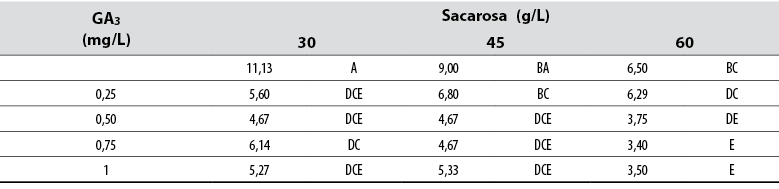
Numero de hojas
El Anova permitió detectar diferencias estadísticas (Pr≤ 0,05) entre todos los tratamientos con respecto a la variable de número de hojas por tratamiento. La prueba de Tukey mostró que un suministro de 30 g/L de sacarosa sin GA3 en el medio indujo el mayor número de hojas por brote; en contraste, la combinación de 60 g/L con 0,75 o 1,00 mg/L de GA3 formó el menor número de hojas por brote (tabla 5). Los datos generales mostraron que el número de hojas tiende a disminuir a medida que aumentan las concentraciones de GA3 y sacarosa en los medios de cultivo (tabla 5).
Tabla 5. Efecto del ácido giberélico (GA3) y la sacarosa en el número de hojas formadas en explantes de jengibre rojo (A. purpurata) cultivados in vitro
*Los números con la misma letra no son diferentes según la prueba de Tukey (α ≤ 0,05)
Fuente: Elaboración propia
El jengibre rojo (A. purpurata) es una planta herbácea con inflorescencias coloridas, grandes y duraderas que son muy apreciadas en el mercado internacional de flores, donde una sola flor de tallo cuesta alrededor de US$5,6 (Whole Blossom, 2018). El jengibre rojo crece naturalmente en la costa norte (región Atlántica) de Colombia, donde se ha adaptado a los ambientes tropicales, húmedos y cálidos de esta región; sin embargo, la producción de cultivos comerciales se ve limitada por la ausencia de un protocolo eficiente para proporcionar cantidades masivas de material vegetal de alta calidad (Suárez et al., 2008). La micropropagación ha demostrado ser un método eficiente para producir grandes cantidades de propágulos con altos estándares sanitarios y fidelidad genética para varias especies de plantas ornamentales (Cardoso et al., 2018; Kunakhonnuruk et al., 2018; Park et al., 2017).
El jengibre rojo se ha multiplicado a través de la micropropagación de explantes con meristemos preexistentes utilizando brotes de inflorescencia como explantes iniciales, que se cultivaron en medio ms suministrado con BAP/AIA (ácido indoleacético) o ácido naftalenacético (NAA), es decir, una combinación para la inducción y multiplicación de brotes (Illg & Faria, 1995). Los brotes de rizoma se cultivaron en un medio provisto de varias combinaciones de bap con kinetina para la producción de brotes (Kochuthressia et al., 2010), y los brotes de rizoma cultivados en medios MS con diferentes niveles de BAP y NAA, o ácido diclorofenoxiacético 2,4 (2,4-D), se utilizaron como explantes para la inducción de callos y la organogénesis indirecta del brote (Vijaykumar & Namdeo, 2015). En contraste con estos estudios, para la investigación actual, en lugar de usar citocinas o auxinas para la inducción y multiplicación de brotes, se usaron giberelinas y sacarosa para evaluar sus efectos sobre el crecimiento y desarrollo de brotes.
Los datos mostraron que los tratamientos en los cultivos indujeron efectos significativos para todas las variables. Aunque la multiplicación de brotes no era el propósito principal de este estudio, se observó que las concentraciones estadísticamente altas de sacarosa (45 y 60 g/L) aumentaban el número de brotes, lo que es equivalente a un suministro de 1,0-2,0 mg/L de bap combinado con 1,5-2,0 mg/L de kinetina en el medio de cultivo para la multiplicación de brotes, de acuerdo con trabajos como el realizado por Kochuthressia et al. (2010).
Se sabe que las giberelinas aumentan la longitud del brote al inducir el alargamiento y la división celular (Ayano et al., 2014; Camara et al., 2018; Han et al., 2011; Rizza et al., 2017). En este estudio, los brotes fueron más largos (> 12 cm) cuando se cultivaron en medios suministrados con niveles más altos de GA3 (0,75 or 1,0 mg/L) y también superiores en tamaño en comparación con la longitud del brote de A. purpurata de otros estudios (7,9 cm) en ausencia de GA3 (Kochuthressia et al., 2010). Se ha demostrado que un suministro de GA3 en los medios de cultivo de explantes de diferentes especies aumenta el tamaño del cultivo y contribuye a un mejor rendimiento de las plántulas, cuando se transfieren a condiciones ex vitro y, posteriormente, al campo (Dos Santos et al., 2017; Hesami et al., 2018; Kang et al., 2004). Por el contrario, los altos niveles de sacarosa en el medio de cultivo disminuyeron el potencial osmótico y, por lo tanto, las fuerzas de retención de nutrientes y agua en el medio aumentan, lo que dificulta que las plantas cultivadas obtengan agua y compuestos orgánicos/inorgánicos del medio (Hassan, 2017; Hazubska-Przybył et al., 2016).
Las raíces son órganos vegetales especializados en la absorción de agua y nutrientes (Augstein & Carlsbecker, 2018; Hodge et al., 2009). Las especies de plantas se pueden clasificar como fáciles, difíciles o recalcitrantes para formar raíces adventicias (Hartmann et al., 2002). Por lo general, la formación de raíces in vitro se induce al suministrar al medio reguladores del crecimiento vegetal (RCV) como el ácido naftalenacético (ANA), el AIA o el ácido indolbutírico (AIB). Se sabe que las giberelinas previenen la formación de raíces adventicias y la sacarosa reduce el tamaño de las raíces (Gao et al., 2018; Rahman & Blake, 1988), y también lo hemos señalado en este estudio. Los datos mostraron que el suministro de sacarosa y GA3 redujo el tamaño de la raíz a medida que las concentraciones suministradas aumentaron en el medio; sin embargo, no se observó un patrón específico con respecto a la formación de raíces adventicias. A. purpurata se clasifica como una especie fácil de enraizar debido a la formación ex vitro de grandes cantidades de raíces adventicias (Suárez et al., 2008). El medio basal con el suministro convencional de 30 g/L de sacarosa generó un mayor número de raíces adventicias formadas (> 10 raíces por explante); este resultado mostró claramente que no solo el GA3 y los altos niveles de sacarosa tienen un efecto perjudicial sobre la formación de raíces adventicias y el crecimiento de las raíces, sino también que los brotes de jengibre rojo forman fácilmente raíces adventicias en ausencia de inductores de raíz (auxinas) en el medio de cultivo.
De manera similar al enraizamiento, la formación de hojas parecía verse afectada negativamente por los altos niveles de sacarosa en el medio de cultivo; no obstante, los efectos de los aumentos de GA3 no son aparentes. Como el crecimiento de las plantas in vitro es heterótrofo en lugar de autótrofo, las hojas exigen en lugar de ser fuentes de energía. Como se indicó anteriormente, los altos niveles de sacarosa en el medio reducen el potencial osmótico, lo que resulta en menos nutrientes disponibles para los tejidos de la planta, incluidos los compuestos energéticos, como los carbohidratos. La disminución de la formación de hojas podría ser una respuesta del crecimiento in vitro de la planta que tiene un suministro limitado de nutrientes y, por lo tanto, se reduce la cantidad de hojas (Carloni et al., 2017; Martins et al., 2015).
Los reguladores del crecimiento de las plantas son sustancias que, en cantidades muy bajas, afectan el crecimiento y los procesos de desarrollo en estas (Gaspar et al., 1996; Rademacher, 2015). Las giberelinas son RCV que promueven el alargamiento y la división celular y, por lo tanto, el crecimiento y desarrollo de los órganos de las plantas (Hedden & Sponsel, 2015; Kuhnle et al., 1983). Cuando se usan in vitro, las giberelinas a menudo se emplean para promover la longitud en los brotes micropropagados, para aumentar la supervivencia de la planta cuando se transfieren a condiciones ex vitro y para mejorar el rendimiento de la planta cuando se siembra en el campo (Ali et al., 2018; Brondani et al., 2012). Esta investigación mostró los efectos beneficiosos del GA3 para aumentar la longitud de los brotes micropropagados de A. purpurata; sin embargo, la formación de órganos, como hojas y raíces, y su tamaño —igualmente importante para la supervivencia y el crecimiento de las plantas— se vieron afectados negativamente por el suministro de GA3. Finalmente, se aconseja que se realicen otros experimentos de rendimiento en campo de plantas micropropagadas con o sin suministro de GA3 en el medio de micropropagación.
Conclusiones
En el estudio se comprobó que el suministro de GA3 combinado con sacarosa afectó estadísticamente el número y la longitud del brote, la formación y la longitud de la raíz, y la formación de hojas en los brotes de A. purpurata cultivados in vitro.
De este se concluye, además, que un creciente suministro de GA3 en el medio de cultivo redujo el número de brotes por explante de A. purpurata, pero aumentó su longitud. Asimismo, la longitud y el número de hojas en los brotes de A. purpurata disminuyeron a medida que el contenido de sacarosa aumentó en el medio de cultivo. Finalmente,los brotes micropropagados se desempeñaron mejor en longitud, pues aumentaron cuando los niveles de GA3 fueron de 1,0 mg/L, independientemente del nivel de sacarosa.











 text in
text in