Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera Sep./Dec. 2020 Epub Aug 31, 2020
https://doi.org/10.21930/rcta.vol21_num3_art:1465
Manejo de sistemas productivos
Evaluación de Bacillus spp. como rizobacterias promotoras del crecimiento vegetal (RPCV) en brócoli (Brassica oleracea var. italica) y lechuga (Lactuca sativa)
1Universidad Politécnica Salesiana. Quito
2Universidad Politécnica Salesiana. Quito
3Universidad Politécnica Salesiana. Quito
4Universidad Politécnica Salesiana. Quito
5Universidad Politécnica Salesiana. Quito
6Universidad Politécnica Salesiana. Quito
La lechuga y el brócoli son productos de importancia agrícola en Ecuador, cuyo cultivo demanda considerables cantidades de nutrientes minerales obtenidos, generalmente, de fertilización química. Dado que el uso de rizobacterias promotoras de crecimiento vegetal (RPCV) es una alternativa biológica para el desarrollo de estas especies hortícolas, se estudiaron varias cepas de Bacillus spp. mediante pruebas en laboratorio y campo. La fijación biológica de nitrógeno se realizó mediante una evaluación cualitativa en medio de cultivo libre de nitrógeno; la producción de ácido indolacético se realizó en medio Tryptic Soy Broth (TSB) y se cuantificó la concentración de este con el reactivo de Salkowski; la solubilización de fosfatos se realizó en medio NBRIP, y se cuantificó la concentración de fósforo transformado con el reactivo Mo-Blue. Los datos obtenidos mostraron una diferencia significativa entre los tratamientos (p < 0,01), donde B. megaterium y B. licheniformis presentaron mayor capacidad para fijar nitrógeno, producir auxinas y solubilizar fosfatos. La evaluación de campo determinó, por una parte, un incremento en altura de 26,7 % y 13,72 % en lechuga y brócoli respectivamente, con la aplicación semanal de B. licheniformis. Por otra parte, la aplicación semanal de B. megaterium incrementó significativamente el contenido de materia seca, longitud y peso de la raíz tanto en lechuga como en brócoli. Todas las comparaciones se hicieron frente a un testigo. Estos resultados demuestran que las cepas identificadas en la investigación pueden ser consideradas como rizobacterias promotoras de crecimiento vegetal y son una alternativa biológica a los fertilizantes de síntesis química.
Palabras clave auxinas; biofertilizante; fijación de nitrógeno; rizobacterias; solubilización de fosfatos
Lettuce and broccoli are valuable agricultural products in Ecuador whose cultivation demands considerable quantities of mineral nutrients, usually obtained from chemical fertilizers. As the use of plant growth-promoting rhizobacteria (PGPR) has shown to be a biological alternative for cropping these vegetable species, several strains of Bacillus spp. were evaluated through laboratory and field tests. Biological nitrogen fixation was performed by a qualitative assessment in a free nitrogen culture medium; the indoleacetic acid production was carried out in a Tryptic Soy Broth (TSB) medium by quantifying its concentration using Salkowski’s reagent; phosphate solubilization was established on an NBRIP medium and the transformed phosphorus concentration was quantified with the Mo-Blue reagent. The data obtained showed a significant difference between the treatments (p < 0.01) where B. megaterium and B. licheniformis showed a higher ability to fix nitrogen, produce auxins, and solubilize phosphate. Field tests achieved, on the one hand, an increase in height of 26.7 % and 13.7 % in lettuce and broccoli, respectively, with a weekly application of B. licheniformis. On the other hand, a weekly application of B. megaterium significantly increased the dry matter content, length, and root weight in lettuce as well as in broccoli. All comparisons were made against a control. These results show that the strains identified in this research could be considered as growth-promoting microorganisms and are a biological alternative to chemical fertilizers.
Keywords auxins; biofertilizer; nitrogen fixation; phosphate solubilizing; rhizobacteria
Introducción
En el suelo habitan microorganismos capaces de incrementar de forma favorable la capacidad de las plantas para acceder a nutrientes indispensables para su desarrollo (Correa, 2016). Este grupo de microorganismos se conocen como rizobacterias promotoras de crecimiento vegetal (RPCV) y está constituido por varias especies de bacterias que pueden incrementar el crecimiento y la productividad en las plantas, de distintas formas (González & Fuentes, 2017).
Las bacterias asociadas con la rizósfera de las plantas son capaces de generar varios mecanismos que influyen positivamente en el crecimiento vegetal, dentro de los que se identifican los directos, que corresponden a la producción de fitohormonas de tipo auxinas y giberelinas (Moreno et al., 2018). Por otra parte, las rizobacterias pueden afectar la disponibilidad de nutrientes por la intervención directa en los ciclos biogeoquímicos, como la fijación biológica de nitrógeno y la solubilización de fósforo (Ramírez et al., 2017). Indirectamente, pueden contribuir mediante la inducción de la resistencia sistémica a fitopatógenos, el control biológico de enfermedades, y la producción de antibióticos y de sideróforos (Camelo et al., 2011). Los géneros más conocidos son Azospirillum, Bacillus, Burkholderia, Rhizobium, Enterobacter, Azotobacter, Erwinia, Klebsiella, Xanthomonas y Pseudomonas (Bashan et al., 2012; Cassán et al., 2009).
En múltiples investigaciones realizadas, se ha demostrado el potencial de las bacterias del género Bacillus como RPCV. Además, se ha evidenciado que varias de sus especies, como B. subtilis, B. megaterium, B. licheniformis . B. pumilus, son usadas para la solubilización de fosfatos, producción de hormonas reguladoras del crecimiento vegetal, fijación biológica del nitrógeno y producción de sustancias que actúan como antagonistas de patógenos, lo cual mejora la calidad de los cultivos (Tejera et al., 2013).
La agricultura actual está enfocada en implementar prácticas que aseguren la conservación de los suelos, por lo que el uso de RPCV se presenta como una alternativa compatible con la actividad microbiológica que promueve la nutrición de las plantas (Grageda et al., 2012). Además, la implementación de RPCV se considera como una estrategia de la agricultura sustentable en los países en desarrollo (Cassán et al., 2009).
La lechuga se la considera una de las hortalizas de hoja más importantes. En el Ecuador hay 1.499 ha con un rendimiento promedio de 19.432 t/ha (Instituto Nacional de Estadística y Censos [INEC], 2016). La provincia con mayor producción es Pichincha, con 15.575 t/ha cultivadas en 924 ha, y después está la provincia de Chimborazo, con 1.905 t/ha producidas en 232 ha (INEC, 2018)
En cuanto al brócoli, Ecuador está ubicado en séptimo lugar como exportador de esta hortaliza y el 98 % de su producción está destinado a la exportación, principalmente, a Estados Unidos (INEC, 2016). En la actualidad, la superficie sembrada de brócoli alcanza las 11.462 ha, con una producción de 188.095 Tm, y la provincia con mayor producción es Cotopaxi, con 10.199 ha sembradas de este vegetal (INEC, 2018).
Tanto el brócoli como la lechuga son especies que ocupan un lugar importante en la producción agrícola en Ecuador, por lo que la búsqueda de técnicas que mejoren la producción sin causar daños en el ambiente ni en la salud humana es relevante.
La presente investigación tuvo como finalidad evaluar la eficiencia de Bacillus spp. como microorganismos promotores del crecimiento vegetal en hortalizas, mediante análisis en laboratorio y pruebas en vivero. De esta manera, se espera aplicar recursos de biotecnología para el desarrollo de una agricultura amigable con el medio ambiente y como alternativa de reducción del uso de fertilizantes químicos.
Materiales y métodos
Para las distintas pruebas en laboratorio se utilizaron cepas de Bacillus spp. crioconservadas en el cepario del Centro de Investigación y Valoración de la Biodiversidad, del Laboratorio Ciencias de la Vida de la Universidad Politécnica Salesiana.
Identificación molecular de los microorganismos RPCV
Extracción de ADN
Los microorganismos bacterianos se cultivaron en Tryptic Soy Broth (TSB) y se incubaron a 30 °C y 100 rpm. El ADN se extrajo a partir de cultivos de 24 horas mediante la metodología descrita por Sambrook y Russell (2001).
Mediante electroforesis se determinó la presencia de ADN; para esto, se utilizó gel de agarosa al 1 % y se añadió 5 µL de Sybr Safe por cada 50 mL de agarosa diluida en TBE 1X. Se mezcló 5 µL de ADN con 5 µL de tampón de carga Blue Juice 2X y se corrieron las muestras a 90 V por 40 minutos en la cámara de electroforesis Labnet. El gel fue revelado y fotografiado en el fotodocumentador Bio-Imaging Systems.
Reacción de la cadena de la polimerasa PCR
Para la identificación molecular de los microorganismos se amplificó la región 16S con los cebadores 27F (5’-AGAGTTTGATCCTGGCTCA-3’) y 1492R (5´ GGTTACCTTGTTACGACTT-3’) (Weisburg et al., 1991). En tubos Eppendorf de 0,2 mL, se colocó 12,5 µL de Go Taq Master Mix de Promega, 0,5 µL de cebador forward, 0,5 µL de cebador reverse, 10 µL de agua libre de nucleasas y 1 µL de ADN; finalmente, se obtuvo un volumen final de 25 µL para la reacción. La PCR se realizó en un termociclador marca Labnet Multigene bajo las siguientes condiciones: desnaturalización inicial a 95 °C por 2 minutos, 24 ciclos de desnaturalización a 95 °C por 30 segundos, hibridación del cebador a 58 °C por 1 minuto, extensión inicial por 2 minutos a 72 °C y extensión final de 10 minutos a 72 °C, seguido de mantenimiento a 4 °C.
Los productos PCR fueron sometidos a secuenciación Sanger y la búsqueda de similitud de las secuencias fueron llevadas a cabo utilizando la opción BLAST (N), en el Genbank de NCBI.
Fijación biológica de nitrógeno atmosférico
Las cepas fueron reactivadas en cajas Petri con agar nutritivo y se incubaron a 37 °C durante 24 horas. Para la preparación del medio de cultivo NFb, se utilizó la formulación propuesta por Ramírez et al. (2015); una vez obtenido el medio, se ajustó el pH a 6 con KOH (1 N) y se esterilizó a 121 °C por 15 minutos a 1 atm de presión. Las cepas se sembraron por estriado en el medio NFB en cajas Petri y se incubaron a 37 °C durante 48 horas.
Producción de ácido indolacético (AIA)
Las cepas se reactivaron en tubos de ensayo con caldo nutritivo y se incubaron a 37 °C durante 48 horas. Para este proceso, se utilizó la metodología de Posada (2017), con las siguientes modificaciones: se sembraron 100 μL de las bacterias previamente incubadas en 6 mL de medio TSB, suplementado con L-Triptófano (1 mg/mL). Posteriormente, se incubó a 30 °C y a 100 rpm, durante 4 días.
Para determinar la concentración de AIA se elaboró el reactivo de Salkowski, mediante una solución de 15 mL de FeCl3·6 H2O (0,5 M) al que se añadieron 300 mL de H2SO4 (98 %) y 500 mL de agua destilada (Acuña et al., 2011). Concluido el periodo de incubación se centrifugaron los tubos a 3.000 rpm por 15 minutos, se tomó 1 mL de sobrenadante y se mezcló con 4 mL del reactivo Salkowski; luego, se dejó reposar a temperatura ambiente en oscuridad por 30 minutos. Terminado este tiempo, se midió la absorbancia a 530 nm en un espectrofotómetro JASCO V-730, en celdas plásticas. Finalmente, se diseñó una curva patrón a partir de concentraciones conocidas y los datos de absorbancia obtenidos de las muestras se reemplazaron en la ecuación de la curva patrón para determinar las ppm de AIA, producido por cada cepa.
Solubilización de fosfatos
Las cepas se reactivaron en tubos de ensayo con caldo nutritivo y se incubaron a 37 °C durante 48 horas. Se preparó el medio de cultivo NBRIP con la formulación usada por Tejera et al. (2013) (Glucosa, 10 g; Ca3PO4, 5 g; MgCl2 6H2O, 0,25 g; KCl, 0,2 g; (NH4)2 SO4, 0,1g; H2O destilada, 1 L), el medio se esterilizó a 121 °C por 15 minutos y 1 atm de presión, el fosfato tricálcico se esterilizó en seco por separado y se agregó al medio estéril. Se sembraron 200 μL de las bacterias activas en matraces de 100 mL con 50 mL de medio NBRIP y se incubaron con agitación a 30 °C y 100 rpm, durante 7 días (Rodríguez et al., 2013).
Asimismo, se preparó el reactivo Mo-Blue con soluciones de ácido sulfúrico (H2SO4,5N), tartrato de antimonio y potasio (C8H4K2O12Sb2·3H2O), molibdato de amonio ((NH4)6Mo7O24) y ácido ascórbico (C6H8O6, 0,1 M), mediante la metodología de Bobadilla y Rincón (2008).
Transcurrido el periodo de incubación se centrifugaron 2 mL de muestra a 5.000 rpm, se tomaron 500 μL del sobrenadante y se mezclaron con 400 μL de reactivo Mo-Blue. Posteriormente, se aforó a 2 mL con agua destilada y se midió por espectrofotometría a 880 nm con el equipo JASCO V-730. Los datos de absorbancia obtenidos se reemplazaron en la ecuación de la curva patrón, para determinar la concentración (ppm) de fosfatos solubilizados por cada cepa.
Ensayo en campo
El ensayo se realizó en la provincia de Tungurahua, cantón Ambato, parroquia Izamba a una altitud de 2.590 m s. n. m., con una temperatura media de 14,6 °C y una humedad media de 68,6 %.
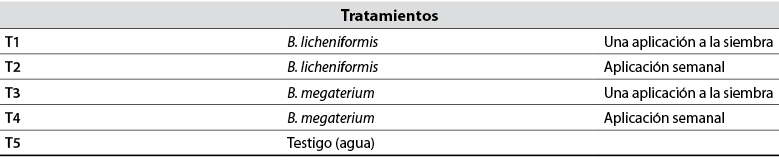
A partir de las dos mejores cepas bacterianas obtenidas en las pruebas de laboratorio, se implementaron 5 tratamientos, incluyendo un testigo, y 3 repeticiones por cada tratamiento, para un total de 15 unidades experimentales para cada especie hortícola. Los tratamientos analizados fueron T1: cepa 1 con una sola aplicación; T2: cepa 1 con aplicación semanal; T3: cepa 2 con una aplicación; T4: cepa 2 con aplicación semanal; T5: testigo. Se utilizaron bandejas de germinación de 338 hoyos, de manera que cada bandeja fue una unidad experimental. Para brócoli se utilizó la variedad Avenger (Sakata) y para lechuga la variedad Coolguard (PanDia Seeds). Se elaboraron biopreparados con las dos cepas seleccionadas, a partir de la metodología descrita por Acurio et al. (2020) y se aplicaron en las bandejas de germinación a la concentración de 1x106 UFC/mL con bombas de aspersión manual.
Las variables evaluadas fueron longitud y grosor del tallo, materia seca, longitud y peso de la raíz. Los datos de longitud y grosor del tallo se tomaron cada 7 días, con ayuda de un pie de rey y los datos fueron analizados mediante de la metodología del área bajo la curva descrita por Navarro (2010). Para la materia seca, en la semana 6 se separó la parte aérea de la planta y se secó en bolsas de papel, con ayuda de una estufa, a 72 °C durante 48 horas; transcurrido el tiempo de secado se tomó el peso en una balanza analítica. De la misma manera, en la semana 6 la variable longitud de la raíz se tomó con ayuda con un pie de rey y el peso de la raíz se determinó con una balanza analítica.
Resultados y discusión
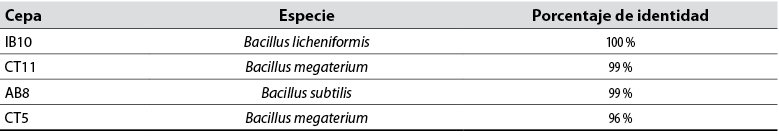
Las secuencias obtenidas fueron analizadas en el Blast (N) de NCBI. Se obtuvo así la identificación de las cuatro cepas utilizadas en la investigación (tabla 1).
Capacidad bacteriana de promoción de crecimiento vegetal in vitro
El cambio colorimétrico del medio de cultivo NFB de color verde a azul se dio en todas las cajas a las 24 horas e indicó la fijación de nitrógeno ambiental. Asimismo, se observó el crecimiento de colonias separadas.
Posada (2017) determinó la presencia de los genes nifU, nifS, nifV y nifF en B. subtilis, los cuales están involucrados en la formación de los clústeres de la enzima nitrogenasa encargada de la fijación biológica de nitrógeno. Martínez et al. (2013), en su investigación, evidenciaron que cepas de Bacillus megaterium y Bacillus subtilis crecieron en el medio de cultivo NFB. Por otro lado, Mota (2013) demostró que B. licheniformis es potencialmente capaz de fijar nitrógeno; sin embargo, su crecimiento es lento cuando se emplea glucosa y ácido málico como sustratos, lo que sustenta el desarrollo lento de colonias que se pudo evidenciar en los ensayos realizados.
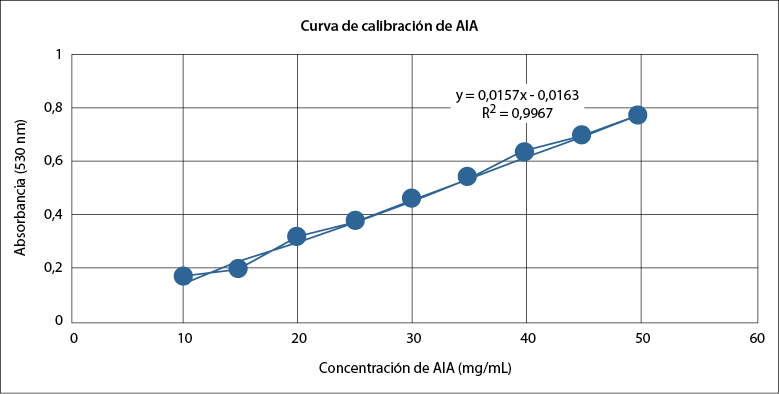
Para la cuantificación de ácido indolacético, se determinó la curva patrón a partir de concentraciones conocidas (tabla 2) y se obtuvo la ecuación de la curva y = 0,0157x – 0,0163 con un R2 = 0,9967 (figura 1).
Tabla 2 Absorbancias para la curva de calibración de AIA
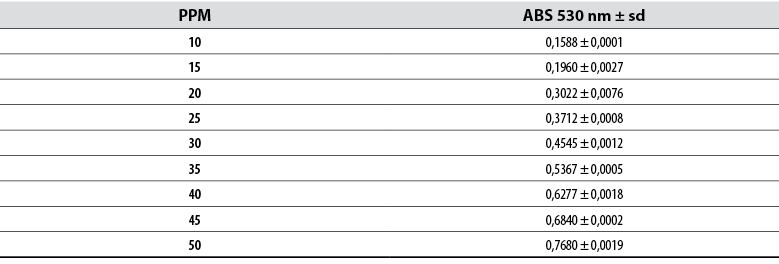
Nota: Los datos corresponden a la media de tres repeticiones.
Fuente: Elaboración propia
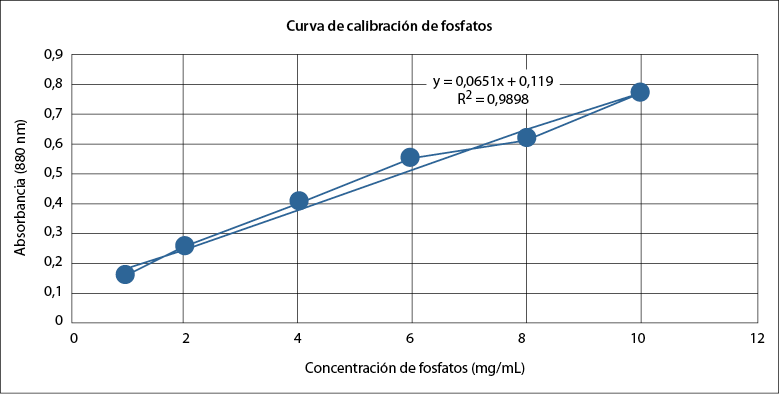
De la misma manera, se determinó la curva patrón para la absorbancia de fosfatos, a partir de concentraciones conocidas (tabla 3), y se obtuvo la ecuación de la curva y = 0,0651x - 0,119 con un R2 = 0,9898 (figura 2).
Tabla 3 Absorbancias para la curva de calibración de fosfatos
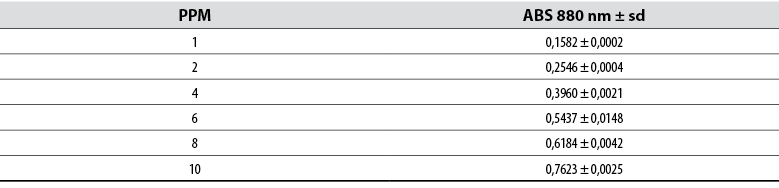
Nota: Los datos corresponden a la media de tres repeticiones.
Fuente: Elaboración propia.
Las cepas en estudio fueron capaces de producir AIA y solubilizar fosfatos (tabla 4).
Tabla 4 Capacidades bacterianas de promoción de crecimiento vegetal in vitro
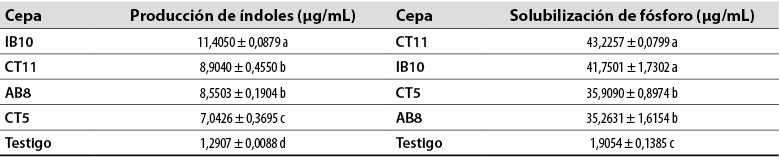
Medias en la misma columna con una letra común no son significativamente diferentes, según la prueba de Tukey (p < 0,05). Los datos corresponden a la media de tres repeticiones con su respectiva desviación estándar.
Fuente: Elaboración propia.
Mediante el análisis de varianza se hallaron diferencias estadísticas altamente significativas para la producción de índoles y solubilización de fosfatos (p < 0,01), con respecto al testigo. Las cepas de Bacillus licheniformis (IB10) y Bacillus megaterium (CT11) presentaron los promedios más altos.
Diversos estudios reportan la capacidad de producir auxinas por cepas de Bacillus, como Tejera et al. (2011). En dicho estudio, cuantificaron auxinas mediante el método colorimétrico de Salkowski, con resultados que varían entre los 1 y 17 µg/mL para cepas de Bacillus spp. De manera específica, Posada (2017) determinó que B. subtilis produce índoles totales en una concentración de 15 µg/mL usando 500 mg/mL de L-triptófano. Para B. megaterium, Chávez et al. (2016) reportaron concentraciones de 6,3 a 7,1 mg/L en medio de cultivo suplementado con 1 mg/mL de triptófano; la cepa de B. megaterium utilizada en esta investigación obtuvo un valor mayor, que fue de 8,9 mg/mL. Para B. licheniformis se han obtenido concentraciones de 35,15 µg/mL en medio de cultivo líquido con K-lactato, suplementado de triptófano a 100 mg/L (Sánchez & Pérez, 2018). En contraste con los resultados obtenidos en esta investigación, la cepa de B. licheniformis produjo 11,4 µg/mL.
En cuanto a la solubilización de fosfatos, Tejera et al. (2013) identificaron cepas de Bacillus con la capacidad de solubilizar fosfatos inorgánicos en medio NBRIP líquido, en concentraciones de fosfato soluble de 0,23 y 11,58 mg/L. Por otro lado, Chávez et al. (2016) obtuvieron en su investigación concentraciones desde 26,0 hasta 134,6 mg/L de fósforo soluble cultivando cepas de Bacillus. Los valores obtenidos en este ensayo fueron de 43,2 mg/L y 41,7 mg/L para Bacillus megaterium y Bacillus linchenifromis, respectivamente.
Pruebas en campo
Las cepas que obtuvieron los mejores resultados en las pruebas de laboratorio, evaluadas en campo, fueron IB10 (B. licheniformis) y CT11 (B. megaterium) (tabla 5).
Evaluación de la respuesta de la lechuga (Lactuca sativa) a la inoculación de bacterias promotoras de crecimiento vegetal
Se determinó que al menos uno de los tratamientos aplicados presenta diferencia significativa en la altura y materia seca de las plántulas con un valor p < 0,01, mientras que para el grosor no se presentó diferencia estadística (tabla 6).
Tabla 6 Área bajo la curva (ABC) de altura y media de materia seca

Medias en la misma columna con una letra común no son significativamente diferentes, según la prueba de Tukey (p < 0,05). Los datos corresponden a la media de tres repeticiones con su respectiva desviación estándar.
Fuente: Elaboración propia
En la investigación se obtuvo un 26,7 % más de crecimiento foliar en comparación con las plantas testigo en lechuga. Martínez et al. (2013) mencionaron que la producción de AIA por RPCV promueve el desarrollo radical y vegetativo en plántulas de lechuga, lo cual se traduce en mayor altura para las plántulas.
En la investigación realizada por Stoll et al. (2018) en la cual se inoculó cepas bacterianas a plántulas de lechuga, se observó un incremento significativo del peso fresco de la planta en relación con el testigo no inoculado, pues se obtuvo hasta un 30 % más de peso debido a su acción como RPCV. Sánchez et al. (2014) evaluaron consorcios de cepas bacterianas en plantas de lechuga (L. sativa), tratamiento que obtuvo un 102 % más de materia seca en comparación con el tratamiento químico, debido a una mejor nutrición que tienen las plántulas por el crecimiento de sus raíces.
Maccarrone et al. (2016), en su investigación, evidenciaron un mayor crecimiento y porcentaje de materia seca con respecto al testigo. De igual forma demostraron un mayor incremento en el desarrollo radicular en las plantas tratadas con la suspensión bacteriana, mediante la inoculación de 1 x 107 UFC/mL de la cepa de Bacillus en plántulas de lechuga en un ensayo de 55 días. La aplicación se realizó en el suelo y hojas.
En el análisis de la longitud de la raíz destacaron todos los tratamientos bacterianos en comparación con el testigo, mientras que para el peso de la raíz se destacó el tratamiento 4 (tabla 7).
Evaluación de la respuesta del brócoli (Brassica oleracea var. italica) a la inoculación de rizobacterias promotoras de crecimiento vegetal en invernadero
Se determinó que al menos uno de los tratamientos aplicados presenta diferencia significativa en la altura, grosor y materia seca de las plántulas con un valor p < 0,01 (tabla 8).
Tabla 8 Área bajo la curva (ABC) de altura, grosor y media de materia seca
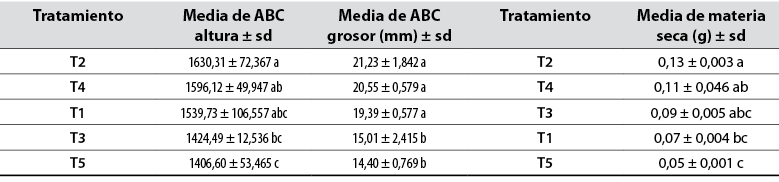
Medias en la misma columna con una letra común no son significativamente diferentes, según la prueba de Tukey (p < 0,05). Los datos corresponden a la media de tres repeticiones con su respectiva desviación estándar.
Fuente: Elaboración propia
Al inocular las plántulas con las RPCV, estas aumentan su longitud y grosor proporcionalmente debido a que las bacterias que se asocian a la raíz producen fitohormonas como AIA, e incrementan la fijación de nitrógeno y la solubilización de fosfatos (Vivanco et al., 2016). Esto se comparó con los resultados obtenidos en la presente investigación, donde se obtuvo un 13,7 % más de crecimiento foliar en comparación con las plantas testigo para la especie brócoli.
Gutiérrez et al. (2019) determinaron que las rizobacterias inducen a rangos de suficiencia en P, Ca, Fe y Mn, lo cual se demostró con el mayor contenido obtenido de materia seca, con respecto a las plantas testigo. Esto explica la capacidad que tienen las cepas aplicadas para solubilizar compuestos poco móviles del suelo, como los fosfatos, con lo que se mejora la asimilación de este macronutriente.
En el análisis de la longitud de la raíz, se destacaron los tratamientos 2 y 4, mientras que para el peso de la raíz se destacó el tratamiento 4, aun cuando es estadísticamente similar al tratamiento T2, pero con diferencia probabilística con respecto a los otros tratamientos (tabla 9).
Tabla 9 Longitud y peso de la raíz
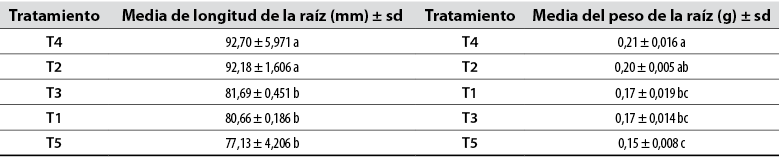
Medias en la misma columna con una letra común no son significativamente diferentes, según la prueba de Tukey (p < 0,05). Los datos corresponden a la media de tres repeticiones con su respectiva desviación estándar.
Fuente: Elaboración propia
Según Sánchez et al. (2014), la inoculación con bacterias puede mejorar el desarrollo radical de las plantas, a través del incremento de la capacidad de absorción de agua y nutrientes en los cultivos, mediante la producción de reguladores de crecimiento que se encuentran asociados a la interface de las raíces. Sin embargo, la eficiencia de los microorganismos se puede ver afectada por algunas condiciones bióticas, como las respuestas sinérgicas, antagónicas o el estado fenológico de la planta (Bhattacharyya & Jhan, 2012). Además, Yildirim et al. (2010) realizaron el aislamiento de cepas de Bacillus y produjeron una suspensión bacteriana a una concentración de 1 x 108 UFC/mL, la cual fue aplicada directamente en la raíz de plántulas de brócoli. Demostraron que la aplicación de la suspensión aumenta en un 31 % el rendimiento total, en un 25 % el rendimiento de la cabeza y en un 16 % el diámetro de la cabeza; esto se explica con el aumento en la fijación de nitrógeno y la producción de fitohormonas por las cepas de Bacillus. Yildirim et al. (2010) también demostraron que la eficiencia en la aplicación de la suspensión bacteriana aumenta si también se realiza una fertilización basal orgánica, ya que durante el periodo reproductivo los minerales acumulados pasarán a las partes reproductivas de la planta.
Conclusiones
El análisis molecular de las cuatro cepas bacterianas del género Bacillus determinó que pertenecen a las especies de B. licheniformis (IB10), B. megaterium (CT11), B. subtilis (AB8) y B. megaterium (CT5). En el ensayo de producción de auxinas, B. licheniformis obtuvo 11,40 µg/mL, seguida por B. megaterium, con 8,90 µg/mL. En cuanto al ensayo de solubilización de fósforo, B. megaterium obtuvo un valor de 43,22 µg/mL y B. licheniformis con 41,75 µg/mL.
Aplicaciones semanales de B. megaterium en plántulas de lechuga influyeron significativamente en el aumento de materia seca, longitud de raíz y peso de raíz; por otro lado, en la variable de “altura” se obtuvo mejores resultados con aplicaciones semanales de B. licheniformis, en comparación con el testigo. En las plántulas de brócoli, la aplicación semanal de B. licheniformis influyó significativamente en el aumento de la altura, grosor y materia seca, mientras que con aplicaciones semanales de B. megaterium, la longitud y el peso de la raíz fueron valores mayores, en comparación con el testigo.
Finalmente, en ambas especies hortícolas se pudo evidenciar un efecto positivo en el desarrollo vegetal con la aplicación de bacterias pertenecientes al género Bacillus.
Agradecimientos
Los autores agradecen a la Ph. D. María Elena Maldonado, coordinadora del grupo de investigación BioARN, por su apoyo al proyecto.
REFERENCIAS
Acurio, R., Tenorio, E., Collaguazo, L., Chiluisa, V., & Vaca, I. (2020). Evaluation of Bacillus megaterium strain AB4 as a potential biocontrol agent of Alternaria japonica, a mycopathogen of Brassica oleracea var. italica. Biotechnology Reports, 26, https://doi.org/10.1016/j.btre.2020.e00454 [ Links ]
Acuña, J., Jorquera, M., Martínez, O., Menezes-Blackburn, D., Fernández, M., Marschner, P., Greiner, R., & Mora, M. (2011). Indole acetic acid and phytase activity produced by rhizosphere bacilli as affected by pH and metals. Journal of Soil Science and Plant Nutrition, 11(3). 1-12. http://dx.doi.org/10.4067/S0718-95162011000300001 [ Links ]
Bashan, Y., Salazar, B., Moreno, M., Lopez, B., & Linderman, R. (2012). Restoration of eroded soil in the Sonoran Desert with native leguminous trees using plant growth-promoting microorganisms and limited amounts of compost and water. Journal of Environmental Management, 102, 26-36. https://doi.org/10.1016/j.jenvman.2011.12.032 [ Links ]
Bhattacharyya, P., & Jha, D. (2012). Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World Journal of Microbiology and Biotechnology, 28(1), 1327-1350. https://doi.org/10.1007/s11274-011-0979-9 [ Links ]
Bobadilla, C., & Rincón, S. (2008). Aislamiento y producción de bacterias fosfato solubilizadoras a partir de compost obtenido de residuos de plaza [Undergraduate thesis, Pontificia Universidad Javeriana]. Repositorio Institucional. https://javeriana.edu.co/biblos/tesis/ciencias/tesis130.pdf [ Links ]
Camelo, M., Vera, S., & Bonilla, R. (2011). Mecanismos de acción de las rizobacterias promotoras del crecimiento vegetal. Ciencia y Tecnología Agropecuaria, 12(2), 159-166. https://doi.org/10.21930/rcta.vol12_num2_art:227 [ Links ]
Cassán, F., Perrig, D., Sgroy, V., Masciarelli, O., Penna, C., & Luna, V. (2009). Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.). European Journal of Soil Biology, 45(1), 28-35. https://doi.org/10.1016/j.ejsobi.2008.08.005 [ Links ]
Chávez, L. A., Hernández, A., Cabrera, J. A., Luna, L., & Pacheco, J. R. (2016). Aislados de Bacillus provenientes de la rizósfera de cactus incrementan la germinación y la floración en Mammillaria spp. (Cactaceae). Revista Argentina de Microbiología, 48(4), 333-341. https://doi.org/10.1016/j.ram.2016.09.001 [ Links ]
Correa, O. (2016). Los microorganismos del suelo y su rol indiscutido en la nutrición vegetal. En Z. Martín, C. Fernández, & R. Lavado (Eds.), Aportes de la microbiología a la producción de los cultivos. (1a ed, pp. 1-10). Editorial de la Facultad de Agronomía. https://www.researchgate.net/publication/306960003_LOS_MICROORGANISMOS_DEL_SUELO_Y_SU_ROL_INDISCUTIDO_EN_LA_NUTRICION_VEGETAL [ Links ]
González, H., & Fuentes, N. (2017). Mecanismo de acción de cinco microorganismos promotores de crecimiento vegetal. Revista de Ciencias Agrícolas, 34(1), 17-31. http://dx.doi.org/10.22267/rcia.173401.60 [ Links ]
Grageda, O., Díaz, A., Peña, J., & Vera, A. (2012). Impacto de los biofertilizantes en la agricultura. Revista Mexicana de Ciencias Agrícolas, 3(6), 1261-1274. https://doi.org/10.29312/remexca.v3i6.1376 [ Links ]
Gutiérrez-Chávez, A., Hernández-Huerta, J., Robles-Hernández, l., & González-Franco, A. (2019). Rizobacterias promotoras de crecimiento vegetal en lechuga (Lactuca sativa L.) bajo sistema aeropónico. Revista Mexicana de Fitosanidad, 3(1), 1-10. http://www.revimexfito.com.mx/files1/Remefi%203_1/REMEFI_3(1)_1-10_2019.pdfe [ Links ]
Instituto Nacional de Estadística y Censos. (2016). Índice de publicación ESPAC 2015. https://www.ecuadorencifras.gob.ec/documentos/webinec/Estadisticas_agropecuarias/espac/espac_20142015/2015/Presentacion%20de%20resultados%20ESPAC_2015.pdf [ Links ]
Instituto Nacional de Estadística y Censos. (2018). Encuesta de Superficie y Producción Agropecuaria Continua, ESPAC.https://www.ecuadorencifras.gob.ec/estadisticas-agropecuarias-2/ [ Links ]
Maccarrone, A., Benzzo, M., & Seluy, L. (2016). Aislamiento y selección de microorganismos de género Bacillus con actividad antifúngica y/o promotora del crecimiento. Encuentro de jóvenes investigadores, Universidad Nacional de Litoral. https://bibliotecavirtual.unl.edu.ar:8443/bitstream/handle/11185/2079/RCB12.pdf [ Links ]
Martínez, L., Peniche, R., Iturriaga, M., Medrano, S., & Pacheco, J. (2013). Caracterización de rizobacterias aisladas de tomate y su efecto en el crecimiento de tomate y pimiento. Revista Fitotecnia Mexicana, 36(1), 63-69. https://doi.org/10.35196/rfm.2013.1.6373802013000100007 [ Links ]
Moreno, A., Carda, V., Reyes, J., Vásquez, J., & Cano, P. (2018). Rizobacterias promotoras del crecimiento vegetal: una alternativa de biofertilización para la agricultura sustentable. Revista Colombiana de Biotecnología, 20(1), 68-83. https://doi.org/10.15446/rev.colomb.biote.v20n1.73707 [ Links ]
Mota, L. (2013). Utilización de un medio enriquecido con melazas para la producción de biomasa de Bacillus licheniformis con potencial biofertilizante [Master's thesis, Universidad Tecnológica de la Mixteca]. http://jupiter.utm.mx/~tesis_dig/11621.pdf [ Links ]
Navarro, J. (2010). La técnica del área bajo la curva. http://www.kerwa.ucr.ac.cr/handle/10669/585 [ Links ]
Posada, L. (2017). Promoción de crecimiento vegetal de Bacillus subtilis EA-CB0575, colonización rizosférica y potencial genómico y bioquímico [PhD thesis, Universidad Nacional de Colombia]. Repositorio BDigital. http://bdigital.unal.edu.co/57419/1/43979285.2017.pdf [ Links ]
Ramírez, R., Camacho, A., Reyes, G., & Esquivel, R. (2015). Técnicas básicas de microbiología y su fundamento. Trillas. [ Links ]
Ramírez, L., Lozano, L., Méndez, M., Rojas, S., & Torres, J. (2017). Bacillus spp: una alternativa para la promoción vegetal por dos caminos enzimáticos. Nova, 15(27), 46-65. https://doi.org/10.22490/24629448.1958 [ Links ]
Rodríguez, O., Aguilera, I., & Pérez, R. (2013). Adecuación de un micrométodo colorimétrico para la cuantificación de fósforo soluble en cultivos microbianos. Revista Cubana de Química, 25(1), 3-8. http://www.redalyc.org/pdf/4435/443543730001.pdf [ Links ]
Sambrook, J., & Russell, W. (2001). Molecular Cloning. A Laboratory Manual (3.ª ed.). Cold Spring Harbor Laboratory Press. [ Links ]
Sánchez, B., García, A., Romero, A., & Bonilla, R. (2014). Efecto de rizobacterias promotoras de crecimiento vegetal solubilizadoras de fosfato en Lactuca sativa cultivar White Boston. Revista Colombiana de Biotecnología, 16(2), 122-128. https://doi.org/10.15446/rev.colomb.biote.v16n2.41077 [ Links ]
Sánchez, D., & Pérez, J. (2018). Caracterización y evaluación de PGPRs sobre el crecimiento de plántulas de Dioscorea rotundata in vitro. Agronomía Costarricense, 42(2), 75-91. https://doi.org/10.15517/rac.v42i2.33780 [ Links ]
Stoll, A., Olalde, V., & Bravo, J. (2018). Efecto de bacterias promotoras del crecimiento vegetal andinas sobre el crecimiento de plántulas de lechuga bajo condiciones industriales. Biotecnología y Sustentabilidad,1(1), 36-40. http://revistas.uaz.edu.mx/index.php/biotecnologiaysust/article/view/165 [ Links ]
Tejera, B., Heydrich, M., & Rojas, M. (2013). Aislamiento de Bacillus solubilizadores de fosfatos asociados al cultivo del arroz. Agronomía Mesoamericana, 24(2), 357-364. https://doi.org/10.15517/am.v24i2.12535 [ Links ]
Tejera, B., Rojas, M. M., & Heydrich, M. (2011). Potencialidades del género Bacillus en la promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. Revista CENIC Ciencias Biológicas, 42(3), 131-138. http://www.redalyc.org/pdf/1812/181222321004.pdf [ Links ]
Vivanco, R., Molina, D., Morales, Y., Quintero, V., Munive, A., & Muñoz, J. (2016). Reto agrobiotecnológico: inoculantes bacterianos de segunda generación. Alianzas y Tendencias, 1(1), 9-19. https://www.researchgate.net/publication/307540839_Reto_agrobiotecnologico_inoculantes_bacterianos_de_segunda_generacion [ Links ]
Weisburg, W., Barns, S., Pelletier, D., & Lane, D. (1991). 16S ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology, 173(2), 697-703. https://doi.org/10.1128/jb.173.2.697-703.1991 [ Links ]
Yildirim, E., Karlidag, H., Turan, M., & Donmez, M. F. (2010, February 20-24). Potential use of plant growth promoting rhizobacteria in organic broccoli (Brassica oleracea L., var. italica) Production [Paper]: Ecofruit. 14th International Conference on Organic Fruit-Growing. Proceedings for the conference, Hohenheim, Germany. https://www.ecofruit.net/2010/34_RP_E_Yildrim_H_Karlidag_M_Turan_M_F_Donmez_S227bis235.pdf [ Links ]
Recibido: 20 de Mayo de 2019; Aprobado: 04 de Marzo de 2020











 text in
text in