Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera Sep./Dec. 2020 Epub Aug 31, 2020
https://doi.org/10.21930/rcta.vol21_num3_art:1344
Fisiología vegetal
Optimización de la prueba de tetrazolio para evaluar la viabilidad en semillas de Solanum lycopersicum L.
1Universidad Francisco de Paula Santander. San José de Cúcuta, Colombia
2Universidad Francisco de Paula Santander. San José de Cúcuta, Colombia
3Universidad Francisco de Paula Santander. San José de Cúcuta, Colombia
El tomate (Solanum lycopersicum) es una de las hortalizas más consumidas en el mundo con un aumento en su demanda, por lo que conocer la viabilidad de sus semillas es de suma importancia, ya que estas son la base del éxito de su producción. Debido a esto, el presente estudio tuvo como objetivo optimizar la prueba de tetrazolio determinando el pretratamiento adecuado para potenciar la prueba. El material vegetal se recolectó de cultivos establecidos en el municipio del Cáchira, departamento de Norte de Santander, Colombia. Las semillas se extrajeron de los frutos maduros y, posteriormente, se expusieron a pretratramientos con hipoclorito de sodio y agua destilada durante 10 minutos, con tres concentraciones de 2, 3, 5- cloruro trifenil tetrazolio (0,25%, 0,15% y 0,10%) y distintos tiempos de exposición (6 h, 12 h y 24 h). Los datos de viabilidad obtenidos se corroboraron mediante la prueba de germinación en toallas de papel húmedas. Los resultados de viabilidad más relacionados con la prueba de germinación se obtuvieron al emplear las concentraciones de 0,25% y 0,15%, utilizando tanto el pretratamiento con hipoclorito de sodio como la inmersión en agua destilada.
Palabras clave calidad de las semillas; cloruro de trifenil tetrazolio; germinación de las semillas; pretratamiento; tomate
Tomato (Solanum lycopersicum) is one of the most consumed vegetables worldwide with increasing demand. Therefore, knowing its seeds viability is of utmost importance since these are the basis of their production success. Accordingly, the study aimed at optimizing the tetrazolium test by determining the appropriate pretreatment to enhance it. Plant material was collected from crops established in the municipality of Cáchira, department of Norte de Santander, Colombia. The seeds were extracted from ripe fruits and subsequently exposed to preconditioning with sodium hypochlorite and distilled water for 10 minutes, with three concentrations of 2,3,5-triphenyl tetrazolium chloride (0.25%, 0.15%, and 0.10%) and different exposure times (6 h, 12 h, and 24 h). The viability data obtained were corroborated by the germination test on wet paper towels. The viability results with the highest correlation with the germination test were obtained using the 0.25% and 0.15% concentrations, and utilizing the pre-conditioning treatment with sodium hypochlorite as well as immersion in distilled water.
Keywords pretreatment; seed germination; seed quality; tomato; triphenyl tetrazolium chloride
Introducción
El tomate Solanum lycopersicum L. (Solanaceae) es uno de los cultivos de hortalizas más importantes en todo el mundo (Elkelish et al., 2020; Vásquez & Castaño, 2017; Yuqing et al., 2018). Este se consume tanto fresco como procesado (Mahieddine et al., 2018) y ha tenido un aumento en su producción por su alta demanda (Ahmad et al., 2017; Katirci et al., 2018). Es un cultivo económicamente importante en diversos países (Ebrahim & Saleem, 2017), que sitúa su origen en la región andina de Colombia, Chile, Perú y Bolivia. Sin embargo, hay indicios de que se domesticó principalmente en México (Medina et al., 2017; Rahman et al., 2018). Además, el tomate es considerado un alimento saludable por sus propiedades, atribuidas principalmente al componente denominado licopeno (Navarro & Periago, 2016), que se caracteriza por presentar una alta actividad antioxidante, vitamínica, antiinflamatoria y antiproliferativa (Amjad et al., 2018; Chen et al., 2019). También se asocia con una serie de beneficios en la salud, como reducir el riesgo de padecer enfermedades cardiovasculares crónicas y cáncer (Adekiya & Agbede, 2017; Johnson et al., 2019). Además, contiene β-caroteno, vitaminas C y E (Elbadrawy & Sello, 2016; Park et al., 2018), y compuestos fenólicos (Tembe et al., 2018) como flavonoides y polifenoles (Amin et al., 2018).
Las semillas son el soporte de la industria agrícola (Zhang et al., 2018); por lo tanto, generar información sobre la calidad de la semilla es de gran importancia para asegurar una rápida germinación y uniformidad de las plantas en campo (Faber et al., 2015), y para la conservación en bancos de germoplasma (Al-Hammad & Al-Ammari, 2017). Debido a la gran importancia de este parámetro (calidad de la semilla), se han desarrollado diversos métodos; para ello, incluso se ha implementado espectroscopia de infrarrojo cercano (Shrestha et al., 2017). Sin embargo, la agricultura necesita pruebas prácticas y factibles en tiempo y recursos, entre las que se destaca la tinción topográfica con tetrazolio (TZ), por ser una prueba económica, eficaz y rápida (Lima et al., 2018) para determinar la viabilidad de cualquier tipo de semilla (Costa et al., 2018).
El empleo de métodos rápidos para conocer la viabilidad es importante, con el fin de acelerar la toma de decisiones en cuanto al manejo de los lotes de semillas (Medeiros et al., 2015). Esta prueba se basa en la actividad de las enzimas deshidrogenasas que reducen la sal de TZ (cloruro 2, 3, 5-trifeniltetrazolio) en los tejidos vivos de la semilla, al generar trifenil formazan, un compuesto de color rojo no difusible, lo cual indica actividad respiratoria y viabilidad de las células y tejidos; por el contrario, los tejidos muertos no presentan coloración (Campos & Kossmann, 2017; Cripa et al., 2014; Salazar et al., 2018; Salazar, Quintero, & Bustos, 2020). No obstante, para que la absorción de la solución de TZ sea adecuada y los resultados de la prueba sean propicios, algunas especies necesitan que sus semillas se preparen antes de la inmersión en la solución de TZ, procedimientos conocidos como preacondicionamientos o pretratamientos (Caravita & Takaki, 2014; Jácome & Dos Santos, 2010; Nascimento et al., 2016). Existen diversos pretratamientos, entre los que se encuentra la hidratación, que promueve la activación del sistema enzimático para obtener una tinción más nítida (Leitzke et al., 2017), Asimismo, cuando las semillas tienen capas duras, se recomienda escarificarlas antes de la tinción y, para esto, suele utilizarse el hipoclorito de sodio, más eficiente aún que el ácido sulfúrico (Vásquez et al., 2019).
Además, de la importancia del pretratamiento, existen otros parámetros como la concentración de la solución, el tiempo de exposición y la temperatura, que son esenciales para el ajuste de la metodología adaptada para cada especie (Gimenez et al., 2014; Pereira et al., 2017; Torres et al., 2018). Generalmente, se busca mejorar las metodologías, con el fin de utilizar concentraciones de la solución de tetrazolio más bajas (Salazar, Quintero, & Moreno, 2020; Salazar, Quintero, & Rojas, 2020), optimizando así el uso de los recursos financieros del laboratorio; de esta forma, se puede analizar una gama más amplia de muestras (Leitzke et al., 2017). Según lo anterior este estudio tiene como objetivo determinar la eficacia de los pretratamientos para la optimización de la prueba de tetrazolio en las semillas de S. lycopersicum.
Materiales y métodos
Material vegetal
Los frutos maduros de tomate chonto variedad Libertador fueron colectados de cultivos establecidos en el municipio de Cáchira (07°44'27"N; 73°02'55"O) a una altitud de 2.025 m s.n.m., en el departamento de Norte de Santander, Colombia. Las semillas fueron retiradas de los respectivos frutos y secadas a temperatura ambiente; además, se mantuvieron en bolsas de papel kraft durante 20 minutos, en un ambiente controlado (20 °C y 55% HR), para evitar el deterioro durante el estudio (Santos et al., 2007). La investigación se llevó a cabo en el laboratorio de Biología, ubicado en la Facultad de Ciencias Básicas, en la Universidad Francisco de Paula Santander.
Pretratamiento y viabilidad de semillas
Con el fin de optimizar la eficacia de la prueba y comparar dos de los compuestos más usados, se estudiaron los siguientes pretratamientos: la inmersión en agua destilada, con comprobada eficacia como pretratamiento en semillas de soja (Pereira et al., 2019); acondicionamiento osmótico en la solanácea Physalis ixocarpa Brot. (Marín et al., 2007; Lallana & García, 2013); hipoclorito de sodio al 1,0% con comprobada eficacia como acondicionamiento químico en solanáceas y brasicáceas (Valqui, 2017; Vásquez et al., 2019), por un lapso de 10 minutos. Asimismo, se utilizó un control que consistió en la no aplicación de pretratamiento (Benítez et al., 2013). Para esto, se implementó el método de jeringuilla descrito por Salazar (2012): un grupo de semillas se colocó dentro de una jeringa de 5 mL, equipada con un filtro de tela (Salazar & Vega, 2017); al final del periodo de pre-tratamientos se realizaron tres enjuagues con agua destilada para eliminar los sobrantes de la solución de cloro. Se utilizaron 5 réplicas de 100 semillas, a las cuales se les adicionó 5 mL de la solución de TZ a tres concentraciones (0,25%, 0,15% y 0,1%), y tres tiempos de exposición (6 h, 12 h y 24 h), a una temperatura de 25 °C, en condiciones de oscuridad. La viabilidad de las semillas se clasificó con la ayuda de un estereoscopio microscopio LEICA EZ4, tomando como parámetro su coloración roja.
Prueba de germinación
Los datos de viabilidad obtenidos se corroboraron mediante una prueba de germinación (Espitia et al., 2017). Se utilizaron cinco repeticiones de 100 semillas cada una; se colocaron a germinar en toallas de papel humedecidas con agua destilada en una cantidad equivalente a 2,5 veces la masa del sustrato seco (Carvalho et al., 2013; Macedo et al., 2017; Oliveira et al., 2018), en un recipiente plástico previamente desinfectado, en condiciones de oscuridad durante 72 horas (Salazar & Botello, 2018). Fueron consideradas semillas germinadas aquellas que presentaron la radícula de al menos tres milímetros de largo (Kaye et al., 2018), y se expresó como porcentaje de germinación.
Análisis estadísticos
Con los datos obtenidos, se efectuó el análisis de varianza ANOVA para determinar el efecto de los tratamientos sobre las semillas viables de tomate. Las medias se compararon con la prueba de rango múltiple DSH (Diferencia Significativa Honesta) de Tukey, para determinar si existen diferencias significativas con la probabilidad de p ≤ 0,05, con la ayuda del software estadístico Statgrafic Centurion versión XVI.
Resultados y discusión
Prueba de tetrazolio
El porcentaje de viabilidad de las semillas fue afectada significativamente por el tiempo de exposición (24 h en la tabla 1), concentración de la solución de tetrazolio (0,25% con medias por encima del resto de concentraciones) y los pretratamientos aplicados (el uso de cloro 1% estuvo por encima de control y agua destilada), corroborando así la importancia de estos parámetros y lo necesario que es manejarlos para optimizar la prueba de tetrazolio. Pereira et al. (2019) resaltan la importancia de preparar la semilla antes de la exposición a la solución de tetrazolio, ya que al pretratar las semillas de Glycine max L. (Fabaceae) con agua se obtuvo una coloración más nítida del embrión, lo que facilitó la clasificación. El tiempo de exposición y concentración es un parámetro determinante en la prueba de TZ ya que, en los diversos ensayos practicados, el desarrollo de la prueba mantuvo un patrón similar, a mayor periodo y concentración (0,15% es mayor, pero sin diferencias significativas con 0,25%), aumenta la intensidad de la tinción en los tejidos vivos (tabla 1); por lo tanto, se facilita la clasificación de las semillas viables e inviables (Lamarca & Barbedo, 2014).
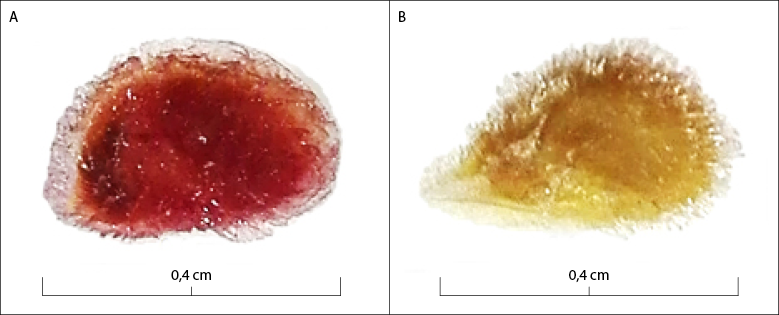
Fuente: Elaboración propia
Figura 1 Viabilidad de semillas de S. lycopersicum usando la prueba de tetrazolio. A. Semilla viable; B. Semilla no viable
Tabla 1 Viabilidad de semillas de S. lycopersicum sometidas a tres pretratamientos y evaluadas por la prueba de tetrazolio
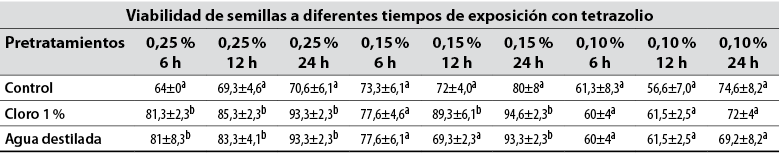
Nota. Los valores con diferente letra de cada columna indican diferencias estadísticamente significativas según Tukey HSD (p ≤ 0,05).
Fuente: Elaboración propia
Sin embargo, los porcentajes más altos de viabilidad (94,6% y 93,3%) se obtuvieron al implementar una concentración del 0,15% durante 24 horas, tanto en el pretratamiento con hipoclorito de sodio (NaClO) como el de agua destilada, respectivamente, siendo estos estadísticamente homogéneos entre sí (tabla 1). Así, se resalta la importancia de preparar las semillas antes de sumergirlas en la solución de TZ, en relación con el control (Mendes et al., 2009), de manera que se logró obtener resultados semejantes de viabilidad sin diferencias significativas de las semillas de tomate al emplear tanto la concentración de 0,25% (70,6 ± 6ª en control, 93,3 ± 2,3b con el uso de cloro 1% y 93,3 ± 2,3b con el uso de agua destilada) como en 0,15% (80 ± 8ª en el pretratamiento control, 94,6 ± 2,3b con el uso de cloro y 93,3 ± 2,3b en el pretratamiento de agua destilada) en un tiempo de exposición de 24 horas (tabla 1).
Estos resultados se correlacionan con los obtenidos por Jácome y Dos Santos (2010), que recomiendan usar una concentración de 0,15% para evaluar la viabilidad en semillas de Leucaena leucocephala (Lam.) de Wit. (Fabaceae). Las metodologías adecuadas deben permitir un buen desarrollo de la prueba y varía dependiendo de la especie evaluada; por ejemplo, Lamarca y Barbedo (2014) estudiaron tres especies del género Eugenia L. (Myrtaceae) que requirieren distintas concentraciones con el mismo periodo de exposición para un buen desarrollo de la prueba de viabilidad.
Teniendo en cuenta la coloración (figura 1), los valores de viabilidad más bajos se obtuvieron al implementar la concentración del 0,10%, ya que las semillas presentaban una tinción débil, dificultando la interpretación de los resultados, independiente del pretratamiento y del tiempo de exposición a la solución de TZ, siendo estos estadísticamente homogéneos entre sí (tabla 1). La metodología apropiada para la prueba de TZ debe facilitar la diferenciación de tejidos viables de los no viables, y estar en la capacidad de distinguir lotes de semillas con distinta calidad fisiológica (Santos et al., 2017); en este caso, las semillas que no expresaron su coloración se consideraron inviables, cuando la poca tinción puede deberse a la baja concentración de la solución utilizada, por lo que no se recomienda utilizar la concentración de 0,10% para evaluar la viabilidad en semillas de S. lycopersicum.
Estudios realizados por Ribeiro et al. (2010) en semillas de triticale (x. Triticosecale Wittmack, Poaceae) indican que la concentración de 0,1% se puede utilizar para determinar la capacidad germinativa de las semillas; sin embargo, la identificación de las semillas viables se dificulta por la baja tinción de los tejidos. Cabe resaltar que la interpretación de los resultados de la prueba depende de un analista, que debe cumplir ciertos parámetros, como conocer las partes de las semillas, así como tener experiencia y la capacidad suficiente para identificar las semillas (Cripa et al., 2014).
Comparación de germinación y viabilidad
La prueba de germinación permite identificar si las semillas no germinaron por ser latentes, abortadas o presentar daños en el embrión; además, se utiliza para corroborar los resultados de viabilidad obtenidos con la prueba de TZ (Salazar & Botello, 2018). El porcentaje de germinación del 96% evidencia que las semillas presentaban una alta capacidad germinativa; valor que se relaciona directamente con los resultados de viabilidad obtenidos al emplear concentraciones de 0,25% y 0,15% en un periodo de 24 horas y exponer las semillas a pretratamientos de inmersión en hipoclorito de sodio y agua destilada durante 10 minutos (tabla 1), siendo estos tratamientos los más efectivos para evaluar la viabilidad de las semillas de S. lycopersicum, no solo por la gran correlación entre la prueba de germinación y viabilidad, sino porque permite reducir hasta un 0,15% (reducir 0,10% en relación 0,25%) la concentración de la solución de TZ que se va a utilizar sin afectar la eficacia de la prueba y veracidad de los resultados; de este modo, se optimiza la aplicación de los recursos del laboratorio y se permite analizar un mayor número de muestras (Leitzke et al., 2017; Oliveira et al., 2018).
Los valores más altos de viabilidad de las semillas (94,6%) y de mayor correlación con el porcentaje de germinación (96%) se obtuvieron al implementar el pretratamiento con hipoclorito de sodio. Generalmente, este fuerte agente oxidante tiene un amplio uso por sus características desinfectantes; sin embargo, se ha utilizado en semillas de orquídeas con el fin de escarificarlas y estimular su germinación (Cripa et al., 2014; Salazar & Botello, 2018; Salazar, Botello, & Quintero, 2019; Salazar & Maldonado, 2020; Salazar, Quintero, & Bustos, 2020; Salazar, Torres, & Rojas, 2019). En diversos estudios este compuesto generalmente impulsa la germinación por medio de la degradación de la cubierta de la semilla (Akbari et al., 2012) y acelera el lavado del ácido abscísico (ABA) endógeno de la semilla (Bae et al., 2013, 2014).
Por lo regular, las semillas con capas duras necesitan ser escarificadas y, para llevar a cabo este proceso, suele utilizarse el NaClO con el propósito de mejorar la efectividad de la tinción (Salazar & Vega, 2017). En semillas de Cypripedium lentiginosum P.J. Cribb & S.C. Chen (Orchidaceae) se emplea este compuesto para producir una escarificación de la testa de la semilla, de tal forma que aumente su naturaleza hidrófila por la oxidación de la pared celular (Jiang et al., 2017). La disminución de sus características hidrófobas permite un mayor contacto de la solución de tetrazolio con los tejidos de la semilla, logrando así una tinción óptima, lo que facilita la distinción entre simientes viables e inviables, aumentando la seguridad de la interpretación de los resultados.
De igual manera, la inmersión en agua destilada antes de la tinción ofrece una opción viable para optimizar la prueba de viabilidad. Esto concuerda con lo obtenido por Lallana y García (2013), quienes obtuvieron buenos resultados de viabilidad implementando la inmersión en agua destilada en semillas de Trichocentrum jonesianum (Rchb. F.) M.W. Chase & N.H. Williams (Orchidaceae). El éxito de este pretratamiento radica principalmente en la activación de las enzimas deshidrogenasas, encargadas de liberar los iones de hidrógeno que reducen la sal de tetrazolio a formazan, lo que permite una coloración de los tejidos adecuada, facilitando la clasificación de los lotes de semillas (Carvalho et al., 2014; Oliveira et al., 2018). Asimismo, se evidenció que no fue necesario romper la testa de la semilla para obtener datos exactos sobre la viabilidad en relación con la germinación.
Realizar el pretratamiento con hipoclorito de sodio o agua destilada, empleando una concentración 0,15% de la solución y un tiempo de exposición de 24 horas en semillas de tomate, permite generar información sobre la calidad de la semilla, revelando aspectos importantes de un lote de semillas ya sea para su conservación o para su siembra (Duarte et al., 2017); además, emplear semillas de alta calidad en la siembra del cultivo asegura una rápida germinación y emergencia, así como uniformidad de las plántulas en el lote (Faber et al., 2015).
Conclusiones
La utilización de agua destilada e hipoclorito de sodio al 1%, como pretratamiento en semillas de S. lycopersicum, aumenta la eficacia de la prueba de tetrazolio, al usarse las concentraciones de 0,25% y 0,15%, durante 24 horas. Asimismo, la utilización de tetrazolio al 0,10% no garantiza la eficacia de la prueba en semillas de tomate.
Agradecimientos
A la Universidad Francisco de Paula Santander por su valiosa colaboración.
REFERENCIAS
Adekiya, A. O., & Agbede, T. M. (2017). Effect of methods and time of poultry manure application on soil and leaf nutrient concentrations, growth and fruit yield of tomato (Lycopersicon esculentum Mill). Journal of the Saudi Society of Agricultural Sciences, 16(4), 383-388. http://dx.doi.org/10.1016/j.jssas.2016.01.006 [ Links ]
Ahmad, M. K., Javed, S. B., Ahmed, K. K., Nadeem, F., Yousaf, B., & Umer, H. J. (2017). Morphological and physico-biochemical characterization of various tomato cultivars in a simplified soilless media. Annals of Agricultural Sciences, 62(2), 139-143. https://doi.org/10.1016/j.aoas.2017.10.001 [ Links ]
Akbari, M., Akbari, M., Akbari, D., & Sajedi, N. A. (2012). Influence of sodium hypochlorite on seed germination and early seedling growth of rice (Oryzasativa L.) variety Tarum. Research on Crops, 13(1), 11-15. [ Links ]
Al-Hammad, B. A., & Al-Ammari, B. S. (2017). Seed viability of five wild Saudi Arabian species by germination and X-ray tests. Saudi Journal of Biological Sciences, 24(6), 1424-1429. http://doi.org/10.1016/j.sjbs.2017.04.004 [ Links ]
Amin, R. L., Chaudhary, C., Khan, S., & Chandra, A. (2018). Induction of mutagenized tomato populations for investigation on agronomic traits and mutant phenotyping. Journal of the Saudi Society of Agricultural Sciences, 17(1), 51-60. http://doi.org/10.1016/j.jssas.2016.01.002 [ Links ]
Amjad, M. B., Mahmood, A. A., Ali, K. K., Ishaq, M. A. R., Javed, M. A., Sagheer, A., & Tariq, M. (2018). Role of pollination in yield and physicochemical properties of tomatoes (Lycopersicon esculentum). Saudi Journal of Biological Sciences, 25(7), 1291-1297. https://doi.org/10.1016/j.sjbs.2017.10.006 [ Links ]
Bae, K. H., Suk, M. K., Hyun, M. L., Young, N. K., Mo, J. S., & Song, G. (2013). Effects of NaOCl treatment on in vitro germination of seeds of a rare endemic plant, Oreorchis coreana Finet. Journal of Plant Biotechnology, 40(1), 43-48. http://doi.org/10.5010/JPB.2013.40.1.043 [ Links ]
Bae, K. H., Hee, K. O., & Kim, S. Y. (2014). Sodium hypochlorite treatment and light-emitting diode (LED) irradiation effect on in vitro germination of Oreorchispatens (Lindl.) Lindl. Journal of Plant Biotechnology, 41(1), 44-49. http://doi.org/10.5010/JPB.2014.41.1.44 [ Links ]
Benítez, S. P., Lobo, M., Delgado, O. A., & Medina, C. I. (2013). Estudios de germinación y remoción de latencia en semillas de papayuelas Vasconcellea cundinamarcensis y Vasconcellea goudotiana. Ciencia y Tecnología Agropecuaria, 14(2), 187-197. https://doi.org/10.21930/rcta.vol14_num2_art:407 [ Links ]
Campos, S. A., & Kossmann, I. D. F. (2017). Seed quality evaluation by tetrazolium staining during a desiccation study of the recalcitrant seeds of Carapa guianensis Aubl. and Carapa surinamensis Miq. – Meliaceae. African Journal of Agricultural Research, 12(12), 1005-1013.http://doi.org/10.5897/AJAR2016.11854 [ Links ]
Caravita, L. A., & Takaki, M. (2014). Teste de tetrazólio para avaliação da qualidade de sementes de Tabebuia roseoalba (Ridl.) Sandwith - Bignoniaceae, submetidas ao armazenamento. Revista Árvore, 38(2), 233-240. https://doi.org/10.1590/S0100-67622014000200003 [ Links ]
Carvalho, T. C., Krzyzanowski, F. C., Castro, O. O., & Panobianco, M. (2013). Tetrazolium test adjustment for wheat seeds. Journal of Seed Science, 35(3), 361-367. http://doi.org/10.1590/S2317-15372013000300013 [ Links ]
Carvalho, T. C., Ribeiro, C. S. G., Castro, O. O., & Panobianco, M. (2014). Adaptation of the tetrazolium test method for estimating the viability of sorghum seeds. Journal of Seed Science, 36(1), 246-252. http://doi.org/10.1590/2317-1545v32n2713 [ Links ]
Chen, D., Huang, C., & Chen, Z. (2019). A review for the pharmacological effect of lycopene in central nervous system disorders. Biomedicine & Pharmacotherapy, 111, 791-801. https://doi.org/10.1016/j.biopha.2018.12.151 [ Links ]
Costa, M. A., Cordeiro, E. S. S., Martins, N. V. L., & Alves, H. P. (2018). Seed quality evaluation by tetrazolium staining of Parkia multijuga Benth. Agricultural Sciences, 9(5), 577-586. https://doi.org/10.4236/as.2018.95040 [ Links ]
Cripa, F. B., Nascimento, L. C. F., Grings, A. C., & Bortolini, M. F. (2014). Tetrazolium test for viability estimation of Eugenia involucrata DC. and Eugenia pyriformis Cambess. seeds. Journal of Seed Science, 36(3), 305-311. http://dx.doi.org/10.1590/2317-1545v36n3991 [ Links ]
Duarte, E. R., Mangeòn, V., Küppers, G., Rocha, P., & Niella, F. (2017). Tamaño y viabilidad de semillas: implicancias en la evolución y conservación de Phaius tankervilleae (Orchidaceae). Caldasia, 39(2), 388-399. https://doi.org/10.15446/caldasia.v39n2.62184 [ Links ]
Ebrahim, M. K. H., & Saleem, A. R. (2017). Alleviating salt stress in tomato inoculated with mycorrhizae: Photosynthetic performance and enzymatic antioxidants. Journal of Taibah University for Science, 11(6), 850-860. http://doi.org/10.1016/j.jtusci.2017.02.002 [ Links ]
Elbadrawy, E., & Sello, A. (2016). Evaluation of nutritional value and antioxidant activity of tomato peel extracts. Arabian Journal of Chemistry, 9(2), S1010-S1018. http://dx.doi.org/10.1016/j.arabjc.2011.11.011 [ Links ]
Elkelish, A. A., Alhaithloul, A. S., Qari, H., Soliman, M. H., & Hasanuzzaman, M. (2019). Pretreatment with Trichoderma harzianum alleviates waterlogging-induced growth alterations in tomato seedlings by modulating physiological, biochemical, and molecular mechanisms. Environmental and Experimental Botany, 171, 103946. http://doi.org/10.1016/j.envexpbot.2019.103946 [ Links ]
Espitia, M. C., Cardona, C. A., & Araméndiz, T. (2017). Morfología y viabilidad de semillas de Bombacopsis quinata . Anacardium excelsum. Cultivos Tropicales, 38(4), 75-83. [ Links ]
Faber, M. F., Ribeiro, C. S. G., Pazolini, K., Possenti, J. C., & Panobianco, M. (2015). Criteria for implementation of a tetrazolium test in canola seeds. Journal of Seed Science, 37(4), 222-227. http://doi.org/10.1590/2317-1545v37n4153255 [ Links ]
Gimenez, J. I., Ferreira, G., & Cavariani, C. (2014). Tetrazolium test for assessment of seed viability of atemoya (Annona cherimola Mill. x A. squamosa L.). Journal of Seed Science, 36(3), 357-361. http://doi.org/10.1590/2317-1545v36n31004 [ Links ]
Jácome, C. C., & Dos Santos, C. P. (2010). Teste de tetrazólio em sementes de leucena. Revista Brasileira de Sementes, 32(2), 66-72. https://doi.org/10.1590/S0101-31222010000200008 [ Links ]
Jiang, H., Chen, M. C., & Lee, Y. I. (2017). In vitro germination and low-temperature seed storage of Cypripedium lentiginosum P.J. Cribb & S.C. Chen, a rare and endangered lady's slipper orchid. Scientia Horticulturae, 225, 471-479. http://doi.org/10.1016/j.scienta.2017.07.040 [ Links ]
Johnson, O. E., Ling, N. C., Aniza, Y. Y., & Sukor, R. (2019). Effects of simultaneous UV-C radiation and ultrasonic energy postharvest treatment on bioactive compounds and antioxidant activity of tomatoes during storage. Food Chemistry, 270, 113-122. doi: https://doi.org/10.1016/j.foodchem.2018.07.031 [ Links ]
Katirci, N., Isik, N., Güpür, Ç., Ozge, H. G., Gursoy, O., & Yilmaz, Y. (2018). Differences in antioxidant activity, total phenolic and flavonoid contents of commercial and homemade tomato pastes. Journal of the Saudi Society of Agricultural Sciences, 19(4), 249-254. https://doi.org/10.1016/j.jssas.2018.11.003 [ Links ]
Kaye, T. N., Sandlin, I. J., & Bahm, M. A. (2018). Seed dormancy and germination vary within and among species of milkweeds. AoB PLANTS, 10(2), 1-24. https://doi.org/10.1093/aobpla/ply018 [ Links ]
Lallana, V. H., & García, L. F. (2013). Efecto de pretratamientos en la prueba de viabilidad de semillas de Trichocentrum jonesianum (Orchidaceae). Investigación Agraria, 15(2), 129-132. [ Links ]
Lamarca, E. V., & Barbedo, C. J. (2014). Methodology of the tetrazolium test for assessing the viability of seeds of Eugenia brasiliensis Lam., Eugenia uniflora L. and Eugenia pyriformis Cambess. Journal of Seed Science, 36(4), 427-434. http://doi.org/10.1590/2317-1545v36n41029 [ Links ]
Leitzke, I. C., Meneghello, G. E., Madruga, L. T., Costa, C. J., & Nogueira, V. S. (2017). Methodological adjustments to the tetrazolium test in rice seeds. Journal of Seed Science, 39(1), 41-49. http://dx.doi.org/10.1590/2317-1545v39n1169643 [ Links ]
Lima, C. B., Boaventura, A. C., & Villela, T. T. (2018). Comparing procedures for performing tetrazolium test on carrot seeds. Horticultura Brasileira, 36, 240-245. http://doi.org/10.1590/S0102-053620180216 [ Links ]
Macedo, D. M. S., Alcántara, R. L. B., Gomes, K. R. S., Barros, S. T., & Pereira, A. A. (2017). Viabilidade e vigor de sementes de Poincianella pyramidalis (Tul.) L. P. Queiroz pelo teste de tetrazólio. Revista Ciência Agronômica, 48(2), 381-388. https://doi.org/10.5935/1806-6690.20170044 [ Links ]
Mahieddine, B., Amina, B., Mohamed, S. F., Sana, B., & Wided, D. (2018). Effects of microwave heating on the antioxidant activities of tomato (Solanumly copersicum). Annals of Agricultural Sciences, 63(2), 135-139. https://doi.org/10.1016/j.aoas.2018.09.001 [ Links ]
Marín, J., Mejía, J., Hernández, A., Peña, A., & Carballo, A. (2007). Acondicionamiento osmótico de semillas de tomate de cáscara. Agricultura Técnica en México, 33(2), 115-123. [ Links ]
Medeiros, A. P. S. R., Mendoça, A. F. J., Barros, S. T., Nogueira, N. W., & Oliveira, R. M. F. (2015). Teste de tetrazólio para avaliação da qualidade fisiológica de sementes de Vignaunguiculata (L.) Walp. Revista Ciência Agronômica, 46(3), 638-644. http://doi.org/10.5935/1806-6690.20150048 [ Links ]
Medina, T. S., Arroyo, G. F., & Dzul, J. G. C. (2017). Origin and evolution of tomato production Lycopersicon esculentum in México. Ciência Rural, 47(3), 1-8. http://doi.org/10.1590/0103-8478cr20160526 [ Links ]
Mendes, A. M. S., Bastos, A. A., & Melo, M. G. G. (2009). Padronização do teste de tetrazólio em sementes de Parkia velutina Benoist (Leguminosae – Mimosoideae). Acta amazónica, 39(4), 823-828. http://dx.doi.org/10.1590/S0044-59672009000400010 [ Links ]
Navarro, I. G., & Periago, M. J. (2016). El tomate, ¿alimento saludable y/o funcional? Revista Española de Nutrición Humana y Dietética, 20(4), 323-335. http://doi.org/10.14306/renhyd.20.4.208 [ Links ]
Nascimento, F. O., Barros, S. T., Nogueira, N. W., & Oliveira, R. M. F. (2016). Viability of Simira gardneriana M.R. Barbosa & Peixoto seeds by the tetrazolium test. Journal of Seed Science, 38(1), 007-013. http://doi.org/10.1590/2317-1545v38n1153565 [ Links ]
Oliveira, V. R., Carvalho, A. P., Santos, A. M. O., Bento, M. A. A., & Vinicius, D. L. S. (2018). Adequacy of the tetrazolium test methodology for Stylosanthes capitata Vogel seeds. Journal of Seed Science, 40(4), 435-441. http://doi.org/10.1590/2317-1545v40n4192968 [ Links ]
Park, M. H., Sangwanangkul, P., & Baek, D. R. (2018). Changes in carotenoid and chlorophyll content of black tomatoes (Lycopersicone sculentum L.) during storage at various temperatures. Saudi Journal of Biological Sciences, 25(1), 57-65. doi: http://doi.org/10.1016/j.sjbs.2016.10.002 [ Links ]
Pereira, E. P., Barros, S. T., Nobre, J. P. A., Vaines, F. S. S., & Torquato, R. O. (2017). Tetrazolium test for the viability of gherkin seeds. Revista Ciência Agronômica, 48(1), 118-124. http://doi.org/10.5935/1806-6690.20170013 [ Links ]
Pereira, D. F., Bugatti, P. H., Lopes, F. M., Souza, A. L. S. M., & Saito, P. T. M. (2019). Contributing to agriculture by using soybean seed data from the tetrazolium test. Data in Brief, 23, 103652. http://doi.org/10.1016/j.dib.2018.12.090 [ Links ]
Rahman, M. M. S., Rashid, M. H., Hossain, M. M., & Zakaria, M. (2018). Morphological characterization of tomato (Solanum lycopersicum L.) genotypes. Journal of the Saudi Society of Agricultural Sciences, 19(3), 233-244. https://doi.org/10.1016/j.jssas.2018.11.001 [ Links ]
Ribeiro, C. S., Castro, O. O., Araújo, M. I. G., & Panobianco, M. (2010). Tetrazolium test for evaluating triticale seed viability. Revista Brasileira de Sementes, 32(3), 163-169. https://doi.org/10.1590/S0101-31222010000300018 [ Links ]
Salazar, S. A. M. (2012). Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). Acta Agronómica, 61(1), 69-78. [ Links ]
Salazar, S. A. M., & Vega, N. A. C. (2017). Asymbiotic seed germination and in vitro propagation of Cattleya trianae Linden & Reichb.f. (Orchidaceae). Acta Agronómica, 66(4), 544-548. https://doi.org/10.15446/acag.v66n4.63597 [ Links ]
Salazar, S. A. M., & Botello, E. A. D. (2018). Viabilidad de semillas de Glycine max (L.) utilizando la prueba de tetrazolio. Revista de Investigación Agraria y Ambiental, 9(2), 89-98. https://doi.org/10.22490/21456453.2270 [ Links ]
Salazar, S., Maldonado, H., y Quintero, J. (2018). Evaluación de la calidad fisiológica de las semillas de Linum usitatissimum L. con la prueba de tetrazolio. Avances en Investigación Agropecuaria, 22(3), 25-35. [ Links ]
Salazar, S., Botello, E. & Quintero, J. (2019). Efecto de pretatamientos en la prueba de tetrazolio en semillas de Epidendrum barbaricum Hágsater & Dodson. Acta Agronómica, 68(4), 306-311. https://doi.org/10.15446/acag.v68n4.79619 [ Links ]
Salazar, S. A. M., Torres, C. A. L., & Rojas, J. P. S. (2019). Cytotoxic evaluation of sodium hypochlorite, using Pisum sativum L. as effective bioindicator. Ecotoxicology and Environmental Safety, 173, 71-76. https://doi.org/10.1016/j.ecoenv.2019.02.027 [ Links ]
Salazar, S., Quintero, J., & Rojas, J. (2020). Optimization of the tetrazolium test in three species of orchids of the Andean forest. Australian Journal of Crop Science, 14(5), 822-830. https://doi.org/10.21475/ajcs.20.14.05.p2276 [ Links ]
Salazar, S., Quintero, J., & Moreno, L. (2020). Improvement of the methodology of the tetrazolium test using different pretreatments in seeds of the genus Epidendrum (Orchidaceae). Journal of Seed Science, 42, e202042013. http://doi.org/10.1590/2317-1545v42231028 [ Links ]
Salazar, S., & Maldonado, H. (2020). Evaluation of the cytotoxic potential of sodium hypochlorite using meristematic root cells of Lens culinaris Med. Science of the Total Environment, 701, 134992. https://doi.org/10.1016/j.scitotenv.2019.134992 [ Links ]
Salazar, S., Quintero, J. & Bustos, V. (2020). Implementación de la prueba de tetrazolio en las semillas de Raphanus sativus L. Revista Facultad De Ciencias Básicas, 15(2), 7-15. https://doi.org/10.18359/rfcb.3831 [ Links ]
Santos, M. A. O., Novembre, A. D. L. C., & Marcos-Filho, J. (2007). Tetrazolium test to assess viability and vigour of tomato seeds. Seed Science and Technology, 35(1), 213-223. https://doi.org/10.15258/sst.2007.35.1.19 [ Links ]
Santos, L. M., Marquez, F. C. P. R., Balistiero, M. F., & Américo, C. (2017). Optimization of tetrazolium tests to assess the quality of Platymiscium floribundum, Lonchocarpus muehlbergianus and Acacia polyphylla DC. Seeds. Journal of Seed Science, 39(2), 189-197.http://doi.org/10.1590/2317-1545v39n2167534 [ Links ]
Shrestha, S., Deleuran, L., & Gislum, R. (2017). Separation of viable and non-viable tomato (Solanum lycopersicum L.) seeds using single seed near-infrared spectroscopy. Computers and Electronics in Agriculture, 142(A), 348-355. https://doi.org/10.1016/j.compag.2017.09.004. [ Links ]
Tembe, K. O., Chemining’wa, G., Ambuko, J., & Owino, W. (2018). Evaluation of African tomato landraces (Solanum lycopersicum) based on morphological and horticultural traits. Agriculture and Natural Resources, 52(6), 536-542. https://doi.org/10.1016/j.anres.2018.11.014 [ Links ]
Torres, A. A. S., Walessa, N. N., Barros, S. T., Pereira, C. B., Souza, M. L. N., & Pereira, E. P. (2018). Tetrazolium test to estimate okra (Abelmoschus esculentus (L.) Moench) seed viability. Revista Caatinga, 31(4), 817-822. http://doi.org/10.1590/1983-21252018v31n403rc [ Links ]
Valqui, J. (2017). Desempeño germinativo de semillas de Lepidium meyenii Walpers “maca”: la importancia de las accesiones, la temperatura y los promotores de germinación. [Undergraduate thesis, Universidad Peruana Cayetano Heredia]. Repositorio UPCH. http://repositorio.upch.edu.pe/handle/upch/893 [ Links ]
Vásquez, L. M. R., & Castaño, J. Z. (2017). Manejo integrado de la marchitez vascular del tomate [Fusarium oxysporum f. sp. lycopersici (Sacc.) W.C. Snyder & H.N. Hansen]: una revisión. Revista U.D.C.A Actualidad & Divulgación Científica, 20(2), 363-374. [ Links ]
Vásquez, W., Pupiales, P., Viteri, P., Sotomayor, A., Feican, C., Campaña, D., & Viera, W. (2019). Escarificación química y aplicación de ácido giberélico para la germinación de semillas de cultivares de mora (Rubus glaucus BENTH). Interciencia, 44, 159-164. [ Links ]
Yuqing, W., Yaxian, Z., Zhipeng, G., & Wencai, Y. (2018). Breeding for resistance to tomato bacterial diseases in China: Challenges and prospects. Horticultural Plant Journal, 4(5), 193-207. https://doi.org/10.1016/j.hpj.2018.08.004 [ Links ]
Zhang, T., Wei, W., Zhao, B., Wang, R., Li, M., Yang, L., Wang, J., & Sun, Q. (2018). A reliable methodology for determining seed viability by using hyperspectral data from two sides of wheat seeds. Sensors, 18(3), 1-23. https://doi.org/10.3390/s18030813 [ Links ]
Recibido: 03 de Mayo de 2019; Aprobado: 27 de Abril de 2020











 text in
text in 



