Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia y Tecnología Agropecuaria
versão impressa ISSN 0122-8706versão On-line ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera set./dez. 2020 Epub 31-Ago-2020
https://doi.org/10.21930/rcta.vol22_num1_art:1138
Sanidad vegetal y protección de cultivos
Efecto del extracto de alga Ulva fasciata sobre Pseudocercospora griseola en el cultivo de frijol
1Universidad Técnica de Manabí. Portoviejo
2Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina. Chapecó
3Universidade Federal de Santa Catarina. Florianópolis
La mancha angular es una de las enfermedades foliares más comunes del cultivo de frijol en el sur de Brasil. El objetivo del trabajo fue evaluar el efecto del extracto de la macroalga Ulva fasciata en la severidad de la mancha angular, los niveles de pigmentos foliares y la productividad de los genotipos de frijol común IPR Uirapuru, CF 22 y Mouro graúdo, durante los años 2005 y 2006. Las plantas tratadas con el extracto de alga o el fungicida azoxistrobina se pulverizaron en los estados fenológicos V3, V5, R6 e R7. Plantas no tratadas se utilizaron como testigos. La severidad (%) de la enfermedad se estimó a partir del estado V3, para un total de seis evaluaciones cada año. Los valores de la severidad se calcularon como área bajo la curva de progreso de la enfermedad (ABCPE). En el 2006 se determinaron los pigmentos foliares (clorofila a, b, total y carotenoides) y en los dos años se evaluó el rendimiento de granos, aunque en el 2005 solamente se evaluó el peso de mil granos. En conclusión, el control que ejerce el extracto de U. fasciata sobre la mancha angular depende de la interacción biológica entre el genotipo de frijol y el ambiente. Por otro lado, el extracto no afectó el contenido de los pigmentos foliares ni la producción de granos.
Palabras clave control alternativo; extracto de alga; mancha angular; Phaseolus vulgaris; pigmentos foliares
Angular leaf spot is one of the most common diseases in beans crops in southern Brazil. This research aims to evaluate the effect of the extract from macroalga Ulva fasciata on angular leaf spot severity, foliar pigment content, and yield of common bean genotypes IPR Uirapuru, CF 22, and Mouro graúdo for 2005 and 2006. Plants were sprayed at phenological stages V3, V5, R6, and R7 with the alga extract or fungicide azoxystrobin. Untreated plants served as controls. Disease severity (%) was estimated from the V3 stage, totaling six examinations a year. Severity values were integrated as the area under the disease progress curve (AUDPC). Foliar pigments (chlorophyll a, b, total, and carotenoids) were determined in 2006. Grain yield was evaluated in both years, but the thousand-grain weight in 2005 only. The control exerted by the U. fasciata extract on angular leaf spot depends on the biological interaction between the bean genotype and the environment. The efficiency of U. fasciata extract in controlling angular leaf spot depended on the interaction between bean genotypes and the environment. Besides, the extract did not affect leaf pigment content or grain yield.
Keywords alga extract; alternative control; angular leaf spot; foliar pigments; Phaseolus vulgaris
Introducción
El rendimiento potencial del frijol común Phaseolus vulgaris L. (Fabaceae) es reducido considerablemente por el aparecimiento de enfermedades como la mancha angular causada por el hongo Pseudocercospora griseola (Sacc.) Crous & Braun (Delgado et al., 2013). Esta enfermedad puede reducir la producción hasta en un 70% (Mora-Brenes et al., 1983), principalmente por la defoliación y reducción fotosintética de las plantas (Bergamin Filho et al., 1997; Jesus-Junior et al., 2001). Debido a las condiciones favorables anuales de inóculo del patógeno en los cultivos del sur de Brasil, la mancha angular es una de las enfermedades más importantes que afectan el rendimiento de granos en esta leguminosa.
La resistencia genética de frijol a la mancha angular ha sido la más recomendada, por ser económica, eficiente y de menor riesgo para el medio ambiente. Sin embargo, la gran variabilidad del patógeno dificulta la obtención de cultivares con altos niveles de resistencia (Pastor-Corrales et al., 1998). Como consecuencia, la enfermedad ha sido manejada principalmente por el uso de fungicidas, destacándose algunas estrobilurinas que han presentado un control superior al 80% (Sartorato & Rava, 2003). En la búsqueda de tecnologías de producción menos perjudiciales al hombre y al medio ambiente, el uso de productos naturales o con capacidad para inducir resistencia ha asumido mayor importancia en el área de protección de plantas (Wordell Filho et al., 2007).
Una de las alternativas para el manejo de enfermedades en plantas puede ser el empleo de macroalgas (Paulert et al., 2009). A pesar del potencial, las macroalgas han sido poco exploradas como estimulantes fisiológicos o inductores de resistencia a estreses bióticos (Stadnik & Freitas, 2014). Dentro de este contexto, se conoce que extractos obtenidos de Ulva sp. y sus polisacáridos aplicados preventivamente controlan enfermedades fúngicas en diferentes especies de plantas de importancia agrícola. Por ejemplo, extractos acuosos de Ulva spp. reducen la severidad de la antracnosis (Colletotrichum lindemuthianum) del frijol en 44% (Abreu et al., 2008), la alternariosis (Alternaria porri) de la cebolla pequeña en 70% (Araújo et al., 2012), y de los oídios de la vid, pepino y frijol, en 77, 80 y 90%, respectivamente (Jaulneau et al., 2011). Asimismo, aplicaciones preventivas de Ulva spp., aparte de proteger plantas de carretón (Medicago truncatula) del hongo Colletotrichum trifolii, pueden activar genes relacionados con la biosíntesis de fitoalexinas y de proteínas asociadas a la patogénesis y la pared celular (Cluzet et al., 2004).
Aparte de la inducción de resistencia, los extractos de estas algas parecen tener efecto estimulante en la fisiología de las plantas (Stadnik & Freitas, 2014). Por ejemplo, el fertilizante líquido proveniente de U. lactuca mejora la absorción de nutrientes y aumenta el crecimiento, fotosíntesis y florecimiento de Tagetes erecta (Sridhar & Rengasamy, 2010); además, estimula el metabolismo del nitrógeno en raíces y brotes de haba Vicia faba L. (Fabaceae) (El-Naggar et al., 2005). Por otro lado, la aplicación foliar del extracto metanólico de U. fasciata en plántulas de frijol cultivadas en condiciones de invernadero estimula el crecimiento y la masa fresca de la parte aérea de las plantas infectadas con antracnosis (Paulert et al., 2009).
Generalmente, los patógenos pueden afectar negativamente los pigmentos foliares al causar lesiones en las hojas (Bassanezi et al., 2002). Por ejemplo, C. lindemuthianum reduce los niveles de clorofila y de carotenoides en las hojas de frijol (Lobato et al., 2009). Estos efectos negativos pueden ser evitados con la aplicación de fungicidas (Zhang et al., 2010) o con extractos de algas (Blunden et al., 1997).
Existen varios trabajos con extractos de Ulva spp. y sus componentes como ulvana desarrollados en condiciones de laboratorio. Sin embargo, se carece de estudios que evalúen la eficacia de esos derivados en condiciones de campo. Por lo tanto, el objetivo del presente trabajo fue evaluar el efecto de extracto alcohólico de U. fasciata sobre la severidad de mancha angular, los niveles de pigmentos foliares y la producción de granos de tres cultivares de frijol común del grupo negro.
Materiales y métodos
Los experimentos se establecieron durante los años 2005 (24/02 - 31/05) y 2006 (13/02 - 20/05) en la Estación Experimental de la Empresa de Investigación Agropecuaria y Extensión Rural de Santa Catarina (Epagri) de Ituporanga, región del Valle Alto de Itajaí, SC, Brasil, ubicada en las coordenadas 27°38'S y 49°60'W, a una altitud 475 m s.n.m.
Material biológico y tratamientos
En el presente estudio se emplearon los genotipos de frijol cv. IPR Uirapuru (IAPAR, Londrina-PR), CF 22 y Mouro graúdo (materiales criollos), de hábito de crecimiento indeterminado tipo II. Las plantas fueron tratadas en los estados fenológicos V3, V5, R6 e R7 con el extracto algal (50 mg de masa seca/mL) o con el fungicida azoxistrobina 60 g.i.a./ha (Amistar®, Syngenta), utilizando una fumigadora de mochila con capacidad para 20 L, presión máxima de 75 psi y caudal de 600 mL/min. Plantas no tratadas se utilizaron como testigos.
El extracto algal se preparó de acuerdo con la metodología de Abreu et al. (2008), con modificaciones. Macroalgas verdes de las especies Ulva fasciata fueron colectadas en febrero 2005 en la playa Armação, en Florianópolis-SC (27,4454°S y 48,2956°O), lavadas en agua corriente y rápidamente secadas en una estufa a 50 °C por 48 horas. El material seco fue finamente triturado y el polvo seco mantenido en un recipiente opaco a -20 °C. Para la extracción de los compuestos, se adicionó etanol (98%) al polvo seco, en una relación 3,5:100 (p:v). Después de 24 horas, el extracto fue filtrado en papel filtro Whatman (n.º 4) y evaporado en un rotavapor a 40 °C. Finalmente, la fracción acuosa fue recogida, cuantificada y conservada a 4 °C hasta su utilización.
Condiciones experimentales
Las semillas de frijol tratadas previamente con carbendazim (45 g i.a. por 100 kg de semillas) + tiram (105 g i.a. 100 kg de semillas), se sembraron en un sistema de siembra directa, sobre restos de centeno Secale cereale L. (Poaceae), en las épocas agrícolas 2005 y 2006. Se utilizaron 12 semillas por metro linear resultando en una población de 25 plantas m-2. Las unidades experimentales constaron de un área útil de 7,2 m2, estando cada parcela constituida por cuatro líneas de cuatro metros de largo y 0,45 metros de ancho. Se fertilizó con la composición 5-20-20 (N-P2O5-K2O) en dosis de 250 kg/ha. Las arvenses fueron controladas con la aplicación del herbicida fluazifope-p-butílico (200 g i.a./ha) + fomesafen (250 g i.a./ha), y los insectos plagas con la pulverización de lambda-cialotrina (10 g i.a./ha) en los estados fenológicos V3 e V5.
Evaluación de la mancha angular
Durante los dos años se estimó la severidad (%) de la mancha angular semanalmente a partir del estado fenológico V3, totalizando seis evaluaciones durante cada campaña. Se utilizó una escala de notas de 1 a 9, donde 1 = ausencia de síntomas y 9 = 100% del área foliar afectada (Marques-Júnior et al., 1997). Los promedios (notas) de cada parcela se transformaron a porcentaje y, posteriormente, se integraron como área bajo la curva de progreso de la enfermedad (ABCPE), conforme la ecuación de integración trapezoidal descrita por Campbell y Madden (1990).
Determinación de pigmentos foliares
Los pigmentos foliares se determinaron en el 2006, en diez folíolos jóvenes de frijol completamente expandidos, colectados aleatoriamente en las dos hileras centrales de cada parcela en el estado fenológico R5. Se eliminaron áreas necrosadas (cuando eran existentes) y pecíolo de cada folíolo. Para la extracción de pigmentos foliares, cada muestra de 2 g de tejido foliar (masa fresca) fue macerada en un mortero conteniendo nitrógeno líquido. Rápidamente, se adicionaron 30 mL de acetona (85%) y se agitó durante 2 min. El extracto resultante se filtró en papel filtro (marca Whatman, modelo 40, porosidad: 8 µm) en embudo de Büchner acoplado a una bomba de vacío (caudal de 2,2 m3/hora). La solución obtenida fue completada hasta 50 mL con acetona 85%. Después de la homogenización, se retiró una alícuota de 2 mL y se midió la absorbancia en longitudes de onda de 646, 663 y 470 nm, correspondientes a la absorción de la luz de clorofila a y b, y de carotenoides, respectivamente. Todas las muestras se analizaron por duplicado.
Para el cálculo de los niveles de clorofila a y b, y de carotenoides totales, se emplearon las ecuaciones de Lichtenthaler (1987), siendo el contenido de pigmentos de los extractos convertido a μg/mL. Con esos valores posteriormente se calcularon los pigmentos foliares totales:
Clorofila a (μg/mL) = (12,21 × A663) - (2,81 × A646) Ecuación 1
Clorofila b (μg/mL) = (20,13 × A646) - (5,03 × A663) Ecuación 2
Carotenoides (μg/mL) = [(1.000 × A470) - (3,27 × Ca) - (104,0 × Cb)] / 229 Ecuación 3
Evaluación de la masa de mil granos y el rendimiento
Las plantas se cosecharon cuando alcanzaron la madurez fisiológica. Los valores de rendimiento obtenidos en 2005 y 2006 se transformaron a kilogramos por hectárea (kg/h) y se corrigieron al 13% de humedad. En el 2005 se determinó la masa de mil granos.
Diseño experimental y análisis estadístico
Se empleó un diseño de bloques completos al azar con arreglo factorial 3 × 3 (genotipos × tratamientos), con cuatro réplicas. Para el análisis de los datos, se verificó la existencia de la homogeneidad de las variancias y normalidad de los residuos aplicando las pruebas de Bartlett y de Shapiro-Wilks, respectivamente. Los datos del ABCPE fueron transformados para √x+1. Después de ser satisfechas las presuposiciones, los datos se sometieron a ANOVA de dos vías. Cuando existió diferencia significativa entre los tratamientos, se utilizó la prueba de Tukey (p < 0,05) para comparar las medias. Todos los análisis se realizaron con el software estadístico ASSISTAT, versión 7.5 beta 2012 (Silva & Azevedo, 2002).
Resultados y discusión
Los tres genotipos utilizados fueron susceptibles a mancha angular (figuras 1 y 2). Esto ocurre debido a que ninguno de ellos tuvo como progenitor al cv. Ouro Negro, frecuentemente usado en programas de mejoramiento en Brasil, por ser fuente de genes de resistencia a P. griseola (Pastor-Corrales et al., 1998; Sanglard et al., 2013; Sartorato, 2006). Hasta el momento, únicamente se conoce la susceptibilidad del cv. Uirapuru a mancha angular (Sartorato, 2006).
La mayor severidad final de la enfermedad se observó en los genotipos Mouro Graúdo y CF 22, en 2005 y 2006, respectivamente, con interacción significativa entre los genotipos y los años (figura 1, p < 0,05). Este comportamiento puede haber sido provocado por la diversidad patogénica de P. griseola en Ituporanga. En esta localidad han sido relatados los patotipos 63-23, 63-31 y 63-63, de una muestra de ocho aislados de este hongo (Sartorato, 2002). La gran variabilidad genética (Abadio et al., 2012) y patogénica (Silva et al., 2008) de P. griseola dificulta la obtención de cultivares con resistencia genética duradera. Es posible también que la interacción entre factores ambientales y los genotipos hayan afectado las respuestas de defensa asociadas a la resistencia basal de los genotipos al patógeno de modo diferente (Walters & Heil, 2007).
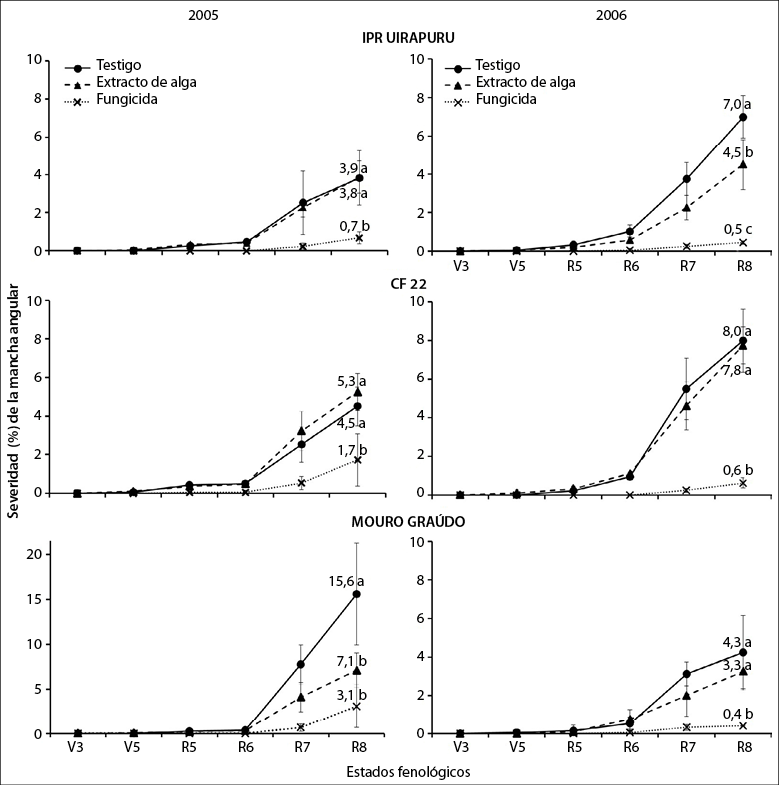
Fuente: Elaboración propia
Figura 1 Progreso temporal de la severidad de la mancha angular en los genotipos de frijol IPR Uirapuru, CF 22 y Mouro graúdo, tratados con extracto de Ulva fasciata y azoxistrobina, en los años 2005 y 2006. Letras minúsculas indican diferencia significativa por la prueba de Tukey (p < 0,05) entre tratamientos para cada genotipo en la última evaluación. Las barras representan el desvío estándar de los promedios de severidad de la enfermedad.
El extracto de U. fasciata disminuyó la severidad final (figura 1) y la ABCPE (figura 2) de mancha angular únicamente en los genotipos Mouro graúdo (52%) e IPR Uirapuru (37%), en los años 2005 y 2006, respectivamente. En estos genotipos, el efecto protector del extracto es semejante a lo relatado en otras enfermedades, como la antracnosis del frijol (Colletotrichum lindemuthianum) en 44% (Abreu et al., 2008), la alternariosis (Alternaria porri) de la cebolla pequeña en 70% (Araújo et al., 2012) y los oídios de la vid, pepino y frijol, en niveles de 77, 80 y 90%, respectivamente (Jaulneau et al., 2011). Sin embargo, Delgado et al. (2013) no encontraron diferencias en la severidad de la mancha angular en el frijol, entre las plantas tratadas con el polisacárido algal ulvana (principal constituyente de las paredes celulares de esa alga). Este hecho denota la importancia de los resultados encontrados en el presente trabajo, ya que sería el primer relato de control de esta enfermedad en frijol en condiciones de campo.
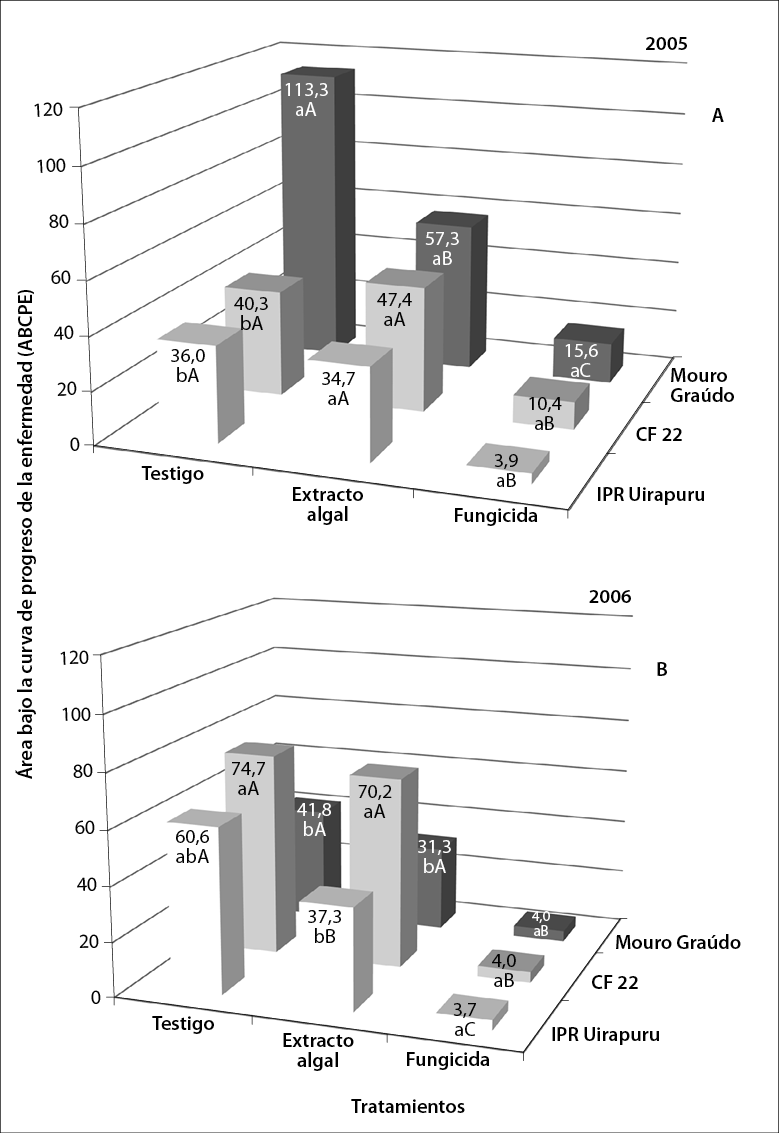
Fuente: Elaboración propia
Figura 2 Área bajo la curva de progreso de la enfermedad (ABCPE) de la mancha angular en los genotipos Mouro graúdo, CF 22 e IPR Uirapuru, tratados con Ulva fasciata y azoxistrobina, en los años 2005 (A) y 2006 (B). Los valores promedios de ABCPE seguidos por la misma letra minúscula en los tratamientos y seguidos por la misma letra en mayúsculas en los genotipos no difieren estadísticamente entre ellos por la prueba de Tukey (p < 0,05)
En los dos años, el fungicida disminuyó significativamente (entre 62 y 93%) la severidad de la enfermedad en todos los genotipos cuando se comparó con los testigos no tratados. Además, el extracto de alga redujo la severidad de mancha angular solo en los genotipos Mouro graúdo (54%) e IPR Uirapuru (36%), en 2005 y 2006, respectivamente (figura 1). Tal vez, la aplicación del extracto de U. fasciata puede haber inducido resistencia en ambos genotipos. Se conoce que aplicaciones preventivas de Ulva spp., aparte de proteger plantas de alfalfa del hongo C. trifolii, pueden activar genes relacionados con la biosíntesis de fitoalexinas y de proteínas asociadas a la patogénesis y la pared celular (Cluzet et al., 2004). Asimismo, el polisacárido ulvana (uno de los componentes del extracto), aparte de proteger plantas de frijol contra C. lindemuthianum, aumenta la actividad de las enzimas peroxidasa (POX) y glucanasa (GLU) en plantas resistentes inoculadas con agua (Freitas & Stadnik, 2012). Ese polisacárido también induce una explosión oxidativa inicial, activando las vías de señalización del ácido salicílico, ácido jasmónico o etileno en plantas contra patógenos (El Modafar et al., 2012: Vera et al., 2011).
Considerando la severidad final (figura 1) y el ABCPE (figura 2), existió interacción significativa entre los genotipos y los tratamientos (p < 0,01). En términos biológicos, hubo también interacción entre los años y los genotipos, pues el genotipo Mouro Graúdo presentó la mayor severidad final de la enfermedad y ABCPE en el 2005, pero una menor severidad en 2006, al compararse con los demás genotipos.
En los dos años, el fungicida disminuyó significativamente (entre 74 y 95%) el ABCPE en todos los genotipos, con relación al testigo (figura 2). Plantas de los genotipos Mouro graúdo e IPR Uirapuru tratados con extracto algal durante 2005 (figura 2A) y 2006 (figura 2B) presentaron una reducción del ABCPE de 49 y 38%, respectivamente, con relación a las plantas testigo. Esto sugiere que, a pesar de que el extracto tiene algún efecto sobre la enfermedad, ese efecto es intermediario y dependiente de interacciones con el genotipo y el ambiente. Interacciones entre genotipos y componentes del extracto de U. fasciata han sido registradas en otros patosistemas (Stadnik & Freitas, 2014). Por ejemplo, el tratamiento preventivo de plantas de frijol con ulvana incrementó la actividad de la enzima GLU en el cv. Pérola, moderadamente susceptible a U. appendiculatus, pero no en el cv. IPR Juriti, altamente susceptible (Borsato et al., 2010). Anteriormente, Delgado et al. (2013), en tres periodos experimentales consecutivos, relataron que ulvana no afectó el desarrollo de la infección natural de mancha angular en dos cultivares de frijol. Por otro lado, la inducción de resistencia puede ser afectada por las condiciones ambientales (Walters & Fountaine, 2009). Esas condiciones pueden afectar la fisiología de plantas, la respuesta al ataque de patógenos, e inclusive la estabilidad de los componentes activos del extracto de U. fasciata, tales como la ulvana (Delgado et al., 2013).
Aunque los niveles de todos los pigmentos foliares fueron similares entre genotipos y entre los tratamientos (fungicida y extracto de U. fasciata), mostraron medias generales de 6,2, 4,8, 11,0 y 0,7 μg/mL para clorofila a, b, total y carotenoides, respectivamente (tabla 1); el contenido de esos pigmentos en algunas plantas puede aumentar con la aplicación de fungicidas (Zhang et al., 2010) o extractos de algas (Blunden et al., 1997). Inclusive, a pesar de que el grupo químico del fungicida causa el denominado efecto reverdeciente (greening effect), observado principalmente en gramíneas (Venancio et al., 2003), no proporcionó un aumento en los pigmentos. Esto tiene su explicación en que los pigmentos foliares fueron solamente determinados en el estado fenológico R5, y no a lo largo del tiempo. Por ejemplo, Zhang et al. (2010), aplicando varios fungicidas, entre ellos azoxistrobina en el cultivo de trigo, no observaron diferencias en el contenido de clorofila al ser comparado ese fungicida al testigo (agua) en estados iniciales (prefloración y floración completa), pero sí en estados avanzados (grano lechoso y pastoso).
Tabla 1 Niveles de clorofila a, b y totales, y carotenoides cuantificados a los 30 días después de la primera aplicación (estado fenológico R5) de extracto de Ulva fasciata y fungicida, en los genotipos de frijol IPR Uirapuru, CF 22 e Mouro graúdo, en el 2006
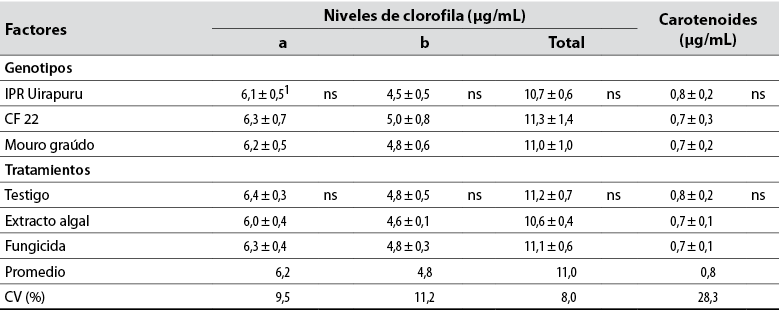
1Valores representados por la media ± la desviación estándar de la media de diez réplicas;
ns:La diferencia entre genotipos o tratamientos no es significativa.
Fuente: Elaboración propia
La mancha angular no afectó los niveles de pigmentos foliares en las plantas de frijol, aunque se conozca que existe una relación negativa entre la enfermedad y la tasa fotosintética (Bassanezi et al., 2001) y la emisión de la clorofila fluorescente (Bassanezi et al., 2002). Dos hipótesis pueden ser colocadas para explicar las discrepancias entre el presente trabajo y los de la literatura. La primera es la cantidad de la enfermedad en folíolos. Al momento de la colecta (R5) de folíolos para la determinación de los pigmentos foliares, la severidad de la mancha angular fue inferior al 1%. Según Lopes y Berger (2001), en uno de los experimentos el contenido de clorofila en áreas no necróticas no disminuyó significativamente en los folíolos de frijol con hasta 20% de severidad de antracnosis. Asimismo, los niveles de clorofila disminuyeron acentuadamente apenas en folíolos inoculados con roya con severidad mayor al 30%. La segunda hipótesis es la localización del patógeno en el folíolo. La clorofila no es significativamente afectada en el área verde de folíolos de frijol con bajos niveles de severidad de antracnosis (Lopes & Berger, 2001). La reducción de la fotosíntesis en el huésped puede ser limitada a las partes afectadas y regiones adyacentes a estas (Moriondo et al., 2005).
Los genotipos Mouro graúdo (433 g) e IPR Uirapuru (4.319 kg/ha) presentaron el mayor peso de mil granos y rendimiento de granos en el 2006, respectivamente. La aplicación del fungicida aumentó el peso de mil granos en 13% y el rendimiento de granos en 21% en 2005 y 12% en 2006, en comparación con los testigos (tabla 2). El extracto algal no aumentó esas variables productivas, debiéndose posiblemente al control de mancha angular ejercido solo en dos genotipos y en años distintos. Esa hipótesis sería confirmada por el hecho de que el fungicida redujo la enfermedad en los tres genotipos durante los dos años, pudiendo explicar así la mayor productividad de granos obtenida en el presente trabajo. Este fungicida, aparte de controlar la antracnosis en frijol, incrementa la emergencia y vigor de las plantas, el número de vainas totales y rendimiento de granos (Pynenburg et al., 2011). Por otro lado, no se evidenció interacción significativa entre los genotipos y los tratamientos en estas dos variables (tabla 2).
Tabla 2 Masa de mil granos (g) y rendimiento de granos (kg/ha) en los genotipos de frijol IPR Uirapuru, CF 22 y Mouro graúdo, tratados con extracto de Ulva fasciata y fungicida en los años 2005 y 2006
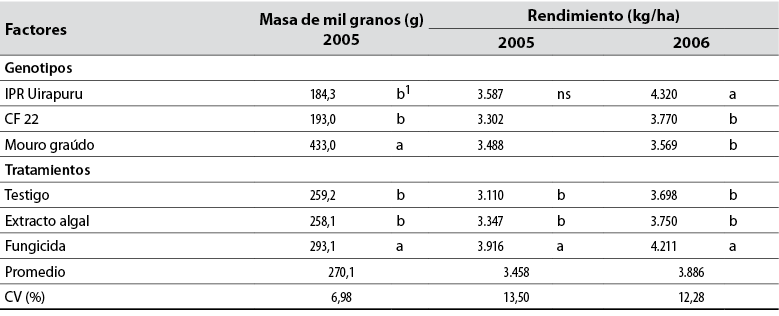
ns:No es significativo en la columna;
1Promedios seguidos por la misma letra no difieren estadísticamente por la prueba de Tukey (p < 0,05).
Fuente: Elaboración propia
El extracto de U. fasciata parece tener un efecto sobre la mancha angular, pero inestable, siendo dependiente de interacciones con el genotipo y el ambiente. En el futuro será necesario estudiar formas para aumentar la eficiencia del extracto algal (formulación), evaluando su efecto en la fisiología de otras culturas y sus enfermedades (patógenos foliares o radiculares) en condiciones de campo.
Conclusiones
En las condiciones experimentales de este trabajo, se constató que el control de mancha angular por el extracto de Ulva fasciata depende de la interacción biológica entre el genotipo de frijol y el ambiente. Además, el extracto de U. fasciata no afectó el contenido de pigmentos foliares, masa de mil granos y producción de granos.
Agradecimientos
Los autores expresan sus agradecimientos a la Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina, de la República Federativa de Brasil, por haber brindado las facilidades para la ejecución de la presente investigación.
REFERENCIAS
Abadio, A. K. R., Lima, S. S., Santana, M. F., Salomão, T. M. F., Sartorato, A., Mizubuti, E. S. G., Araújo, E. F., & Queiroz, M. V. (2012). Genetic diversity analysis of isolates of the fungal bean pathogen Pseudocercospora griseola from central and southern Brazil. Genetics and Molecular Research, 11(2), 1272-1279. http://doi.org/10.4238/2012.May.14.1 [ Links ]
Abreu, G. F., Talamini, V., & Stadnik, M. J. (2008). Bioprospecção de macroalgas marinhas e plantas aquáticas para o controle da antracnose do feijoeiro. Summa Phytopathologica, 34(1), 78-82. https://doi.org/10.1590/S0100-54052008000100017 [ Links ]
Araújo, I. B., Peruch, L. A. M., & Stadnik, M. J. (2012). Efeito do extrato de alga e da argila silicatada na severidade da alternariose e na produtividade da cebolinha comum (Allium fistulosum L.). Tropical Plant Pathology, 37(5), 363-367. https://doi.org/10.1590/S1982-56762012000500010 [ Links ]
Bassanezi, R. B., Amorim, L., Bergamin Filho, A., Hau, B., & Berger, R. D. (2001). Accounting for photosynthetic efficiency of bean leaves with rust, angular leaf spot and anthracnose to assess crop damage. Plant Pathology, 50(4), 443-452. https://doi.org/10.1046/j.1365-3059.2001.00584.x [ Links ]
Bassanezi, R. B., Amorim, L., Bergamin Filho, A., & Berger, R. D. (2002). Gas exchange and emission of chlorophyll fluorescence during the monocycle of rust, angular leaf spot and anthracnose on bean leaves as a function of their trophic characteristics. Journal of Phytopathology, 150(1), 37-47. https://doi.org/10.1046/j.1439-0434.2002.00714.x [ Links ]
Bergamin Filho, A., Carneiro, S. M. T. P. G., Godoy, C. V., Amorim, L., Berger, R. D., & Hau, B. (1997). Angular leaf spot of Phaseolus beans: Relationships between disease, healthy leaf area, and yield. Phytopathology,87(5), 506-515. https://doi.org/10.1094/PHYTO.1997.87.5.506 [ Links ]
Blunden, G., Jenkins, T., & Liu, Y. M. (1997). Enhanced leaf chlorophyll levels in plants treated with seaweed extract. Journal of Applied Phycology, 8, 535-543. https://doi.org/10.1007/BF02186333 [ Links ]
Borsato, L. C., Di Piero, R. M., & Stadnik, M. J. (2010). Mecanismos de defesa eliciados por ulvana contra Uromyces appendiculatus em três cultivares de feijoeiro. Tropical Plant Pathology, 35(5), 318-322. http://dx.doi.org/10.1590/S1982-56762010000500008 [ Links ]
Campbell, C. L., & Madden, L. V. (1990). Introduction to Plant Disease Epidemiology. John Wiley and Sons. [ Links ]
Cluzet, S., Torregrosa, C., Jacquet, C., Lafitte, C., Fournier, J., Mercier, L., Salamagne, S., Briand, X., Esquerré-Tugayé, M. T., & Dumas, B. (2004). Gene expression profiling and protection of Medicago truncatula against a fungal infection in response to an elicitor from green algae Ulva spp. Plant, Cell & Environment, 27(7), 917-928. https://doi.org/10.1111/j.1365-3040.2004.01197.x [ Links ]
Delgado, D. Z., Freitas, M. B., & Stadnik, M. J. (2013). Effectiveness of saccharin and ulvan as resistance inducers against rust and angular leaf spot in bean plants (Phaseolus vulgaris). Crop Protection, 47, 67-73. https://doi.org/10.1016/j.cropro.2013.01.003 [ Links ]
El Modafar, C. H., Elgadda, M., El Boutachfaiti, R., Abouraicha, E., Zehhar, N., Petit, E., El Alaoui-Talibi, Z., Courtois, B., & Courtois, J. (2012). Induction of natural defense accompanied by salicylic acid-dependant systemic acquired resistance in tomato seedlings in response to bioelicitors isolated from green algae. Scientia Horticulturae, 138, 55-63. https://doi.org/10.1016/j.scienta.2012.02.011 [ Links ]
El-Naggar, A. H., Osman, M. E. H., El-Sheekh, M. M., & Gheda, S. F. (2005). Influence of the aqueous extracts of Ulva lactuca and Chlorella kessleri on growth and yield of Vicia faba. Algological Studies, 116(1), 213-229. http://doi.org/10.1127/1864-1318/2005/0116-0213 [ Links ]
Freitas, M. B., & Stadnik, M. J. (2012). Race-specific and ulvan-induced defense responses in bean (Phaseolus vulgaris) against Colletotrichum lindemuthianum. Physiological and Molecular Plant Pathology, 78, 8-13. https://doi.org/10.1016/j.pmpp.2011.12.004 [ Links ]
Jaulneau, V., Lafitte, C., Corio-Costet, M. F., Stadnik, M. J., Salamagne, S., Briand, X., Esquerré-Tugayé, M. T., & Dumas, B. (2011). An Ulva armoricana extract protects plants against three powdery mildew pathogens. European Journal of Plant Pathology, 131(3), 393-401. https://doi.org/10.1007/s10658-011-9816-0 [ Links ]
Jesus-Junior, W. C., Vale, F. X. R., Coelho, R. R., Hau, B., Zambolim, L., Costa, L. C., & Bergamin Filho, A. (2001). Effects of angular leaf spot and rust on yield loss of Phaseolus vulgaris. Phytopathology, 91(11), 1045-1053. https://doi.org/10.1094/phyto.2001.91.11.1045 [ Links ]
Lichtenthaler, H. K. (1987). Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Methods in Enzymology, 148, 350-382. https://doi.org/10.1016/0076-6879(87)48036-1 [ Links ]
Lobato, A. K. S., Gonçalves-Vidigal, M. C., Vidigal Filho, P. S., Costa, R. C. L., Cruz, F. J. R., Santos, D. G. C., Silva, C. R., Silva, L. I., & Sousa, L. L. (2009). Changes in photosynthetic pigment and carbohydrate content in common bean cultivars infected by Colletotrichum lindemuthianum. Plant, Soil and Environment, 55(2), 58-61. http://doi.org/10.17221/259-PSE [ Links ]
Lopes, D. B., & Berger, R. D. (2001). The effects of rust and anthracnose on the photosynthetic competence of diseased bean leaves. Phytopathology, 91(2), 212-220. https://doi.org/10.1094/PHYTO.2001.91.2.212 [ Links ]
Mora-Brenes, B., Chaves, G. M., & Zambolim, L. (1983). Estimativas de perdas no rendimento do feijoeiro comum (P. vulgaris L.) causadas pela mancha angular (Isariopsis griseola Sacc.). Fitopatologia Brasileira,8, 599. [ Links ]
Moriondo, M., Orlandini, S., Giuntoli, A., & Bindi, M. (2005). The effect of downy and powdery mildew on grapevine (Vitis vinifera L.) leaf gas exchange. Journal of Phytopathology,153(6), 350-357. https://doi.org/10.1111/j.1439-0434.2005.00984.x [ Links ]
Pastor-Corrales, M. A., Jara, C., & Singh, S. P. (1998). Pathogenic variation in sources of and breeding for resistance to Phaeoisariopsis griseola causing angular leaf spot in common bean. Euphytica, 103, 61-171. https://doi.org/10.1023/A:1018350826591 [ Links ]
Paulert, R., Talamini, V., Cassolato, J. E. F., Duarte, M. E. R., Noseda, M. D., Smania Júnior, A., & Stadnik, M. J., (2009). Effects of sulfated polysaccharide and alcoholic extracts from green seaweed Ulva fasciata on anthracnose severity and growth of common bean (Phaseolus vulgaris L.). Journal of Plant Diseases and Protection, 116, 263-270. https://doi.org/10.1007/BF03356321 [ Links ]
Pynenburg, G. M., Sikkema, P. H., & Gillard, C. L. (2011). Agronomic and economic assessment of intensive pest management of dry bean (Phaseolus vulgaris). Crop Protection, 30, 340-348. https://doi.org/10.1016/j.cropro.2010.12.006 [ Links ]
Marques-Júnior, O. G. M. A. P., Ferreira, F., & Santos, J. B. (1997). Viabilidade do emprego de notas na avaliação de alguns caracteres do feijoeiro (Phaseolus vulgaris L.). Revista Ceres, 44(254), 411-420. [ Links ]
Sanglard, D. A. C. A. G., Balbi, P., Arruda, K. M. A., Barros, E. G., & Moreira, M. A. (2013). Characterization of the angular leaf spot resistance gene present in common bean cultivar Ouro Negro. Journal of Agricultural Science,5, 19-23. http://doi.org/10.5539/jas.v5n2p19 [ Links ]
Sartorato, A. (2002). Identification of Phaeoisariopsis griseola pathotypes from five States in Brazil. Fitopatologia Brasileira, 27(1), 78-81. https://doi.org/10.1590/S0100-41582002000100012 [ Links ]
Sartorato, A. (2006). Novas fontes de resistência do feijoeiro comum à mancha angular. Fitopatologia Brasileira,31(2), 192-194. https://doi.org/10.1590/S0100-41582006000200012 [ Links ]
Sartorato, A., & Rava, C. A. (2003). Controle químico da mancha angular de feijoeiro comum. Summa Phytopathologica,29(2), 202-204. [ Links ]
Silva, F. A. S., & Azevedo, C. A. V. (2002). Versão do programa computacional Assistat para o sistema operacional Windows. Revista Brasileira de Produtos Agroindustriais, 4(1), 71-78. http://www.deag.ufcg.edu.br/rbpa/rev41/Art410.pdf [ Links ]
Silva, K. J. D., Souza, E. A., Sartorato, A., & Freire, C. N. S. (2008). Pathogenic variability of isolates of Pseudocercospora griseola, the cause of common bean angular leaf spot, and its implications for resistance breeding. Journal of Phytopathology, 156(10), 602-606. https://doi.org/10.1111/j.1439-0434.2008.01413.x [ Links ]
Sridhar, S., & Rengasamy, R. (2010). Effect of seaweed liquid fertilizer on the growth, biochemical constituents and yield of Tagetes erecta, under field trial. Journal of Phytology,2(6), 61-68. [ Links ]
Stadnik, M. J., & Freitas, M. B. (2014). Algal polysaccharides as source of plant resistance inducers. Tropical Plant Pathology, 39(2), 111-118. http://dx.doi.org/10.1590/S1982-56762014000200001 [ Links ]
Venancio, W. S., Rodrigues, M. A. T., Begliomini, E., & De Souza, N. L. (2003). Physiological effects of strobilurin fungicides on plants. Publicatio UEPG Ciências Exatas e da Terra, Agrárias e Engenharias, 9, 59-68. [ Links ]
Vera, J., Castro, J., Gonzalez, A., & Moenne, A. (2011). Seaweed polysaccharides and derived oligosaccharides stimulate defense responses and protection against pathogens in plants. Marine Drugs, 9, 2514-2525. https://doi.org/10.3390/md9122514 [ Links ]
Walters, D., & Heil, M. (2007). Costs and trade-offs associated with induced resistance. Physiological and Molecular Plant Pathology, 71, 3-17. https://doi.org/10.1016/j.pmpp.2007.09.008 [ Links ]
Walters, D. R., & Fountaine, J. M. (2009). Practical application of induced resistance to plant diseases: an appraisal of effectiveness under field conditions. The Journal of Agricultural Science, 147(5), 523-535. https://doi.org/10.1017/S0021859609008806 [ Links ]
Wordell Filho, J. A., Martins, D. A., & Stadnik, M. J. (2007). Aplicação foliar de tratamentos para o controle do míldio e da podridão-de-escamas de bulbos de cebola. Horticultura Brasileira,25(4), 544-549. http://dx.doi.org/10.1590/S0102-05362007000400010 [ Links ]
Zhang, Y. J., Zhang, X., Chen, C. J., Zhou, M. G., & Wang, H. C. (2010). Effects of fungicides JS399-19, azoxystrobin, tebuconazole, and carbendazim on the physiological and biochemical indices and grain yield of winter wheat. Pesticide Biochemistry and Physiology, 98(2), 151-157. https://doi.org/10.1016/j.pestbp.2010.04.007 [ Links ]
Recibido: 19 de Octubre de 2018; Aprobado: 28 de Julio de 2020











 texto em
texto em 



