Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera Sep./Dec. 2020 Epub Aug 31, 2020
https://doi.org/10.21930/rcta.vol22_num1_art:1528
Genética y mejoramiento animal
Evaluación de la calidad seminal de conejos alimentados con dietas que contienen diferentes niveles de inclusión de semillas de linaza (Linum usitatissimum)
1Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA), CI Motilonia. Agustín Codazzi, Cesar, Colombia
2Universidad Federal del Reconcavo de Bahía. Cruz das almas, Bahía, Brazil
3Universidad Estadual de Santa Cruz, Ilheús, Bahía, Brazil
4Universidad Federal del Reconcavo de Bahía. Cruz das almas, Bahía, Brazil
5Universidade Federal da Bahía. Salvador, Brazil
6Berros & Mugidos Consultoria Agropecuária LTDA. Itaberaba, Bahía, Brazil
7Universidad Federal dos Vales do Jequitinhonha e Mucuri. Unaí, Minas Gerais, Brazil
8Universidad Federal del Reconcavo de Bahía. Cruz das almas, Bahía, Brazil
El objetivo de este trabajo fue evaluar el efecto de la semilla de linaza (Linum usitatissimum) en la calidad física y morfológica del semen fresco y refrigerado de conejos. Se emplearon 20 machos Nueva Zelandia distribuidos en grupos según niveles de inclusión de semilla en su dieta durante 100 días: 0%, 3%, 6% y 9%. 15 días después de iniciar el suministro de la dieta se realizaron colectas seminales una vez por semana con vagina artificial y una hembra como maniquí. Para la evaluación física y morfológica se diluyó en medio Tris-yema y refrigerado a 5 °C; se valoró la motilidad espermática progresiva, el vigor espermático y la morfología espermática a las 0, 2, 12, 24, 48 y 72 horas post-refrigeración. La información fue analizada mediante análisis de varianza y de regresión al 5% de significancia. Para la morfología, volumen, color y aspecto seminal del semen fresco (p > 0,05) no hubo diferencia. Para volumen, turbidez, motilidad, vigor y concentración, hubo valores medios de 0,92 ± 0,24 mL; 0,86 ± 0,35; 76,58 ± 7,13%; 3,37 ± 0,28 y 205,75 ± 20,77 × 106 sptz, respectivamente. Hubo diferencia para motilidad y vigor espermático a las 0, 2, 12, 24, 48 y 72 horas post-refrigeración (p < 0,005). Se concluyó que la inclusión de hasta 9% de semilla de linaza en la dieta de conejos no alteró los parámetros físicos y microscópicos evaluados en este estudio en semen fresco y refrigerado de conejo.
Palabras clave conejo; dieta; espermatozoide; linaza; reproducción animal
The aim of this study was to evaluate the effect of flaxseed (Linum usitatissimum) on the physical and morphological quality of fresh and refrigerated rabbit semen. Twenty New Zealand males were used, and distributed in four groups according to the level of inclusion of flaxseed in the total diet for 100 days: 0 %, 3 %, 6 %, and 9 %. Fifteen days after starting the supply of the diet, seminal collections were made once a week with an artificial vagina and a female as a dummy. For the physical and morphological evaluations, the semen was diluted in Tris-Egg Yolk medium and cooling at 5 °C; progressive sperm motility, and spermatic vigor and morphology were assessed at 0, 2, 12, 24, 48, and 72 post-cooling hours. This information was analyzed through analyses of variance and regression at 5 % significance. For the morphology, volume, color, and seminal appearance of fresh semen (p > 0.05), there was no difference. For volume, turbidity, motility, vigor, and concentration, average values of 0.92 ± 0.24 mL; 0.86 ± 0.35; 76.58 ± 7.13 %; 3.37 ± 0.28, and 205.75 ± 20.77 x 106 sptz were recorded, respectively. There were differences for motility and vigor at 0, 2, 12, 24, 48, and 72 post-cooling hours (p > 0.005). In conclusion, the inclusion of up to 9 % flaxseed in the rabbit diet did not alter the physical and microscopic parameters evaluated in this study in fresh and refrigerated rabbit semen.
Keywords animal reproduction; diet; linseed; rabbit; spermatozoa
Introducción
Múltiples investigaciones se han interesado en los mecanismos que operan en la manipulación de las dietas y sus efectos reproductivos en diversas especies. Entre ellas, puede ser citado el efecto de la energía sobre los procesos reproductivos de machos y hembras (Rigolon et al., 2003).
Diferentes fuentes de lípidos han sido suministradas a animales de producción, incluyendo grasas de plantas procesadoras de subproductos. Asimismo, se han proporcionado grasas provenientes de semillas de oleaginosas, como la semilla de girasol, de soya, de canola, de algodón, de linaza, entre otras (Wathes et al., 2007).
Otros estudios han comprobado que la relación entre los ácidos grasos poliinsaturados tipo 3 y tipo 6 tienen un grado de responsabilidad, ya que mejoran la fluidez en la membrana espermática (debido a los lípidos composicionales). Esto deriva en mejorar la calidad seminal (Freitas et al., 2014; Strzezek et al., 2004).
En el contexto descrito previamente, la semilla de linaza se muestra como una importante alternativa para elevar los índices reproductivos. Esto se debe al ácido linolénico en cantidades aproximadas de más de 50 g/100 g de la suma de ácidos grasos (Cunnane et al., 2003) y de ácido linoleico (16%) (Kennelly, 1996). Por consiguiente, es interesante analizar la utilización de linaza, especialmente para suministro de omega-3, ya que puede tratarse de una alternativa para mejorar los índices de fertilidad.
Por ello, se propuso determinar el efecto de la semilla de linaza (Linum usitatissimum) adicionada en la ración alimenticia de conejos en la calidad física y morfológica de semen fresco y refrigerado de conejo.
Materiales y métodos
El proyecto fue aprobado por el Comité de Ética de Uso de Animales (CEUA) de la Universidad Federal del Recóncavo de Bahia, Brasil. Fueron distribuidos veinte conejos adultos de la raza Nueva Zelandia, con edad promedio de 8 meses y una media de peso de 3,0 ± 0,4 kg. Se ubicaron en jaulas individuales recubiertas de alambre con 1 m2, con comederos de acero galvanizado y bebederos manuales de cerámica.
Los animales se distribuyeron aleatoriamente en cuatro grupos de acuerdo con el nivel de inclusión de semilla de linaza marrón en la materia seca de la dieta total: 0%, 3%, 6% y 9% (tabla 1). Las raciones experimentales fueron propuestas basándose en las recomendaciones de Villamide et al. (2010) para machos en edad reproductiva. Además, se utilizó heno de Tifton como voluminoso con relación volumen: ración de 70:30 y suministro de agua a voluntad.
Tabla 1 Proporción de componentes de las dietas experimentales basada en materia seca
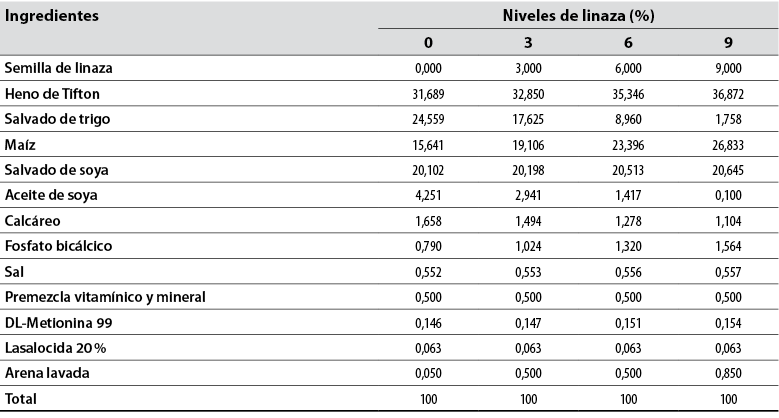
Fuente: Adaptada de Villamide et al. (2010)
Las dietas fueron ofrecidas a voluntad en comederos de 20 × 20 × 10, con opción de 10% para sobras. Esto se realizó a las 8:00 a. m. y a las 3:00 p. m. diariamente por un total de 100 días.
Para evaluar la calidad física y microscópica seminal se llevaron a cabo colectas de semen. Estas empezaron 15 días después de iniciado el suministro de las dietas (fase de adaptación) y se realizaron una vez por semana, en el horario de 7:00 a. m. Los eyaculados fueron obtenidos por el método de la vagina artificial (Andrade et al., 2002) y el uso de una hembra como maniquí. Se obtuvo un total de 67, 67, 72 y 69 eyaculados correspondientes respectivamente a los grupos alimentados con 0%, 3%, 6% y 9% de semilla de linaza.
Al culminar la colecta seminal, el gel del eyaculado fue retirado de inmediato con ayuda de una pinza. A continuación, el eyaculado fue almacenado en baño de maría a 37 °C. Para efectuar el examen físico seminal se tuvieron en cuenta los siguientes criterios: volumen del eyaculado sin gel (mL); aspecto seminal (1-2), siendo 1 = blanco acuoso y 2 = blanco lechoso; turbidez espermática (0-5), donde 0 es ausencia de turbidez (no implica ausencia de motilidad) y 5 es el valor máximo dado a un acentuado movimiento masal; motilidad espermática progresiva (0-100%) y vigor espermático (0-5), donde 0 es ausencia de movimiento con desplazamiento de cola lateral débil e inexpresivo, y 5 es movimiento vigoroso, veloz y progresivo de los espermatozoides. Para la evaluación de turbidez, se colocó una muestra (20 µL) de semen sobre una lámina previamente calentada a 37,5 °C y observada en microscopio, con objetivo de 10x a 20x. Para observación de vigor espermático y motilidad, se utiliza el procedimiento anterior, y al final se coloca encima una lamínula previamente calentada a 37,5 °C, y es observada a 40x. Para la evaluación de concentración espermática el semen fue diluido (20 µL) en agua destilada (1 mL) y se realizó el conteo en cámara de recuento Neubauer (improved cuadrícula doble, Germany). Los eyaculados con vigor 3 y con motilidad 70% se sometieron al proceso de refrigeración.
Los eyaculados fueron diluidos en medio Tris-yema (Castellini et al., 2002) modificado: 2,42 g de Tris (C4HNO3), ácido cítrico (1,34 g), D-fructosa (1 g), gentamicina (1 mg/mL) en agua destilada (80 mL) y yema de huevo (20 mL). Se elaboró una primera dilución a razón de 1:1 y, posteriormente, una segunda dilución, en la que se agregó el diluyente restante calculado de tal forma que quedara una concentración final de 100 millones de espermatozoides. Enseguida el semen fue puesto en una caja BotuFLEX® (Botucatu, Brasil), que permite el transporte refrigerado. Después, fue guardado en nevera estabilizada a 5 °C y refrigerado. La motilidad y el vigor espermático se evaluaron a las 0, 2, 12, 24, 48 y 72 horas post-refrigeración.
Los defectos mayores, menores y totales fueron evaluados mediante la técnica de lámina húmeda en microscopia de interferencia de fase en 400x, en donde una alícuota del semen (20 µL) fue conservada en agua destilada, para inmediatamente ser evaluada en cuanto a morfología espermática (defectos mayores, menores y totales). Allí se contabilizaron 200 células, que se clasificaron de acuerdo con Rao et al. (1980).
Para determinar los datos bioclimáticos de temperatura ambiente y humedad relativa del aire, fue situado el termómetro digital de ambiente (Supermedy®, São Paulo, SP, Brasil) y termo-higro digital (THAL-300 Termo-higro Anemómetro luxímetro Digital/Instrutherm®) en el galpón experimental. Estos se posicionaron a la altura del lomo de los animales y los índices fueron revisados a las 8:00 a. m. y a las 3:00 p. m. en toda la fase experimental.
El diseño experimental usado fue Delineamiento Completamente al Azar (DCA). Se realizó análisis de varianza y de regresión al 5% de significancia, previo a la prueba de comparación de los efectos del tratamiento (o tratamiento o tiempo) y los datos presentaron distribución normal.
Para las variables evaluadas del semen fresco y post-refrigeración, se realizó la prueba de medias para tratamientos a través del procedimiento PROC GLM de SAS 9.0. Las ecuaciones de regresión fueron generadas a través de PROC REG. Se admitió α = 0,05.
Para evaluar la motilidad espermática progresiva y vigor espermático post-refrigeración, se utilizó el procedimiento PROC MIXED COVTEST de SAS 9.0 para comparación de los efectos del tratamiento y tiempo. Las medias fueron comparadas a través de contrastes ortogonales y las ecuaciones de regresión fueron generadas. Se admitió α = 0,05.
Resultados y discusión
Semen fresco
La semilla de linaza incorporada en la ración de alimento de conejos no alteró el aspecto seminal (coloración y consistencia seminal); predominó la coloración blanca y la consistencia acuosa (p > 0,05) (tabla 2). Resultados similares fueron obtenidos por Andreazzi et al. (2004) con adición de 3% de aceites en dietas de conejos (canola, maíz y soya). Según Campos et al. (2012), la coloración lechosa representa la normalidad para la especie cunícula, pues demuestra buena calidad seminal, y además existen otras coloraciones como amarillo-citrino que demuestran una concentración espermática menor.
Tabla 2 Aspecto y turbidez del semen fresco de conejos suplementados con semilla de linaza (Linum usitatissimum) en la dieta
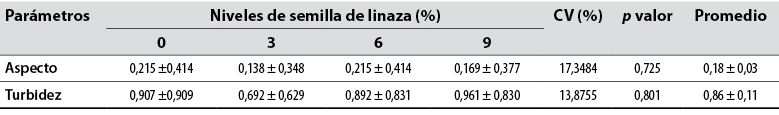
Nota: CV: coeficiente de variación. abc: Medias con letras distintas entre columnas difieren significativamente (p < 0,05).
Fuente: Elaboración propia
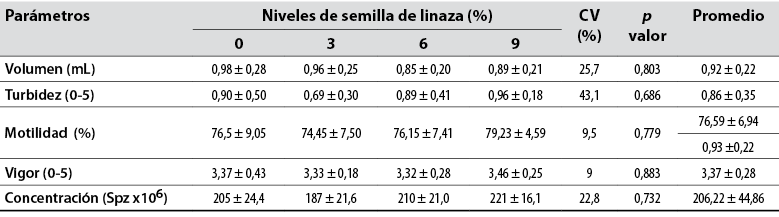
La presente investigación no mostró diferencia (p > 0,05) para volumen seminal con valor medio de 0,92 ± 0,22 mL para todos los grupos (tabla 3). Un experimento de Gliozzi et al. (2009) menciona una conclusión similar. Dicho estudio evaluaba el aceite de pescado (fuente de omega 3) y vitamina E en la suplementación de dietas de conejos y sus efectos en la calidad seminal. Sin embargo, los autores mencionan no encontrar diferencia en el volumen seminal de los animales.
Para turbidez espermática no se encontró diferencia (p > 0,05) con valor medio de 0,86 ± 0,35 (tabla 3). Existe un trabajo conducido por Campos et al. (2012) en el que evaluaron la calidad seminal de conejos suplementados con jalea real (0,5 y 1,0 gramos). Cabe resaltar que dicha jalea es fuente de ácido docosahexaenóico (DHA) (ácido graso omega-3). Entre los resultados, se encontraron valores de 3,33 ± 1,12 y 3,11 ± 1,17, los cuales superan los valores de este experimento.
En otro experimento donde fue medida la hipercolesteremia y sus efectos en las funciones endocrinas y exocrinas del testículo de conejos, se implementaron dietas con y sin 3% de colesterol por 12 semanas. Esto arrojó valores de 2,3 ± 0,4 para el grupo tratado y 3,3 ± 0,3 para el grupo control (Shimamoto & Sofikitis, 1998).
Para motilidad espermática progresiva no hubo diferencia (p > 0,05), ya que se encontraron para todos los grupos valores medios de 76,59 ± 6,94% (tabla 3). Mourvaki et al. (2010) tampoco encontraron diferencias para este parámetro en un estudio con suministro de 5% de linaza en la dieta de conejos. Los autores obtuvieron un 72,4% para el grupo control y 75,5% para el que recibió linaza.
Los valores por debajo de lo normalmente encontrado para motilidad espermática progresiva en conejos pueden estar relacionados con alteración de la temperatura corporal. Según Jimoh y Ewuola (2018), la motilidad espermática disminuye de forma significativa cuando la temperatura ambiental se eleva por encima de 27 °C, lo que dificulta alcanzar una óptima capacidad reproductiva. La temperatura promedio durante la fase experimental fue de 27,08 °C, en donde la máxima y mínima promedio registradas fueron de 29,6 °C y 23,9 °C, respectivamente. La humedad relativa promedio fue de 67,87 %, siendo que la máxima y mínima promedio registrada fue de 74,5% y 57,7%.
Como se evidencia en la tabla 3, el valor medio para vigor espermático fue de 3,37 ± 0,28 para los grupos, lo que permite afirmar que no hubo diferencia significativa (p > 0,05). Con el fin de caracterizar una buena calidad seminal, Alvarino (2000) informó que para conejos los valores de vigor espermáticos deben ser igual o mayores a 3.
Por otra parte, Castellini et al. (2004) mostraron que es posible mejorar los parámetros seminales con el suministro de linaza en la dieta, la cual promueve mejoras en la motilidad espermática progresiva de los espermatozoides. Mourvaki et al. (2010) reforzaron esta afirmación con su estudio sobre el efecto de la suplementación con linaza en el nivel de ácidos grasos de los componentes seminales y de los gránulos prostáticos. Los autores concluyeron que la cola del espermatozoide es la región más afectada por las dietas con adición de linaza, después del acrosoma. Esto puede deberse a las cantidades incrementadas de ácidos grasos omega-3 en la cola y la disminución del colesterol en esta, ya que una mayor fluidez de membrana de esa región aumenta la velocidad curvilínea del espermatozoide.
Para concentración espermática no se observaron diferencias significativas (p > 0,05), con valor medio de 206,22 ± 44,86 × 106 sptz/mL para los grupos evaluados (tabla 3). No obstante, lo reportado por Alvarino (1993) estaba en el rango de 150 a 900 × 106 sptz/mL, con una media de 250 × 106 sptz/mL.
Tabla 3 Parámetros macroscópicos y microscópicos del semen fresco de conejos suplementados con semilla de linaza (Linum usitatissimum) en la dieta
Nota: CV: coeficiente de variación. abc: Medias con letras distintas entre columnas difieren significativamente (p < 0,05).
Fuente: Elaboración propia
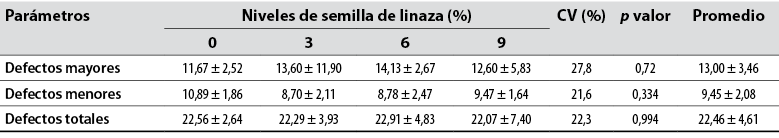
Para las alteraciones morfológicas espermáticas del semen fresco no se observaron diferencias (p > 0,05), ya que los grupos arrojaron medias en orden respectivo de 13,00 ± 3,46%, para defectos mayores; 9,45 ± 2,08%, para defectos menores y 22,46 ± 4,61%, para defectos totales (tabla 4). La patología de defectos primarios más observada en este experimento fue gota citoplasmática proximal, siendo similar a lo observado por Campos et al. (2012).
Los valores hallados se encuentran dentro de los mencionados por Foote y Carney (2000), señalando para el semen de conejo un 75% de morfología espermática normal. Conclusiones similares también fueron mencionadas por Andreazzi et al. (2004) usando dietas para conejos que manejaban 3% de aceite de canola, maíz y soya.
Semen refrigerado
No hubo diferencia para motilidad espermática progresiva y vigor espermático del semen refrigerado (p > 0,05) en función de los tratamientos (tabla 5). Varios aspectos pueden interferir en la calidad seminal post-dilución; uno de ellos es la diferencia del semen de conejo en comparación al de la mayoría de las especies, ya que este presenta bajo coeficiente de permeabilidad al agua (Curry et al., 1995), lo que dificulta la eficiencia al emplear diluyentes para semen de conejos (Mocé & Vicente, 2009).
Tabla 5 Motilidad espermática progresiva y vigor espermático en semen refrigerado de conejo por niveles de inclusión de semilla de linaza (Linum usitatissimum) en la dieta
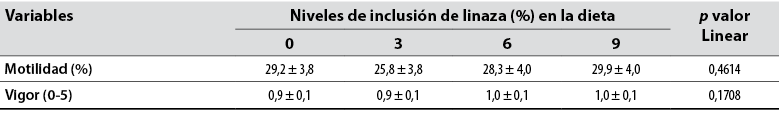
Nota: CV: coeficiente de variación. abc: Medias con letras distintas entre columnas difieren significativamente (p < 0,05).
Fuente: Elaboración propia
Se obtiene un mejor resultado con diluyentes que tienen como base Tris, frente a otras opciones de diluyentes (Cortell & De Castro, 2008). Por otra parte, la yema de huevo tiene mejores resultados frente a otras sustancias para conservación seminal posterior a la dilución (Andrade et al., 2008). La velocidad de la refrigeración del semen también puede interferir en la calidad seminal y consecuentemente en la fertilidad y número de gazapos nacidos (Mocé et al., 2009).
Hubo comportamiento linear decreciente (p < 0,05) para la motilidad espermática progresiva del semen refrigerado en función del tiempo con valores de 63,80 ± 1,60 (0 h), 46,20 ± 2,33 (2 h), 30,40 ± 1,47 (12 h), 17,60 ± 1,47 (24 h), 11,60 ± 0,83 (48 h) y 5,18 ± 2,54% (72 h). Asimismo, se presentó comportamiento linear decreciente para el vigor espermático del semen refrigerado con valores de 2,20 ± 0,08 (0 h), 1,54 ± 0,11 (2 h), 1,15 ± 0,07 (12 h), 0,55 ± 0,08 (24 h), 0,22 ± 0,05 (48 h) y 0,06 ± 0,05 (72 h) (tabla 6).
Tabla 6 Motilidad espermática progresiva y vigor espermático, por tiempo de refrigeración del semen de conejos alimentados con semilla de linaza (Linum usitatissimum) en la ración
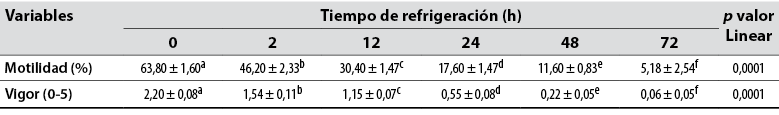
Nota: CV: coeficiente de variación. abc: Medias con letras distintas entre columnas difieren significativamente (p < 0,05).
Fuente: Elaboración propia
Los valores difieren de los que mencionan Andrade et al. (2008), quienes contrastan en el semen de conejo varios medios diluidores: ringer lactato, citrato-yema y leche descremada. En su estudio encontraron valores de motilidad espermática progresiva de 64,5 ± 8,7 (ringer lactato), 67,0 ± 5,3 (citrato-yema) y 65,9 ± 5,3% (leche descremada) al inicio de incubación (0 min). A los 120 minutos de incubación encontraron valores de 50,3 ± 16,9 (ringer lactato), 57,5 ± 14,0 (citrato-yema) y 55,8 ± 8,0% (leche desnatada). Sin embargo, existen diferencias en las habilidades de los medios para mantener la viabilidad del semen por periodos prolongados de tiempo (Seed et al., 1996). Estas diferencias pueden ser visualizadas en la fertilidad y en el número de gazapos, de acuerdo con López y Alvarino (1998). Los mismos autores evaluaron semen refrigerado con diluyente comercial a las 2, 24, 48, 72 y 96 horas de refrigeración, y encontraron disminución significativa de fertilidad con 72 y 96 horas de refrigeración. También hay reportes de fertilidad con una tasa superior a un 60% en inseminaciones con concentración espermática de 6 × 106 por dosis, pero eso depende del reproductor, de la raza, del grado de selección (International Rabbit Reproduction Group, 2005). Lo recomendable son 20 × 106 millones de espermatozoides por coneja (Rebollar, 2000).
No hubo diferencia para defectos mayores con media de 12,01 ± 3,74% entre los grupos. Para defectos menores, la media fue de 20,11 ± 5,56%, y para defectos totales, la media fue de 32,39 ± 5,76% en semen después de 72 horas de refrigeración (tabla 7).
Tabla 7 Aspectos morfológicos del semen post-refrigeración 72 horas de conejos alimentados con semilla de linaza (Linum usitatissimum) en la dieta
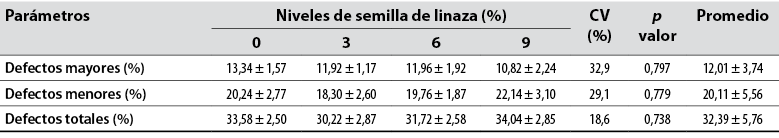
Nota: CV: coeficiente de variación. abc: Medias con letras distintas entre columnas difieren significativamente (p < 0,05).
Fuente: Elaboración propia
Los parámetros que muestran valores superiores a los de la literatura consultada son los de morfología espermática del semen fresco y del semen a las 72 horas post-refrigeración, según Foote y Carney (2000). Un porcentaje elevado de anormalidades espermáticas en una colecta puede no reflejar un decrecimiento de la fertilidad, pero puede interferir en los valores de prolificidad (Lavara et al., 2005).
Conclusiones
La inclusión de hasta 9% de semilla de linaza en la dieta de conejos no alteró los parámetros físicos y microscópicos de semen fresco; sin embargo, alteró la motilidad espermática progresiva y el vigor de semen evaluado post-refrigeración, lo que indica que hay todavía un reto en la búsqueda de fuentes lipídicas en las dietas que optimicen la calidad seminal en conejos.
Agradecimientos
Agradecimientos a CAPES y a la UFRB de Brasil.
REFERENCIAS
Alvarino, M. (1993). Control de la reproducción en el conejo. Ediciones Paraninfo. https://www.mundiprensa.com/catalogo/9788471144485/control-de-la-reproduccion-en-el-conejo [ Links ]
Alvarino, J. (2000). Reproductive performance of male rabbits. Proceedings of the 7th World Rabbit Congress, 8(1), 13-35. https://world-rabbit-science.com/WRSA-Proceedings/Congress-2000-Valencia/Papers/Reproduction/R00a-Alvarino.pdf [ Links ]
Andrade, A., Celeghini, E., Yonezawa, L., Spers, A., & Arruda, R. (2008). Eficiência in vitro de tres diluidores para semen de coelho. Brazilian Journal of Veterinary Research and Animal Science, 45(Supplement), 33-39. http://doi.org/10.11606/S1413-95962008000700004 [ Links ]
Andrade, A. F. C., Yonezawa, L. A., Celeghini, E. C. C., Spers, A., & Arruda, R. P. (2002). Um novo modelo de vagina artificial para coelhos. Revista Brasileira de Reprodução Animal, 26(3), 201-204. [ Links ]
Andreazzi, M. A., Scapinello, C., Vanini de Moraes, G., Garcia de Faria, A., Michelan, A. C., & Georg, P. C. (2004). Avaliação da qualidade do semên em coelhos alimentados com rações contendo diferentes fontes de óleos vegetales. Acta Scientiarum Animal Sciences, 26(1), 87-93. http://doi.org/10.4025/actascianimsci.v26i1.1945 [ Links ]
Campos, P., Barbosa, L., Neves, M., Melo, B., Morais, A., & Morais, D. (2012). Qualidade seminal e morfometria testicular de coelhos (Oryctolagus cuniculus) suplementados com geleia real. Arquivo Brasileiro de Medicina Veterinaria e Zootecnia, 64(6), 563-568. http://doi.org/10.1590/S0102-09352012000600023 [ Links ]
Castellini, C., Dal Bosco, A., & Cardinali, R. (2004). Effect of dietary alpha-linolenic acid on the semen characteristics of rabbit bucks. Proceedings of 8th World Rabbit Congress, 245-250. https://www.semanticscholar.org/paper/Effect-of-dietary-%CE%B1-linolenic-acid-on-the-semen-of-Castellini-Bosco/3922d0922ba83b72c7710e20b05354d1c02f1483 [ Links ]
Castellini, C., Lataiolli, P., Dal Bosco, A., & Beghelli, D. (2002). Effect of supranutritional level of dietary alpha-tocopheryl acetate and selenium on rabbit semen. Theriogenology, 58(9), 1723-1732. http://doi.org/10.1016/S0093-691X(02)01083-X [ Links ]
Cortell, C., & De Castro, M. V. (2008). Effect of gelatin addition to freezeng extender on rabbit semen parameters and reproductive performance. 9th World Rabbit Congress, 327-332. https://www.semanticscholar.org/paper/Effect-of-gelatin-addition-to-freezing-extender-on-Cortell-Castro/a349f18ae90beb04d9585375e6832df66a36aa4a [ Links ]
Cunnane, S., Ganguli, S., Menard, C., Liede, A., Hamadeh, M., Chen, Z., Wolever, T. & Jhenkins, D. (2003). High α-linolenic acid flaxseed (Linum usitatissimum): some nutritional properties in humans. Bristish Journal of Nutrition, 69(2), 443-453. http://doi.org/10.1079/BJN19930046 [ Links ]
Curry, M., Redding, B., & Watson, P. (1995). Determination of water permeability coefficient and its activation energy for rabbit spermatozoa. Cryobiology, 32(2), 175-181. http://doi.org/10.1006/cryo.1995.1016 [ Links ]
Foote, H., & Carney, W. (2000). The rabbit is a model for reproductive and developmental toxicity studies: Review. Reproductive Toxicology, 14(6), 477-493. http://doi.org/10.1016/S0890-6238(00)00101-5 [ Links ]
Freitas, B. W., Guimarães, J. D, Silveira, C. O., Bezerra, L. L., Maitan, P. P. (2014). Uso del colesterol carreado por ciclodextrinas na criopreservação de sêmen. Revista Brasileira de Reprodução Animal, 38(4), 225-229. http://www.cbra.org.br/pages/publicacoes/rbra/v38n4/pag225-229%20(RB577).pdf [ Links ]
Gliozzi, T., Zaniboni, L., Maldjian, A., Luzi, F., Maertens, L., & Cerolini, S. (2009). Quality and lipid composition of spermatozoa in rabbit fed DHA and vitamin E rich diets. Theriogenology, 71(6), 910-919. http://doi.org/10.1016/j.theriogenology.2008.10.022 [ Links ]
International Rabbit Reproduction Group. (2005). Guidelines for the handling of rabbit bucks and semen. World Rabbit Science, 13(2), 71-91. http://doi.org/10.4995/wrs.2005.527 [ Links ]
Jimoh, O. A., & Ewuola, E. O. (2018). Semen characteristics, seminal biochemical and oxidative stress markers in rabbit during heat stress. Journal of Veterinary Andrology, 3(2), 35-44. http://cesica.org/publicaciones/index.php/journal_veterinary_andrology/article/view/59/48 [ Links ]
Kennelly, J. (1996). The fatty acid composition of milk fat as influenced by feeding oilseeds. Animal Feed Science and Technology, 60(3), 137-152. http://doi.org/10.1016/0377-8401(96)00973-X [ Links ]
Lavara, R., Mocé, E., Lavara, F., De Castro, M., & Vicente, J. (2005). Do parameters of seminal quality correlate with the results of on-farm inseminations in rabbits? Theriogenology, 64(5), 1130-1141. http://doi.org/10.1016/j.theriogenology.2005.01.009 [ Links ]
López, F., & Alvarino, J. (1998). Artificial insemination of rabbits with diluted semen stored up to 96 hours. World Rabbit Science, 6(2), 251-253. http://doi.org/10.4995/wrs.1998.352 [ Links ]
Mocé, E., & Vicente, J. (2009). Rabbit sperm cryopreservation: a review. Animal Reproduction Science, 110(1-2), 1-24. http://doi.org/10.1016/j.anireprosci.2008.08.015 [ Links ]
Mocé, E., Lavara, R., & Vicente, J. (2009). Effect of cooling rate to 5°C, straw size and farm on fertilizing ability of cryopreserved rabbit sperm. Reproduction in Domestic Animals, 45(5), 1-7. https://doi.org/10.1111/j.1439-0531.2009.01507.x [ Links ]
Mourvaki, E., Cardinalli, R., Dal Bosco, A., Corazzi, L., & Castellini, C. (2010). Effects of flaxseed dietary supplementation on sperm quality and on lipid composition of sperm subfractions and prostatic granules in rabbits. Theriogenology, 73(5), 629-637. http://doi.org/10.1016/j.theriogenology.2009.10.019 [ Links ]
Rao, A. R., Bane, A. & Gustafsson, B. K. (1980). Changes in the morphology of spermatozoa during their passage through the genital tract in dairy bulls with normal and impaired spermatogenesis. Theriogenology, 14(1), 1-12. https://doi.org/10.1016/0093-691X(80)90129-6 [ Links ]
Rebollar, P. G. (2000). Tecnología de la reproducción cunícola. Lagomorpha: Revista de la Asociación Española de Cunicultura, 109, 28-36. https://dialnet.unirioja.es/servlet/articulo?codigo=2869659 [ Links ]
Rigolon, L. P., Prado, I. N., Cavalieri, F. L. B., Nascimento, W. G., & Negr, J. A. (2003). Efeito de diferentes níveis de ingestão de energia sobre a produção e viabilidade de embriões em novilhas e vacas. Revista Brasileira de Zootecnia, 32(6), 1304-1310. http://doi.org/10.1590/S1516-35982003000600004 [ Links ]
Seed, J., Chapin, R., Clegg, E., Dostal, L., Foote, R., & Hurtt, M. (1996). Methods for assessing sperm motility, morphology and counts in the rat, rabbit and dog: a consensus report. Reproductive Toxicology, 10(3), 237-244. http://doi.org/10.1016/0890-6238(96)00028-7 [ Links ]
Shimamoto, K., & Sofikitis, N. (1998). Effect of hipercolesteroalemia on testicular function and sperm physiology. Yonago Acta Médica, 41, 23-29. https://pdfs.semanticscholar.org/44fb/7ffc031a8b08e1924246f655c8ad37465529.pdf [ Links ]
Strzezek, J., Fraser, L., Kuklinska, M., Dziekonska, A., & Lecewicz, M. (2004). Effects of dietary supplementation with polyunsaturated fatty acids and antioxidants on biochemical characteristics of boar semen. Reproductive Biology, 4(3), 271-287. http://www.pan.olsztyn.pl/repbiol/docs/backup/repbiol_vol4_num3_page271.pdf [ Links ]
Villamide, M. J., Maertens, L., & De Blas, C. (2010). Feed Formulation. CAB International. En C. De Blas & J. Wiseman (Eds.), The Nutrition of the Rabbit (pp. 222-232). Cambridge: CABI. https://pdfs.semanticscholar.org/f851/6b7c142fd8dd9005de50c83f8b7ec9288db2.pdf [ Links ]
Wathes, D. C., Abayasekara, D. R., & Aitken, R. J. (2007). Polyunsaturated fatty acids in male and female reproduction. Biology of Reproduction, 77(2), 190-201. doi: http://doi.org/10.1095/biolreprod.107.060558. [ Links ]
Recibido: 04 de Julio de 2019; Aprobado: 17 de Junio de 2020











 text in
text in