Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera Sep./Dec. 2020 Epub Aug 31, 2020
https://doi.org/10.21930/rcta.vol21_num3_art:1604
Fisiología vegetal
Enraizamiento de esquejes de tallo juvenil de Solanum tuberosum L. var. yungay mediante la aplicación del ácido 2,4-diclorofenoxiacético
1Universidad Nacional de Trujillo. Trujillo, Peru
2Universidad Nacional de Trujillo. Trujillo, Peru
3Universidad Nacional de Trujillo. Trujillo, Peru
4Universidad Nacional de Trujillo. Trujillo, Peru
5Universidad Nacional de Trujillo. Trujillo, Peru
6Universidad Nacional de Trujillo. Trujillo, Peru
7Universidad César Vallejo. Trujillo, Peru
Para la propagación de Solanum tuberosum, los tubérculos son la forma más empleada en la mayoría de las zonas agroecológicas. El empleo de esquejes de tallo juvenil es una práctica exclusiva de viveros y empresas agrícolas que hacen uso de hormonas enraizantes, inaccesibles para los pequeños agricultores por su alto costo. Se ha reportado que la auxina sintética 2,4-diclorofenoxiacético (2,4-D) a muy baja concentración induce al enraizamiento de esquejes y puede ser una alternativa viable para la agricultura a pequeña escala. Ante la necesidad de un mayor conocimiento, se propuso como objetivo de investigación evaluar el efecto enraizante del 2,4-D en esquejes de tallo juvenil de S. tuberosum var. yungay. La fase experimental se desarrolló en el invernadero del Instituto de la Papa y Cultivos Andinos de la Universidad Nacional de Trujillo (Perú), con plántulas procedentes del mismo instituto que se convirtieron en plantas madre donadoras de esquejes de tallo juvenil, los cuales fueron sembrados en cama de enraizamiento con diferentes concentraciones de 2,4-D. El análisis estadístico de los resultados demostró que la concentración de 0,3% generó un promedio mayor en número de raíces (6,52), longitud de raíces (5,31 cm) y altura de plántula (2,63 cm). Se concluyó que el 2,4-D en concentración del 0,3% produce un mejor enraizamiento de esquejes de tallo juvenil de S. tuberosum var. yungay.
Palabras clave auxinas; esquejes; papas; propagación vegetativa; sustancias de crecimiento vegetal
For the propagation of Solanum tuberosum, tubers as seeds are the most commonly used method in most agroecological areas. The use of young stem cuttings is an exclusive practice of nurseries and agricultural companies, which employ rooting hormones that are inaccessible to small farmers. Reportedly, synthetic auxin 2,4-dichlorophenoxyacetic acid (2,4-D) at a very low concentration induces the rooting of cuttings and can be an accessible alternative for small-scale agriculture. Given the need for broader knowledge, this research aims to evaluate the rooting effect of 2,4-D in young stem cuttings of S. tuberosum var. yungay. The experimental phase took place in the greenhouse of the Institute for Potato and Andean Crops, Universidad Nacional de Trujillo, Peru, with seedlings from the same Institute. These seedlings became mother plant donors of young stem cuttings, which were sown in a rooting bed with different 2,4-D concentrations. When analyzed statistically, the results obtained show that the 0.3% concentration caused a higher average in the number of roots (6.52), root length (5.31 cm), and seedling height (2.63 cm). In conclusion, 2,4-D at a 0.3% concentration produces the better rooting of young stem cuttings of S. tuberosum var. yungay.
Keywords auxins; cuttings; plant growth substances; potatoes; vegetative propagation
Introducción
La zona norte del lago Titicaca es uno de los centros de origen y diversidad de Solanum tuberosum L. En este lugar, a partir de especies silvestres como Solanum bukasovii Juz. y Solanum bukasovii var. multidissectum (Hawkes) Ochoa, se originó Solanum stenotomum Juz. et Buk., catalogada como la primera papa domesticada. Solanum stenotomum dio origen a Solanum andigenum Juz. et Buk., que por procesos de poliploidización e hibridación interespecífica originó la gran diversidad de papas. Los antiguos peruanos fueron los responsables de dispersarlas por el centro, sur y norte de Perú y, más adelante, los colonizadores españoles se encargaron de diseminarlas por Europa y el mundo (Centro Internacional de la Papa & Federación Departamental de Comunidades Campesinas, 2006; Gil-Rivero et al., 2019; Gómez et al., 2012; Rodríguez, 2010).
Actualmente, en Perú se conocen más de 5.000 variedades de papa, entre silvestres, nativas y comerciales, y este se considera el cuarto alimento principal de la dieta humana por sus características nutricionales y culinarias (Gómez et al., 2012; Kramm, 2017). En el campo culinario, la papa puede consumirse en diversas preparaciones tales como sopas, purés, papas fritas, papas secas, chuño y tocosh; estas dos últimas son las de mayor importancia etnomedicinal para las poblaciones andinas por su contenido de antibióticos naturales (Álvarez, 2001; Centro Internacional de la Papa, Asociación Pataz & Instituto Nacional de Innovacion Agraria, 2015; Pesantes, 2015).
Solanum tuberosum se propaga de manera vegetativa mediante esquejes, tubérculos y cultivos in vitro, y por vía sexual a través de semilla botánica, que es la forma más empleada porque conserva los atributos agronómicos de la especie. Según el principio de totipotencialidad celular, las plantas conservan la capacidad de regenerar y reconstruir sus tejidos hasta constituirse nuevamente en plantas enteras con un mismo genotipo (Araújo et al., 2009; Hartmann & Kester, 1995; Rojas et al., 2004). Por ello, los agricultores emplean tubérculos-semilla para obtener plantas idénticas a la planta madre, aunque esta vía tiene la desventaja de permitir la transmisión de enfermedades que, aunadas a malas prácticas agrícolas y al potencial genético, disminuyen los rendimientos.
Esta problemática condujo a implementar nuevas alternativas de propagación en los sistemas de producción, como el cultivo in vitro de tejidos vegetales. El cultivo de meristemos, la embriogénesis somática y la tuberización in vitro son las técnicas más empleadas en biotecnología vegetal, ya que garantizan una mejor calidad genética y fitosanitaria del cultivo debido a una menor carga viral y bacteriana. De esta manera, se maximiza la producción y la rentabilidad de las cosechas (Araque et al., 2018; Hernández & Díaz, 2019; Tacoronte et al., 2017).
La propagación por esquejes de tallo juvenil es útil en programas de semillas prebásica y básica. Esta técnica consiste en seleccionar plantas jóvenes de invernadero que contengan entre cinco y seis nudos para cortarlas a nivel de la base del vástago, dejando una hoja basal con su respectiva yema. Luego, se elimina la yema apical y se seccionan porciones de tallo para obtener esquejes constituidos por una hoja y su yema axilar, los cuales, al ser tratados con hormonas y sembrados en arena, inducirán su enraizamiento (Cotes & Ñustez, 2001; Ramírez et al., 2011b).
Para el enraizamiento de un esqueje, es necesario el correcto balance hormonal de fitohormonas o de fitorreguladores. En agricultura, la fitohormona más empleada es el ácido indol-3-butírico (AIB) y el fitorregulador de mayor uso es el ácido 1-naftalenacético (ANA), compuestos no muy asequibles para los pequeños y medianos agricultores y técnicos agropecuarios (García et al., 2001; Moreno et al., 2009; Uribe et al., 2012). Por otro lado, aunque se conoce que el 2,4-D es la auxina sintética de acción herbicida más empleada en la agricultura para el control de malezas por ser económica y de fácil adquisición, se ha reportado que, en una baja concentración, induce el enraizamiento de esquejes (De la Cruz et al., 2014). Por esta razón, el objetivo de esta investigación fue evaluar el enraizamiento de esquejes de tallo juvenil de S. tuberosum var. yungay mediante la aplicación de diferentes concentraciones de 2,4-diclorofenoxiacético.
Materiales y métodos
Se seleccionaron plantas de Solanum tuberosum var. yungay (Solanaceae) con cinco a seis nudos, procedentes del Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos de la Universidad Nacional de Trujillo, y se cultivaron en macetas de 10 cm de diámetro con sustrato constituido por una mezcla de arena, humus y musgo en proporción 1:1:1 y condiciones de invernadero.
Preparación de la cama de siembra
En el invernadero se acondicionó una cama de siembra compuesta de dos capas de arena: la primera, de 4 cm de espesor, con arena gruesa de 1 cm de diámetro en el fondo y la segunda, de 10 cm de espesor, con arena fina de 0,05 cm de diámetro para la superficie. Este sustrato fue previamente desinfectado con hipoclorito de sodio al 2 % por 24 horas y solarización por una semana.
Siembra de esquejes de Solanum tuberosum var. yungay
Cuando las plantas madres lograron aclimatarse y tuvieron entre cinco y seis hojas, se seccionaron esquejes de tallo juvenil constituidos por un brote y su correspondiente hoja (figura 1). El método consistió en humedecer la parte basal de los esquejes con agua para luego impregnarlos con la hormona 2,4-D en polvo según los tratamientos indicados: T1: 0 %; T2: 0,3 %; T3: 0,5 % y T4: 0,8 %.
Finalmente, las plantas se sembraron en cama de enraizamiento a capacidad de campo y se regaron dos veces por semana con agua estéril provista de fertilizante líquido a base de NPK (12-14-12) y a razón de 5 g/L. El invernadero se mantuvo a una temperatura promedio de 25 °C ± 2 °C, una humedad relativa del 80 % y un fotoperiodo de 16 horas luz y 8 horas de oscuridad.
Diseño estadístico
Se empleó un diseño completamente aleatorizado y constituido por 4 tratamientos, 24 repeticiones y 96 unidades experimentales. A los 20 días de la siembra, se midió el número de raíces, la longitud de estas y la altura de plántula. Los datos registrados se analizaron con el entorno de desarrollo integrado RStudio, versión 1.2.5033 y se evaluó la presencia de diferencias estadísticamente significativas mediante la prueba Anova de Welch, debido al no cumplimiento de la homocedasticidad en cada una de las variables, y la prueba post hoc de Games-Howell, con un nivel de significancia del 5 %, para la selección del mejor tratamiento.
Resultados y discusión
El número de raíces, la longitud de raíz mayor y la altura de plántula producidas por las diferentes concentraciones de 2,4-D a los 20 días de siembra evidencian notoriamente la acción de la auxina sintética, con diferencias significativas entre tratamientos y parámetros evaluados (tabla 1). Ramírez et al. (2011a) han demostrado que en solanáceas es necesario utilizar auxinas para el enraizamiento de esquejes juveniles, mientras que en otras especies vegetales no son indispensables, pues basta con el agua como inductor del enraizamiento. Sin embargo, es importante considerar que el tipo de sustrato empleado influye en la calidad y la cantidad de raíces formadas debido a una mayor aireación y retención de agua (López et al., 2008). Por su parte, Ludwig-Müller y Cohen (2002) informaron que las auxinas regulan el desarrollo de las plantas, incluido el enraizamiento, dado que la concentración de hormona usada es responsable de la inducción o inhibición del desarrollo radical de las futuras plantas.
Tabla 1 Valores promedio de las variables medidas para cada tratamiento
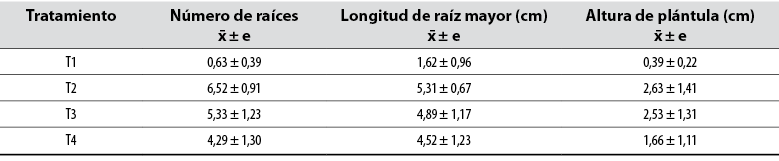
Nota: x̄ ± e: estimación media
Fuente: Elaboración propia
Cuando se empleó 0,3 % de 2,4-D, se obtuvieron mejores resultados en cuanto al número de raíces, la longitud de raíz mayor y la altura de plántula (tabla 1). Al analizar la prueba post hoc de Games-Howell (tabla 2), se evidenció que el tratamiento T2 es el mejor, en tanto logró un mayor número de divisiones celulares que promovieron la emisión de raíces (figura 2). De la Cruz et al. (2014) corroboraron este hallazgo al afirmar que la concentración de 0,3 % de 2,4-D ejerce un efecto positivo en el enraizamiento de esquejes juveniles de Rosa canina L. (Rosaceae).
Tabla 2 Subconjuntos homogéneos obtenidos con prueba de Games-Howell para cada tratamiento según las variables analizadas
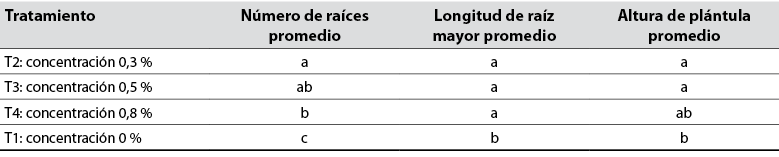
Nota: Las letras diferentes en subconjuntos presentan una diferencia significativa al 95 % de confianza.
Fuente: Elaboración propia

Foto: Segundo Eloy López Medina
Figura 2 Plántula enraizada de S. tuberosum var. yungay obtenida a partir de esqueje de tallo juvenil con aplicación de 2,4-D a los 20 días de siembra
Por otro lado, se observó que, al incrementar la dosis de 2,4-D de 0,3 % a 0,5 % y 0,8 %, no se presentó ningún aumento en el número de raíces, la longitud de raíz mayor y la altura de plántula que superara los resultados del tratamiento T2. Se puede inferir que con una concentración mayor de 2,4-D se genera un desbalance hormonal que termina inhibiendo el enraizamiento. Hartmann y Kester (1995) informaron que los volúmenes de reguladores de crecimiento deben ser óptimos para inducir el enraizamiento. Por otro lado, Moreno et al. (2004) sostienen que al emplear ácido 1-naftalenacético (ANA) se obtienen buenos resultados en el enraizamiento de esquejes de papa. En efecto, Ramírez et al. (2011a) reportaron que el empleo de ANA a una concentración de 0,4 % induce el 100 % de enraizamiento y supervivencia de esquejes. Por su parte, López et al. (2016) indicaron que el ácido indol-3-butírico (AIB) en una concentración de 0,0001 % tiene un efecto positivo en el enraizamiento de esquejes.
Como consecuencia de un buen desarrollo radical, se observó un mayor incremento en la longitud de las plantas (tabla 1, figura 2). Asimismo, la acción de las auxinas, que aumentan la plasticidad de la pared celular, generó un mayor depósito de celulosa, la cual promueve el crecimiento longitudinal (Hager, 2003; Henríquez, 2004). Giraldo et al. (2009) informaron que la presencia de auxinas induce la síntesis de giberelinas, que son las hormonas responsables del alargamiento celular.
Agradecimientos
Un agradecimiento especial al Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos de la Universidad Nacional de Trujillo (Perú), por brindarnos las facilidades para llevar a cabo esta investigación en su establecimiento. De la misma manera, se agradece al Dr. Segundo Eloy López Medina, por permitirnos usar las fotografías del presente artículo.
REFERENCIAS
Álvarez, M. (2001). Oportunidades para el desarrollo de productos de papas nativas en el Perú. Revista Latinoamericana de la Papa, 13(2), 58-79. https://doi.org/10.37066/ralap.v13i2.134 [ Links ]
Araque, E., Bohórquez, M., Pacheco, J., Correa, L., Urquijo, J., Castañeda, S., & Pacheco, J. (2018). Propagación y tuberización in vitro de dos variedades de papa. Ciencia en Desarrollo, 9(1), 21-31. https://doi.org/10.19053/01217488.v9.n1.2018.7132 [ Links ]
Araújo, J., Guerra, D., Araújo, J., Lopes, S., & Balbinot, E. (2009). Propagação vegetativa de cedo-australiano (Toona ciliata M. Roemer) por miniestaquia. Revista Árvore, 33(2), 205-213. http://dx.doi.org/10.1590/S0100-67622009000200002 [ Links ]
Centro Internacional de la Papa & Federación Departamental de Comunidades Campesinas. (2006). Catálogo de variedades de papa nativa de Huancavelica - Perú. Centro Internacional de la Papa. https://bit.ly/2WzRgVl [ Links ]
Centro Internacional de la Papa, Asociación Pataz & Instituto Nacional de Innovacion Agraria. (2015). Catálogo de variedades de papa nativa de Chugay, La Libertad - Perú. Catalog of ancestral potato varieties from Chugay, La Libertad - Peru. Centro Internacional de la Papa. https://hdl.handle.net/10568/69083 [ Links ]
Cotes, J., & Ñustez, C. (2001). Evaluación de dos tipos de esquejes en la producción de semilla prebásica de papa criolla (Solanum phureja Juz et. Buck) variedad “yema de huevo”. Agronomía Colombiana, 18(1-2), 7-13. https://bit.ly/39czSek [ Links ]
De la Cruz, J., Mejía, F., Mostacero, J., Lopéz, E., & Gonza, A. (2014). Efecto de la concentración del 2,4-diclorofenoxiacético (2,4-D) en el enraizamiento de estacas de Rosa sp., rosa silvestre, en condiciones de invernadero. Revista INDES, 2(1), 37-43. http://dx.doi.org/10.25127/indes.20142.61 [ Links ]
García, D., Jiménez, J., Peña, A., & Rodríguez, J. (2001). Propagación vegetativa de tomate de cáscara (Physalis ixocarpa Brot.) mediante enraizamiento de esquejes. Agricultura Técnica en México, 27(1), 27-33. [ Links ]
Gil-Rivero, E., Lopéz-Medina, E., Mostacero-León, J., & De la Cruz-Castillo, J. (2019). Papas nativas con potencial antioxidante, cultivadas en el norte del Perú. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 18(3), 289-324. https://bit.ly/2ZHYKYE [ Links ]
Giraldo, L., Ríos, H., & Polanco, M. (2009). Efecto de dos enraizadores en tres especies forestales promisorias para la recuperación de suelos. Revista de Investigación Agraria y Ambiental, 1, 41-47. https://doi.org/10.22490/21456453.1966 [ Links ]
Gómez, T., López, J., Pineda, R., Galindo, L., Arango, R., & Morales, J. (2012). Caracterización citogenética de cinco genotipos de papa criolla , Solanum phureja (Juz. et Buk.). Revista Facultad Nacional de Agronomía Medellín, 65(1), 6379-6387. https://revistas.unal.edu.co/index.php/refame/article/view/30764 [ Links ]
Hager, A. (2003). Role of the plasma membrane H+-ATPase in auxin-induced elongation growth: historical and new aspects. Journal of Plant Research, 116, 483-505. https://doi.org/10.1007/s10265-003-0110-x [ Links ]
Hartmann, H., & Kester, D. (1995). Propagación de plantas. Principios prácticos. Compañía Editorial Continental. [ Links ]
Henríquez, E. (2004). Evaluación de tres factores de enraizamiento en estacas de morera (Morus alba) [Undergraduate thesis, Universidad de Chile]. Academic repository Universidad de Chile. http://repositorio.uchile.cl/handle/2250/101738 [ Links ]
Hernández, A., & Díaz, H. (2019). Inducción in vitro de callo embriogénico a partir del cultivo de anteras en "papa amarilla" Solanum goniocalyx Juz. & Bukasov (Solanaceae). Arnaldoa, 26(1), 277-286. http://dx.doi.org/10.22497/arnaldoa.261.26111 [ Links ]
Kramm, V. (2017). Manual del cultivo de la papa en Chile [Boletín INIA N.º 10]. Instituto de Desarrollo Agropecuario; Instituto de Investigaciones Agropecuarias. https://bit.ly/399fGu0 [ Links ]
López, E., Gil, A., & López, A. (2016). Enraizamiento de esquejes de Stevia rebaudiana Bertoni (Asteraceae) “estevia”, aplicando dosis creciente de ácido indolbutírico. Arnaldoa, 23(2), 569-576. https://doi.org/10.22497/arnaldoa.232.23209 [ Links ]
López, F., Guío, N., Fischer, G., & Lasprilla, D. (2008). Propagación de uchuva (Physalis peruviana L.) mediante diferentes tipos de esquejes y sustratos. Revista Facultad Nacional de Agronomía Medellín, 61(1), 4347-4357. https://revistas.unal.edu.co/index.php/refame/article/view/24733 [ Links ]
Ludwig-Müller, J., & Cohen, J. (2002). Identification and quantification of three active auxins in different tissues of Tropaeolum majus. Physiologia Plantarum, 115(2), 320-329. https://doi.org/10.1034/j.1399-3054.2002.1150220.x [ Links ]
Moreno, N., Álvarez-Herrera, J., Balaguera-López, H., & Fischer, G. (2009). Propagación asexual de uchuva (Physalis peruviana L.) en diferentes sustratos y a distintos niveles de auxina. Agronomía Colombiana, 27(3), 341-348. https://revistas.unal.edu.co/index.php/agrocol/article/view/13277 [ Links ]
Moreno, S., Marquinez, X., & Caro, M. (2004). Evaluación de dos tipos de esquejes para producción de tubérculo- semilla élite en cuatro variedades de papa Solanum phureja Juz et Buk y Solanun tuberosum L. Acta Biológica Colombiana, 9(2), 111-112. https://revistas.unal.edu.co/index.php/actabiol/article/view/27380/27644 [ Links ]
Pesantes, A. (2015). Efecto antibacteriano in vitro de Solanum tuberosum L. (papa fermentada) en cepas de Escherichia Coli comparado con gentamicina y ceftriaxona [Undergraduate thesis, Universidad Privada Antenor Orrego]. Digital Repository Universidad Privada Antenor Orrego. http://repositorio.upao.edu.pe/handle/upaorep/1562 [ Links ]
Ramírez, L., Zuluaga, C., & Cotes, J. (2011a). Evaluación de metodologías de enraizamiento de esquejes de tallo lateral en genotipos de Solanum phureja. Revista Facultad de Ciencias Básicas, 7(2), 192-203. https://doi.org/10.18359/rfcb.2103 [ Links ]
Ramírez, L., Zuluaga, C., & Cotes, J. (2011b). Sobrevivencia de esquejes de tallo lateral de genotipos de Solanum phureja. Revista Facultad de Ciencias Básicas, 7(2), 182-191. https://doi.org/10.18359/rfcb.2105 [ Links ]
Rodríguez, L. (2010). Origen y evolución de la papa cultivada. Una revisión. Agronomía Colombiana, 28(1), 9-17. https://revistas.unal.edu.co/index.php/agrocol/article/view/17588 [ Links ]
Rojas, S., García, J., & Alarcón, M. (2004). Propagación asexual de plantas. Conceptos básicos y experiencias con especies amazónicas. Corporación Colombiana de Investigación Agropecuaria; Ministerio de Agricultura y Desarrollo Rural; Programa Nacional de Transferencia de Tecnología Agropecuaria. http://hdl.handle.net/20.500.12324/17056 [ Links ]
Tacoronte, M., Vielma, M., Olivo, A., & Chacín, N. (2017). Efectos de nitratos y sacarosa en la propagación in vitro de tres variedades de papa nativa. Revista Colombiana de Biotecnología, 19(2), 63-73. https://doi.org/10.15446/rev.colomb.biote.v19n2.70160 [ Links ]
Uribe, M., Ulloa, J., Delaveau, C., Sáez, K., Muñoz, F., & Cartes, P. (2012). Influencia de las auxinas sobre el enraizamiento in vitro de microtallos de Nothofagus glauca (Phil.) Krasser. Gayana Botanica, 69(1), 105-112. https://doi.org/10.4067/S0717-66432012000100010 [ Links ]
Recibido: 14 de Septiembre de 2019; Aprobado: 08 de Junio de 2020











 text in
text in 




