Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.21 no.3 Mosquera Sep./Dec. 2020 Epub Aug 31, 2020
https://doi.org/10.21930/rcta.vol21_num3_art:1275
Recursos biofísicos
Presencia de hongos micorrízicos arbusculares nativos asociados a la rizosfera de la palma naidí en Colombia
1Universidad Nacional Abierta y a Distancia. Cali, Colombia
2Biorgánicos del Norte, SAS. Bucaramanga, Colombia
3Universidad Nacional Abierta y a Distancia. Turbo, Colombia
En la región del Pacífico colombiano, el naidí, Euterpe oleracea Mart. (Arecaceae), produce un fruto de gran importancia por su alta calidad nutritiva, que representa una fuente de ingresos para las familias de la zona. En el presente estudio, se evalúa la presencia de hongos micorrízicos arbusculares (HMA) en suelo rizosférico de E. oleracea en el Bajo Calima, Buenaventura (Colombia). Este es el primer informe de HMA de E. oleracea en Colombia. Se recolectaron muestras de suelo superficiales (0-10 cm) de dos localidades (L1: influencia de cultivos de arroz; L2: zona de bosque tropical) y se determinaron las propiedades químicas del suelo, el número de esporas y la colonización micorrízica del sistema radicular. Se observó baja colonización micorrízica (10 % en L1 y 4 % en L2), que se correlacionó de forma negativa con el contenido disponible de P en el suelo. Sin embargo, se registraron diferencias significativas entre las áreas (p = 0,009). Se observaron esporas (660 y 791 esporas/100 g suelo en L1 y L2, respectivamente) globosas, subglobosas y ovoides, representadas en diversos morfotipos que pueden clasificarse como Claroideoglomeraceae, Glomeraceae, Diversisporaceae, Paraglomeraceae y Ambisporaceae. La baja colonización micorrízica observada podría ocurrir debido al alto contenido de P disponible en las localidades evaluadas (13,1 mg/kg en L1 y 20,5 mg/kg en L2), entre otros factores edáficos que podrían estar asociados, ya que aún no se cuenta con suficientes estudios que relacionen factores ecológicos con la dinámica de HMA en bosques tropicales. Por otra parte, la cantidad de esporas encontradas en el suelo rizosférico de E. oleracea sugiere un gran potencial para explorar la actividad de HMA nativos de la región del Pacífico colombiano, con el fin de lograr prácticas productivas sustentables de esta palmera.
Palabras clave bosque tropical; esporas fúngicas; Euterpe oleracea; hongos del suelo; organismos del suelo
In the Colombian Pacific region, the naidí palm, Euterpe oleracea Mart. (Arecaceae) produces high-value fruit due to its high nutritional quality, representing an economic benefit to the families of the region. In this study, we evaluated the occurrence of arbuscular mycorrhizal fungi (AMF) in the rhizospheric soil of E. oleracea in Bajo Calima, Buenaventura. This is the first report of AMF of E. oleracea in Colombia. Surface soil samples (0 - 10 cm) were collected in two areas (L1 - under the influence of rice cropping and L2 - tropical rainforest). The chemical properties of the soil, the number of spores, and the mycorrhizal colonization in the root were established. We observed low mycorrhizal colonization (10 % in L1 and 4 % in L2), negatively correlated to the content of available phosphorus in the soil. However, significant differences between areas (. = 0.009) were recorded. Globose, subglobose, and ovoid spores were observed (660 and 791 spores/100 g soil in L1 and L2, respectively). Spores are represented in several morphotypes that can be classified as Claroideoglomeraceae, Glomeraceae, Diversisporaceae, Paraglomeraceae, and Ambisporaceae. High available P content (13.1 mg/kg in L1 and 20.5 mg/kg in L2), among other edaphic factors associated, could explain the low mycorrhizal colonization observed, especially when there are not enough studies linking ecological factors with AMF dynamics in tropical rainforests. On the other hand, spore abundances reported in the rhizospheric soil of E. oleracea suggest a high potential to explore indigenous AMF activity in the Colombian Pacific region to achieve sustainable production practices in this palm.
Keywords Euterpe oleracea; fungal spores; soil fungi; soil organisms; tropical forest
Introducción
El naidí o açaí, Euterpe oleracea Mart. (Arecaceae), es una palmera que crece en América del Sur (Jones, 1995) y se distribuye ampliamente en Brasil (Gallori et al., 2004), Ecuador, las Guayanas, Panamá, Venezuela y Colombia (Galeano & Bernal, 2018). Se encuentra en mayor número en suelos periódicamente inundados, aunque también crece con menores densidades en suelos no inundados (Cavalcante, 1974). En Colombia, E. oleracea se encuentra en las regiones Amazónica y Pacífico, así como en el valle del Magdalena (Galeano & Bernal, 2018). El fruto de la palma naidí es una baya de color morado-negro (Gallori et al., 2004) y de consumo masivo por su alto valor nutricional y niveles elevados de minerales, lípidos y proteínas (Silva et al., 2014), por lo que representa una fuente de ingresos económicos para las familias que lo venden en los mercados locales (Montenegro-Gómez & Rosales-Escarria, 2015). Corpocampo, una organización empresarial basada en estrategias de uso sostenible, cuenta con aproximadamente 5.000 hectáreas sembradas entre Buenaventura (Valle del Cauca) y Putumayo, y tres plantas de producción en Guapi (Cauca), Tumaco (Nariño) y Puerto Asís (Putumayo), donde procesa cinco millones de toneladas de naidí al año, de las cuales el 98 % se exporta y solo el 2 % se comercializa en el mercado nacional (Llano, 2017).
Los hongos micorrízicos arbusculares (HMA) del filo Glomeromycota son conocidos por sus asociaciones beneficiosas con las plantas y se ha informado que colonizan más del 80 % de las raíces de estas (Ambrosino et al., 2018; Rivera et al., 2016). Sin embargo, se ha publicado poca información en la literatura sobre los HMA relacionados con las palmas tropicales (Molineros Hurtado et al., 2013). No obstante, el resultado encontrado sugiere que las palmas son dependientes de la colonización de HMA, como se ha descrito para Euterpe edulis (Bonfim et al., 2015; Sgrott et al., 2012), Euterpe precatoria (Garcés-Ruiz et al., 2017) y Bactris gasipaes (Garcés-Ruiz et al., 2017; Riascos Ortiz et al., 2011). Los HMA desarrollan asociaciones con E. oleracea según lo observado por Chu (1999), quien encontró beneficios en el crecimiento y la adquisición de nutrientes en las etapas de pre-vivero y vivero. El establecimiento de semillas de E. oleracea es un proceso complejo, ya que las plantas muestran un crecimiento lento y una alta mortalidad (Bovi et al., 1987). Sin embargo, se observó un aumento significativo en el crecimiento y la adquisición de nutrientes en las plántulas después de ser inoculadas con siete especies de HMA, lo que demuestra que E. oleracea es una planta dependiente de micorrizas (Chu, 1999).
Cuando se realizó esta investigación, no existía información bibliográfica sobre HMA asociados con la rizosfera de E. oleracea en Colombia ni sobre si las propiedades químicas del suelo —principalmente fósforo— pueden afectar las poblaciones naturales de los HMA para obtener el máximo beneficio de la simbiosis con la palma naidí. En consecuencia, el objetivo de esta investigación fue aportar información relacionada con algunos factores ambientales que pueden afectar la ocurrencia y distribución de HMA nativos para su uso en otras localizaciones.
Materiales y métodos
Área de estudio
La investigación se realizó en dos áreas ubicadas en el Bajo Calima, Buenaventura (Colombia), en las coordenadas 03°54' y 04°00' de latitud norte, y 77°05' y 77°30' de longitud oeste. Según el sistema de clasificación de Köppen, el clima de esta región es Af (bosque húmedo tropical), con una precipitación media anual de 7.328 mm, una temperatura media anual de 26,1 °C e inundaciones regulares. Se recolectaron muestras de suelo de dos sitios diferentes con presencia de E. oleracea. El primero fue un área bajo la influencia del cultivo de arroz (L1) y el segundo se ubicó en un área de bosque tropical (L2). Se extrajeron tres muestras de suelo de la rizosfera de E. oleracea entre 0 y 10 cm de profundidad. Las raíces finas de E. oleracea (<1 mm) son más abundantes en esta capa de suelo en comparación con otras profundidades. Las tres muestras de suelo se mezclaron en una muestra compuesta hasta completar 1.000 g. Las muestras de suelo y raíces se colocaron en bolsas plásticas, se almacenaron a 4 °C (antes de su preparación y análisis) y se transportaron al laboratorio.
Análisis químico del suelo
Las propiedades químicas del suelo se determinaron en 150 g de todas las muestras de suelo. El pH se midió en una relación suelo-agua de 1:1 con un medidor de pH (Lab 855 - SI Analytics, GmbH, Mainz, Alemania) y el contenido de materia orgánica se determinó mediante el método colorimétrico Wakley Black K2Cr2O7-H2SO4. El fósforo (P) disponible y el total se establecieron siguiendo los métodos de digestión ácida y Bray II, respectivamente. El aluminio se extrajo con KCl, mientras el calcio, el magnesio, el potasio y el sodio se determinaron mediante espectrometría de absorción atómica. Las muestras de suelo fueron analizadas en el Centro Internacional de Agricultura Tropical (CIAT).
Muestreo de raíces y esporas
Las esporas de HMA se extrajeron de submuestras de suelo de 100 g mediante el método de tamizado en húmedo y decantación (Brundrett & Juniper, 1995). Las esporas se contaron e identificaron montando la muestra en portaobjetos de vidrio con PVLG mezclado con reactivo de Melzer (1:1 v/v) (Morton, 1991). El número de esporas se registró en HMA/100 g de suelo seco (Sánchez de Prager et al., 2010; Sieverding, 1983). Para estimar la tasa de colonización de HMA, se seleccionaron raíces finas en E. oleracea (<1 mm) obtenidas de mezclas de suelo, que se aclararon con KOH al 10 % y se tiñeron con azul tripán o azul de tripano (0,05 %). Las raíces teñidas se lavaron con agua y los excesos de colorante se eliminaron con lactoglicerol. Se cortaron fragmentos de raíces de 1 cm de largo y se montaron en paralelo sobre placas según Deguchi et al. (2017), Rivera et al. (2016) y Sieverding (1983).
Análisis estadístico
La colonización de micorrizas y el número de esporas entre dos áreas se compararon usando la prueba . en el software SigmaPlot, versión 11.0 (SYSTAT Software Inc., California, EE. UU.). El nivel de P disponible, la abundancia de esporas y la colonización de micorrizas se analizaron mediante la correlación producto-momento de Pearson en SigmaPlot. La abundancia de esporas y la colonización de micorrizas se transformaron utilizando log10 en la correlación producto-momento de Pearson.
Resultados y discusión
Análisis químicos del suelo
El valor del pH del suelo resultó bajo en ambas áreas evaluadas y osciló entre 5,12 y 5,44. También se observaron altos niveles de P total y disponible en L1 y L2, respectivamente. Además, se registró un contenido similar de materia orgánica en L1 y L2 (tabla 1). Los niveles de Ca, Mg, K, P, S y N detectados en el suelo variaron entre L1 y L2.
Tabla 1 Análisis químico del suelo en los dos sitios de muestreo donde crece la palma naidí (E. oleracea) en el Bajo Calima, Pacífico colombiano
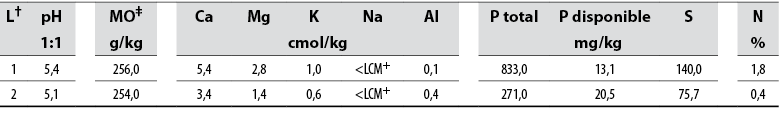
Nota: Los valores se basan en una muestra compuesta para cada área.
†Sitios de muestreo;
‡Materia orgánica;
+Límite de cuantificación del método
Fuente: Elaboración propia
Colonización de micorrizas y abundancia de esporas
La colonización micorrízica en L1 (10,2 ± 0,9 %) fue significativamente mayor que en L2 (4,3 ± 0,9 %). De acuerdo con la correlación producto-momento de Pearson, se observó una correlación negativa entre los niveles de P disponibles y la colonización micorrízica en L1 (p = 0,006; r = -1,0) y L2 (p = 0,02; r = -1,0). El número de esporas varió de 660 a 791 por 100 g de suelo seco (figura 1), aunque L2 mostró la mayor abundancia de esporas.
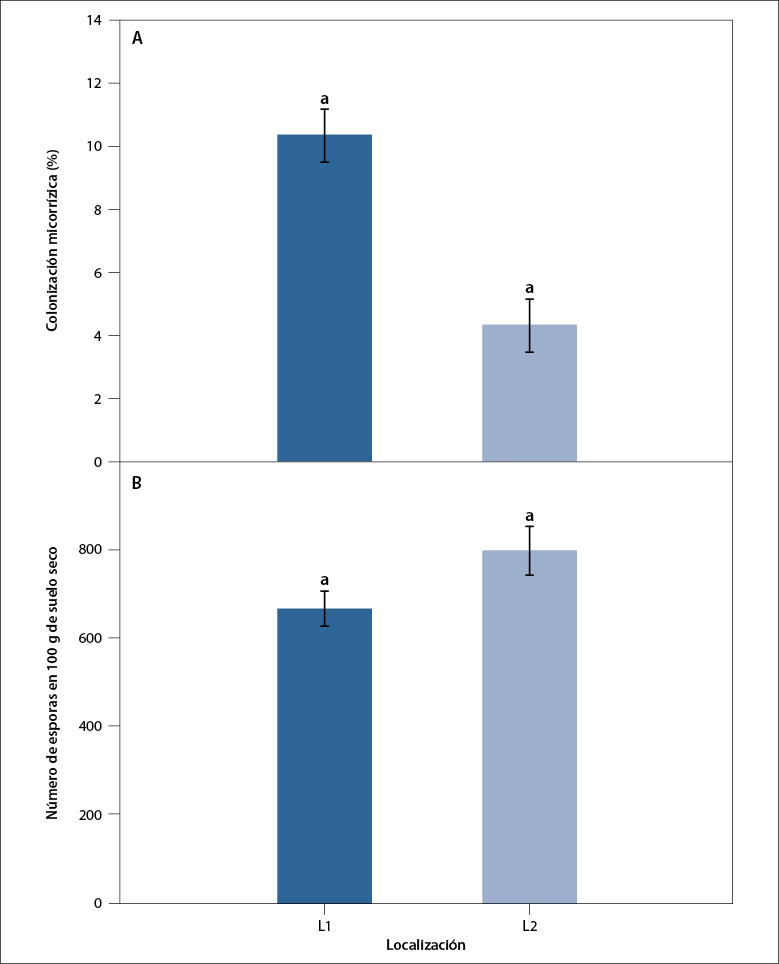
Fuente: Elaboración propia
Figura 1 A. Colonización micorrízica (%); B. Abundancia de esporas (número de esporas/100 g de suelo seco) asociado con la rizosfera de E. oleracea en una zona influenciada por cultivos de arroz (L1) y una zona de bosque tropical (L2) del Pacífico colombiano. Las barras representan valores medios y su error estándar (EE). Letras diferentes muestran una diferencia significativa entre las áreas muestreadas (p < 0,05)
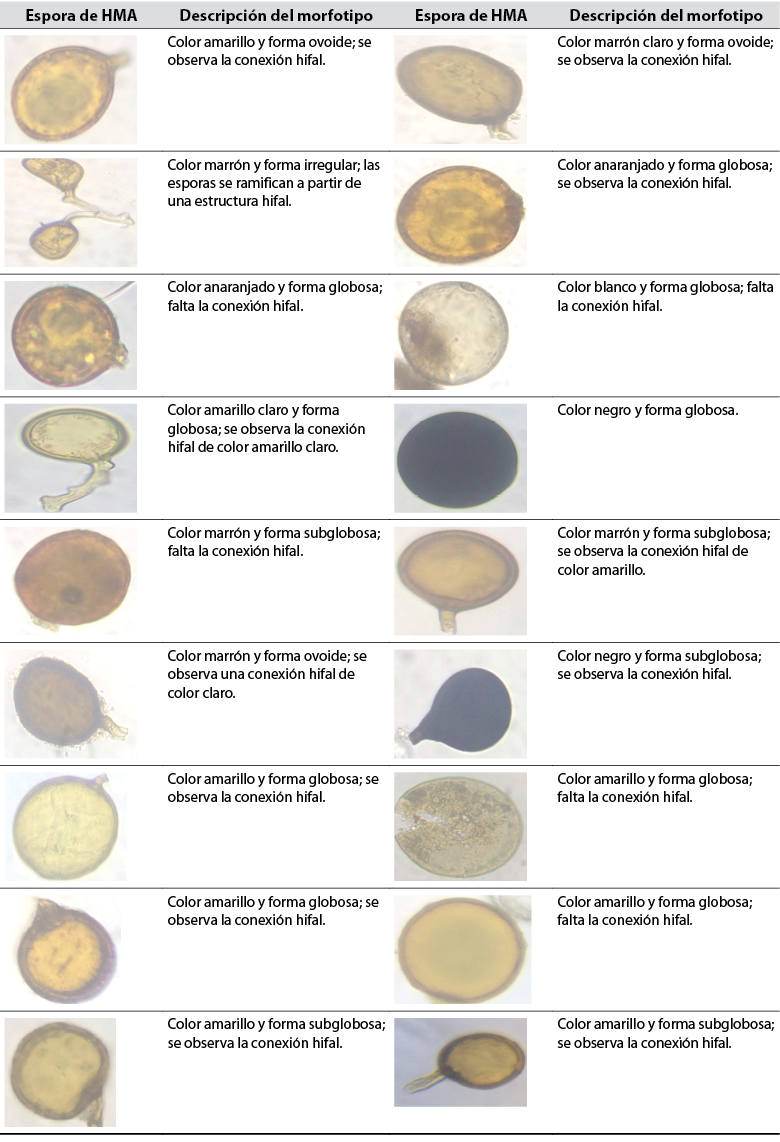
Se registraron esporas ovoides y globosas representadas en varios morfotipos (tablas 2 y 3). Las esporas observadas en la tabla 2 pertenecen a L1, mientras que las esporas de la tabla 3 se encontraron en L2. La mayor parte de las esporas son glomoides (morfotipo de Glomus) y se pueden clasificar como Claroideoglomeraceae, Glomeraceae, Diversisporaceae o Paraglomeraceae; también existen especies dimórficas que se pueden clasificar como Ambisporaceae. Dentro del filo Glomeromycota, las especies con formación de esporas glomoides son el grupo más grande (Oehl et al., 2011). Las esporas de color negro representan el mismo morfotipo y posiblemente pertenecen a la misma especie.
Tabla 2 Esporas de hongos micorrízicos arbusculares (HMA) aisladas de la rizosfera de E. oleracea en un área influenciada por cultivos de arroz (L1)
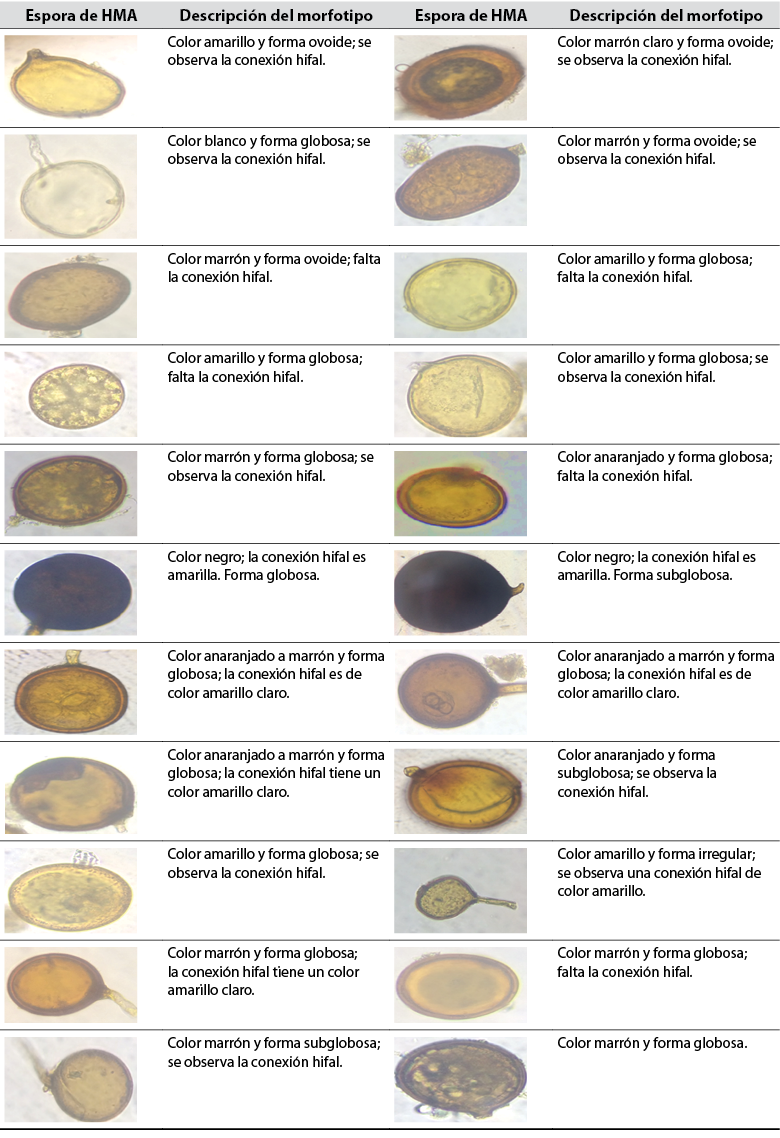
Fuente: Elaboración propia. Fotografías: Maité Rosales
Discusión
En este estudio se evaluó la colonización micorrízica y la abundancia de esporas asociadas a la rizosfera de E. oleracea en dos áreas —la primera bajo la influencia de un arrozal inundado y la segunda en bosque tropical lluvioso— ubicadas en el Bajo Calima (Colombia), para comprender cómo el nivel de P disponible afecta la colonización de micorrizas y la abundancia de esporas. En el estudio actual, el análisis de suelos mostró altos niveles de P total, principalmente en L1, donde se aplican grandes cantidades de fertilizantes en los campos de arroz cerca del área donde se encuentran las plantas de E. oleracea. Según Casas (2012), el P disponible mostró niveles adecuados y altos en las áreas L1 y L2, respectivamente (tabla 1).
Sin embargo, varios estudios indican que los suelos ricos en formas naturales de P o niveles altos de P debido a la fertilización disminuyen la colonización de raíces por HMA (Maia et al., 2009; Moreira & Siqueira, 2006). Esta situación se observó en el presente estudio, donde los niveles de P disponible fueron 13,10 mg/kg en L1 y 20,50 mg/kg en L2, mientras que la colonización micorrízica fue baja (10 % en L1 y 4 % en L2). Esto concuerda con los hallazgos reportados por Ramos-Zapata et al. (2006) sobre la dinámica de la dependencia micorrízica en Desmoncus orthacanthos, una palma nativa de Yucatán (México), según los cuales los niveles más bajos de P disponible en el suelo (12 ppm) mostraron una mayor colonización de micorrizas (25 %), mientras que los niveles más altos de P disponible (24 ppm) registraron valores más bajos de colonización micorrízica (7 %). Por tanto, la relación de E. oleracea observada entre el P disponible y la colonización micorrízica indicaría que la asociación simbiótica podría estar relacionada con la absorción de este elemento.
No obstante, las tasas de colonización bajas podrían estar asociadas con otros factores, ya que no hay suficientes estudios que relacionen los factores ecológicos con la dinámica de los HMA en los bosques tropicales (Eom et al., 2000). Por ejemplo, se reportaron correlaciones entre la abundancia de HMA o la colonización de micorrizas y los valores de pH o el contenido de materia orgánica en la palmera E. edulis en el Bosque Atlántico brasileño (Bonfim et al., 2015). Sin embargo, en los hallazgos de esta investigación no se evaluó ninguna correlación con el pH o el contenido de materia orgánica. A pesar de haber realizado el estudio en suelos de bosque tropical caracterizados por valores de pH y fertilidad extremadamente bajos (Martins et al., 2015; Pereira et al., 2010), los HMA pueden ser esenciales en el establecimiento y la supervivencia de plantas forestales debido a su impacto en los suelos (Zangaro & Moreira, 2010).
Por otro lado, aunque se ha informado que las características individuales del suelo desempeñan un papel importante en las comunidades de HMA en ecosistemas naturales y agrícolas (Jansa et al., 2014), el efecto impulsor de las propiedades del suelo no se puede atribuir a una sola característica de este, sino a las interacciones entre todas junto con la planta hospedante y los factores ambientales no relacionados con las propiedades del suelo (Alguacil et al., 2016). Si bien no se conoce bien el papel del pH en la colonización micorrízica, este es importante dada la condición ácida de los suelos evaluados en este trabajo (Clark, 1997; Coughlan et al., 2000; Duarte et al., 2018; Siqueira et al., 1984). Por el contrario, la baja colonización micorrízica (<20 %) observada en este estudio podría estar asociada con el efecto de la inundación del suelo, como se reportó en investigaciones realizadas en las mismas condiciones (Miller, 2000; Pérez et al., 2011).
Según Zangaro et al. (2008, 2012), la madurez de las plantas de E. oleracea que crecen en bosques secundarios en una sucesión tardía (Mazuera & Ladrach, 1981) también es un factor que puede disminuir la colonización de micorrizas en bosques maduros. En este tipo de bosque, se han registrado valores bajos de colonización de micorrizas, lo que indica que los árboles con menor actividad metabólica no pudieron resistir la asociación de la simbiosis debido a la disminución de la disponibilidad de carbohidratos (Zangaro et al., 2008, 2012). Además, al comparar varias coberturas vegetales (suelos cubiertos de gramíneas nativas y bosques secundarios y maduros) a profundidades de 0-10 cm y 10-20 cm, se observó una relación negativa entre la profundidad del suelo y la madurez de la vegetación con la colonización de micorrizas. Los valores más bajos se encontraron en el bosque maduro y en capas de suelo a más de 10 cm de profundidad (Zangaro et al., 2014), como lo han informado otros autores (Brown & Bledsoe, 1996; Cardoso et al., 2003; Ingleby et al., 1997; Muthukumar et al., 2003; Powers et al., 2005).
Considerando la relevancia de esta palma en Colombia, así como los factores ambientales que afectan la asociación simbiótica en la región del Pacífico, se compararon los resultados de abundancia de esporas con los encontrados en E. edulis, una palma que crece en los bosques tropicales brasileños. En este estudio se registró una mayor abundancia de esporas en comparación con las encontradas en áreas de bosque tropical similares en Brasil. Medina et al. (2012) reportaron una baja abundancia de esporas (120-400 esporas en 100 g de suelo seco) en cinco áreas forestales de Minas Gerais, mientras que Bonfim et al. (2015) encontraron entre 8 y 22 esporas en 1 g de suelo seco en el Bosque Atlántico de São Paulo. Aun así, los niveles de P disponibles también podrían afectar la abundancia de esporas en el presente estudio, ya que los niveles altos de P también afectan la esporulación de HMA (Lin et al., 2012; Maia et al., 2009).
Se encontraron varios morfotipos de HMA asociados a E. oleracea que pueden clasificarse como Claroideoglomeraceae, Glomeraceae, Diversisporaceae, Paraglomeraceae y Ambisporaceae. Así mismo, 58 taxones de HMA asociados a la rizosfera de E. edulis se clasificaron mediante técnicas moleculares en Ambisporaceae, Diversisporaceae, Acaulosporaceae, Entrophosporaceae, Glomeraceae, Dentiscutataceae, Gigasporaceae, Intraornatosporaceae, Racocetraceae, Scutellosporaceae y Praglomeraceae, a lo largo de un gradiente altitudinal en el Bosque Atlántico brasileño, siendo considerada esta región como un punto caliente (hotspot) de biodiversidad de HMA (Bonfim et al., 2015). En este sentido, la región donde se realizó este estudio muestra resultados interesantes sobre la diversidad de HMA debido a las condiciones climáticas similares a las de los bosques lluviosos del Atlántico. De manera similar, mediante herramientas moleculares, se reportó que los géneros asignados a Acaulosporaceae, Archaeosporaceae y Glomeraceae están asociados con E. precatoria en suelos contaminados de la selva amazónica de Ecuador (Garcés-Ruiz et al., 2017). Sin embargo, es importante considerar que las muestras recolectadas en el campo son sumamente variables, dado que las esporas están altamente expuestas al parasitismo y al deterioro por varios agentes edáficos (Leal et al., 2009).
Este artículo es el primer informe sobre HMA asociados a la rizosfera de E. oleracea y al género Euterpe en Colombia, aunque ya se había revelado la asociación de HMA en la rizosfera de E. oleracea en condiciones de invernadero (Chu, 1999). Se necesitan más estudios con identificaciones sólidas para evaluar la estructura, composición y diversidad de los HMA relacionados con E. oleracea en la región del Pacífico colombiano, un área fuente de especies nativas de HMA que puede ser una buena alternativa para sistemas agrícolas y agroforestales con condiciones limitadas de nutrientes.
Conclusiones
En este estudio se encontró baja colonización de micorrizas y gran abundancia de esporas en dos áreas con palmas de E. oleracea. La abundancia de esporas encontrada en la rizosfera de E. oleracea sugiere un potencial para explorar HMA nativos en la región del Pacífico colombiano, que se puede articular con una producción sostenible de la palma. Un nivel de P disponible en el suelo afectó negativamente la colonización de raíces de HMA, pero la influencia de otros parámetros edáficos junto con el efecto de la planta también podrían estar relacionados con factores ecológicos en la dinámica de los HMA en bosques tropicales. Se requieren estudios sobre E. oleracea en Colombia, ya que es vital realizar trabajos de bioprospección, incluyendo los HMA, para la producción sostenible de palmas de E. oleracea en diferentes condiciones ambientales.
Agradecimientos
Los autores agradecen a Maité Rosales, por la toma de las fotografías utilizadas en este trabajo; al Dr. Sidney Luiz Sturmer, de la Universidade Regional de Blumenau, Santa Catarina (Brasil), por su ayuda en la identificación de algunas esporas, y a M. Sc. Stalin Sarango Flores, del Instituto de Biología de la Universidad de Leiden (Países Bajos), por sus valiosas contribuciones para completar este artículo.
REFERENCIAS
Alguacil, M. M., Torres, M. P., Montesinos-Navarro, A., & Roldán, A. (2016). Soil Characteristics Driving Arbuscular Mycorrhizal Fungal Communities in Semiarid Mediterranean Soils. Applied and Environmental Microbiology, 82(11), 3348-3356. https://doi.org/10.1128/AEM.03982-15 [ Links ]
Ambrosino, M. L., Busso, C. A., Cabello, M. N., Velázquez, M. S., Torres, Y. A., Ithurrart, L. S., ... & Palomo, I. R. (2018). Total and structure colonization by arbuscular mycorrhizal fungi in native, perennial grasses of different forage quality exposed to defoliation. Journal of King Saud University-Science, 32(1), 377-383. https://doi.org/10.1016/j.jksus.2018.06.001 [ Links ]
Bonfim, J. A., Vasconcellos, R. L. F., Gumiere, T., Mescolotti, D. L. C., Oehl, F., & Cardoso, E. J. B. N. (2015). Diversity of arbuscular mycorrhizal fungi in a Brazilian Atlantic forest toposequence. Microbial Ecology, 71, 164-177. https://doi.org/10.1007/s00248-015-0661-0 [ Links ]
Bovi, M. L., Godoy-Júnior, G., & Saes, L. A. (1987). Pesquisas com os gêneros Euterpe e Bactris no Instituto Agronômico de Campinas. Agronômico, 39(2), 129-174. [ Links ]
Brown, A. M., & Bledsoe, C. (1996) Spatial and temporal dynamics of mycorrhizas in Jaumea carnosa, a tidal salt marsh halophyte. Journal of Ecology, 84, 703–715. https://doi.org/10.2307/2261333. [ Links ]
Brundrett, M., & Juniper, S. (1995). Non-destructive assessment of spore germination of VAM fungi and production of pot cultures from single spores. Soil Biology and Biochemistry, 27(1), 85-91. [ Links ]
Cardoso, I. M., Boddington, C., Janssen, B. H., Oenema, O., & Kuyper, T. W. (2003). Distribution of mycorrhizal fungal spores in soils under agroforestry and monocultural coffee systems in Brazil. Agroforestry Systems, 58(1), 33-43. https://doi.org/10.1023/A:1025479017393 [ Links ]
Casas, R. (2012). El suelo de cultivo y las condiciones climáticas. Editorial Paraninfo. [ Links ]
Cavalcante, P. B. (1974). Frutas comestíveis da Amazônia. Publicações Avuisa N927. Instituto Nacional de Pesquisas da Amazônia. https://bit.ly/362wYI5 [ Links ]
Chu, E. Y. (1999). The effects of arbuscular mycorrhizal fungi inoculation on Euterpe oleracea Mart. (açaí) seedlings. Pesquisa Agropecuária Brasileira, 34(6), 1018-1024. http://dx.doi.org/10.1590/S0100-204X1999000600013 [ Links ]
Clark, R. B. (1997). Arbuscular mycorrhizal adaptation, spore germination, root colonization, and host plant growth and mineral acquisition at low pH. Plant and Soil, 192, 15-22. https://doi.org/10.1023/A:1004218915413 [ Links ]
Coughlan, A. P., Dalpé, Y., Lapointe, L., & Piché, Y. (2000). Soil pH-induced changes in root colonization, diversity, and reproduction of symbiotic arbuscular mycorrhizal fungi from healthy and declining maple forests. Canadian Journal of Forest Research, 30, 1543-1554. https://doi.org/10.1139/x00-090 [ Links ]
Deguchi, S., Matsuda, Y., Takenaka, C., Sugiura, Y., Ozawa, H., & Ogata, Y. (2017). Proposal of a new estimation method of colonization rate of arbuscular mycorrhizal fungi in the roots of Chengiopanax sciadophylloides. Mycobiology, 45(1), 15-19. https://doi.org/10.5941/MYCO.2017.45.1.15 [ Links ]
Duarte, L. M., Bertini, S. C. B., Stürmer, S. L., Lambais, M. R., & Azevedo, L. C. B. (2018). Arbuscular mycorrhizal fungal communities in soils under three phytophysiognomies of the Brazilian Atlantic Forest. Acta Botanica Brasilica, 33(1), 50-60. https://doi.org/10.1590/0102-33062018abb0236 [ Links ]
Eom, A. H., Hartnett, D. C., & Wilson, G. W. (2000). Host plant species effects on arbuscular mycorrhizal fungal communities in tallgrass prairie. Oecologia, 122(3), 435-444. https://doi.org/10.1007/s004420050050 [ Links ]
Galeano, G., & Bernal, R. (2018). Euterpe oleracea Mart. In R. Bernal, S. R. Gradstein & M. Celis (Eds.), Catálogo de plantas y líquenes de Colombia (2020-08-25). Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá. http://catalogoplantasdecolombia.unal.edu.co/es/resultados/especie/Euterpe%20oleracea/ [ Links ]
Gallori, S., Blilia, A.R., Bergonzi, M. C., Barbosa, W. L. R., & Vincieri, F. F. (2004). Polyphenolic Constituents of fruit pulp of Euterpe oleracea Martt. (Açai palm). Chromatographia, 59(11-12), 739-743. https://doi.org/10.1365/s10337-004-0305-x [ Links ]
Garcés-Ruiz, M., Senés-Guerrero, C. D., Declerck, S., & Cranenbrouck, S. (2017). Arbuscular Mycorrhizal Fungal Community Composition in Carludovica palmata, Costus scaber and Euterpe precatoria from weathered oil ponds in the Ecuadorian Amazon. Frontiers in Microbiology, 8, 2134. https://doi.org/10.3389/fmicb.2017.02134 [ Links ]
Ingleby, K., Diagne, O., Deans, J. D., Lindley, D. K., Neyra, M., & Ducousso, M. (1997). Distribution of roots, arbuscular mycorrhizal colonisation and spores around fast-growing tree species in Senegal. Forest Ecology and Management, 90(1), 19-27. https://doi.org/10.1016/S0378-1127(96)03875-3 [ Links ]
Jansa, J., Erb, A., Oberholzer, H. R., Šmilauer, P., & Egli, S. (2014). Soil and geography are more important determinants of indigenous arbuscular mycorrhizal communities than management practices in Swiss agricultural soils. Molecular Ecology, 23(8), 2118-2135. https://doi.org/10.1111/mec.12706 [ Links ]
Jones, D. L. (1995). Palms throughout the world. Reed Books. [ Links ]
Leal, P. L., Stürmer, S. L., & Siqueira, J. O. (2009). Occurrence and diversity of arbuscular mycorrhizal fungi in trap cultures from soils under different land use systems in the Amazon, Brazil. Brazilian Journal of Microbiology, 40(1), 111-121. https://doi.org/10.1590/S1517-83822009000100019 [ Links ]
Lin, X., Feng, Y., Zhang, H., Chen, R., Wang, J., Zhang, J., & Ch, H. (2012). Long-term balanced fertilization decreases arbuscular mycorrhizal fungal diversity in an arable soil in north China revealed by 454 pyrosequencing. Environmental Science & Technology, 46(11), 5764-5771. https://doi.org/10.1021/es3001695 [ Links ]
Llano, J. (2017, October 17). Açaí: El “Súper fruto” al rescate del Pacífico colombiano Universidad de los Andes. https://agronegocios.uniandes.edu.co/2017/10/17/acai-el-super-fruto-al-rescate-del-pacifico-colombiano/ [ Links ]
Maia, R., Serrão, B., Vasconcelos, S. S., Souza, C., & de Freitas, J. (2009). Efeitos da fertilização fosfatada sobre a população de fungos micorrízicos arbusculares em um sistema agroflorestal na Amazônia Oriental. XXXII Congresso brasileiro de ciência do solo: O solo e a produção de bioenergia: Perspectivas e desafios. SBCS. https://ainfo.cnptia.embrapa.br/digital/bitstream/item/43708/1/1626.pdf [ Links ]
Martins, S. C., Neto, E. S., Piccolo, M. C., Almeida, D. Q., Camargo, P. B., do Carmo, J. B., Porder, S., Lins, S. R., & Martinelli, L. A. (2015). Soil texture and chemical characteristics along an elevation range in the coastal Atlantic Forest of Southeast Brazil. Geoderma Regional, 5, 106-116. https://doi.org/10.1016/j.geodrs.2015.04.005 [ Links ]
Mazuera, G. H., & Ladrach, W. E. (1981). Composición y crecimiento de la regeneración natural de cuatro a quince años de edad en la concesión del Bajo Calima. Cartón de Colombia. [ Links ]
Medina, J. M., Moreira, S. L. S., Alves, R. C., Martins, M. L., & da Rocha-Campos, A. N. (2012). Fungos micorrízicos arbusculares em Euterpe edulis Martius (Palmeira Juçara) no município de Rio Pomba/MG. Vértices, 14(2). https://doi.org/10.19180/1809-2667.20120050 [ Links ]
Miller, S. P. (2000). Arbuscular mycorrhizal colonization of semi-aquatic grasses along a wide hydrologic gradient. New Phytologist, 145(1), 145-155. https://doi.org/10.1046/j.1469-8137.2000.00566.x [ Links ]
Molineros Hurtado, F. H., Mosquera-Espinosa, A. T., Gómez-Carabalí, A., & Otero, J. T. (2013). Variación temporal en la colonización de hongos micorrízicos arbusculares de Bactris gasipaes Kunth en Buenaventura. Acta Agronómica, 62(4), 344-351. https://revistas.unal.edu.co/index.php/acta_agronomica/article/view/38690/45147 [ Links ]
Montenegro-Gómez, S. P., & Rosales-Escarria, M. (2015). Fruto de naidí (Euterpe oleracea) y su perspectiva en la seguridad alimentaria colombiana. Entramado, 11(2), 200-207. http://dx.doi.org/10.18041/entramado.2015v11n2.22238 [ Links ]
Moreira, F. M., & Siqueira, J. O. (2006). Microbiologia e bioquímica do solo. Editora UFLA. [ Links ]
Morton, J. B. (1991). INVAM newsletters, vol. 1-5. West Virginia University. [ Links ]
Muthukumar, T., Sha, L., Yang, X., Cao, M., Tang, J., & Zheng, Z. (2003). Distribution of roots and arbuscular mycorrhizal associations in tropical forest types of Xishuangbanna, southwest China. Applied Soil Ecology, 22(3), 241-253. https://doi.org/10.1016/S0929-1393(02)00156-7 [ Links ]
Oehl, F., Silva, G. A. D., Goto, B. T., & Sieverding, E. (2011). Glomeromycota: three new genera and glomoid species reorganized. Mycotaxon, 116, 75-120. https://doi.org/10.5248/116.75 [ Links ]
Pereira, F. D., de Mello, A., Correa, H., Michelotti, F., Maneschy, R. Q., & Knoechelmann, C. M. (2010). Distribuição de fungos micorrízicos nos assentamentos palmares e araras. Agroecossistemas, 2(1), 2-7. http://dx.doi.org/10.18542/ragros.v2i1.1173 [ Links ]
Pérez, A., Rojas, J. R., & Montes, V. D. (2011). Hongos formadores de micorrizas arbusculares: una alternativa biológica para la sostenibilidad de los agroecosistemas de praderas en el caribe colombiano. Revista Colombiana de Ciencia Animal, 3(2), 366-385. https://doi.org/10.24188/recia.v3.n2.2011.412 [ Links ]
Powers, J. S., Treseder, K. K., & Lerdau, M. T. (2005). Fine roots, arbuscular mycorrhizal hyphae and soil nutrients in four neotropical rain forests: patterns across large geographic distances. New Phytologist, 165(3), 913-921. https://doi.org/10.1111/j.1469-8137.2004.01279.x [ Links ]
Ramos-Zapata, J. A., Orellana, R. & Allen, E. B. (2006). Mycorrhizal dynamics and dependence of Desmoncus orthacanthos Martius (Arecaceae), a native palm of the Yucatan Peninsula, Mexico. Interciencia, 31(5), 364-370. https://www.redalyc.org/articulo.oa?id=33911609 [ Links ]
Riascos Ortiz, D., Sarria-Villa, G., Varón de Agudelo, F., Gómez-Carabalí, A. & Mosquera-Espinosa, A. (2011). Reconocimiento de hongos con potencial benéfico asociados a la rizosfera de chontaduro (Bactris gasipaes H.B.K.) en la región Pacífico del Valle del Cauca, Colombia. Acta Agronómica, 60(4), 319-327. https://revistas.unal.edu.co/index.php/acta_agronomica/article/view/28846 [ Links ]
Rivera, F. A., González, V., González, J. G., & Ossa, P. A. (2016). Caracterización molecular, análisis morfológico y colonización micorrízica en la rizósfera del aguacate (Persea americana Mill) en Caldas, Colombia. Acta Agronómica, 65(4), 398-405. http://dx.doi.org/10.15446/acag.v65n4.51714 [ Links ]
Sánchez De Práguer, M., Posada, R., Velázquez, D., & Narváez, M. (2010). Metodologías básicas para el trabajo con micorriza arbuscular y hongos formadores de micorriza arbuscular. Universidad Nacional de Colombia, Sede Palmira. [ Links ]
Sgrott, A. F., Booz, M. R., Pescador, R., Heck, T. C., & Stürmer, S. L. (2012). Inoculação micorrízica arbuscular aumenta biomassa de Euterpe edulis e Archontophoenix alexandrae após dois anos em condições de campo. Revista Brasileira de Ciência do Solo, 36(4), 1103-1112. https://doi.org/10.1590/S0100-06832012000400005 [ Links ]
Sieverding, E. (1983). Manual de métodos para la investigación de la micorriza vesículo-arbuscular en el laboratorio. Centro Internacional de Agricultura Tropical. http://ciat-library.ciat.cgiar.org/ciat_digital/CIAT/books/historical/198.pdf [ Links ]
Silva, D. F., Vidal, F. C., Santos, D., Costa, M. C., Morgado-Díaz, J. A., Nascimento, M. D., & de Moura, R. S. (2014). Cytotoxic effects of Euterpe oleracea Mart. in malignant cell lines. BMC Complementary and Alternative Medicine, 14, 175. https://doi.org/10.1186/1472-6882-14-175 [ Links ]
Siqueira, J. O., Hubbell, D. H. & Mahmud, A.W. (1984). Effect of liming on spore germination, germ tube growth and root colonization by vesicular arbuscular mycorrhizal fungi. Plant and Soil, 76, 115-124. https://doi.org/10.1007/BF02205572 [ Links ]
Zangaro, W., de Assis, R. L., Rostirola, L. V., de Souza, P. B., Gonçalves, M. C., Andrade, G., & Nogueira, M. A. (2008). Changes in arbuscular mycorrhizal associations and fine root traits in sites under different plant successional phases in southern Brazil. Mycorrhiza, 19, 37-45. https://doi.org/10.1007/s00572-008-0202-5 [ Links ]
Zangaro, W., & Moreira, M. (2010). Micorrizas arbusculares nos Biomas Floresta Atlântica e Floresta de Araucária. In J. Siqueira, F De Souza, E. Cardoso, & S. Tsai, (Eds.), Micorrizas: 30 anos de pesquisas no Brasil. Vol. 1. (pp. 279-310). Editora UFLA. [ Links ]
Zangaro, W., Alves, R. A., Lescano, L. E., Ansanelo, A. P., & Nogueira, M. A. (2012). Investment in fine roots and arbuscular mycorrhizal fungi decrease during succession in three Brazilian ecosystems. Biotropica, 44(2), 141-150. https://www.jstor.org/stable/41495941 [ Links ]
Zangaro, W., de Almeida Alves, R., de Souza, P. B., Rostirola, L. V., Lescano, L. E., Rondina, A. B., & Nogueira, M. A. (2014). Succession and environmental variation influence soil exploration potential by fine roots and mycorrhizal fungi in an Atlantic ecosystem in southern Brazil. Journal of Tropical Ecology, 30(3), 237-248. https://doi.org/10.1017/S0266467414000078 [ Links ]
Recibido: 26 de Enero de 2019; Aprobado: 26 de Agosto de 2020











 text in
text in