Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706On-line version ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.22 no.1 Mosquera Jan./Apr. 2021 Epub Jan 01, 2021
https://doi.org/10.21930/rcta.vol22_num1_art:1686
Genética vegetal y biodiversidad
Diversidad genética del aguacate criollo en Nayarit, México, determinada por ISSR
1Universidad Autónoma de Nayarit. Tepic
2Universidad Autónoma de Nayarit. Tepic
3Universidad Autónoma de Nayarit. Tepic
4Universidad Autónoma de Nayarit. Tepic
5Universidad Autónoma de Nayarit. Tepic
Los frutos de aguacate son nutritivos y de gran aceptación para su consumo en fresco. México es uno de los países con mayor producción y consumo de aguacate a nivel mundial. Las condiciones geográficas y edafoclimáticas de Nayarit, México, han sido idóneas para la reproducción del género Persea, por lo que existe un gran acervo genético del aguacate. El objetivo fue analizar la diversidad genética de Persea americana criollo del estado de Nayarit con los marcadores genéticos ISSR que son altamente polimórficos. Se recolectaron 43 materiales de aguacate criollo en cinco municipios de Nayarit, México. El nivel de diversidad genética detectado fue del 64 %, mientras que el análisis molecular de varianza indicó que la mayor variación se encuentra dentro de las poblaciones (82 %). La distancia genética de Nei y Li (Dice) agruparon los genotipos entre grupos de acuerdo con las distancias genéticas y se observó que la agrupación en la mayoría de los nodos estuvo asociada a la situación geográfica o climática. La información generada de esta investigación puede ser útil para construir estrategias de conservación y manejo del cultivo.
Palabras clave condiciones edafoclimáticas; distancia genética; genotipos; marcadores genéticos; Persea americana
Avocado fruits are nutritious and highly accepted for fresh consumption. Mexico is one of the world’s largest producers and consumers of avocado. The geographical and edaphoclimatic conditions of Nayarit, Mexico, have been ideal for reproducing the genus Persea, hence the large avocado gene pool. This research analyzes the genetic diversity of native Persea americana from Nayarit using the highly polymorphic ISSRs genetic markers. We collected 43 samples of native avocado from five municipalities in Nayarit. The level of genetic diversity detected was 64 %, and the analysis of molecular variance indicated that the most significant variation is within populations (82 %). Dice’s genetic distance clustered the genotypes among groups according to genetic distances, and the clusters were associated with geographical or climatic conditions. Therefore, the information generated by this research can be useful in developing crop conservation and management strategies.
Keywords edaphoclimatic conditions; genetic distance; genetic markers; genotypes; Persea americana
Introducción
Persea americana Mill. (aguacate) pertenece a la familia Lauraceae, ampliamente distribuida en el mundo, especialmente en Asia y América. En México existen al menos 26 diferentes especies relacionadas con el aguacate (Reyes et al., 2013). En la actualidad se conocen tres razas diferentes de aguacate: Mexicana, Persea americana var. drymifolia (Schltdl. & Cham.) S. F. Blake; Guatemalteca, P. americana var. guatemalensis (L. O. Williams), y Antillana, P. americana var. americana Miller. Estas tres variedades se pueden diferenciar por sus características morfológicas-fisiológicas (Barrientos et al., 2010).
Actualmente, la mayoría de las variedades comerciales de aguacate son híbridos interraciales desarrollados a partir del intercambio de materiales entre las diferentes zonas (Álvarez et al., 2018). En las regiones americanas en donde el aguacate se cultiva desde tiempos precolombinos, la producción proviene de fuentes distintas de árboles nativos o criollos y cultivares selectos reproducidos asexualmente, en las que las características organolépticas y nutricionales varían según sus condiciones edafoclimáticas (Mijares-Oviedo & López-López, 1998); además, son un refugio de diversidad genética única que alberga genes que aún no han sido estudiados (Gutiérrez et al., 2015), siendo las variedades criollas las que suelen ser más resistentes a plagas y enfermedades (Sánchez, 1999).
La identificación tradicional de las plantas se hace por caracterización fenotípica, un procedimiento lento y limitado debido a que la expresión de los caracteres cuantitativos está sujeta a una fuerte influencia ambiental (Galindo-Tovar et al., 2008). Los marcadores moleculares permiten identificar, clasificar y aprovechar la diversidad genética existente en los genomas de las plantas, ya que las diferencias o similitudes a nivel del ADN entre individuos se observa en forma directa (Galindo-Tovar et al., 2008).
Las relaciones filogenéticas del aguacate han sido estudiadas con diversos marcadores moleculares RFLP (Davis et al., 1998; Furnier et al., 1990), minisatélites y microsatélites (Ashworth & Clegg, 2003; Cañas-Gutiérrez et al., 2019a), RAPD (Fiedler et al., 1998; Reyes et al., 2013) con AFLP (Chao, 2003) y SNP (Rendón-Anaya et al., 2019; Talavera et al., 2019). Las Inter-Secuencias Simples Repetidas (ISSR) son marcadores altamente polimórficos y han probado su utilidad en estudios de diversidad genética, filogenia, identificación de genes, mapeo genético y biología evolutiva (Cai et al., 2010).
De acuerdo con Reyes et al. (2013), Persea indica (L.) Spreng. y P. lingue (Ruiz & Pav.) Nees mantienen poca relación genética con el resto de las especies estudiadas por pertenecer al subgénero Eriodaphne. Por otra parte, los resultados permitieron diferenciar genotipos de las diferentes especies del subgénero Persea incluyendo a P. americana y un híbrido interespecífico incluido en el estudio. Sin embargo, otros estudios se han dificultado debido a su complejidad genética y a la evolución reticulada de la especie, principalmente debido a la selección y a los múltiples cruzamientos entre las distintas variedades (Galindo-Tovar et al., 2008). Los ambientes variados en los que el aguacate ha evolucionado y las diversas formas en que ha sido manejado por diferentes culturas han producido la gran diversidad de genotipos que actualmente se conocen (Chen et al., 2009).
Estos marcadores han sido utilizados en muchas especies como, por ejemplo, en especies de los géneros Agave (Dávila et al., 2007), Plukenetia (Rodríguez et al., 2010) y Manihot (Alzate, 2010).
En el estado de Nayarit, México, aún es posible encontrar plantas silvestres de P. americana que forman parte de la vegetación, cuyas características son contrastantes a diferencia de las variedades mejoradas que se cultivan en diferentes sistemas agrícolas y de forma intensiva, tanto en huertos familiares como de traspatio (Sánchez, 1999).
El cultivo del aguacate es económicamente rentable y representa óptimas perspectivas de desarrollo económico para el país y en especial para el estado de Nayarit, por ser una de las entidades federativas con mayor producción después de Michoacán, Jalisco y Morelos (Secretaría de Agricultura, Ganadería Desarrollo Rural, Pesca y Alimentación [Sagarpa], 2018). El objetivo de este trabajo fue determinar la variabilidad genética del aguacate criollo, mediante marcadores moleculares tipo ISSR. La información obtenida permitirá la identificación y clasificación de la diversidad existente y aprovechar dicha diversidad en programas de mejoramiento genético.
Materiales y métodos
Material genético
Se colectaron 10 hojas jóvenes de cada uno de 43 árboles de aguacate en los municipios de Tepic (21°55'60''N, 104°94'70''O), Xalisco (21°42'55''N, 104°89'18''O), San Blas (21°33'56''N,105°10'59''O), Tecuala (22°39'92''N, 105°44'85''O) y Compostela (21°25'09''N,21°25'09''N), con una altitud de 950, 1.324, 53, 19 y 190 m s.n.m., respectivamente, de huertos familiares, de traspatio y de árboles silvestres; además, se utilizó como testigo un aguacate variedad Hass (tabla 1).
Caracterización molecular
La extracción de ADN se llevó a cabo con 400 mg de hojas liofilizadas de cada árbol, de acuerdo con el método descrito por Clarke et al. (1989). La integridad del ADN extraído se evaluó por electroforesis en geles de agarosa al 1 % y se observó en un transiluminador ultravioleta (UVP Benchtop). La cuantificación del ADN se realizó en un nanodrop (Jenway, UK). Las muestras de ADN se diluyeron a 10 ng/µL y se almacenaron a -20 °C para su posterior uso. Para la amplificación del ADN se realizaron pruebas con ocho iniciadores de ISSR reportados por Cuiris-Pérez et al. (2009), usados en el presente estudio (tabla 2). La reacción de amplificación consistió en 4,0 µL de ADN genómico (40 ng), 1,5 µL mezcla de dNTP, 2,0 µL de iniciadores ISSR (1,0 µM), 2,2 µL 1X taq buffer, 0,2 µL ADN taq polimerasa (1 U/mL), 0,8 µL MgCl2 (2,0 mM) y 9,3 µL de ddH2O. La PCR se llevó a cabo en un termociclador SelecCycler.
Tabla 2 Lista de iniciadores utilizados en el análisis molecular y sus respectivas secuencias
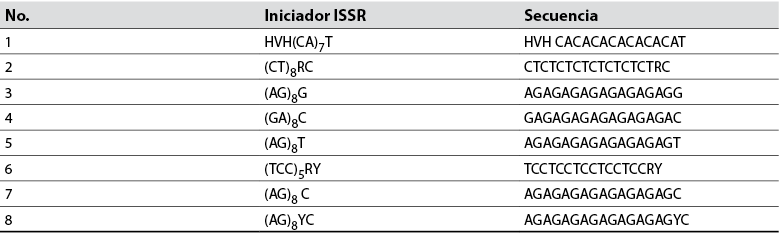
Fuente: Adaptado de Cuiris-Pérez et al. (2009)
Análisis de datos
Con los datos generados por ISSR se generó una matriz binaria de unos y ceros, para la presencia (1) y ausencia (0) de cada una de las bandas en cada genotipo. La relación de similitud genética entre las poblaciones estudiadas fue estimada por el método de pares no ponderados con media aritmética (UPGMA) usando el método de Dice. Los datos de la matriz binaria fueron analizados por software Sistema de Análisis Multivariado y Taxonómico Numérico (NTSYS).
Los datos de la matriz para diversidad genética de poblaciones fueron analizados usando el programa TPFGA (Miller, 1997), utilizando las distancias genéticas de Nei y Li (1979). La diversidad genética de las poblaciones se cuantificó de acuerdo con el número de alelos por locus (A), el porcentaje de loci polimórfico (% P), heterocigosis observada (Ho), heterocigosis esperada (He), el Índice de Diversidad (ID) y AMOVA, se realizó un análisis con el programa TPFGA y GenAlEx (Genetic Analysis in Excel) v. 6.4.
Se realizó una prueba de estructura genética mediante un análisis bayesiano de asignación de individuos, en el que de una a cinco poblaciones podían estar agrupadas. El programa fue ejecutado usando 100.000 iteraciones de MCMC (cadenas de Markov Monte Carlo), 10.000 réplicas y 10 repeticiones para cada K, empleando el programa de STRUCTURE 2.3.4. (Evanno et al., 2005).
Resultados y discusión
Todos los iniciadores ISSR (Cuiris-Pérez et al., 2009) generaron información polimórfica, lo que permitió caracterizar los 43 genotipos en estudio (figura 1).
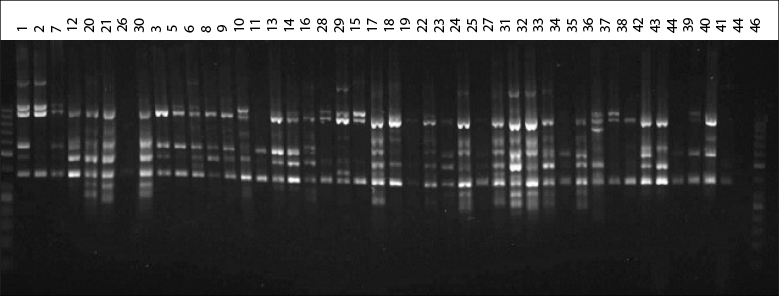
Fuente: Elaboración propia
Figura 1 Perfil genético de genotipos de aguacate criollo obtenido mediante el iniciador CT8RC.
Nivel de polimorfismo
Los ocho iniciadores del tipo ISSR utilizados en 43 genotipos de aguacate criollo, pertenecientes a cinco municipios, amplificaron un total de 82 loci. El número de bandas detectadas fue desde 12 hasta 17. Otros investigadores reportan que los iniciadores utilizados para aguacate amplificaron entre 15 y 17 bandas y alta heterocigocidad, como sucedió en este estudio (Galindo et al., 2011). En relación con la información del contenido de información de polimorfismo (PIC) detectado para cada una de las secuencias reportadas, en esta investigación los resultados indican que el PIC fluctuó de 36 a 94 % (tabla 3). En general, el PIC promedio fue del 63,82 % detectado con este tipo de secuencias, considerado moderado. Los resultados obtenidos en este trabajo son muy similares al trabajo realizado por Cuiris-Pérez et al. (2009), donde obtuvieron un promedio de 92,64 % con 231 genotipos y siete iniciadores. Este tipo de secuencias es considerado alto, por lo que los ISSR son adecuados para estudios de diversidad genética en aguacate.
En contraste, Álvarez et al. (2018) reportaron un PIC promedio de 31,7 % al utilizar marcadores RAPD, mientras que Bharad et al. (2009) reportaron hasta un 73 % y Salazar et al. (2010), reportaron un 87 % utilizando isoenzimas. Por otra parte, la diversidad genética (ID) promedio en este trabajo fue del 64 %, muy similar a lo observado por Ashworth y Clegg (2003), quienes reportaron un promedio de diversidad genética del 60,7 % cuando analizaron 35 cultivares de aguacate y dos parientes silvestres por medio de marcadores microsatélites, pero es bajo comparado con lo observado por Álvarez et al. (2018), quienes informaron valores del 84 %.
Tabla 3 Parámetros de diversidad genética del aguacate criollo (Persea americana) en cinco localidades muestreadas en Nayarit, México
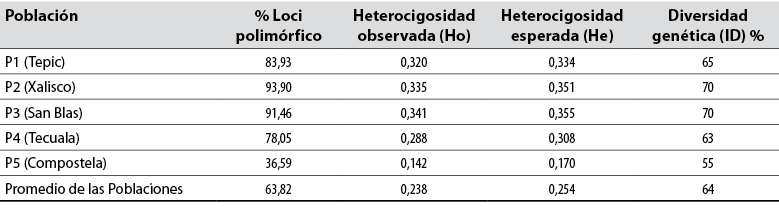
Fuente: Elaboración propia
En relación con la heterocigosidad esperada (He) en las diferentes localidades, Tepic, Xalisco, San Blas y Tecuala presentan valores muy similares con un promedio de 0,33, mientras que Compostela tuvo un valor de 0,17 valor considerado bajo. Por otra parte, la heterocigosidad observada (Ho) en la población tres presentó un promedio de 0,34, el más alto de todas las poblaciones, mientras que el menor valor fue de 0,14, correspondiente a la población cinco (tabla 3). En un trabajo similar realizado por Ponce (2013) en los valles interandinos de Ecuador, se obtuvo una heterocigosis observada (Ho) de 0,64, mientras que la heterocigosis esperada (He) fue de 0,74, el cual arroja valores altos; si se considera que la heterocigosis es una medida de la diversidad genética, estos índices indican moderada diversidad genética en Nayarit, especialmente si se compara con trabajos similares, como el de Ashworth y Clegg (2003), quienes obtuvieron heterocigosidad de 0,63.
Los datos obtenidos del AMOVA se resumen en la tabla 4, los cuales mostraron que la diferencia entre localidades es baja (18 %), mientras que la variación dentro de cada localidad (82 %) es amplia; Cañas-Gutiérrez et al. (2019a) obtuvieron resultados similares, y mostraron que la mayor parte de la variación genética ocurrió dentro de (94,5 %) en lugar de entre (5,44 %) municipio, donde sugiere que los aguacates de esa parte de Colombia son genéticamente distintos según el sitio muestreado. Esto concuerda con las relaciones genéticas, es decir, con la agrupación en cada uno de los nodos que está definida por su localización o condiciones climáticas. Estos resultados se deben a las diferencias genéticas que hay en la colección de trabajo de aguacate, debido a la gran variabilidad de criollos que pueden existir. Asimismo, estos resultados son similares a los obtenidos por Ponce (2013), cuyos datos obtenidos del AMOVA mostraron una diferenciación de 17 % procedentes de las diferentes provincias, y el 83 % de la variación observada entre individuos. Esos resultados se deben a las diferencias genéticas que hay en la colección de trabajo de aguacate debido a materiales introducidos de otros países.
Relaciones genéticas
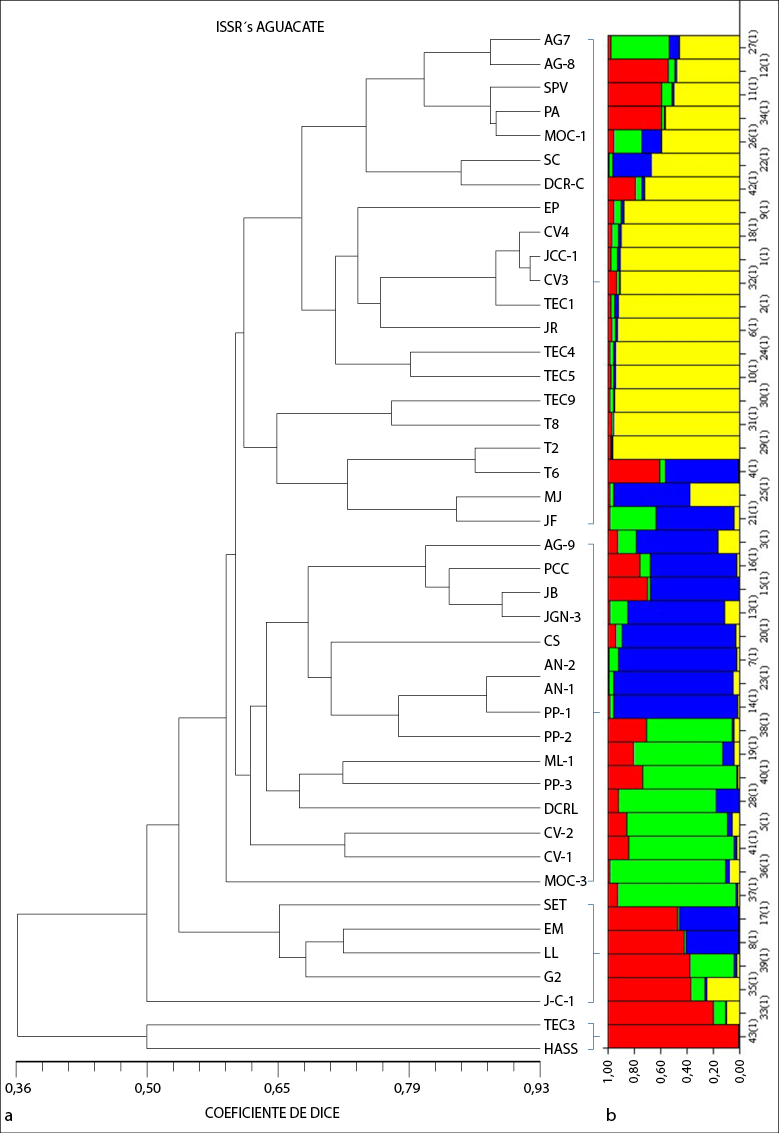
De acuerdo con el análisis de agrupamiento generado por aguacates criollos podemos decir que, debido a la polinización cruzada que posee, no se conformaron grupos bien definidos, pero se observa que dentro de los grupos se unen por localidades. Galindo-Tovar et al. (2011) mencionaron que, debido a la gran variabilidad fenotípica y a los híbridos entre las diferentes variedades de aguacate, la identificación de genotipos mediante microsatélites ha resultado ambigua, por lo que ha sido difícil designar la composición racial. El dendograma generado muestra cuatro grupos principales (figura 2).
En el grupo I se integraron los genotipos de cinco localidades: Tecuala (Tec 1,2,4,5,6,8,9), San Blas (CV-3 y 4, JCC-1), Xalisco (SC, DCR-C y EP), Las Varas (JR, MJ, JF) y Tepic (AG-7 y 8, SPV, PA, MOC-1); los municipios de Tecuala y San Blas tienen la característica en común de altitud (24 a 13 m s.n.m.), clima subtropical y predominancia de suelos tipo solonchak; Tepic y Xalisco tienen una altitud entre 950 a 1.400 m s.n.m. y Compostela de 190 m s.n.m., con predominancia de suelos tipo luvisol y cambisol, y con un clima tropical. Podemos ver que los materiales dentro de este grupo se asocian debido a su localización geográfica. En ese sentido, Ohsawa e Ida (2007) indicaron que la altitud es un referente para estimar la diversidad genética, pues un alelo en particular permite mostrar diferencias entre poblaciones, como resultado de la selección natural sobre la altitud.
El grupo II se formó con tres localidades: Tepic (AG-9, PCC, MOC-3), San Blas (AN-1 y 2, PP-1, 2 y 3, CS, CV-1 y 2) y Xalisco (JGN-3, ML-1, JB y DCR-L), y el grupo III, por Tepic (SET, EM), San Blas (J-C-1) y Xalisco (LL y G2). Estos dos grupos son muy similares en agrupación de localidades, debido a que tienen una altitud y temperaturas afines y el municipio de San Blas está ubicado en la zona costera del estado a una altitud de 53 m s.n.m., lo que concuerda con lo reportado por Cuiris-Pérez et al. (2009) y Rodríguez et al. (2003) quienes trabajaron con diversidad genética dentro de una colección de germoplasma en Cuba y México. Estos autores comentan que, por las características de los ISSR, pueden identificar fragmentos más específicos, por lo que podrían compartir similitudes en el interior de su genoma, aun cuando estos pueden tener diferente origen geográfico. En el grupo IV el genotipo Hass quedó separado de la mayoría de los genotipos encontrados en los grupos antes mencionados, excepto Tec-3, lo que puede indicar que estos dos genotipos pueden ser similares. El aguacate Hass se utilizó como referencia para observar la diferencia genética que existe entre un aguacate criollo y un cultivar conocido.
Los resultados obtenidos en esta investigación coinciden con los reportados por Cañas- Gutiérrez et al. (2015) quienes, al realizar la caracterización morfológica y molecular con marcadores AFLP de 111 cultivares de criollos y comerciales de aguacate (P. americana) en Colombia, encontraron altos niveles de heterocigocidad, y la distancia genética produjo tres agrupaciones que incluyeron individuos que se encontraban con gran cercanía y similares condiciones geográficas. Asimismo, Cañas-Gutiérrez et al. (2019a, b), utilizando marcadores microsatélites SSR en aguacates criollos de Colombia, sugieren que la estructura del aguacate en Antioquia se debió a diferencias en las condiciones agroecológicas de la zona estudiada. Álvarez et al. (2018), en su evaluación molecular del aguacate criollo (P. americana) en Nuevo León, México, utilizando marcadores RAPD, encontraron dos grandes grupos que también se asociaron por su origen geográfico, agrupándose materiales de la región norte, por una parte, y de la región sur, por otra; dichas regiones presentan condiciones agroecológicas diferentes.
A su vez, en un estudio de Reyes et al. (2013) de distinción de especies el género Persea utilizó ISSR, se agruparon algunos individuos con características en común como individuos de la raza Mexicana, individuos de la raza Guatemalteca, y a P. lingue. P. indica del subgénero Eriodaphne, lo que indica la marcada falta de afinidad entre las especies e híbridos tanto del subgénero Persea (con excepción de las razas de P. americana) como de Eriodaphne. Talavera et al. (2019) realizaron un estudio en España donde utilizaron 71 accesiones de las tres razas: Mexicana, Guatemalteca y Antillana, utilizando marcadores SNP; en dicho estudio se obtuvo un valor de Ho bajo (0,16) respecto al marcador molecular SSR. Estos marcadores utilizados separaron ampliamente las accesiones estudiadas según su raza botánica.
De acuerdo con Ashworth y Clegg (2003), las condiciones de agrupamiento de las localidades muestreadas se explican por la complejidad del estado híbrido de los aguacates, debido a la antigua hibridación de la especie o a una diferenciación racial más reciente de lo que se ha supuesto. Esto, aunado a la antigua relación del aguacate con el hombre y a las diferentes condiciones de domesticación (Galindo-Tovar et al., 2008), ha resultado en una gran diversidad de genotipos de afinidades genéticas difíciles de separar, mostrada por los individuos colectados en esta investigación. Hay cierta agrupación en este estudio, por lo que Galindo-Tovar et al. (2011) comentan que la integración de un grupo de aguacates refleja la interacción geográfica de cuatro localidades ubicadas en un área geográfica definida por características similares, de suelo, tipo de vegetación y clima, aunque con variantes de precipitación pluvial y temperatura.
Lo anterior es de particular interés para el aguacate criollo en Nayarit, cuyo problema para su comercialización es la corta vida de anaquel del fruto, por lo que al encontrar variación genética se incrementa la posibilidad de generar nuevos materiales; asimismo, se podrían aprovechar la característica de los aguacates nativos recolectados para generar variedades con alto contenido de aceite, por arriba de lo registrado en variedades comerciales como el Hass, lo que coincide con investigaciones realizadas en variedades criollas recolectadas en Colombia (Álvarez et al., 2018).
Los resultados de Structure muestran 4 grupos (k = 4). En la figura 2, cada individuo está representado por una barra, que contiene de 1 a 4 colores. Cada color representa un grupo y el mayor porcentaje de asignación de color que contiene la barra es lo que indica a que grupo pertenece cada individuo (figura 2b). Se calcularon la Fst 1 de 0,4250, Fst 2 de 0,6948, Fst 3 de 0,4069 y Fst 4 de 0,5547, para los cuatro grupos. Los valores indican que los individuos de los grupos 1 y 3 están menos relacionados entre sí respecto a los grupos 2 y 4. Estos resultados son un apoyo al árbol UPGMA, demostrando que en el aguacate criollo existen diferencias genéticas entre ellos. Galindo-Tovar et al. (2011) realizaron un estudio de estructura poblacional con 60 accesiones de 7 municipios de Veracruz, analizados con marcadores microsatélites SSR; además, identificaron dos grupos con un Fst promedio de 0,2782 y concluyeron que en los dos grupos hay poca diferenciación genética entre sus individuos por los valores de Fst.
Chen et al. (2009), quienes estudiaron la estructura poblacional del centro de México con aguacate silvestre, encontraron dos grupos que se distinguieron por la elevación y latitud de origen. Es difícil conocer con exactitud a qué raza pertenece cada genotipo por falta de control de razas puras y, posiblemente, los genotipos estudiados sean mezclas de razas. Los autores mencionan que los cultivares modernos son mezclas complejas e inexactas de las tres razas, debido al largo periodo de polinización abierta e hibridación interracial.
Fuente: Elaboración propia
Figura 2 (a) Dendograma formado a partir de distancia de Dice de los 43 genotipos de aguacate (Persea americana) criollo obtenido mediante ocho primers (ISSR) y (b) representación gráfica de la estructura genética de las seis poblaciones donde los grupos genéticos (K) están indicados por los colores sobre el eje X
Conclusiones
De acuerdo con el dendograma generado, los genotipos se agruparon de acuerdo con su origen geográfico y diferencias de elevación, denotando que existe diversidad genética al interior de la misma especie. Todas las localidades fueron polimórficas, lo que demuestra que los aguacates criollos representan un acervo genético, que podría emplearse para realizar mejoramiento genético y generación de nuevas variedades con mejores características de interés comercial.
Agradecimientos
Los autores agradecen a la Unidad Académica de Agricultura de la Universidad Autónoma de Nayarit, por facilitar las instalaciones para realizar esta investigación.
REFERENCIAS
Álvarez, O. M. G., Pecina, Q. V., Acosta, D. E., & Almeyda, L. I. H. (2018). Evaluación molecular del aguacate criollo (Persea americana Mill) en Nuevo León, México. Revista Colombiana Biotecnología, 20(2), 38-46. http://doi.org/10.15446/rev.colomb.biote.v20n2.69551 [ Links ]
Alzate, A. M., Vallejo, C. F. A., Ceballos, L. H., Perez, J. C., & Fregene, M. (2010). Variabilidad genética de la yuca cultivada por pequeños agricultores de la región Caribe de Colombia. Acta Agróquimica, 59(4), 385-393. http://www.scielo.org.co/pdf/acag/v59n4/v59n4a01.pdf [ Links ]
Ashworth, V. E., & Clegg, M. T. (2003). Microsatellite markers in avocado (Persea americana Mill.): Genealogical relationships among cultivated avocado genotypes. Journal of Heredity, 94(5), 407-415. http://doi.org/10.1093/jhered/esg076 [ Links ]
Barrientos, P. A. F., Reyes, A. J. C., & Aguilar, M. J. J. (2010). Manual gráfico para la descripción varietal de aguacate. Servicio Nacional de Inspección y Certificación de Semillas - Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SNICS-SAGARPA) y Universidad Autónoma Chapingo (UACh). https://chapingo.mx/horticultura/pdf/producto/libros.pdf [ Links ]
Bharad, S. G., Kulwal, P. P., & Bagal, S. A. (2009). Estudio de la diversidad genética en A. squamosa mediante marcadores morfológicos, bioquímicos y RAPD. Acta Horticulturae, 839, 615-623. http://doi.org/10.17660/ActaHortic.2009.839.84 [ Links ]
Cai, Y., Sun, D., Wu, G., & Peng, J. (2010). ISSR-based genetic diversity of Jatropha germplasm in China. Biomass and Bioenergy, 34(12), 1739-1750. https://doi.org/10.1016/j.biombioe.2010.07.001 [ Links ]
Cañas-Gutiérrez, G. P., Galindo-López, L. F., Arango-Isaza, R., & Saldamando-Benjumea, C. I. (2015). Diversidad genética de cultivares de aguacate (Persea americana) en Antioquia, Colombia. Agronomía Mesoamericana, 26(1), 129-143. http://doi.org/10.15517/am.v26i1.16936 [ Links ]
Cañas-Gutierrez, G. P., Arango-Isaza, R. E., & Saldamando-Benjumea, C. I. (2019a). Microsatellites revealed genetic diversity and population structure in Colombian avocado (Persea americana Mill.) germplasm collection and its natural populations. Journal of Plant Breeding and Crop Science,11(4), 106-19. http://doi.org/10.5897/JPBCS2018.0792 [ Links ]
Cañas-Gutiérrez, G. P., Alcaraz, L., Hormaza, J. I., Arango-Isaza, R. E., & Saldamando-Benjumea, C. I. (2019b). Diversity of avocado (Perseaamericana Mill.) cultivars from Antioquia (Northeast Colombia) and comparison with a worldwide germplasm collection. Turkish Journal of Agriculture and Forestry, 43(4), 437-49. http://doi.org/10.3906/tar-1807-25 [ Links ]
Chao, T. (2003). Marcadores AFLP en aguacate (interview). University of California Riverside. http://www.scielo.org.mx/scielo.php?script=sci_nlinks&ref=6314108&pid=S2007-0934201300040000300008&lng=es [ Links ]
Chen, H., Morell, P. L., Asgworth, V. E. T. M., De la Cruz, M., & Clegg, M. T. (2009). Tracing the geographic origins of mayor avocado cultivars. Journal of Heredity, 100(1), 56-65. http://doi.org/10.1093/jhered/esn068 [ Links ]
Clarke, B. C., Moran, L. B., & Appels, R. (1989). DNA analysis in wheat breeding. Genome, 32(2), 334-339. http://doi.org/10.1139/g89-450 [ Links ]
Cuiris-Pérez, H., Guillén-Andrade, H., Pedraza–Santos, M. E., López-Medina, J., & Vidales-Fernández, I. (2009). Genetic variability within Mexican race avocado Persea americana Mill. germoplasm collection determined by ISSRs. Revista Chapingo Horticultura, 15(2), 169-175. https://www.redalyc.org/articulo.oa?id=60912457009 [ Links ]
Dávila, M., Castillo, M. A., & Laurentin, H. (2007). Uso de marcadores moleculares ISSR para inferir las relaciones genéticas y la variabilidad intraespecífico en Agave. Revista. Facultad de Agronomía, 33, 93-111. [ Links ]
Davis, J., Henderson, D., Kobayashi, M., Clegg, M. T., & Clegg, M. T. (1998). Genealogical relationships among cultivated avocado as revealed through RFLP analyses. The American Genetic Association, 89(4), 319-323. http://doi.org/10.1093/jhered/89.4.319 [ Links ]
Evanno, G., Regnaut, S., & Goudet, J. (2005). Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study. Molecular Ecology, 14, 2611-2620. http://doi.org/10.1111/j.1365-294X.2005.02553.x [ Links ]
Fiedler, J., Bufler, G., & Bangerth, F. (1998). Genetic relationships of avocado (Persea americana Mill.) using RAPDS markers. Euphytica, 101(2), 249-255. http://doi.org/10.1023/a:1018321928400 [ Links ]
Furnier, G. R., Cummings, M. P., & Clegg, M. T. (1990). Evolution of the avocados as related by DNA restriction fragment variation. Journal Heredity, 81(3), 183-188. http://doi.org/10.1093/oxfordjournals.jhered.a110963 [ Links ]
Galindo-Tovar, M. E., Arzate, A. M, Ogata, N., Murguia, J., Lee, H. E., & Landero, I. (2008). Origen y domesticación del aguacate (Persea americana Mill. Lauraceae) en Mesoamérica. XXI Reunión Científica-Tecnológica Forestal y Agropecuaria Veracruz y I del Trópico Mexicano (pp. 516-523). https://www.uv.mx/personal/megalindo/files/2010/07/PD2.pdf [ Links ]
Galindo-Tovar, M. E., Milagro-Pérez, P. A., Alejandre-Rosas, J. A., Leyva-Ovalle, O. R., Landero-Torres, I., Lee-Espinosa, H., & Murguía-González, J. (2011). Relaciones genéticas del aguacate (Persea americana Mill.) en siete municipios del centro de Veracruz, caracterizadas con microsatélites. Tropical and Subtropical Agroecosystems, 13(3), 339-346. https://www.redalyc.org/pdf/939/93920942010.pdf [ Links ]
Gutiérrez, D. A., Martínez, de la C. J., García, Z. E. A., Iracheta, D. L., Ocampo, M. J. D., & Cerda, H. I. M. (2015). Estudio de la diversidad genética del aguacate nativo en Nuevo León, México. Revista Fitotecnia Mexicana, 32(1), 9-18. http://www.scielo.org.mx/pdf/rfm/v32n1/v32n1a2.pdf [ Links ]
Mijares-Oviedo, P., & López-López, L. (1998). Variedades de aguacate y su producción en México. Departamento de Fitotecnia. En Centro de Investigaciones y Tecnológicas del Aguacate en el Estado de México (Cictamex), Memoria 1998 de la Fundación Salvador Sánchez Colín (pp. 22-32). Cictamex. http://www.avocadosource.com/Journals/CICTAMEX/CICTAMEX_1998/cictamex_1998_22-32.pdf [ Links ]
Miller, M. P. (1997). Tools for population genetic analysis (TFPGA) 1.3: a windows program for the analysis of allozyme and molecular population genetic data. [ Links ]
Nei, M., & Li, W. H. (1979). Mathematical model for studying genetic variation in terms of restriction endonucleases. Proceedings of National Academy Sciences, 76, 5269-5273. http://doi.org/10.1073/pnas.76.10.5269 [ Links ]
Ohsawa, T., & Ida, Y. (2007). Global patterns of genetic variation in plant species along vertical and horizontal gradients on mountains. Global Ecology and Biogeography, 17(2), 152-163. http://doi.org/10.1111/j.1466-8238.2007.00357.x [ Links ]
Ponce, M. L. A. (2013). Caracterización de la variabilidad genética de aguacate (Persea americana Mill) de los Valles interandinos de Ecuador [Undergraduate thesis, Universidad de las Fuerzas Armadas, Quito, Ecuador]. Repository Iniap. http://repositorio.iniap.gob.ec/handle/41000/1378 [ Links ]
Rendón-Anaya, M., Ibarra-Laclette, E., Méndez-Bravo, A., Lan, T., Zheng, C., Carretero-Paulet, L., Perez-Torres, C. A., Chacón-López, A., Hernández-Guzmán, G., Chang, T.-H., Farr, K. M., Barbazuk, W. B., Chamala, S., Mutwil, M., Shivhare, D., Alvarez-Ponce, D., Mitter, N., Hayward, A., Fletcher, S., Rozas, J., ... Herrera-Estrella, L. (2019). The avocado genome informs deep angiosperm phylogeny, highlights introgressive hybridization, and reveals pathogen-influenced gene space adaptation. Proceedings of the National Academy of Sciences of the United States America, 116(34), 17081-9. https://doi.org/10.1073/pnas.1822129116 [ Links ]
Reyes, J. C., Valadez, E., Simuta, L., Barrientos, A. F., & Gallegos, C. (2013). Distinción de especies del género Persea mediante RAPD e ISSR de ADN. Revista de Ciencias Agrícolas, 4(4), 517-529. http://doi.org/10.29312/remexca.v4i4.1185 [ Links ]
Rodríguez, A., Corazon, M., Cachique, D, Mejía, K., Del Castillo, D., Renno, J. F., & García, C. (2010). Diferenciación morfológica y por ISSR (Inter simple sequence repeats) de especies del género Plukenetia (Euphorbiaceae) de la Amazonía peruana: propuesta de una nueva especie. Revista Peruana de Biología, 13(3), 325-330. http://doi.org/10.15381/rpb.v17i3.7 [ Links ]
Rodríguez, M. N. N., Rhode, W., González, C., Ramírez, I. M., Fuentes, J. L., Román, M. A., Xiqués, X, Becker, D., & Velázquez, J. B. (2003). Caracterización morfológica, bioquímica y Molecular de cultivares de aguacatero (Persea americana Mill) en Cuba. Memoria de resúmenes del V Congreso Mundial del aguacate, del 19 al 24 de octubre. Málaga, España. pp. 47-49. [ Links ]
Salazar, C., Vargas, M. C. F., & Flores, J. S. (2010). Estructura y diversidad genética de Annona squamosa en huertos familiares Mayas de la península de Yucatán. Revista Mexicana de Biodiversidad, 81, 759-770. http://doi.org/10.22201/ib.20078706e.2010.003.647 [ Links ]
Sánchez, J. L. (1999). Recursos genéticos de aguacate (Persea americana Mill.) y especies afines en México. Revista Chapingo Serie Horticultura, 5, 7-18. [ Links ]
Secretaría de Agricultura, Ganadería Desarrollo Rural, Pesca y Alimentación (Sagarpa). (2018). Producción y exportación de aguacate.http://www.gob.mx [ Links ]
Talavera, A., Soorni, A., Bombarely, A., Matas, A. J., & Hormaza, J. I. (2019). Genome-Wide SNP discovery and genomic characterization in avocado (Persea americana Mill.). Scientific Reports, 9, 20137. https://doi.org/10.1038/s41598-019-56526-4 [ Links ]
Recibido: 31 de Octubre de 2019; Aprobado: 29 de Julio de 2020











 text in
text in