Introducción
En Colombia, el consumo de productos lácteos como leche, yogur, quesos y mantequilla se incrementó debido a migración masiva de ciudadanos venezolanos y al aumento de las importaciones de estos alimentos (Federación Colombiana de Ganaderos [Fedegan], 2020). Colombia tiene una producción de cerca del 1% de los derivados lácteos a nivel mundial (Ministerio de Agricultura y Desarrollo Rural [MADR], 2016). El derivado lácteo más reconocido en el departamento de Boyacá es el queso Paipa, único alimento madurado con denominación de origen de Colombia (Superintendencia de Industria y Comercio de Colombia, 2011). Este subproducto lácteo es elaborado con leche de vaca, sin cultivos iniciadores, y su procesamiento se basa en la experiencia de los queseros artesanales de la región. Estas condiciones le otorgan características físico-químicas y sensoriales propias (Castellanos et al., 2020).
Como subproducto de este proceso se obtiene el lactosuero, considerado un desecho y, por ello, vertido en efluentes y suelos, que genera problemas ambientales, dado que presenta alto poder contaminante por la cantidad elevada de materia orgánica que posee, en particular de lactosa, el sustrato usado como fuente de energía para el crecimiento microbiano (Khaire & Gogate, 2020; Louasté & Eloutassi, 2020). Por esta razón, se buscan alternativas para el uso de este subproducto lácteo y las investigaciones se enfocan en la obtención de probióticos del lactosuero, con el fin de mitigar su impacto ambiental, estableciendo avances tecnológicos en el tema de fermentaciones con microorganismos (bacterias y levaduras) con potencial probiótico, como una nueva alternativa para la industria láctea en todos los niveles (Guel et al., 2018; Huang et al., 2019; Rosa et al., 2020).
Los probióticos se definen como microorganismos que benefician el tracto digestivo del hospedero cuando se adiciona en la dieta, ya que estimula y equilibra la microbiota intestinal de este (Kareb & Aider, 2019). Se ha mejorado la producción animal debido a la aplicación de probióticos en la industria moderna de alimentos, ya que mejoran su salud, metabolismo y producción (Poloni et al., 2020; Tachibana et al., 2020). En la actualidad, existe una gran cantidad de microorganismos a los que se les atribuyen características de probióticos, por lo que muchas especies se estudian por sus efectos benéficos en la salud animal; sin embargo, no en todos los casos se demuestra que aporten un beneficio a la salud o a la productividad de las especies pecuarias (Mortada et al., 2020), pero se evidencian pocos estudios que revelen su impacto en la industria láctea en el trópico. El suero lácteo tiene alto contenido nutricional debido a que retiene cerca del 55% de los compuestos que conforman la leche y eso incluye lactosa (4,5- 5,0%), lípidos (0,4-1,0%), proteínas solubles (0,6-0,8%) y sales minerales (8-10% de extracto seco) (Louasté & Eloutassi, 2020). El lactosuero de queso Paipa tiene un pH entre 5,6-5,8, lactosa (5,0-5,2%), proteína (0,6-0,8%), humedad (93%), grasa (0,3-0,6%) y minerales (0,4%); no obstante, la calidad sanitaria no fue buena debido al proceso de fermentación artesanal que se lleva a cabo en la preparación de este producto (López et al., 2018). La comercialización de lactosuero deshidratado está creciendo considerablemente, sobre todo en los países en desarrollo, y es una oportunidad que Colombia debe aprovechar para aumentar la producción y el consumo de este tipo de alimentos en el país (Zouari et al., 2020). Como residuo industrial resulta paradójico que se siga desperdiciando, convirtiéndolo así en un sustrato disponible, de bajo costo y útil para la producción de probióticos que pueden ser incluidos en la elaboración de alimentos balanceados.
Por muchos años, las levaduras se usan como fuente proteica en los alimentos balanceados, debido principalmente a su calidad y su elevado contenido de vitaminas, enzimas y otros compuestos que benefician el tránsito digestivo en rumiantes y monogástricos (Shurson, 2018; Vohra et al., 2016). Por lo tanto, se adicionan en las dietas de estos animales, con el fin de mejorar su salud, desempeño y características zootécnicas (Mitchell & Heinrichs, 2020). Se aislaron diferentes tipos de levaduras de lactosuero incluyendo Candida intermedia, Kluyveromyces lactis, Kluyveromyces sp., Meyerozyma guilliermondii, y Torulaspora delbrueckii, pero se usaron para la producción de lipasas, etanol y compuestos volátiles (Coloretti et al., 2017; Knob et al., 2020; Pereira et al., 2017).
Es necesario investigar las características fisiológicas de las levaduras, con el fin de evaluar su potencial probiótico, debido a que las condiciones a las cuales puedan estar sometidas podrían inactivarlas y afectar considerablemente su funcionamiento. Dentro de las características de mayor interés, generalmente se consideran la capacidad de crecimiento a temperaturas extremas, la producción de determinadas enzimas, la resistencia a altas concentraciones de ácido y sales biliares sin sufrir grandes alteraciones en su crecimiento y fisiología (Jurado et al., 2009).
La adaptación de microorganismos a dichas condiciones específicas origina modificaciones genéticas en niveles diferentes, lo que le permite sobrevivir, principalmente bajo condiciones extremas de pH y concentraciones de sales biliares. Tales factores fisiológicos son selectivos, ya que influyen en la supervivencia y el crecimiento del organismo, así como en la estabilización de la microbiota intestinal (Markowiak & Śliżewska, 2018). Por las razones mencionadas, el objetivo de este estudio fue aislar, identificar y evaluar el potencial probiótico (in vitro) de levaduras de lactosuero de queso Paipa con uso potencial en alimentación animal.
Materiales y métodos
Aislamiento de levaduras del lactosuero de queso Paipa
Las levaduras se aislaron de lactosuero fresco (menos de 24 horas de extracción) de queso Paipa proveniente de las plantas Alisos, Cartagena y Pradera, ubicadas en el municipio de Paipa, en el departamento de Boyacá, Colombia. Se recolectó una muestra representativa de 2 L de lactosuero por cada empresa en envases plásticos estériles y en condiciones asépticas, e inmediatamente se trasladaron al laboratorio del Biocatálisis del Grupo de Investigación de Catálisis de la Universidad Pedagógica y Tecnológica de Colombia. Se adicionaron 10 mL de cada muestra por separado a 90 mL de medio YGC estéril (extracto de levadura-glucosa-cloranfenicol [0,1%] —Merck, Alemania—) y se incubaron por 48 horas a 30 °C y 200 rpm. Posteriormente, se realizaron diluciones seriadas con solución salina (0,9%) y las diluciones 10-5, 10-4 y 10-3 se sembraron en superficie de agar Sabouraud con cloranfenicol (0,005%) —Merck, Alemania—. Las cajas se incubaron a 30 °C por 24 h, y las colonias con diferencias morfológicas se purificaron en agar de papa y dextrosa (PDA) —Merck, Alemania—. Las colonias puras se caracterizaron microscópica y macroscópicamente; los aislados se conservaron en tubos inclinados con agar PDA a 4 °C para su posterior identificación molecular y evaluación in vitro de la capacidad probiótica.
Identificación molecular de las cepas aisladas
El aislamiento y la purificación del ADN se llevó a cabo con el kit comercial GeneJET™ (Thermo Fisher Scientific Inc., USA); posteriormente, se llevó a cabo la amplificación por reacción en cadena de la polimerasa (RCP o PCR, por las siglas del inglés polymerase chain reaction assay) con los iniciadores ITS4 e ITS5 de la región genética ITS del ADN ribosomal fúngico. Los fragmentos de PCR se purificaron y secuenciaron mediante método de Sanger et al. (1977) con los iniciadores ITS4 e ITS5. Para el análisis taxonómico de la secuencia se usó la herramienta BLAST del NCBI, y se comparó contra la colección de nucleótidos de este que comprende las bases de datos GenBank, EMBL, DDBJ, PDB y RefSeq, previa limpieza y ensamblaje de las secuencias para la obtención de secuencia problema. También se tuvo en cuenta la herramienta BLAST y se confrontó contra la base de datos de UNITE (https://unite.ut.ee) y la Classifier, alojada en el sitio Web de RDP, contra la base de datos Warcup Fungal ITS trainset 2. De esta forma, se obtuvo la clasificación taxonómica de la secuencia consenso.
Capacidad probiótica de las levaduras mediante ensayos in vitro
Las pruebas in vitro se llevaron a cabo por triplicado para cada cepa en estudio. Se monitoreó la producción de biomasa por medio de densidad óptica a 590 nm en un espectrofotómetro ELx808™ de BioTek. Para todas las pruebas se utilizó como inóculo 1 mL medio YGC con 12 h de crecimiento a 30 °C para obtener una concentración de 1×108 UFC/mL de cada una de las levaduras analizadas.
Prueba de resistencia a sales biliares
Se usó caldo de Extracto de levadura-Peptona-Glucosa (YPG) suplementado con Bile Oxgall (Difco, USA) en concentraciones de 0,05, 0,1, 0,15, 0,20, 0,25 y 0,30%, con posterior esterilización a 121 °C durante 15 min. Se adicionó 1 mL del inóculo previamente descrito a 9 mL de caldo YPG, suplementado con las concentraciones de sales biliares evaluadas, y fueron incubados a 37 °C por 24 h, para simular las condiciones del tracto digestivo de mamíferos.
Estabilidad de la levadura al pH del estómago
Se adicionó ácido clorhídrico concentrado (HCl) a caldo YPG para ajustar el pH a 1,5, 2,0, 2,5, 3,0, 3,5 y 4,0. Se siguió el mismo procedimiento nombrado en el apartado anterior con todas las cepas aisladas.
Resistencia a jugo gástrico
Para simular el pH del jugo gástrico, se preparó una solución compuesta por 0,2 g de cloruro de sodio y 0,32 g de la enzima pepsina que se disolvieron en 80 mL de agua destilada. Se usó ácido clorhídrico concentrado para ajustar el pH a 1,5 y se completó a 100 mL con agua destilada estéril. Se utilizó como control una solución a pH de 6,5, que se ajustó con hidróxido de sodio 5 N y se esterilizó por filtración con el uso de filtros de membrana de nylon de 0,22 µm (Sartorius, Alemania); luego, se sembró 1 mL del inóculo que contenía a la levadura en 9 mL del jugo gástrico artificial a pH 1,5 y 7,0 (control) y se incubaron a 37 °C por 24 h (Mendoza, 2013).
Análisis estadístico
Todos los experimentos se realizaron por triplicado. El análisis de las medias del comportamiento de las cepas de levadura en las pruebas in vitro se analizó mediante un análisis de varianza (ANOVA). Se hizo comparación de medias con la prueba de Tukey (p ≤ 0,05) y se utilizó el programa SPSS Statistics, versión 20.
Resultados y discusión
Aislamiento e identificación de levaduras del lactosuero de queso Paipa
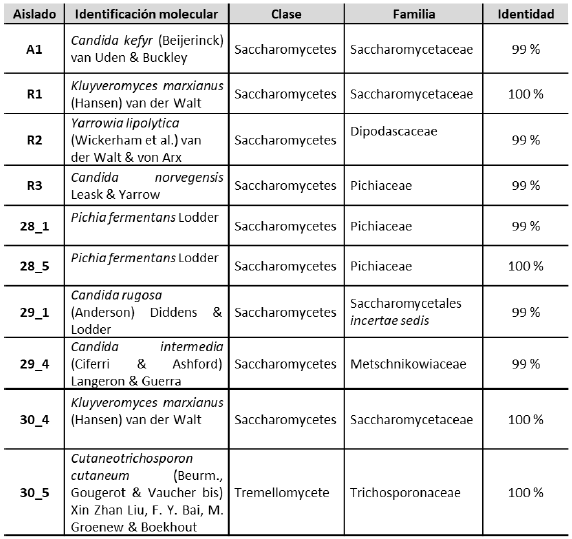
En la tabla 1 se pueden observar los resultados de la identificación molecular de las 10 cepas aisladas del lactosuero de queso Paipa. Entre los microorganismos procedentes del ambiente, las levaduras comúnmente están en la leche y sus subproductos, debido a que es un medio favorable para su crecimiento.
Tabla 1. Identificación molecular de las cepas de levadura aisladas del lactosuero de queso Paipa
Fuente: Elaboración propia
La mayoría de las levaduras identificadas pertenecen al género Candida, que ha sido estudiado ampliamente y aislado de varios sustratos con características similares al lactosuero, pero también se puede asociar a contaminación según la especie. Sen y Mansell (2020) indicaron que las cepas de levadura más empleadas como probióticos pertenecen a los géneros Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, y las especies C. pintolopesii, C. saitoana, K. fragilis, K. lactis, S. boulardii . S. cerevisiae son consideradas como microorganismos generalmente reconocidos como seguros (GRAS) y utilizados como aditivos alimentarios (Gut et al., 2019).
Castillo et al. (2018) aislaron y determinaron el potencial probiótico de la cepa de levadura identificada molecularmente como C. krusei (Castellani) Berhout (Saccharomycetes: Pichiaceae), que tuvo mejor desempeño de inhibición de patógenos in vitro en la prueba de resistencia al cloruro de sodio (2-10%) y presentó la mayor tolerancia frente a otras levaduras y bacterias con potencial probiótico aisladas de estiércol de terneros Brahman. Se ha reportado el uso de C. pintolepesii junto con otros microorganismos del género Lactobacillus como probiótico en dietas de pollos con buenos resultados en cuanto a crecimiento e inmunidad (Rehman et al., 2020). C. utilisse ha utilizado en la dieta de cerdos destetados como fuente de proteína, cuyos resultados indicaron un mejoramiento en la función digestiva y mantenimiento del crecimiento (Cruz et al., 2019). Son muy pocos los estudios que reportan el género Candida como probiótico; sin embargo, C. krusei, debido a su naturaleza patogénica oportunista, llama la atención científica sobre la seguridad de su explotación industrial (Yadav et al., 2012).
Cabe destacar que entre las levaduras aisladas también está el género Kluyveromyces, que ha recibido atención en los últimos años, debido a su potencial biotecnológico. Esta levadura crece en una variedad de sustratos y a altas temperaturas, siendo fuente de un variado número de enzimas que son producidas por este microorganismo en un proceso biotecnológico a nivel industrial (Karim et al., 2020). Desde 1994 fue declarado como de uso seguro (GRAS) por la FDA (Administración de Drogas y Alimentos, US). La especie K. marxianus KU140723-05 fue usada para la inhibición de Salmonella enteritidis en el tracto intestinal de polluelos con resultados efectivos (Bae et al., 2020). En general, este género tiene una actividad antimicrobiana alta y ha sido estudiada su encapsulación en quitosano para su uso potencial en alimentos balanceados (Díaz-Vergara et al., 2017; Vanden et al., 2020). Varios estudios indican el uso de este género en la dieta de diversos animales como fuente de proteína y probióticos (Keimer et al., 2018), por lo que las cepas aisladas del lactosuero del queso Paipa son microorganismos seguros que pueden ser usados en la alimentación animal.
En el presente estudio, también se aislaron dos cepas de Pichia fermentans, levadura no patógena, segura, de crecimiento amplio bajo condiciones microaerofílicas y que se ha usado ampliamente en las industrias de bebidas y alimentos (Pal & Kumar, 2018; Ravasio et al., 2018). Varios estudios indican el uso de P. kudriavzevii como probiótico en humanos (Greppi et al., 2017; Saadat et al., 2020; Sampaolesi et al., 2019), pero en alimentación animal es escasa la bibliografía. Canibe y Borg (2012) hallaron algunas especies de este género en un alimento líquido fermentado en alimentación de cerdos, al igual que Missotten et al. (2015). No se encontraron reportes del estudio probiótico de este microorganismo para alimentación animal; por lo tanto, esta sería la primera evaluación relacionada con esta levadura.
Capacidad probiótica de las levaduras mediante ensayos in vitro. Prueba de resistencia a sales biliares
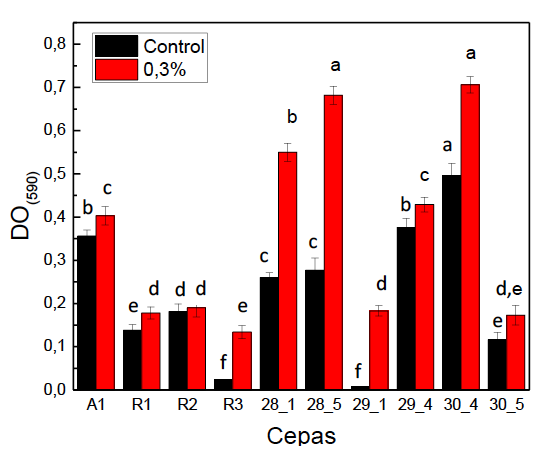
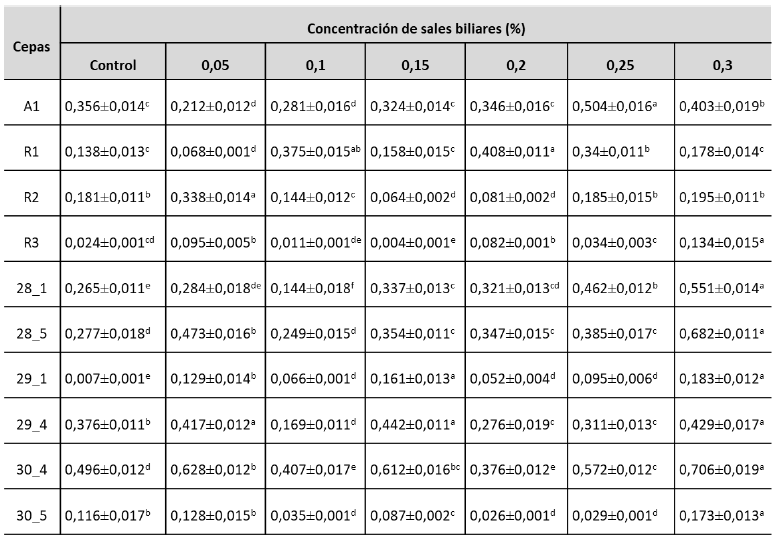
Los resultados de la resistencia a las sales biliares de las levaduras aisladas de lactosuero de queso Paipa se observan en la tabla 2.
Tabla 2. Biomasa de levadura aislada de lactosuero de queso Paipa en respuesta a diferentes concentraciones de sales biliares a las 24 h a 37 °C
Nota:Medias ± desviación estándar. Las medias con diferente superíndice en cada cepa difieren según la prueba de Tukey (p ≤ 0,05).
Fuente: Elaboración propia
Los resultados muestran que las levaduras son capaces de crecer en las diferentes concentraciones de sales biliares equivalentes a las del sistema digestivo. El análisis estadístico mostró diferencias entre las cepas (F: 20,8 ˃ Fcrit: 2,1; p = 1,3 E-14) y las concentraciones de sales biliares (F: 3,8 ˃ Fcrit: 2,3; p = 0,0029). La prueba de Tukey indicó que los mejores crecimientos fueron la cepa 30_4, a una concentración de 0,3%; la cepa 28_5, a 0,3%, y la cepa 30_4, a 0,05% de sales biliares. En el análisis de los datos se evidenció que la cepa R1 (K. marxianus) tuvo su mayor crecimiento a una concentración del 0,2%; las cepas A1 (C. kefir) y R2 (Y. lipolytica) tuvieron su segundo mayor crecimiento a la concentración del 0,3%, mientras que, para las otras siete cepas evaluadas, todas tuvieron su mayor crecimiento a la concentración del 0,3%. Estos resultados son más bajos que los reportados por Helmy et al. (2019), quienes aislaron algunas cepas de levaduras de queso de búfalo que pueden vivir a concentraciones altas de sales biliares (1%), principalmente Pichia kudriavzevii, Saccharomyces cerevisiae . Wickerhamomyces anomalus. Sin embargo, los datos de este estudio son similares a lo encontrado por Hu et al. (2018) en cepas como C. albicans, C. glabrata, C. parapsilosis, Cryptococcus arboriformis, Kazachstania bovina, Lodderomyces elongisporus, y Saccharomyces cerevisiae.
El estudio de Helmy et al. (2019) evidenció que diversas levaduras pueden crecer en presencia de bilis solo si se incuban a 25 °C; sin embargo, las cepas analizadas en el presente estudio crecieron en este ambiente a 37 °C, temperatura de inhibición para muchas de ellas. Los resultados obtenidos son positivos de acuerdo con lo reportado por Hu et al. (2018), quienes manifestaron que las levaduras tienen esta ventaja de crecer a 37 °C sin que se afecte su metabolismo. La resistencia a las sales se debe principalmente a los ácidos grasos insaturados que desempeñan un papel importante en la membrana celular (Begley et al., 2006), así como a la presencia de vesículas que guardan las sales para su ulterior degradación, mediante una acumulación intravesicular (St Pierre et al., 1994). La acumulación de polioles y glicerol constituye otro mecanismo para regular la presión osmótica del microorganismo con el medio ambiente, creando una resistencia a las altas concentraciones de sales biliares (Moser & Savage, 2001). El tracto gastrointestinal posee ciertas características que puede hacer sensibles a los cultivos de la cepa o producto probiótico, los cuales deben ser capaces de soportarlas sin afectar su capacidad metabólica y de colonización para ejercer su acción (Duncan et al., 2003; Jurado et al., 2009).
Se requiere tolerancia a las sales biliares para que las levaduras sobrevivan en el intestino delgado durante su paso por el tracto gastrointestinal. La concentración óptima de bilis del intestino humano y rumiantes oscila entre 0,3 y 0,6%; esta es importante para su buen funcionamiento, lo que permite mejorar su actividad y la digestibilidad de los nutrientes (Bertel et al., 2019; Helmy et al., 2019). Por consiguiente, evaluar la resistencia a este tipo de sales que se encuentran en el tracto gastrointestinal es un factor relevante para seleccionar levaduras con potenciales propiedades probióticas. Los resultados referidos en la literatura denotan variabilidad en la resistencia a concentraciones de sales biliares, dependiendo de la cepa y la concentración empleada. Lo anterior hace imprescindible la evaluación de esta característica en las condiciones específicas en que será empleado el microorganismo probiótico (Markowiak & Śliżewska, 2018).
El comportamiento de las diferentes cepas a la concentración más alta de sales biliares (0,3%) se aprecia en la figura 1. De acuerdo con los resultados, aunque las cepas 28_1, 29_4 y A1 no se pueden descartar por sus buenos valores, se destaca el comportamiento de las cepas 30_4 (K. marxianus) y 28_5 (P. fermentans), al verse incrementado su crecimiento en presencia de bilis con diferencia significativa con el resto de las cepas evaluadas (p ≤ 0,05), lo que nos ofrece la posibilidad de utilizar estas cepas en la obtención de preparados probióticos, ya que deben ser capaces de atravesar el tracto gastrointestinal sin tener alteraciones grandes en su viabilidad.
Estabilidad de la levadura al pH del estómago
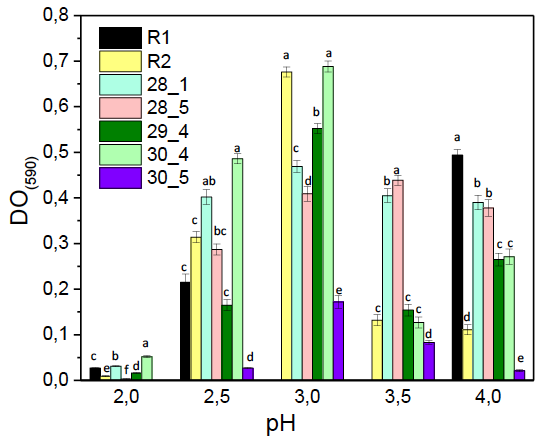
En la figura 2 se muestra la influencia del pH del medio de cultivo sobre el desarrollo celular valorado mediante la densidad óptica luego de 24 h de fermentación a 37 °C. El análisis estadístico no mostró diferencias significativas entre las cepas (F: 2,23 ˃ Fcrit: 2,5; p = 0,074) pero si entre los niveles de pH (F: 6,5 ˃ Fcrit: 2,8; p = 0,0010). La prueba de Tukey indicó que los mejores crecimientos fueron la cepa 30_4, a pH de 3,0; la cepa R_2, a pH 3,0, y la cepa 29_4, a pH 3,0. Como se puede observar, todos los cultivos fueron afectados en un medio de cultivo a pH 2. No obstante, mantuvieron un crecimiento aceptable cepas como la 30_4 y 28_1, las cuales se destacan por su respuesta a pH de 2,5 a 3,5. Se resalta el comportamiento del crecimiento obtenido para la cepa 28_5 y su similar respuesta a pH 2,5 a 4. La cepa A1 no tolero niveles de pH evaluados en el estudio, mientras que la mayoría de las cepas manifestaron su crecimiento más alto a pH 3, excepto la cepa R1.
Estos resultados de pH son similares a los hallados por Hu et al. (2018) en géneros como Candida, Lodderomyces y Saccharomyces. Ellos demostraron que estos géneros sobrevivían en condiciones acídicas (pH 2), lo que concuerda con las cepas de levadura evaluadas a pH 2, capaces de sobrevivir a pesar de permanecer un tiempo más prolongado (24 horas) expuestas a estas fuertes condiciones de acidez. Los datos en el pH son similares al reporte de Helmy et al. (2019) en Pichia kudriavzevii, Saccharomyces cerevisiae y Wickerhamomyces anomalus, quienes encontraron que el pH óptimo está entre 3,5 y 5,0, y que a pH de 2,5 se evidencia una reducción del 30% en el crecimiento de S. cerevisiae. Este tipo de levaduras son tolerantes a medios ácidos, lo que concuerda con los datos obtenidos en el presente trabajo. El pH del lactosuero de queso Paipa oscila entre 5,6 a 5,8 y se evidencia crecimiento de bacterias ácido-lácticas (López et al., 2018), por lo que sería usual la presencia de levaduras que resisten pH bajos. La tolerancia a ácido es importante para la sobrevivencia de los probióticos en el alimento. En general, se afirma que la sobrevivencia durante el tránsito intestinal es un criterio importante para la eficacia de cepas probióticas administradas oralmente. Por esta razón, se considera que la resistencia a bajos pH es uno de los parámetros de importancia primaria para la selección de cultivos de cepas probióticas para su uso como suplemento alimenticio (Markowiak & Śliżewska, 2018).
Fuente: Elaboración propia
Figura 2. Biomasa de levaduras aisladas de lactosuero de queso Paipa en respuesta a diferentes niveles de pH a las 24 h a 37 °C. Las medias con diferente superíndice en cada cepa difieren según la prueba de Tukey (p ≤ 0,05).
Dentro de los mecanismos por los cuales los probióticos pueden influenciar la microbiota del intestino, se asume que la resistencia a bajos pH referida a las condiciones del estómago les permite competir efectivamente en el ecosistema intestinal y es lo que probablemente refuerza el efecto probiótico. Se plantea que el pH óptimo o más favorable para el crecimiento de las levaduras se encuentra alrededor de 4, razón por la cual se considera que la resistencia a bajos pH es uno de los parámetros de importancia primaria para la selección de cultivos de cepas probióticas para su uso como suplemento alimenticio (Kareb & Aider, 2019; Markowiak & Śliżewska, 2018).
En general, se hace alusión en la literatura sobre la capacidad de las levaduras para tolerar valores de acidez desde pH 3 hasta 6,5, lo que constituye un factor importante en la fisiología del microorganismo, ya que facilita el paso de las células vivas y activas de estas levaduras por el tracto digestivo y le permite interactuar con las altas concentraciones de ácido que predominan en el tracto, sin que ocurran grandes alteraciones en la viabilidad celular y su metabolismo de manera irreversible. Por ello, contar con cepas de levadura que sean capaces de resistir valores de acidez por debajo de estos significa una ventaja para ser empleadas en formulaciones de preparados probióticos.
Los rangos de temperatura y pH óptimo para el crecimiento de las levaduras difieren mucho de los encontrados en un ambiente estresante. Las condiciones presentadas en un medio drástico como el que exige la microbiota intestinal requieren de células resistentes que se impongan a una elevada acidez y sean capaces de desarrollarse a altas temperaturas como las empleadas en los diferentes procesos fermentativos industriales. Estas características son de interés para demostrar la capacidad que pueden brindar algunas cepas de levadura para recuperarse y sobrevivir después de exponerse a condiciones medioambientales desfavorables a su fisiología, lo que permite emplear sus células viables en productos probióticos. En conclusión, las cepas 30_4 (P. marxianus) y R2 (Y. lipolytica) tienen la habilidad de crecer a pH bajos (mayor crecimiento a pH 3), por lo que tienen potencial para actuar como probióticos.
Resistencia al jugo gástrico
En la figura 3 se muestran los resultados de la resistencia de las levaduras al jugo gástrico y se puede notar que las cepas presentaron una buena viabilidad durante el tiempo del muestreo para los dos jugos gástricos artificiales. El análisis estadístico mostró diferencias significativas entre las cepas (F: 5,4 ˃ Fcrit: 2,3; p = 0,002) y entre las dos concentraciones de jugos gástricos (F: 4,3 ˃ Fcrit: 3,1; p = 0,004). Las cepas en su mayoría alcanzaron densidades ópticas similares en los dos medios, lo que evidencia que el cambio en el pH del jugo gástrico no altera su crecimiento.
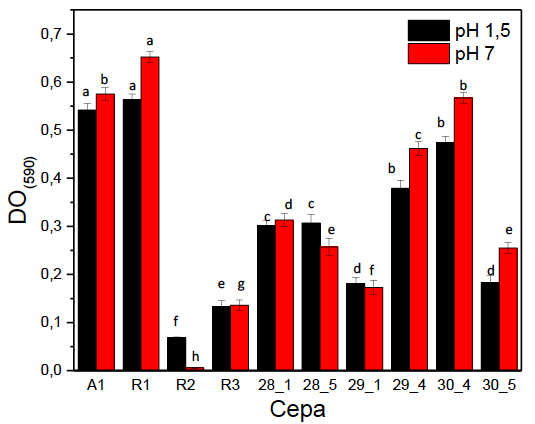
Fuente: Elaboración propia
Figura 3. Biomasa de levaduras aisladas de lactosuero de queso Paipa en respuesta al jugo gástrico a las 24 h a pH 7 y pH 1,5. Las medias con diferente superíndice en cada cepa difieren según la prueba de Tukey (p ≤ 0,05)
Las cepas A1, R1, 29_4 y 30_4 presentaron un mayor crecimiento frente a las demás cepas en el jugo gástrico, lo que demuestra su habilidad para poder sobrevivir y, en algunos casos, crecer en este medio. En las levaduras, la tolerancia al ácido puede ser ocasionada por proteínas especializadas que regulan las cantidades de cationes y el pH del citoplasma (Ohgaki et al., 2005). Diferentes autores emplearon ambientes simulados de digestión gastrointestinal para probar la resistencia de la cepa por evaluar frente a las variadas condiciones gástricas que se presentan (Helmy et al., 2019; Hu et al., 2018; Zullo & Ciafardini, 2019). Estos resultados indican la capacidad de las cepas de levadura evaluadas para resistir e, inclusive, desarrollarse bajo las condiciones acídicas del jugo gástrico, lo que le confiere potencialidades probióticas, ya que le permite transitar por el tracto gastrointestinal de manera viable para ejercer su acción. Las pruebas de tolerancia a pH, jugos gástricos y sales biliares imitaron los rangos similares del tracto gastrointestinal, usando un método in vitro que facilita la evaluación a nivel semicuantitativo de la tolerancia de las levaduras (Helmy et al., 2019).
De acuerdo con los resultados, las cepas analizadas pueden ser consideradas como posibles probióticos, ya que lograron crecer en varios pH similares a los del tracto gastrointestinal y toleraron altas concentraciones de sales biliares sin disminuir su crecimiento, lo que es requisito para llegar al intestino y actuar como probióticos en el hospedero (Hu et al., 2018). Cabe destacar el comportamiento en el presente estudio de las cepas 29_4, A1, 28_1, 28_5 y 30_4 como las levaduras con un comportamiento más regular durante las pruebas in vitro. Las levaduras 28_5 (P. fermentans) y 30_4 (K. marxianus) sobresalen dentro de este grupo como las cepas con mejores resultados.
Conclusiones
El lactosuero de queso Paipa es un subproducto de la industria láctea local, que fue usado como fuente de nutrientes para el crecimiento de levaduras con potencial probiótico. Se aislaron 10 cepas dentro de las que están C. kefyr, C. rugosa, Cut. cutaneum, K. marxianus, P. fermentans, y Y. lipolytica, muchas de ellas usadas como probióticos. Las levaduras identificadas como K. marxianus (30_4) y P. fermentans(28_5) aisladas de lactosuero de queso Paipa se destacaron durante las pruebas in vitro, y son consideradas como levaduras con potencial probiótico aisladas del lactosuero de queso Paipa.