Introducción
Perú es un país megadiverso; la región de los Andes y la selva amazónica peruana poseen una gran diversidad de frutales, muchos de los cuales aún no han sido estudiados a pesar de ser una fuente de primer nivel en la alimentación de dichas poblaciones (Blanco de Alvarado, 2016). La biodiversidad de estas especies presenta un desarrollo incipiente; algunas son poco conocidas en el ámbito nacional y corren el riesgo de perder su material genético, de ahí la importancia de investigarlas (Campos et al., 2018).
En el mundo, alrededor de 57 millones de personas fallecen cada año y las enfermedades crónico- degenerativas no transmisibles son las responsables de las dos terceras partes de estas muertes (Calañas- Continente & Bellido, 2006). Una alternativa para enfrentar estas enfermedades es la incorporación de alimentos con alto contenido de antioxidantes, como las frutas y las verduras, a la dieta diaria (Raskin et al., 2002; Socarrás Suárez & Bolet Astoviza, 2010).
Cárdenas et al. (2016) señalaron que, en los últimos años, la población mundial ha presentado una tendencia a consumir alimentos que proporcionen beneficios para la salud, toda vez que las investigaciones han demostrado que los compuestos bioactivos derivados de plantas pueden disminuir el riesgo de enfermedades cardiovasculares y neurodegenerativas. Sin embargo, los estudios se han centrado principalmente en la caracterización de diferentes frutas de clima templado y su contenido de componentes antioxidantes, y han obviado las frutas silvestres, que presentan mayores propiedades funcionales (Martínez-Navarrete et al., 2008). Las frutas poseen compuestos bioactivos como polifenoles, carotenoides, flavonoides, vitaminas, entre otros, cuyos grupos funcionales actúan en la degradación oxidativa de los radicales libres, responsables de la generación de enfermedades crónico-degenerativas (Gry et al., 2007; Patel et al., 2007; Raskin et al., 2002).
El aguaymanto Physalis peruviana L. (Solanaceae), también conocido como uchuva, es una fruta originaria de la cordillera de los Andes. Aunque fue conocida por los incas, su país de origen no está determinado; algunos estudios señalan que es nativa de Perú, mientras otras evidencias científicas indican que provino de Brasil y posteriormente se aclimató en los altiplanos de Chile y Perú (Fischer et al., 2011; Ramadan, 2011). Al aguaymanto se le han atribuido propiedades medicinales de tipo antiespasmódico, diurético, antiséptico, sedante y analgésico. Además, ayuda a fortalecer el nervio óptico, alivia los problemas de garganta y elimina parásitos del intestino (Ramadan & Mörsel, 2003; Rodríguez & Rodríguez, 2007).
Puente et al. (2011) señalaron que los componentes bioactivos presentes en P. peruviana hacen que sea considerada un alimento funcional, ya que los aceites extraídos presentan altos niveles de fitoesteroles. Asimismo, su elevada actividad antioxidante se debe a que posee altos niveles de polifenoles y de vitaminas A y C. Debido a la presencia de compuestos de fisalinas y withanólidos exclusivos del género Physalis (Solanaceae), se le atribuyen propiedades antiinflamatorias, antimicrobianas y anticancerígenas (Ahmad et al., 1999).
La pitaya amarilla Selenicereus megalanthus (K. Schum. ex Vaupel) Moran (Cactaceae), desconocida por muchos años, es hoy en día un cultivo promisorio (Ortiz-Hernández & Carrillo-Salazar, 2012). Los términos genéricos de pitaya o pitahayase emplean para denominar varias especies, entre las cuales las más importantes son la pitaya amarilla (S. megalanthus, también conocida en la literatura por su sinónimo Hylocereus megalanthus), que tiene una fruta de cáscara amarilla y pulpa blanca, y la pitaya roja (Hylocereus sp.), de cáscara roja y pulpa del mismo color o blanca (Kondo et al., 2013; Le Bellec & Vaillant, 2011; Le Bellec et al., 2006).
El origen de las pitayas no está del todo claro. Varios investigadores consideran que la pitaya amarilla S. megalanthus es nativa de Suramérica (Venezuela, Colombia, Bolivia, Perú y Ecuador), mientras que la pitaya roja H. undatus es originaria de México, Martinica y Colombia (Chemah et al., 2010; Ibrahim et al., 2018; Kondo et al., 2013; Kumar et al., 2018; Siddiq & Nasir, 2012). La pitaya amarilla tiene muchas posibilidades de desarrollo, ya que recibe gran aceptación por su sabor y su forma, y posee propiedades nutricionales y bioactivas benéficas para la salud (Ortiz-Hernández & Carrillo-Salazar, 2012).
El quito quito Solanum quitoense Lamarck (Solanaceae), también conocido como lulo, está clasificado en la sección Lasiocarpa del género Solanum, que comprende más de 14 especies, y el centro primario de su diversidad genética es la región Andina de Colombia, Ecuador y Perú (Lobo, 2006; Lobo et al., 2007). Al estudiar las características fisicoquímicas de la variedad Híbrido Puyo, Gancel et al. (2008) encontraron en la pulpa una alta cantidad de compuestos fenólicos y carotenoides, e identificaron como compuestos bioactivos principales el caroteno y la luteína. Esta fruta tiene un alto potencial como ingrediente de jugos, néctares, helados, dulces, mermeladas, jaleas, coberturas, sorbetes, salsas y otros dulces cocidos (Acosta et al., 2009). Además, posee compuestos nutricionales y altos contenidos de vitamina C y hierro, que le confieren propiedades diuréticas y tonificantes (Gómez-Merino et al., 2014).
Estos frutos que se consumen en la sierra y la selva de Perú han cobrado mucho interés debido a su potencialidad para el consumo y el desarrollo de alimentos funcionales, por lo que resulta importante estudiar su composición fisicoquímica y funcional. El presente estudio tuvo como objetivo determinar las características fisicoquímicas, los compuestos bioactivos y la capacidad antioxidante del aguaymanto, la pitaya amarilla y el quito quito provenientes de la sierra y la selva de Perú, a fin de identificar su potencial uso como fuente de nutrientes y compuestos bioactivos para alimentación humana y como ingrediente para el desarrollo de alimentos funcionales en la industria alimentaria y nutracéutica.
Materiales y métodos
Reactivos
En el estudio se usaron reactivos de grado analítico adquiridos en los laboratorios Merck (Darmstadt, Germany) y Sigma Chemicals Co. (St. Louis, EE. UU.). El agua utilizada fue bidestilada.
Fruta vegetal
Los frutos de la muestra se tomaron en la sierra y la selva central del Perú. El aguaymanto provino de la región Andina Central del departamento de Ayacucho; la pitaya amarilla, de la región Ucayali en la selva norte, y el quito quito, de la provincia de Oxapampa, departamento de Pasco.
Preparación de las muestras
Los frutos se cosecharon de forma manual en un estado óptimo, sin golpes ni magulladuras. Por cada uno de los tres tipos de fruto (tabla 1) se tomaron al azar cinco lotes de 10 kg aproximadamente, de manera que los resultados se expresaron como la media de cada lote. Se pesaron las frutas enteras sin pedúnculo y se realizaron mediciones de diámetro y altura. Posteriormente, luego de ser lavadas, molidas y liofilizadas, las frutas se conservaron a una temperatura de -20 °C para el análisis. Los frutos fueron identificados por especialistas en botánica de la Facultad de Farmacia y Bioquímica de la Universidad Nacional Mayor de San Marcos (tabla 1).
Análisis fisicoquímicos
Los métodos de la Association of Official Analytical Chemists (1995) se utilizaron para estimar contenido de agua, proteínas totales, extracto etéreo, cenizas, fibra cruda, pH, acidez total, sólidos solubles y azúcares totales. El contenido de agua se determinó mediante secado de la muestra en una estufa hasta peso contante; la proteína por el método de Kjeldahl (factor de 6,25); el contenido de fibra mediante el método gravimétrico después de una hidrólisis ácida de las muestras; el extracto etéreo graso en un extractor Soxhlet con éter de petróleo como solvente; el contenido de cenizas por incineración en una mufla a 550 °C ± 15 °C, y los carbohidratos se obtuvieron por diferencia, restando de 100 el contenido de agua, proteína, fibra, grasa y ceniza. Los resultados se expresaron en g por 100 g de peso fresco.
La acidez total se midió por titulación a través de un potenciómetro con una solución de 0,1 M de NaOH y se expresó en porcentaje de ácido cítrico; el pH se estimó con un potenciómetro digital (Trans Instruments); los sólidos solubles mediante un refractómetro (Alla France, 0-32) a 20 °C; el índice de madurez dividiendo los sólidos solubles entre la acidez total, y los azúcares totales mediante el método espectrofotométrico de Dubois mejorado.
El contenido de minerales se determinó en muestras de cenizas secas en una mufla a 550 °C y disueltas en HCl, mientras los extractos de minerales se midieron con un espectrofotómetro de absorción atómica (Perkin Elmer, modelo 3030-B). Los minerales Ca, Mg, Zn, Cu, Mn y Fe se analizaron por espectrometría de absorción atómica con llama (FAAS, por su sigla en inglés), y los minerales K y Na por espectrometría de emisión atómica con llama (FAES, por su sigla en inglés). Para cada mineral se preparó una curva estándar y un blanco respectivo.
La vitamina C (ácido ascórbico) se estimó por el método modificado de titulación con 2,6-diclorofenol- indofenol, que utiliza ácido oxálico en lugar de ácido metafosfórico durante la extracción —como recomiendan Benassi y Antunes (1988)—, y se expresó como mg ácido ascórbico/100 g de muestra.
Extracción de analitos
Se pesaron 0,5 g de muestra seca previamente homogeneizada, se agregaron 5 mL de solución de H2O/MeOH/ácido fórmico (24:25:1) mL, se procedió a sonicar la muestra durante una hora, y se dejó reposar por 24 horas con recipiente tapado en un lugar oscuro. Después, se volvió a sonicar por una hora para luego centrifugar a 3.500 rpm durante 15 min, con posterior filtrado (Romero et al., 2019).
Determinación de compuestos fenólicos y carotenoides totales
Los compuestos fenólicos se analizaron según el método de Folin-Ciocalteu, partiendo de una curva patrón de ácido gálico (Acros Organics, EE. UU.) para expresar los resultados como equivalentes de ácido gálico en mg/100 g de muestra. Para obtener los puntos de la curva, se realizaron mediciones de absorbancia a 765 nm con la ayuda de un espectrofotómetro (Genesys 6 Thermo Scientific, EE. UU.).
El total de carotenoides se obtuvo según el método espectrofotométrico a 470 nm, recomendado por Talcott y Howard (1999). Los resultados fueron expresados como mg β-caroteno/100 g de muestra.
Determinación de la capacidad antioxidante
Ensayo del radical DPPH (1,1-difenil-2-picrilhidrazilo)
Se utilizó el Trolox como estándar a partir de una curva patrón mediante el reactivo DPPH. Las concentraciones de Trolox fueron de 100-800 µM, con metanol al 80 % como disolvente, según Brand- Williams et al. (1995). Se realizó la medición de la absorbancia a 515 nm en un espectrofotómetro marca Hitachi U-2800 A. Los resultados se expresaron como µmoles Trolox/100 g de muestra.
Ensayo ABTS (ácido 2,2-azino-bis[3-etilbenzotiazolina-6-sulfónico])
Se preparó un curva patrón de 5-0,5 mM de Trolox en buffer PBS (fosfato salino). La generación del radical ABTS+ se dio por reacción de ABTS 7 mM con persulfato potásico 2,45 mM, incubados a temperatura de ambiente y en oscuridad por 16 horas. El radical ABTS+ formado fue diluido con buffer PBS hasta obtener una lectura de absorbancia a 730 nm de 0,70 ± 0,02 (aproximadamente 1/75). Los resultados fueron expresados en µmoles Trolox/100 g de muestra (Re et al., 1999).
Ensayo del poder reductor férrico (FRAP)
El oxidante en el ensayo FRAP se preparó mezclando 2,5 mL del reactivo TPTZ (2,4,6-tripiridil-s- triazina) 10 mM preparado en 40 mM de HCl, 25 mL de tampón acetato y 2,5 mL de 20 mM FeCl3.H2O. La mezcla se denominó “reactivo FRAP” (Benzie & Strain, 1996). Se pipetearon 200 µL de muestra en un tubo de ensayo y se mezclaron con 3 mL del reactivo FRAP en un vórtex. La mezcla se dejó reaccionar durante 30 minutos a 37 °C y su absorbancia fue leída a 594 nm. Los resultados fueron expresados en µmoles Trolox/100 g de muestra.
Análisis estadístico
Los datos fueron sometidos previamente a una prueba de bondad de ajuste (prueba de Anderson-Darling) y la homogeneidad de varianzas se verificó mediante la prueba de Bartlett. De los resultados de ambas pruebas se concluyó que los datos analizados no corresponden a una distribución normal, por lo que se utilizó la prueba no paramétrica para muestras independientes de Kruskal-Wallis a fin de evaluar si existían diferencias significativas de medias entre los tratamientos; diferencias menores a p< 0,05 fueron consideradas significativas. Para realizar los análisis estadísticos se empleó el software SPSS para Windows 14.0 (SPSS, Chicago, EE. UU.). Los resultados se presentaron como la media (n=5) de cinco mediciones por cada lote ± desviación estándar.
Resultados y discusión
En la tabla 2 se muestran los resultados del análisis proximal y bromatológico de los frutos de aguaymanto, pitaya amarilla y quito quito. Se puede observar que los frutos evaluados presentaron valores de humedad mayores a 79,2 %, lo cual concuerda con los hallazgos de Gonzales (2007) y Blanco de Alvarado (2016), quienes reportaron valores similares al estudiar las características de los frutos andinos de Perú. Los valores de contenido de proteína, extracto etéreo, ceniza, fibra, carbohidratos y valor energético se encontraron dentro del rango reportado por Collazos et al. (1996).
El aguaymanto y la pitaya amarilla reportaron los mayores contenidos de azúcares totales (tabla 3). Al respecto, Viñas et al. (2013) señalaron que la concentración de azúcares solubles aumenta durante la maduración y alcanza su máximo nivel en el momento de óptima madurez organoléptica. El dulzor final característico del fruto dependerá del tipo y la concentración de los azúcares presentes, que, aunque influenciados en parte por las condiciones externas, obedecen principalmente al genotipo.
Tabla 2. Evaluación proximal y bromatológica de los frutos estudiados
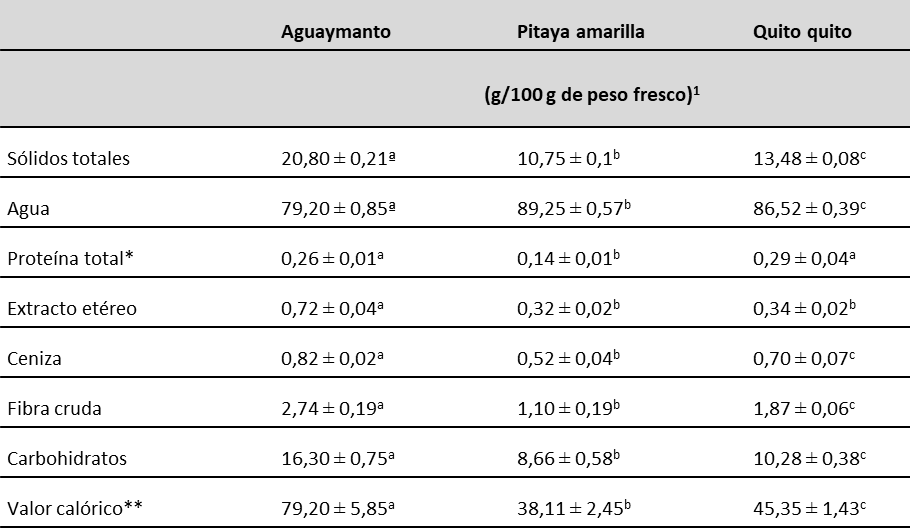
Nota:1Valor medio ± desviación estándar del peso fresco. n=5. Medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05. *Factor de proteína = 6,25. **Valor expresado en kilocalorías
Fuente: Elaboración propia
El aguaymanto y el quito quito reportaron altos contenidos de acidez, mientras la pitaya amarilla registró el contenido de acidez más bajo de las frutas analizadas. Viñas et al. (2013) afirman que la acidez es una característica organoléptica de los frutos para tener en cuenta al evaluar calidad, ya que, junto a los azúcares, es la principal responsable del sabor.
Tabla 3. Características fisicoquímicas de los frutos de aguaymanto, pitaya amarilla y quito quito analizados

Nota:1Valor medio ± desviación estándar del peso fresco; n=5; medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05
Fuente: Elaboración propia
En relación con los sólidos solubles (°Brix), el aguaymanto y la pitaya amarilla reportaron los mayores contenidos. Cabe señalar que en el valor de los sólidos solubles están incluidas todas las moléculas solubles en el jugo de la fruta, pero, debido a que un alto porcentaje de estas son azúcares, esta medida es un buen indicativo del conjunto de azúcares solubles y del dulzor del fruto (Viñas et al., 2013).
En cuanto a los macroelementos, los mayores contenidos de fósforo, calcio y sodio (46,80, 38,40 y 4,50 mg %, respectivamente) correspondieron al aguaymanto, mientras que la pitaya amarilla presentó los mayores valores de magnesio y azufre (28 y 28,20 mg %, respectivamente). Por su parte, el quito quito alcanzó el mayor contenido de potasio (354,90 mg %) (tabla 4).
Tabla 4. Contenido de minerales (macroelementos) en mg/100 g de los frutos evaluados
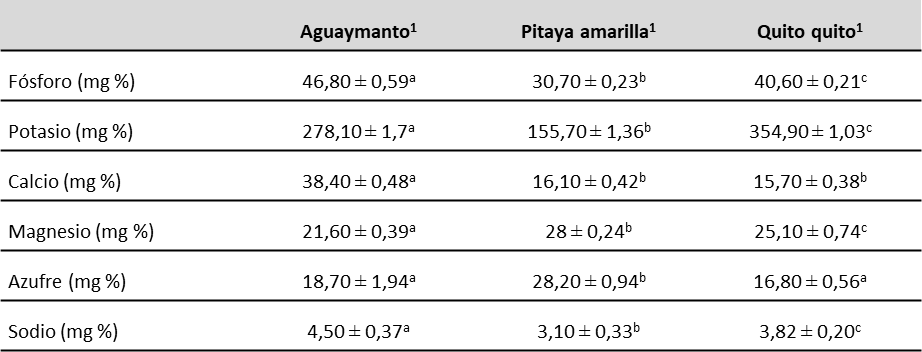
Nota:1Valor medio ± desviación estándar del peso fresco; n=5; medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05
Fuente: Elaboración propia
En cuanto a los microelementos, destaca el contenido de hierro que presentaron la pitaya amarilla y el quito quito (25,90 y 34,60 mg/kg, respectivamente) (tabla 5). Cabe precisar que dichos valores se encuentran dentro de los rangos reportados por Reyes et al. (2017).
Teniendo en cuenta que, según el Instituto de Medicina de Estados Unidos, los requerimientos diarios de hierro en una persona adulta normal son de aproximadamente 8 mg/día (Institute of Medicine, 2001), el consumo de 100 g de aguaymanto o quito quito cubrirían aproximadamente el 30 % o el 40 % de este valor, respectivamente. El hierro presente en estos frutos podría asimilarse en mayor proporción debido a los buenos niveles de vitamina C que presentan, dado que la disponibilidad del hierro no hemínico de las frutas y hortalizas se ve mejorada con la vitamina C. En presencia de 25-75 mg de vitamina C, la absorción del hierro no hemínico de una única comida se duplica o triplica, debido a la reducción del hierro férrico a ferroso, que tiene una menor tendencia a formar complejos insolubles con los fitatos (Cardero et al., 2009).
De igual forma, en los resultados resalta el contenido de cobre de la pitaya amarilla y del quito quito (1,60 y 1,20 mg/kg, respectivamente). Considerando que el cobre forma parte de los componentes de las enzimas en el metabolismo del hierro y su requerimiento es de 0,7-0,9 mg por día (Baker et al., 1999), estos frutos cubrirían alrededor del 20 % de las necesidades diarias de este mineral.
Tabla 5. Contenido de minerales (microelementos) en mg/kg de los frutos evaluados
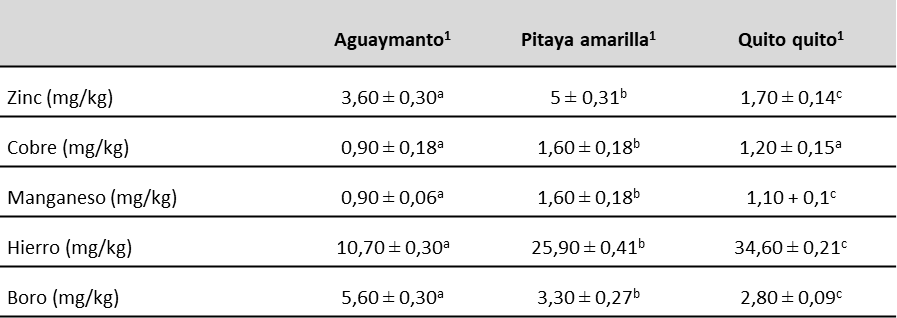
Nota:1Valor medio ± desviación estándar del peso fresco; n=5; medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05
Fuente: Elaboración propia
Con relación al contenido de vitamina C, el aguaymanto (43,1 mg/100 g) presentó el mayor valor, seguido del quito quito (30,1 mg/100 g) y de la pitaya amarilla (10 mg/100 g) (tabla 6). Es preciso indicar que los valores de vitamina C en el aguaymanto y el quito quito son mayores a los reportados por Nagy (1980) en frutos cítricos, que se encuentran en el rango de 35-70 mg/100 g dependiendo de la variedad.
De acuerdo con la clasificación propuesta por Ramful et al. (2011) para el contenido de vitamina C en frutos cítricos, el aguaymanto y el quito quito se encontrarían dentro del grupo intermedio (30- 50 mg/100 g), mientras que la pitaya amarilla estaría en el grupo de bajos niveles de vitamina C (< 30 mg/100 g). Al estudiar la composición de frutos andinos en Ecuador, Pérez-Balladares et al. (2019) encontraron frutos con contenidos de vitamina C altos e intermedios, como el tomate de árbol, la naranjilla, la granadilla, la guayaba, entre otros.
Según el Instituto de Medicina de Estados Unidos, los requerimientos diarios de vitamina C en una persona adulta normal oscilan entre 45-90 mg (Institute of Medicine, 2000); de acuerdo con esto, 100 g de aguaymanto, pitaya amarilla y quito quito cubrirían el 20-90 % de este valor.
Tabla 6. Contenido de compuestos bioactivos

Nota:1Valor medio ± desviación estándar del peso fresco; n=5; medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05
Fuente: Elaboración propia
En cuanto al contenido de polifenoles totales, los mayores valores correspondieron al quito quito (67,24 mg Eq. ácido gálico/100 g) y al aguaymanto (62,93 mg Eq. ácido gálico/100 g), seguidos de la pitaya amarilla (38,02 mg Eq. ácido gálico/100 g). El valor de polifenoles totales del aguaymanto identificado en la presente investigación fue mayor al reportado por Puente et al. (2011): de 39,15 a 40,45 mg de ácido gálico/100 g de peso fresco. No obstante, dicho valor resultó menor al registrado por Muñoz et al. (2007): 100,89 mg de ácido gálico/100 g de peso fresco.
En el caso de la pitaya amarilla, el contenido de polifenoles totales obtenido fue superior al reportado por De Lima et al. (2013) en pitayas procedentes de Brasil, correspondiente a 12,31 mg de ácido gálico/100 g de peso fresco, pero menor al observado por Mejía et al. (2020) en pitayas de Colombia, que alcanzó los 59,1 mg de ácido gálico/100 g de peso fresco. Esta diferencia puede deberse a la procedencia de los frutos y su estado de madurez al momento de los análisis. Por su parte, los valores de polifenoles totales hallados en el quito quito son comparables a los reportados por Acosta et al. (2009) (48,3 mg ácido gálico/100 g de peso fresco) y Contreras-Calderón et al. (2011) (58,3 mg ácido gálico/100 g de peso fresco).
Respecto al contenido de carotenoides totales, el aguaymanto (0,80 mg β-caroteno/100 g) y el quito quito (0,74 mg β-caroteno/100 g) obtuvieron los mayores valores (tabla 5). Cabe señalar que los principales componentes activos de la vitamina A en las frutas son el α-caroteno, el β-caroteno y la β-criptoxantina (Fischer et al., 2000, citado por Puente et al., 2011).
Los carotenoides más comunes son los β-carotenos porque ninguno de los otros carotenoides está presente en la provitamina A, que tiene la mitad de la actividad del β-caroteno y es menos extensa en la naturaleza. En el caso del aguaymanto y el quito quito, los carotenoides son los principales responsables del color naranja de la cáscara. El β-caroteno es muy importante en la prevención de ciertas enfermedades humanas como el cáncer, razón por la cual están relacionados con la actividad antioxidante (Puente et al., 2011).
Ramadan (2011) informó que existe una correlación positiva entre la ingestión de verduras y frutas que contienen carotenoides y la prevención de varias enfermedades crónico-degenerativas. Este autor señala que el principal carotenoide en el aguaymanto es el trans β-caroteno, seguido del 9-cis-β-caroteno y de la trans-α-criptoxantina.
En el quito quito se encontró un valor importante de carotenoides (0,74 mg β-caroteno/100 g de peso fresco), que resulta similar al reportado por Acosta et al. (2009) en Costa Rica, de 0,72 mg β- caroteno/100 g de peso fresco. Estos autores también relacionaron el β-caroteno y la luteína como los principales carotenoides en el fruto, que al consumirse se convierte en retinol como precursor de la provitamina A.
Cabe precisar que el contenido de compuestos bioactivos de los frutos estudiados difiere significativamente de los hallados por Pérez-Balladares et al. (2019) y Guevara et al. (2019), en frutos procedentes de Ecuador. Sin embargo, dicho valor es bastante cercano al reportado por Vasco et al. (2008), quienes también estudiaron el contenido de compuestos bioactivos en frutos de Ecuador. La diferencia en los resultados se debe probablemente a los métodos utilizados, la procedencia y la variedad de los frutos.
Los resultados de la capacidad antioxidante mostraron variaciones significativas según cada método de evaluación (tabla 7), lo que se puede atribuir al tipo de compuesto antioxidante presente en el fruto o a los efectos sinergistas, aditivos o antagonistas que se pueden presentar dentro de la matriz que los contiene (Thaipong et al., 2006).
Tabla 7. Actividad antioxidante (µmoles Trolox/100 g) mediante diferentes métodos

Nota:1Valor medio ± desviación estándar del peso fresco; n=5; medias de una misma fila con diferentes letras son significativamente diferentes a p < 0,05
Fuente: Elaboración propia
Pérez-Jiménez y Saura-Calixto (2007) informaron que es necesario combinar al menos dos métodos de capacidad antioxidante, uno basado en la capacidad de reducción de metales y otro en la capacidad de captación de radicales libres. Estas comparaciones solo son válidas para valores obtenidos en el mismo disolvente y con el mismo método de determinación. Por ello, es difícil comparar la capacidad antioxidante obtenida en este estudio con la observada en otras investigaciones, puesto que los métodos de extracción y los disolventes son diferentes. En la presente investigación, se determinó la capacidad antioxidante mediante tres métodos y los mayores valores se obtuvieron con el ABTS. Sin embargo, los resultados no son comparables porque se usaron diferentes metodologías.
No obstante, Puente et al. (2011) hallaron valores de DPPH en el aguaymanto similares a los del presente análisis. Asimismo, Corrales-Bernal et al. (2015) reportaron valores de antioxidantes con los métodos DPPH y FRAP muy cercanos a los encontrados en la presente investigación, a pesar de que los métodos de extracción fueron diferentes.
Los valores de antioxidantes hallados en el quito quito por los métodos DPPH (280 µmol Trolox/100 g) y FRAP (197 µmol Trolox/100 g) fueron superiores a los reportados por Moreno et al. (2014), de 65 µmol Trolox/100 g para ambos métodos. Esto se debe, como ya se indicó, al tipo de extracción utilizado, la procedencia del fruto y su estado de madurez.
Numerosos estudios señalan que existe una correlación negativa entre la ingesta de compuestos bioactivos de las frutas y el riesgo de presentar enfermedades cardiovasculares y cerebrovasculares, cáncer, enfermedad de Alzheimer, cataratas y algunas otras disfunciones asociadas a la edad (Martínez-Navarrete et al., 2008).
Los resultados obtenidos en el estudio permiten afirmar que el consumo en fresco o procesado del aguaymanto, la pitaya amarilla y el quito quito constituye una fuente potencial de nutrientes. Estas frutas presentan cantidades importantes de nutrientes como la vitamina C; minerales como el cobre y el hierro en elevada proporción, y compuestos antioxidantes como polifenoles totales que podrían contribuir a la salud de las personas que los consumen. De igual forma, podrían utilizarse en la industria alimentaria para el desarrollo de alimentos procesados con propiedades funcionales y nutracéuticas.
Conclusiones
El aguaymanto, la pitaya amarilla y el quito quito presentaron contenido de humedad de 79,20-89,25 g %, proteínas totales de 0,14-0,29 g %, extracto etéreo de 0,32-0,72 g %, cenizas de 0,52-0,82 g %, fibra de 1,10-2,74 g %, carbohidratos de 8,66-16,30 g %, azúcares totales de 9,7-26,85 g % y acidez total de 0,11- 2,51 g %. El valor calórico varió de 38,11 a 79,2 kcal, el pH de 3,23 a 4,8 y los sólidos solubles de 10 a 17 °Brix.
Con relación a los macroelementos, los mayores contenidos de fósforo, calcio y sodio (46,80, 38,40 y 4,50 mg %, respectivamente) correspondieron al aguaymanto, mientras que la pitaya amarilla presentó los mayores valores de magnesio y azufre (28 y 28,20 mg %, respectivamente) y el quito quito alcanzó el mayor contenido de potasio (354,90 mg %). En cuanto a los microelementos, destaca el contenido de hierro que presentaron la pitaya amarilla (25,90 mg/kg) y el quito quito (34,60 mg/kg).
Los frutos de aguaymanto y quito quito presentaron las mayores cantidades de compuestos bioactivos, tales como vitamina C (43,1 y 30,1 mg/100 g, respectivamente), polifenoles totales (62,93 y 67,24 mg ácido gálico/100 g, respectivamente) y carotenoides totales (0,8 y 0,74 mg β-caroteno/100 g, respectivamente).
La capacidad antioxidante se determinó mediante los métodos de secuestro del radical libre (ABTS y DPPH) y ensayo del poder férrico (FRAP). En cada caso, el aguaymanto y el quito quito obtuvieron los mayores valores, que oscilaron entre 197 y 987 µTrolox/100 g, respecto a la pitaya amarilla, cuyo valor varió de 110 a 638 µTrolox/100 g.
Los resultados obtenidos permiten afirmar que el aguaymanto, la pitaya amarilla y el quito quito representan una fuente importante de compuestos nutricionales y bioactivos, y podrían ser aprovechados para la alimentación humana y el desarrollo de alimentos funcionales y nutracéuticos.