Introducción
Dentro de los procesos asociados a los cultivos agrícolas, el control de malezas es de gran importancia. El buen manejo de las malezas está directamente relacionado con el rendimiento (Zimdahl, 2018), debido a que las malezas reducen la productividad del cultivo al competir por agua, luz, espacio y nutrientes (Chauhan & Mahajan, 2014). Las malezas pueden ser controladas en forma mecánica, cultural, biológica o química. Este último es el control más utilizado en la agricultura actual, debido a que se soporta en el uso de herbicidas (Zimdahl, 2018). No obstante, si estos productos químicos no son aplicados correctamente, además de causar daños a las plantas cultivadas, generan efectos nocivos al medio ambiente e, incluso, afectan la salud de las personas que los aplican (Del Puerto et al., 2014).
El diente de león Taraxacum officinale F. H. Wigg. (Asteraceae) es una maleza agresiva, que forma densos grupos de plantas que interfieren en el crecimiento de los cultivos, compitiendo por luz en fases tempranas de plantaciones como maíz Zea mays L. (Poaceae) y frijol Phaseolus vulgaris L. (Fabaceae), muy difícil de erradicar, debido a que su raíz profunda, penetrante y carnosa rebrota luego de ser cortada, lo que limita su control (Aguirre et al., 2019). Además, como lo documentan Hernández y Guzmán (2014), T. officinale se considera como planta hospedera de la mosca blanca que transmite el virus Potato yellow vein virus (PYVV).
Para contrarrestar la acción de las malezas y el uso de herbicidas de síntesis química, la alelopatía surge como una alternativa en los cultivos y ha sido reconocida hoy en día como un enfoque natural para el control de malezas (Arafat & Ali, 2015), debido a que las plantas pueden afectar otras especies al liberar compuestos químicos, reduciendo el crecimiento y el desarrollo (Namkeleja et al., 2013). Estos compuestos se denominan aleloquímicos, que se pueden definir como metabolitos secundarios bioactivos que median las interacciones químicas entre la planta y otros organismos y, por lo tanto, juegan un papel importante en su sucesión y establecimiento (Gindri et al., 2020). Los aleloquímicos son liberados al medio ambiente como exudados, volátiles o residuos de la descomposición de tejidos vegetales; se incluyen compuestos fenólicos, terpenoides y alcaloides, que incluso pueden formularse como herbicidas naturales con la ventaja de que son biodegradables y no persisten en el suelo como contaminantes (Jabran, 2017). De esta manera, la alelopatía permite el manejo sostenible de las malezas mientras reduce el impacto de la agricultura en el medio ambiente (Arafat & Ali, 2015), con el objetivo de mantener un balance ecológico entre el cultivo, la flora y la fauna local, reduciendo el uso de herbicidas de síntesis química (Nawaz et al., 2014), que ponen en riesgo los ecosistemas naturales.
Dentro de las plantas con gran potencial alelopático se han registrado resultados favorables en algunas especies de la familia Myrtaceae. El aceite esencial de Eucalyptus camaldulensis Dehnh. (Myrtaceae) es eficaz e inhibe totalmente la germinación y crecimiento de plantas de Amaranthus hybridus L. (Amaranthaceae) y Portulaca oleracea L. (Portulacaceae) (Verdeguer et al., 2009). También se reporta que el extracto acuoso de Eucalyptus globulus Labill. (Myrtaceae) presentó efectos fitotóxicos en la germinación y crecimiento radicular de Amaranthus retroflexus L. (Amaranthaceae) y Echinochloa crus-galli (L.) P. Beauv. (Poaceae) (Puig et al., 2018).
La champa Campomanesia lineatifolia Ruiz & Pavón (Myrtaceae) es una especie frutal con alto potencial de comercialización, cuyos frutos, además de ser muy apetecidos por el consumidor, contienen de seis a ocho semillas de más o menos 1 cm de diámetro (Álvarez et al., 2009; Balaguera et al., 2012). Estas semillas poseen un alto y diverso contenido de metabolitos secundarios, que presentan actividad antimicrobial (Bonilla et al., 2005), pero también se ha demostrado que tienen actividad bioherbicida en semillas y plantas de Sonchus oleraceus (Martínez, 2019); debido a esto, el objetivo de este estudio fue evaluar el efecto alelopático del extracto etanólico de las semillas de champa C. lineatifolia sobre la germinación y fisiología del diente de león T. officinale.
Materiales y métodos
El estudio se llevó a cabo en el laboratorio de Fisiología Vegetal y el invernadero de vidrio de la Facultad de Ciencias Agrarias de la Universidad Pedagógica y Tecnológica de Colombia, en condiciones de temperatura promedio de 16 °C y humedad relativa del 75 % dentro de las instalaciones, parámetros que fueron medidos con un data logger RT 20 extech.
Se colectaron semillas de T. officinale en lotes que se encontraban en reposo o lotes baldíos, ubicados en los municipios de Tunja, Soracá y Tibaná, en el departamento de Boyacá, Colombia. Las semillas se empacaron en bolsas plásticas y se llevaron al laboratorio. Las semillas de C. lineatifolia fueron obtenidas manualmente de frutos maduros cosechados en el municipio de Miraflores (Boyacá). Una vez obtenidas las semillas, se dejaron secar al ambiente por 48 h; luego, se seleccionó una muestra de aproximadamente 300 g a la que se le agregó 1 L de etanol al 96 %; esta mezcla se agitó y se dejó en reposo en un recipiente de vidrio y en oscuridad por 48 h. El solvente fue agitado ocasionalmente durante este tiempo. Posteriormente, el contenido del frasco fue filtrado (papel filtro Whatman 1) y el líquido fue llevado a un proceso de destilación mediante rotaevaporador (Heidolph Laborota 4000 efficient) para la obtención del extracto, a partir del cual se prepararon diferentes concentraciones para ser utilizadas como tratamientos.
El estudio se realizó en dos fases: la primera correspondió a la aplicación de los extractos en el periodo de germinación; la segunda, en etapa vegetativa. Para las dos fases se utilizó un diseño completamente al azar con cuatro tratamientos correspondientes a cuatro concentraciones de extracto de semillas de champa (0, 3, 6 y 9 %, p/v). Cada tratamiento tuvo cuatro repeticiones, dando como resultado 16 unidades experimentales. En la fase uno, cada una estuvo compuesta por una caja Petri con 100 semillas; en la fase 2, la unidad experimental fue una matera de 500 mL con cinco plantas sembradas en turba rubia canadiense.
En la primera fase del estudio, las semillas fueron puestas en papel absorbente dentro de las cajas Petri, hidratadas periódicamente con los extractos alelopáticos, excepto el testigo que solo se hidrató con agua destilada. Las lecturas se realizaron cada tercer día desde el momento de la germinación de la primera semilla y hasta germinación constante, lo que se logró 11 días después de la siembra. Se consideró como criterio de germinación que la radícula midiera mínimo 2 mm, y se tuvo en cuenta el número de semillas en cada lectura y el tiempo de germinación para calcular el porcentaje de germinación (cociente entre las semillas germinadas y las semillas sembradas, multiplicado por 100), así como la velocidad media de germinación (VMG) y el tiempo medio de germinación (TMG) con las siguientes fórmulas (Ranal & Santana, 2006): VMG= ∑(Ni/Ti), donde Ni = Número de semillas emergidas en el i-ésimo día. Ti= Tiempo en días, para la emergencia en el i-ésimo día, y TMG = N*(A1+A2+Ax)/(A1*T1+A2*T2+Ax*Tx), donde N = Número de semillas emergidas. A1, A2, Ax fue el Número de semillas emergidas en el día 1, en el día 2, y en el día x. T1, T2,..., Tx fue el Número de días entre la siembra y el día 1 de emergencia, entre el día 2 y entre el día x.
En la segunda fase, las semillas fueron sembradas en materas con turba hidratada a capacidad de campo y con riego cada tercer día. Después de la germinación, se adicionó fertilizante líquido de grado 12-4-8 (N-P-K) y se preparó tomando 10 mL y disolviéndolos en 1 L de agua; de esta solución se aplicó 40 mL por matera una vez por semana. En el momento en que las plántulas alcanzaron en promedio 10 cm de altura, se hicieron aplicaciones foliares de manera uniforme a todo el follaje de los extractos con un atomizador de 10 mL. En cada tratamiento fue necesario agregar coadyuvante para lograr una cobertura uniforme en las hojas. A los cinco días de la aplicación se hicieron las mediciones del daño y de la fluorescencia de la clorofila “a”.
La severidad del daño se determinó de manera visual con la utilización de la escala propuesta por la Asociación Latinoamericana de Malezas (ALAM, 1974, citado por Anzalone & Silva, 2010), y la incidencia de daño (%) se calculó como la relación entre el número de plantas con daño por el herbicida/número total de plantas × 100.
Para la fluorescencia de la clorofila “a”, en cada planta seleccionada se escogió una hoja representativa del tercio medio, que se cubrió con papel aluminio para permitirle adaptarse a la oscuridad por 20 minutos. Para la medición, se empleó un fluorómetro modulado WALZ® (modelo Junior PAM), que permitió determinar la eficiencia máxima potencial del PSII (Fv/Fm), la tasa de transporte de electrones fotosintéticos (ETR), el quenching fotoquímico (qP), y el quenching no fotoquímico (NPQ) (Alvarado-Sanabria et al., 2020).
Con los datos obtenidos se realizaron análisis de varianza, previo cumplimiento de los supuestos de normalidad (test de Shapiro-Wilk) y homogeneidad de varianzas (test de Levene). Las variables de germinación no cumplieron los supuestos y se debieron transformar mediante la función arcseno √x+1. El efecto de los tratamientos se evaluó a través de una prueba de comparación de medias de Tukey (p ≤ 0,05) para la fase I, mientras que para la fase II se llevó a cabo un análisis de regresión. Los análisis se realizaron con el software SPSS (Statistical Package for the Social Sciences) IBM v. 19 (Guisande et al., 2013).
Resultados y discusión
Fase 1. Germinacion de semillas
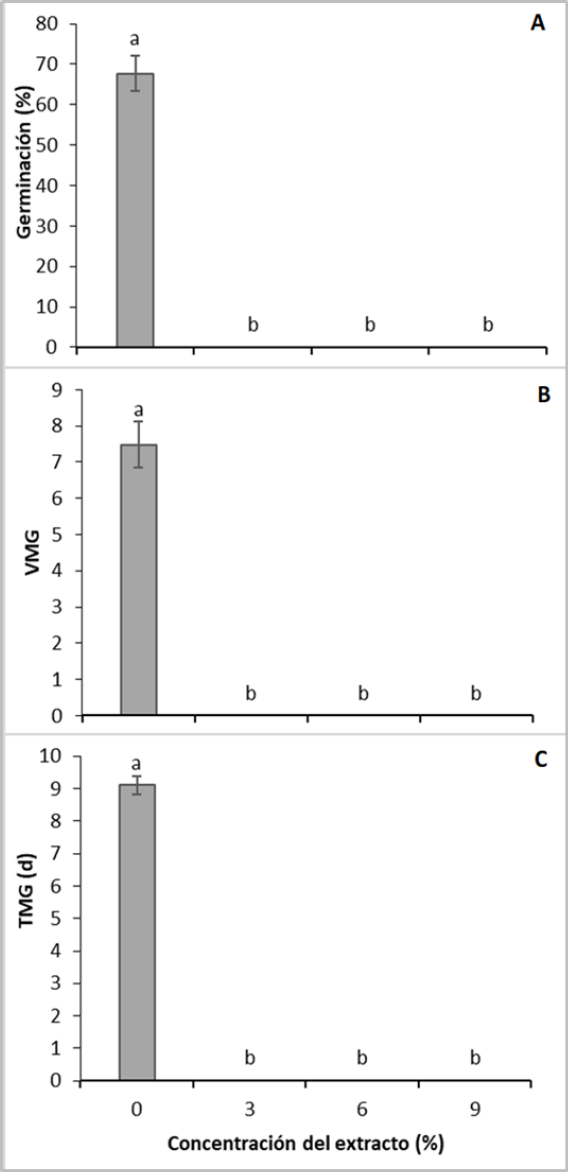
Se encontraron diferencias significativas (p < 0,05) entre el testigo y los demás tratamientos. Cualquier concentración del extracto inhibió totalmente la germinación. En el testigo, la germinación fue de 67,75 ± 4,38 % (figura 1A), resultado similar al descrito por Barrera (2015) para T. officinale.
La inhibición en la germinación puede deberse a que los metabolitos secundarios presentes en el extracto estarían inactivando las enzimas presentes en la degradación de almidón (hidrolasas) y lípidos, y tampoco se permitiría el debilitamiento de las paredes celulares de la semilla (Bewley et al., 2013), con lo que la germinación no se llevaría a cabo.
Fuente: Elaboración propia
Figura 1. Efecto del extracto de las semillas de C. lineatifolia sobre: A) porcentaje de germinación, B) velocidad media de germinación (semillas germinadas/d) y C) tiempo medio de germinación de semillas de T. officinale. Promedios seguidos de letras diferentes presentan diferencias estadísticas de acuerdo con la prueba de Tukey (p ≤ 0,05). Barras verticales sobre cada promedio indican el error estándar (n = 4).
La inhibición de la germinación también se encontró con extractos acuosos de eucalipto que generaron efectos inhibitorios previos a la emergencia de Lactuca sativa L. (Asteraceae) y Agrostis stolonifera L. (Poaceae) (Puig et al., 2018), lo que permite evidenciar que este tipo de extractos causa una disminución en la germinación (Tucat et al., 2013).
El efecto alelopático de extractos de Swinglea glutinosa (Blanco) Merr. (Rutaceae) y Lantana camara L. (Verbenaceae) fue evaluado sobre semillas de diferentes arvenses. Los resultados mostraron que los extractos tienen potencial inhibitorio sobre la germinación de las especies evaluadas (Gil et al., 2012), lo que concuerda con los resultados obtenidos en el presente estudio.
Las semillas del tratamiento testigo presentaron una velocidad media de germinación de 7,5 ± 0,63 semillas germinadas/día (figura 1B). No se calculó la velocidad de germinación en los demás tratamientos, gracias a que la adición del extracto de C. lineatifolia, independientemente de su concentración, inhibió por completo su germinación.
El efecto del extracto sobre las semillas tiene una influencia interna en los procesos fisiológicos: al parecer se ven afectadas por los aleloquímicos, que actúan directamente en la supresión de las actividades enzimáticas o las fitohormonas relacionadas con la hidrólisis de los materiales de reserva del embrión al principio de la activación de la germinación (Singh et al., 2009). Lo anterior respalda las apreciaciones de varios autores que informaron que la velocidad de germinación se ve afectada aun en concentraciones bajas (Flores et al., 2015; Gindri et al., 2020), lo que lleva a concluir que no es necesaria una aplicación de los extractos en altas concentraciones para inhibir o disminuir la velocidad de germinación.
En relación con el tiempo medio de germinación, solo se presentaron valores en el tratamiento testigo. En este caso, las semillas obtuvieron una tasa media de germinación de 9,1 ± 0,18 días (figura 1C). Se ha informado que la germinación de T. officinale más alta en número de semillas se obtuvo de los siete a los diez días después de la siembra, y el tiempo de germinación para este estudio fue de nueve días (Barrera, 2015), lo que se encuentra dentro de los mismos parámetros descritos anteriormente y solo se le determinó al testigo, ya que con los extractos de C. lineatifolia no hubo germinación (figura 1), debido a la inhibición total por el efecto bioherbicida de los compuestos existentes en el extracto (Chaves et al., 2020). En semillas de C. lineatifolia se ha reportado la presencia de β-tricetonas (Bonilla et al., 2005), metabolitos que presentan efecto herbicida (Dayan et al., 2007). También se ha informado que algunos compuestos fenólicos presentes en los extractos naturales como la cumarina, el ácido ferúlico y la narigenina, entre otros, son capaces de interrumpir los procesos de división y elongación celular (Cruz et al., 2007; Colpas et al., 2003), también afectan la movilización de las sustancias de reserva en las semillas (Bewley et al., 2013), y cuando son inhibidos por la acción de estos compuestos aleloquímicos, se ve comprometido el normal desarrollo de la plántula (Gindri et al., 2020).
Fase 2. Aplicación del extracto a las plantas
Incidencia del daño
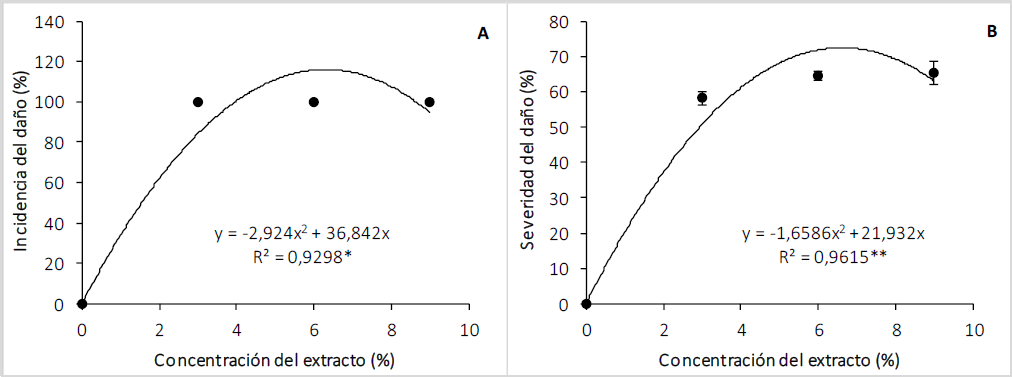
La incidencia de daño de los extractos de las semillas de C. lineatifolia se ajustó a un polinomio de segundo grado. Se evidenció que, con la aplicación del extracto en concentraciones de 3, 6 o 9 %, la incidencia fue del 100 % (figura 2A), lo que demuestra la acción fitotóxica de este extracto sobre el follaje de las plantas, que se caracterizó por presencia de clorosis y tonalidades rojizas sobre la lámina foliar. Es probable que el daño causado por el bioherbicida esté relacionado con alteraciones en los fotosistemas, que en presencia de luz estén sintetizando especies reactivas de oxígeno (ROS, por sus siglas en inglés), que causan daños en diferentes biomoléculas, principalmente sobre las clorofilas, siendo este proceso responsable de la clorosis en las hojas de T. officinale.
Fuente: Elaboración propia
Figura 2. Efecto del extracto de las semillas de C. lineatifolia sobre incidencia (A) y severidad (B) del daño de las plántulas de T. officinale. * Regresión significativa: p < 0,05, ** Regresión significativa: p < 0,01. Barras verticales sobre cada promedio indican el error estándar (n = 4).
El síntoma de manchas rojizas está asociado a pigmentos antociánicos en las plantas (Silva et al., 2012) que, al estar disueltos en las vacuolas del tejido epidérmico, tienen propiedades antioxidantes (Abe et al., 2007), indicando que estos pueden estar involucrados en el proceso de defensa de las plántulas ante compuestos tóxicos como las ROS (Gindri et al., 2020). En este sentido, el género Campomanesia evidencia altos niveles de compuestos fenólicos (González-Jiménez et al., 2015; Madalosso et al., 2012), que al parecer serían los responsables del daño en las hojas de T. officinale. Este daño estimula una serie de metabolitos secundarios, dentro de los que se encuentran las antocianinas, que al estar presentes en las hojas tienen todas las propiedades de un filtro solar. Estas propiedades tienen vías intramoleculares e intermoleculares ultrarrápidas de disipación de energía (Silva et al., 2012). Las antocianinas se activan como mecanismo de protección para absorber la luz y los rayos ultravioleta (Carrasco-Ríos, 2009), transformando rápidamente su energía en calor inofensivo para la planta, siendo esta una estrategia de defensa (Quina & Bastos, 2018) en respuesta al bioherbicida.
Severidad del daño
Este parámetro presentó un comportamiento cuadrático (p < 0,01) en función de las concentraciones de los extractos de C. lineatifolia. Como era de esperarse, las plantas control no presentaron daño; respecto a los extractos, la severidad más baja se encontró en las plantas tratadas con el extracto al 3 % de la concentración, presentando una afectación en la planta de 58,25 %, que aumentó su daño ligeramente con cada aumento en la concentración de extracto, llegando a un 65,50 % de infestación de la planta con el extracto 9 % (figura 2B). La severidad del daño se puede apreciar por presencia de clorosis, la intensidad de los colores rojizos y el área que ocupan en las hojas. En el primer caso, la clorosis se estaría generando por el daño que causaría el extracto etanólico sobre las clorofilas; en el segundo caso, la tonalidad estaría asociada a la acumulación de antocianinas que se relacionan con las funciones de defensa de las plantas (Bennett & Wallsgrove, 1994; Gindri et al., 2020) en la detoxificación de ROS que se forma por el daño causado al aplicar el extracto de C. lineatifolia a las hojas. Aunque no se generó la muerte de las plantas, estos resultados evidencian que hubo efecto herbicida por parte del extracto, pues el daño puede disminuir notablemente el proceso de fotosíntesis y aumentaría el gasto de reservas de carbohidratos en el proceso de respiración para producir ATP y metabolitos de defensa, como consecuencia el crecimiento de las plantas se reduce, cuyo síntoma es atribuido a los herbicidas (Zimdahl, 2018).
Eficiencia máxima potencial del PSII (Fv/Fm)
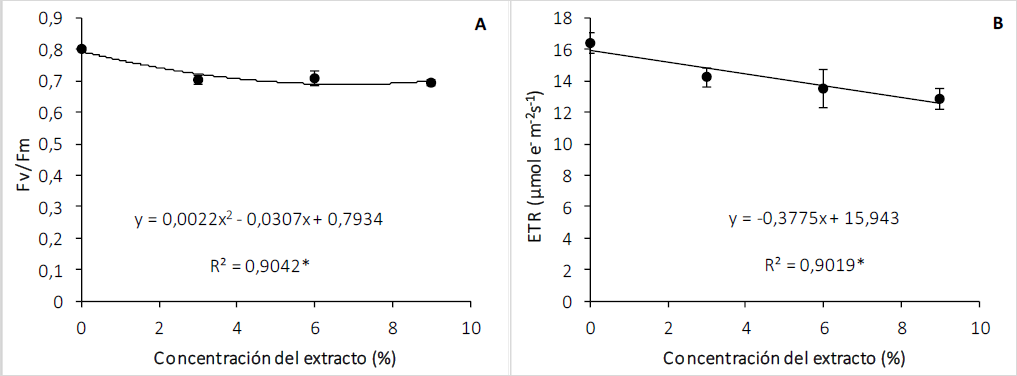
La fluorescencia de la clorofila emitida por las hojas de T. officinale que se encuentran activas es un método confiable y no invasivo para monitorear la fotosíntesis y determinar el estado fisiológico de la planta (Efeoğlu et al., 2009; Jiménez -Suancha et al., 2015; Puig et al., 2018). En la figura 3A, las plantas tratadas con los extractos, comparadas con el testigo, muestran una disminución en la eficiencia máxima potencial del PSII que se ajusta a una ecuación de segundo grado (p < 0,01), indicando una reducción en su actividad fotosintética en las plantas tratadas con los extractos de C. lineatifolia. En estudios previos se ha determinado que la inhibición de la fotosíntesis por aleloquímicos se manifiesta típicamente en una reducción del rendimiento de la eficiencia máxima potencial del PSII y una disminución en la fluorescencia, indicando un deterioro por fotoinhibición (Azcón-Bieto & Talón, 2013; Zhou & Yu, 2006), que puede ser causado por el daño en los tilacoides ante la presencia del extracto de C. lineatifolia.
Fuente: Elaboración propia
Figura 3. Efecto del extracto de las semillas de C. lineatifolia sobre eficiencia máxima del PSII (A) y tasa de transporte de electrones (B) de las plántulas de T. officinale. ** Regresión significativa: p < 0,01. Barras verticales sobre cada promedio indican el error estándar (n = 4).
La disminución en la eficiencia máxima potencial del PSII se debe a que no todos los fotones absorbidos por las clorofilas pueden ser utilizados en los procesos fotoquímicos; por eso, las plantas responden a través de diferentes mecanismos como la fluorescencia de la clorofila y el quenching no fotoquímico, para disipar el exceso de energía y evitar que las membranas fotosintéticas y las clorofilas sean dañadas (González-Salvatierra et al., 2013). La disminución de Fv/Fm indica que las plantas presentan daños sobre el PSII, lo que provoca que el exceso de energía sea transferido al oxígeno a través de la clorofila, provocando daños por fotooxidación. Estos daños excesivos conducen a la destrucción de las membranas y a la oxidación de la clorofila (Puig et al., 2018). Al ser destruidas, las membranas dejan escapar el contenido celular a los espacios intercelulares y las células mueren (Pitty, 2018). Los resultados de esta investigación son similares a los reportados en Sorghum bicolor (L.) Moench (Poaceae), donde la fisiología se ve afectada de forma negativa en respuesta a la aplicación del aceite de E. globulus (Bagavathy & Xavier, 2007).
Tasa de Transporte de Electrones (ETR)
La disminución de la actividad fotosintética se ve reflejada en la reducción en la tasa de transporte de electrones (ETR) (González et al., 2008), indicando un grado de estrés (Khan et al., 2009), lo que mostraría que las plantas de T. officinale presentaron una disminución lineal y significativa (p < 0,01) en la ETR en función de la concentración del extracto de C. lineatifolia: con el extracto al 9 % se generó la menor ETR con un valor de 12,85 ± 0,6 µmol e- m-2s-1 (figura 3B).
Los bajos valores de la ETR pueden estar relacionados con la reducción en la eficiencia del PSII (down regulation) (Liu et al., 2019) y el aumento de los mecanismos de disipación de energía (Moreno et al., 2008), que son consecuencia del daño causado por el extracto de C. lineatifolia.
Quenching fotoquímico (qP)
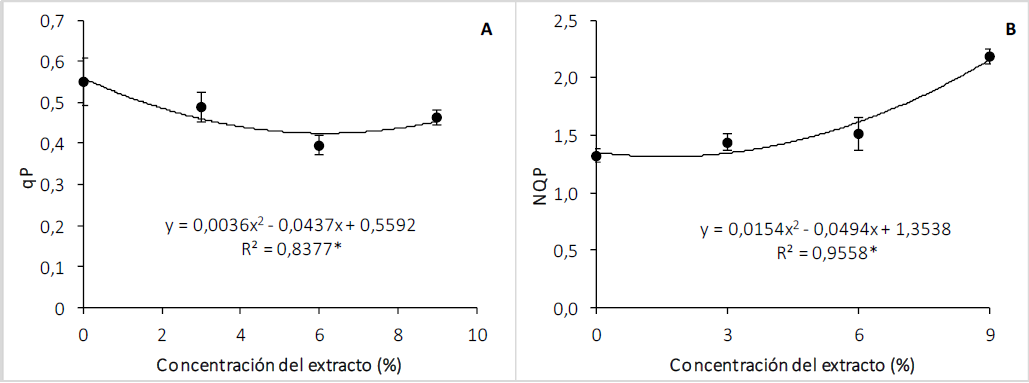
El qP fue mayor en las plantas control y disminuyó con los extractos de C. lineatifolia, pero con efecto similar entre la concentración de 3 y 9 %. Esta tendencia se explicó mediante una función cuadrática (p < 0,05) (figura 4A). El qP representa la proporción de la energía de excitación atrapada por los centros de reacción abiertos, que ha sido usada para el transporte electrónico (Moreno et al., 2008), y en este caso indica que se vio afectada por el bioherbicida. Como la incidencia de fotones es aproximadamente igual en todas las plantas evaluadas, las plantas bajo el efecto del extracto estarían reflejando un daño que afectaría la cantidad de fotones utilizados en la vía fotoquímica y, como consecuencia, la planta presenta algún mecanismo para mitigar el daño en el aparato fotosintético, como por ejemplo la emisión de fluorescencia (Jiménez-Suancha et al., 2015), tal como se vio en los resultados que se muestran en la figura 3A.
Fuente: Elaboración propia
Figura 4. Efecto del extracto de las semillas de C. lineatifolia sobre quenching fotoquímico (A) y quenching no fotoquímico (B) de las plántulas de T. officinale. * Regresión significativa: p < 0,05, ** Regresión significativa: p < 0,01. Barras verticales sobre cada promedio indican el error estándar (n = 4).
Quenching no fotoquímico (NPQ)
En el NPQ se observó que las plantas T. officinale sin tratar mostraron el menor valor, y fue incrementando lentamente con las concentraciones de 3 y 6 %, mientras que con el extracto de 9 % el NPQ incrementó de forma representativa, dando como resultado un ajuste de una regresión polinómica de segundo grado (figura 4B), lo que Groom y Baker (1992) relacionan directamente con la reducción de qP. El aumento del NPQ evidencia una respuesta en las hojas relacionada con la acumulación de compuestos fotoprotectores, que tienen como función regular y proteger el aparato fotosintético del exceso de luz (Horton & Ruban, 2005; Müller et al., 2001), activando mecanismos de disipación de energía regulada en forma de calor (Efeoğlu et al., 2009) como respuesta a los daños del extracto de C. lineatifolia sobre las estructuras celulares. Adicionalmente, se ha documentado que un aumento en NPQ podría estar relacionado con una disminución de la eficiencia máxima del PSII (González-Salvatierra et al., 2013), debido a que el NPQ consta de una variedad de procesos, como redistribución del PSII y PSI para equilibrar el transporte de electrones, y así disipar de forma segura el exceso energía de luz dentro del sistema como mecanismo de protección (Liu et al., 2019). Este mecanismo, junto con la fluorescencia de la clorofila, sería en parte responsable de la supervivencia de T. officinale en presencia del bioherbicida.
Conclusiones
El extracto de Campomanesia lineatifolia al 3 % o superior inhibe completamente la germinación y disminuye la eficiencia del PSII de T. officinale. Estos resultados evidencian el potencial alelopático del extracto etanólico de semillas de Campomanesia lineatifolia sobre T. officinale, que además puede convertirse en una alternativa de manejo para esta especie.















