Introducción
El durazno (Prunus persica L.) pertenece a la familia Rosaceae, se trata de un árbol caducifolio de porte pequeño, su fruto es una drupa de gran tamaño. Este fruto siempre ha presentado un gran valor a nivel mundial, pero actualmente es de gran importancia económica para el Perú, por presentar cada año una mayor exportación (Alza et al., 2000; Aquino, 2009; Herrera, 2016). Dentro de los factores que impiden su optima producción, se encuentra enfermedades como gomosis (Botryosphaeria dothidea) (Olmstead et al., 1995), ataque de plagas como el ácaro araña roja (Tetranychus urticae) (Goldhamer et al., 2002), o el comportamiento recalcitrante de su semilla en la cual dichas semillas no pueden ser llevadas a proceso de secado, son sensibles a la temperatura y no pueden guardarse por mucho tiempo (Pedro et al., 2007). Por esto, han surgido planes de mejoramiento de este cultivo, mediante la multiplicación de forma vegetativa realizada mediante injerto de yema o plumas, omitiéndose el proceso de siembra de la delicada semilla (Quispe, 2016; Vargas, 2018).
En Perú la producción de durazno no se desarrolla a gran escala como si lo realiza su competidor principal Chile, quien es el primer exportador en Latinoamérica y cuarto a nivel mundial. No obstante, el clima y el suelo, aptos para la adecuada producción de este cultivo, benefician la producción anual de durazno en Perú (Atoccsa, 2015). El durazno en el mundo es uno de los frutos más industrializados por su consumo ya sea en conservas, mermeladas, jugos y secos (Herrera, 2016). En los últimos años el Perú ha crecido en la importación del durazno llegando a 1.168 toneladas, por lo que entidades nacionales y privadas se han visto implicadas en planes de mejoramiento, para impulsar y satisfacer el mercado y la industria ante demandas de frutos grandes, variedades altamente productivas, con el color de piel rojo extensa, el color de pulpa amarilla o blanca, la forma del fruto redondo y muy firme, y con retraso en el ablandamiento (Alza, 2000; Becerra, 2017).
Dentro de las variedades de durazno con mayor potencial productivo para exportación se tiene la variedad Huayco Rojo, que en comparación con otras variedades tiene una gran ventaja en el mercado exterior por su agrado y Perú es el único país en producirlo. Sin embargo, no se abastece la demanda externa, lo que deja oportunidad para una mayor producción, ya que países como Rusia y Alemania importan el durazno peruano para completar su demanda. Las regiones con mayor producción de durazno son Ancash, Ayacucho, Abancay y Lima con un total de 5.900 hectáreas (Aquino, 2009; Becerra, 2017; Herrera, 2016). De tal manera, se viene promoviendo el incremento de las áreas de cultivo con variedades de alto rendimiento, mediante la propagación clonal de las mejores plantas empleando las técnicas biotecnológicas como el cultivo de tejidos vegetales in vitro (Calva & Pérez, 2005; Hernández et al., 2019).
La micropropagación a partir de yemas axilares es una técnica utilizada en cultivos de importancia económica, empleando medios de cultivo con agentes específicos; hormonas, minerales, vitaminas, fuentes de carbono y agentes gelificantes en condiciones controladas de temperatura, humedad y luz (Orellana, 1998, Pineda et al., 2021). En este proceso las hormonas o reguladores de crecimiento juegan un papel importante, debido a que su adición en los medios de cultivo puede inducir a generación de nuevos brotes, raíces, así como a la formación de callos y/o embriones somáticos (Argüelles et al., 2020, Delgado & Hoyos, 2016; Hernández-Amasifuen et al., 2021). Las especies del género Prunus presentan inconvenientes en condiciones in vitro como la frecuencia de oxidación de los explantes, la presencia de inhibidores de crecimiento y la dificultad de enraizamiento (Azpeitia et al., 1963; Cabrera, 2003; Guevara et al., 2016). Por tanto el durazno se considera de comportamiento recalcitrante, dificultando su propagación in vitro (Arab et al., 2014; Battistini & De Paoli, 2002; Onofre, 2015).
Dentro de las alternativas se ha propuesto obtener callos con capacidad embriogénica estable. El presente trabajo de investigación tuvo como objetivo desarrollar una metodología eficiente de inducción de callos in vitro en durazno variedad Huayco rojo a partir de hojas.
Materiales y métodos
El trabajo de investigación se realizó en el Laboratorio de Biotecnología Vegetal de la Universidad Nacional José Faustino Sánchez Carrión (Huacho, Huaura, Lima, Perú).
Desinfección del material vegetal
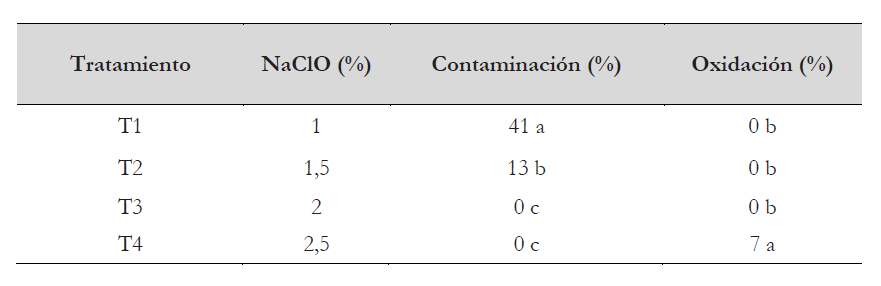
Se utilizaron como explantes hojas jóvenes de plantas de durazno variedad Huayco rojo de 55 días de edad, mantenidas con iluminación y temperatura en condiciones de laboratorio (fotoperiodo 16 horas luz/8 horas oscuridad y temperatura de 25 °C). Los explantes fueron lavados con detergente comercial y agua corriente, enjugándose hasta retirar toda presencia de partículas. Posteriormente se trasladó el material vegetal a la cámara de flujo laminar para continuar con el proceso de desinfección, en alcohol al 70 % por 1 minuto, luego se sometieron a diferentes tratamientos con NaClO (tabla 1) con una gota de Tween 20, durante 10 minutos en cada uno de los tratamientos. Transcurrido el tiempo de inmersión, se realizaron tres enjuagues con agua destilada estéril para eliminar los restos de hipoclorito. Finalmente, las hojas se cortaron en segmentos de aproximadamente 10 mm2 y se colocaron cinco explantes por medio de cultivo previamente esterilizado. El medio de cultivo base fue Murashige & Skoog (MS) (Murashige & Skoog, 1962) a la mitad de su concentración, adicionado con sacarosa al 3 % y agar al 0,7 % como agente gelificante, a un pH ajustado de 5,7 ± 0,1. Los tratamientos se mantuvieron durante 14 días en cámara de incubación para evaluar el porcentaje de contaminación y oxidación. Las condiciones de la cámara de incubación fueron: oscuridad total y temperatura de 25 °C.
Inducción a callogénesis
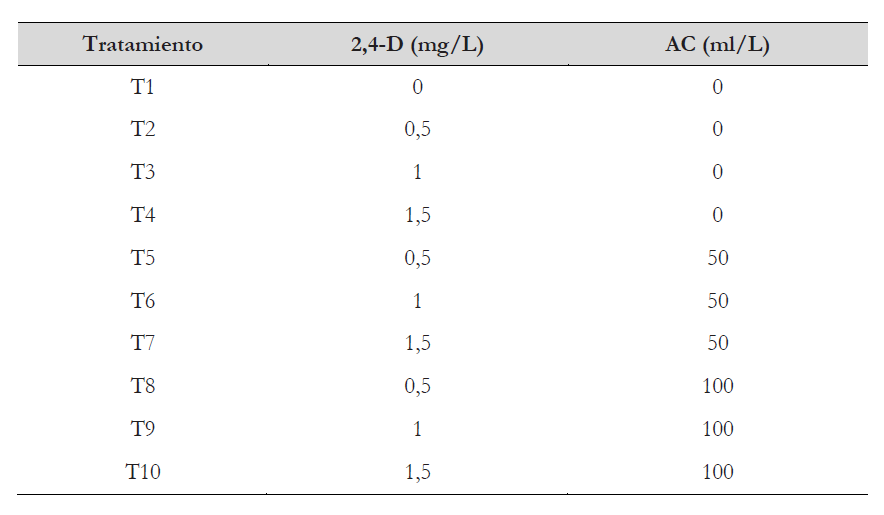
Para la inducción de callos se cultivaron, en placas de Petri, cinco explantes tratamiento (tabla 2) siendo estos la combinación de tres de ácido 2,4–diclorofenoxiacético y tres concentraciones de agua de coco (tabla 2); se consideró un testigo absoluto sin 2,4-D ni agua de coco. Todos los tratamientos se mantuvieron en cámara de incubación a 25 °C en completa oscuridad, durante 35 días.
Diseño experimental y análisis estadístico
Se utilizó el diseño completamente al azar (DCA), los datos se analizaron con el programa estadístico R, (versión 3.6.2) R Core Team, 2021. Se emplearon 15 placas por tratamiento, siendo la unidad experimental una placa con cinco explantes. En el proceso de desinfección de explantes se evaluó el porcentaje de contaminación y oxidación, mientras que en la inducción a callogénesis se evaluó el porcentaje de inducción de callos en los explantes. Se utilizó análisis de varianza (ANVA) y las diferencias entre las medias se determinaron mediante prueba de Tukey (p ≤ 0,05).
Resultados
Desinfección del material vegetal
Se logró la desinfección de hojas de durazno con el uso de NaClO. Los mejores resultados se obtuvieron con el tratamiento T3 (2 % de NaClO) con 0 % de contaminación y 0 % de oxidación de las hojas, seguido del T4 con 0 % de contaminación, pero presentó 7 % de oxidación (tabla 3). Los tratamientos restantes presentaron contaminación correspondiente a hongos filamentosos, los cuales no fueron identificados.
Inducción a callogénesis
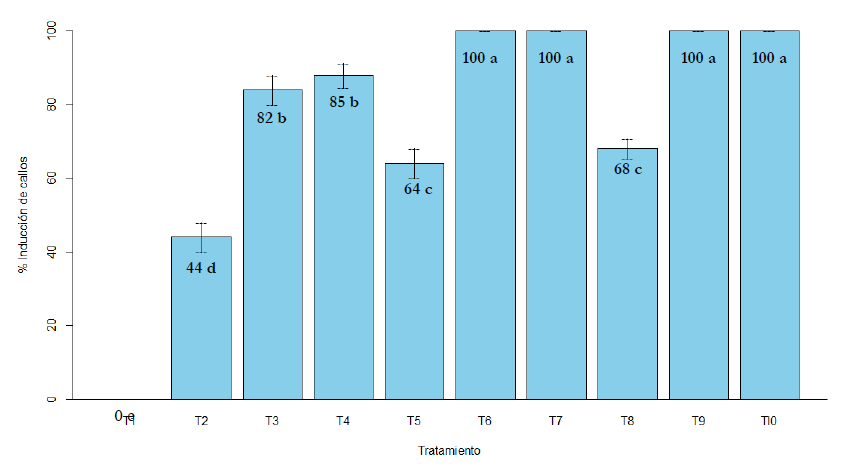
Todos los tratamientos adicionados con reguladores de crecimiento indujeron callos de durazno a partir de hojas (figura 1); se obtuvieron los mejores resultados con el empleo de 1,0 y 1,5 mg/L de 2,4-D junto con 50 y 100 mL/L de agua de coco, no encontrándose diferencia significativa entre estos cuatro tratamientos en el porcentaje de inducción de callos (figura 2). Se observó diferencia en la textura y color de los callos formados, de los cuales tuvo predominancia los de tonalidad amarilla (figura 3).

Fuente: Elaboración propia
Figura 1. Proliferación de callos friables a partir de hojas de durazno variedad Huayco rojo
Fuente: Elaboración propia
Figura 2. Porcentaje de inducción de callos in vitro a partir de hojas de durazno Medias con letras distintas difieren significativamente mediante prueba de Tukey (p < 0,05)
Discusión
El método de empleo de NaClO al 2 % en la desinfección de hojas de durazno permitió obtener explantes libre de contaminación con microorganismos, lo cual es muy importante en el establecimiento in vitro conjuntamente con obtener el menor daño posible de los explantes (Roca & Mroginski, 1991). Se debe tener en consideración que el hipoclorito de sodio tiene capacidad antibacteriana y antifúngica, debido a que el cloro inhibe la actividad enzimática de la membrana citoplasmática de las bacterias y hongos, afectando el metabolismo celular (Estrela et al., 2002; Fukuzaki, 2007).
No se observaron explantes oxidados con el tratamiento T3 (NaClO 2 %). Este resultado favorable podría estar relacionado con las condiciones previstas para el explante, a parte de la concentración y tiempo de exposición en la solución de NaClO, se podría incluir la edad de los explantes, el medio de cultivo y la incubación en oscuridad. Tal como describe Azofeifa (2009), que dentro de las estrategias de reducir la oxidación de los explantes se debe considerar emplear hojas jóvenes, la concentración de las sales del medio de cultivo debe encontrarse a la mitad de su concentración y mantener los explantes en completa oscuridad.
Se logró inducir a la formación de callos a partir de hojas de durazno, empleando 2,4-D y agua de coco en diferentes concentraciones en los medios de cultivos empleados, esto se debe a que los explantes en presencia de reguladores de crecimiento exógenos (o en algunos casos endógenos) presenta un cambio en su metabolismo celular, iniciando una división celular acelerada, dando lugar a la desdiferenciación celular, formando un tejido de células no especializadas llamado callo, el cual puede seguir creciendo, pero este proceso puede ser interrumpido para iniciar organogénesis o embriogénesis, potencialmente para la regeneración de la planta (George et al., 2008).
El agua de coco adicionado en los medios de cultivo con 2,4-D aumentó significativamente el porcentaje de inducción de callos, esto puede estar relacionado a la presencia de azucares, vitaminas y reguladores de crecimiento (variadas concentraciones) como algunos de sus componentes del endospermo líquido del fruto del coco (George et al., 2008). Muchos autores han empleado el agua de coco en combinación de otras hormonas en la inducción de callos, como Efe (2005), empleando agua de coco para inducir callos en óvulos de Gossypium hirsutum y Gossypium barbadense, obtenido buenos resultados. Mientras que Islam y Bari (2012), emplearon el agua de coco juntamente con 2,4-D en la inducción de callos a partir de hipocótilos de Jatropha curcas, obteniendo callos friables de color verde a partir del séptimo día en el medio de inducción. Por otra parte, Naznee et al. (2014), obtuvieron mayor respuesta de callogénesis en segmentos nodales de Tinospora cordifolia empleando agua de coco en medio MS, en concentraciones de 50 y 100 mL/L.
El porcentaje de inducción de callos en hojas de durazno fue superior a los obtenidos por Pérez-Jiménez et al. (2013), quienes lograron 53 % de inducción de callos a partir de hojas de durazno empleando medio de cultivo MS al 100 % de su concentración adicionado con 1,2 mg/L de 2,4- D y 1,0 mg/L de Kinetina. Estos resultados superiores pueden ser efecto de la concentración de las sales MS, ya que en el presente trabajo se empleó a la mitad de su concentración. Esto confirmaría también la evaluación de Feeney et al. (2007), quienes también evaluaron el efecto de la concentración de las sales basales MS sobre la inducción de callos, y concluyeron que se obtienen mejores resultados en callogénesis al emplear el medio basal a la mitad de su concentración. Además, Feeney et al. (2007), evaluaron el efecto de inducción de callos de tres medios basales: Woody Plant Medium (WPM), MS, ½ MS, adicionado con 6-Bencilaminopurina (BAP) en dos variedades de cerezo (Prunus avium L.), obteniendo en la variedad Lapins 62 % de inducción de callos con medio basal WPM, 62 % con ½ MS, y 53 % con MS; mientras que en la variedad Sweetheart obtuvieron 56 % de inducción de callos con medio basal WPM, 38 % con ½ MS, y 26 % empleando MS. Esto también permite apreciar que existe el efecto por especies del género Prunus, razón por la cual se deben buscar las condiciones óptimas para cada especie, debido a que en muchos casos el efecto de los medios depende del genotipo empleado, variando incluso entre variedades o cultivares (Pérez-Tornero & Burgos, 2000).
Finalmente, los resultados de esta investigación permiten recomendar el uso de 2,4-D y agua de coco en la inducción del proceso de callogénsis en P. persica variedad Huayco rojo. El protocolo establecido garantiza la disponibilidad de material suficiente y lo más importante, libre de patógenos, bajo condiciones ambientales totalmente controladas, para aplicar técnicas de avanzada para el mejoramiento de este importante cultivo.
Conclusiones
Se desarrolló una metodología eficiente de inducción de callos in vitro en durazno variedad Huayco rojo a partir de hojas, obteniendo 100 % de inducción de callos empleando a partir de 1 mg/L de 2,4-D y 50 mL/L de agua de coco, con énfasis en la influencia del agua de coco en la inducción de callos, ya que incrementó los porcentajes de inducción en los tratamientos que estuvo presente.