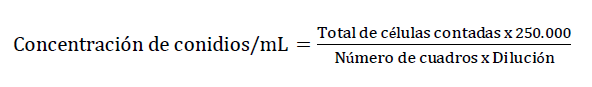Introducción
Los hongos entomopatógenos (HE)se encuentran ampliamente distribuidos en la naturaleza en diversos ecosistemas, donde juegan un papel importante en la regulación de las poblaciones de insectos plaga; ocasionan infecciones letales en su hospedante, incluidas las que viven en el suelo mediante epizootias (Gürlek et al., 2018). Los HE se distribuyen aproximadamente en más de 100 géneros y 750 especies, algunas de las cuales presentan interés agronómico como agentes de control microbiano (García et al., 2019). Entre estos hongos se incluyen a Beauveria bassiana, Metarhizium spp., Isaria fumosorosea y Lecanicillium spp., entre otros, los cuales se usan para el control de docenas de plagas en una amplia variedad de cultivos (Lacey et al., 2015).
Para la mayoría de los hongos entomopatógenos, el proceso de infección comienza con la fijación de los conidios en la superficie externa del cuerpo de los insectos (Gürlek et al., 2018). Las especies pertenecientes al género Metarhizium causan la enfermedad conocida como “muscardina verde”; son patógenos facultativos que atacan a un amplio rango de hospedantes (Hu et al., 2014). Se ha reportado que los suelos de los campos agrícolas albergan altas densidades de Metarhizium spp. en comparación con diferentes ecosistemas dentro de la misma región, como bosques y praderas, por lo que se aíslan con frecuencia a partir de muestras de suelo (Steinwender et al., 2014).
El éxito de un programa de control biológico de plagas basado en hongos entomopatógenos depende de la producción del inóculo para las aplicaciones al campo, la selección de cepas o aislados con alta virulencia, el buen crecimiento, la esporulación y la resistencia a condiciones ambientales adversas (García et al., 2015). En la búsqueda de agentes de control biológico, una de las estrategias básicas es la exploración inicial de los enemigos naturales nativos, antes de introducir agentes exóticos, debido a que las cepas nativas se encuentran adaptadas a las condiciones ambientales de la zona; a diferencia de las cepas de microorganismos transitorios, que por su falta de adaptabilidad pueden resultar poco efectivas en diferentes agroecosistemas (García et al., 2011).
El salivazo Mahanarva andigena (Jacobi) (Hemiptera: Cercopidae) constituye el principal insecto plaga del cultivo de caña de azúcar Saccharum officinarum L. (Poaceae) en las provincias amazónicas ecuatorianas (Mendoza et al., 2013). Este insecto provoca reducciones en el rendimiento agrícola de entre 40 % y 60 % (Valle et al., 2018). En Ecuador, el control de M. andigena depende de insecticidas químicos, tales como Carbaril y Acefato (Centro de Investigación de la Caña de Azúcar del Ecuador [CINCAE], 2013). Sin embargo, el uso de plaguicidas químicos para controlar poblaciones de salivazo es costoso y difícil de implementar, debido al denso crecimiento aéreo del cultivo (Rezende et al., 2015). Además, el uso de estos insecticidas tiene efectos nocivos en la salud humana, animales y el ambiente, así como la generación de resistencia de los insectos (Bautista et al., 2018).
Estos efectos han motivado la búsqueda de estrategias más compatibles con el medio ambiente para regular estos insectos. En especial, los aislados nativos de Metarhizium han sido los más investigados recientemente (Rezende et al., 2015). En Brasil, Metarhizium anisopliae (Metchnikoff) Sorokin (Fungi: Hypocreales: Clavicipitaceae) es el hongo entomopatógeno que se produce y utiliza ampliamente para el control de salivazos(Hemiptera: Cercopidae) como Mahanarva fimbriolata (Stål) y Mahanarva posticata (Stål) en plantaciones de caña de azúcar, con aplicaciones anuales en aproximadamente dos millones de hectáreas (Iwanicki et al., 2019; Tiago et al., 2012).
En este contexto, este hongo puede ser una herramienta promisoria para el control de M. andigena en las condiciones amazónicas ecuatorianas. En esta zona predominan las lluvias frecuentes y la alta humedad durante todo el año, factores que favorecen el desarrollo de hongos entomopatógenos (Erper et al., 2016). Explorar los agroecosistemas de caña de azúcar en la provincia Pastaza puede ser viable para aislar especies nativas de Metarhizium spp. con potencial para el control biológico contra M. andigena, los cuales pueden presentar variabilidad en cuanto a rango de hospederos, características fisiológicas y patogénicas. Para ello, es necesario el aislamiento y caracterización de especies fúngicas para seleccionar aislados promisorios como agentes de control biológico (Torres de la C. et al., 2013). Estos estudios constituyen la base para la producción y escalado de bioproductos que contribuyan a lograr procesos agrícolas sostenibles en agroecosistemas frágiles, como los de la Amazonía ecuatoriana.
Materiales y métodos
Localización del área de estudio
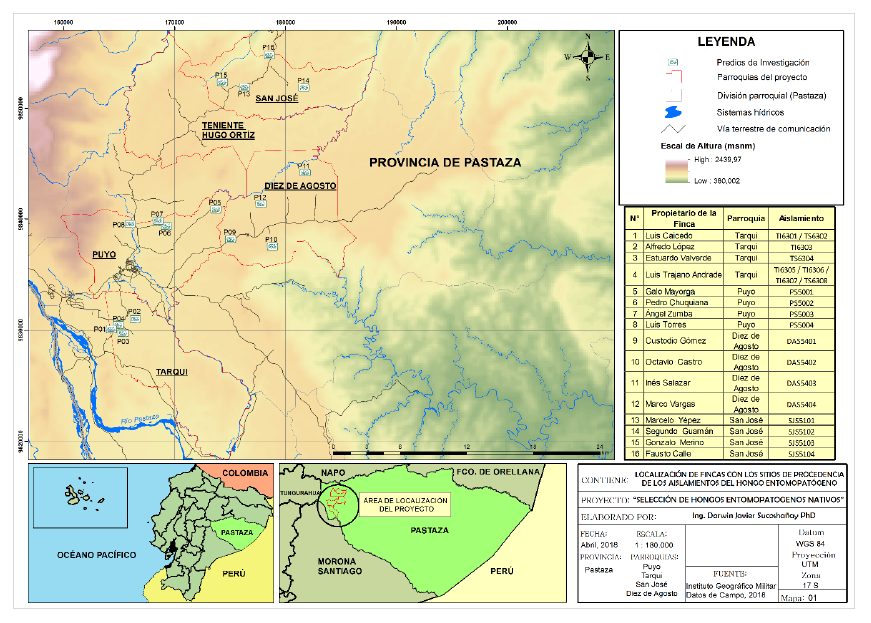
El muestreo y recolección en campo se llevó a cabo en 16 fincas con producción de caña de azúcar del cantón Pastaza, provincia Pastaza, Ecuador (figura 1), durante los años 2017 y 2018. Los suelos de esta zona se clasifican como Hydrandepts, con textura franca, profunda y totalmente lixiviada, tienen un color marrón oscuro, pobres en fósforo y potasio; el pH es de fuerte a moderadamente ácido, entre 4,9 y 5,9. Esta zona presenta una temperatura promedio de 22,6 °C, humedad relativa de 84 % y precipitación promedio anual superior a 5.000 mm (Abril et al., 2019).
Toma de muestras
La colecta de muestras de suelo y ninfas de M. andigena con signos de micosis se realizó en cuatro parroquias con mayor superficie en producción de caña de azúcar (Tarqui, Puyo, Diez de Agosto y San José). En cada parroquia se seleccionaron cuatro fincas que tenían mínimo tres hectáreas en producción de caña de azúcar.
Para la toma de muestras de suelo se utilizó la metodología de Sevim et al. (2010), y Hernández-Domínguez y Guzmán-Franco (2017) con algunas modificaciones. En cada finca se seleccionó una hectárea con cultivo de caña de azúcar, donde se delimitaron cinco puntos en zigzag; en cada punto se tomó una submuestra independiente de suelo de 600 g a una profundidad de 15 a 20 cm cerca de las raíces de cada planta de caña. Con una pala pequeña, se tomaron las muestras de suelo y se colocaron en fundas herméticas tipo ziploc® refrigeradas para el traslado al laboratorio. Se obtuvieron cinco submuestras de cada finca, que conformaron la muestra compuesta por finca.
Aislamiento y obtención de cultivos monospóricos de Metarhizium spp.
El aislamiento se realizó en el laboratorio de Microbiología de la Universidad Estatal Amazónica, a partir de muestras de suelo, para lo cual se utilizó la metodología de dilución seriada (Hernández-Domínguez, & Guzmán-Franco, 2017; Schapovaloff et al., 2015). De la muestra compuesta de suelo se tomaron 90 g y se colocaron en un matraz Erlenmeyer de 250 mL, que contenía 90 mL de solución de Tween® 80 (Panreac Química S.L.U., Barcelona, España) al 0,03 %. La mezcla se homogeneizó en un agitador orbital a 200 rpm durante 15 min a temperatura ambiente. De cada suspensión de suelo se realizaron diluciones seriadas. Se tomaron alícuotas de 100 μL de la dilución 10-2 y se distribuyeron uniformemente en una placa de Petri que contenía (PDA) Potato Dextrosa Agar (DifcoTM Becton, Dickinson and Company, USA) y con 1 % del volumen a preparar de ácido láctico (J.T.Baker®, USA) al 25 %. Luego de ocho días de inoculadas las placas de Petri,se aislaron las colonias que presentaron características compatibles con el género Metarhizium (Bischoff et al., 2009; Humber, 1997, 2012). Según Driver et al. (2000), los análisis moleculares para la identificación de Metarhizium, basado en técnicas de rDNA son uno de los métodos más eficientes para la clasificación de especies; sin embargo, los caracteres morfológicos y microscópicos de los conidios, tales como colonias circulares y extensas de textura variable, con variados matices de verde, predominando el color verde oliváceo de las masas de esporas, son determinantes para la identificación morfológica de las colonias de Metarhizium spp.
Para el aislamiento a partir de insectos micosados, se utilizó la metodología propuesta por García et al. (2012). Los salivazos infectados recolectados en campo se colocaron en un microtubo de 2 mL (Eppendorf, Alemania) con papel filtro Whatman 42 (Sigma Aldrich, USA) y se llevaron al laboratorio donde se desinfectaron superficialmente con hipoclorito de sodio al 1 %, durante 3 min. El exceso de hipoclorito se eliminó con un lavado triple en agua destilada estéril; para evitar el exceso de humedad se colocaron los insectos sobre papel estéril. Cada insecto se depositó en cámara húmeda compuesta de una caja de Petri de 90 mm (Ø) (100 × 15 mm) conteniendo en su interior papel filtro Whatman 42 y sobre él se colocaron dos portaobjetos en forma de cruz, y sobre éste se colocó al insecto (90 % HR) a 27±1 °C, durante ocho días.Cuando se observó algún crecimiento de hongos sobre el cuerpo del insecto, éste se aisló y sembró en un medio de PDA acidificado. El aislamiento se incubó durante ocho días a 27±1 °C, para permitir su desarrollo hasta la esporulación e identificar el microorganismo obtenido.
De los aislados obtenidos a partir de muestras de suelo e insectos micosados se realizaron cultivos monospóricos puros, de acuerdo al procedimiento descrito por Estrada et al. (1999). A cada uno de los aislados se le asignó un código, compuesto por la letra inicial de la parroquia de origen, seguido de la letra inicial de la procedencia (S: suelo o I: insecto) y, por último, el número asignado al cultivo monospórico. Todos los aislados se conservaron en refrigeración a temperatura de 4 °C para su utilización en los ensayos posteriores.
Para la caracterización macroscópica se aplicó la técnica del microcultivo. Se colocó papel de filtro en el interior de cada caja de Petri de 90 mm (Ø) (100 × 15 mm) y sobre este se colocaron dos portaobjetos en forma de cruz. Después de esterilizarlos, se adicionó agar-agua al 1,5 % sobre el portaobjeto de la parte superior, en el cual se sembró una porción de una colonia de cada aislamiento, con ayuda de un asa recta. Seguidamente, se humedeció el papel de filtro con agua destilada estéril, se sellaron con parafilm® M (Sigma Aldrich, USA) y se llevaron las placas a incubación a 27±1 °C. A partir del tercer día y hasta los cinco días se realizaron las observaciones al microscopio (40x) (BB.1153-PLi, Euromex, Euromex Microscopen Spain, S.L.) para verificar la esporulación. De cada aislado se observó el tipo de borde, consistencia, superficie, aspecto y color de la colonia.
Las microfotografías de la morfología, la disposición de los conidios y la medición de 100 conidios (largo y ancho) por cada aislamiento se realizó con ayuda de una cámara digital (CMEX-3 Cámara digital con sensor CMOS de 3 Mp. DC.3000c, Países Bajos), incorporada al microscopio BB.1153-PLi (Euromex), con aumento de 100x.
Caracterización fisiológica
Crecimiento radial y tasa de crecimiento
A partir de cultivos in vitro de cada aislamiento de Metarhizium spp. de cuatro días, se transfirió un círculo de 5 mm de diámetro del borde de la colonia en crecimiento,se colocó en el centro de una placa de Petri de 90 mm (Ø) con medio de cultivo PDA(Difco™,Becton, Dickinson and Company, USA) y se incubó en oscuridad a 27 ± 1 °C. Se prepararon cinco repeticiones por cada aislamiento. El desarrollo micelial se registró mediante un calibrador Vernier digital de 6", milimétrico y standard con pantalla digital de cinco dígitos (Truper®, México) cada dos días y hasta el día 20 después de la transferencia de acuerdo con Torres de la C. et al. (2013) y Cárdenas et al. (2016). Los datos del último día se consideraron para el análisis estadístico. A los valores obtenidos en la medición se le restaron los 5 mm correspondientes a cada círculo de micelio inicial. La tasa de crecimiento se calculó al final del ensayo con la fórmula propuesta por Guigón-López et al. (2010).
Producción conidial
Para determinar la concentración de conidios por cada aislado se siguió la metodología propuesta por Torres de la C. et al. (2013). Se procedió a obtener los conidios de la superficie del cultivo de las cajas Petri de 20 días de incubación bajo condiciones asépticas; para lo cual se inundó la caja de Petri con 10 mL de agua destilada estéril (ADE) + Tween 80 (0,1%) y se raspó la colonia con un bisturí. La suspensión de conidios se filtró con gasa estéril para separar el micelio. Los conidios se agitaron durante 10 min en un Vórtex. Posteriormente, el conteo de conidios se realizó en una cámara de Neubauer (Improved Brigh Line), con la dilución 10-2; se revisaron cinco cuadrantes del cuadrado central con ayuda del objetivo 40x del microscopio. La concentración de conidios por mL se estimó mediante la fórmula:
Germinación de conidios
La germinación de los conidios de cada aislado se determinó al inocular y extender 100 μl de la suspensión 1 × 106 conidios/mL en la superficie de una placa de Petri con una capa delgada de PDA. Después de la incubación a 27 ± 1 °C durante 18 a 24 h, se cortó 1 cm2 de PDA con la presencia de micelio, se colocó sobre un portaobjetos para observar la muestra a 40x y se contabilizó el número de conidios germinados y no germinados. Se consideraron conidios germinados cuando el haustorio alcanzó la longitud de la mitad del conidio (Gürlek et al., 2018; Torres de la C. et al., 2013).
Evaluación de patogenicidad
Se utilizaron ninfas de M. andigena de 8 y 10 mm de longitud, provenientes de un cultivo de caña de azúcar cultivar POJ 93, de la finca La Julita, parroquia Teniente Hugo Ortiz, del cantón Pastaza, sin aplicación de productos químicos. Las unidades de observación estaban constituidas por una caja Petri (100 × 15 mm) que contenía una hoja de caña de 8 cm de longitud, lavada con agua destilada estéril y envuelta por los extremos en un fragmento de algodón humedecido con agua;sobre la hoja se colocaron diez ninfas de M. andigena (Freitas et al., 2012).
Para determinar la patogenicidad contra ninfas de M. andigena, se seleccionaron diez aislados monospóricos que presentaron la mayor producción de conidios y se cultivaron en PDA durante tres semanas. Se obtuvo la suspensión de conidios mediante la adición de 10 mL de Tween 80 al 0,01 % en cada placa de Petri; suavemente se raspó la superficie de los cultivos con un bisturí estéril. Posteriormente, se filtraron las suspensiones de conidios en gasa estéril para eliminar las partes rugosas del medio y el micelio. Los conidios se contaron en una cámara de Neubauer y las suspensiones se prepararon mediante dilución, de acuerdo a Gürlek et al. (2018). Se utilizó una concentración de 1×108 conidios/mL de cada aislado; en cada placa de Petri se aplicó 1 mL de suspensión sobre las ninfas con una micropipeta manual de volumen variable de 100 a 1000 µL (Boeco, Alemania), de acuerdo con Freitas et al. (2012).
Al tratamiento control se le aplicó agua destilada estéril con Tween 80 al 0,01 %. Además, se utilizó un tratamiento químico a base del insecticida Tiametoxam (Actara® 25 WG, Gowan Milling LLC, USA, Syngenta Crop Protection S.A. Sucursal Ecuador) a la dosis de 0,62 g/L. El experimento se realizó bajo un diseño completamente aleatorio con cinco repeticiones, con diez ninfas por cada repetición. Se registró la mortalidad de ninfas de M. andigena durante seis días después de la aplicación de los tratamientos. Los datos de mortalidad se corrigieron según la fórmula de Abbott (1925).
Resultados y discusión
El proceso de aislamiento produjo 20 aislados nativos de Metarhizium spp., de los cuales cinco procedieron de ninfas de M. andigena y quince de muestras de suelo (tabla 1). De los insectos micosados, se obtuvieron aislados, evidencia de que en el lugar de estudio se presentan epizootias naturales por este hongo entomopatógeno.
Tabla 1. Aislados nativos monospóricos de Metarhizium spp. procedentes de cuatro parroquias del cantón Pastaza, provincia de Pastaza, Ecuador
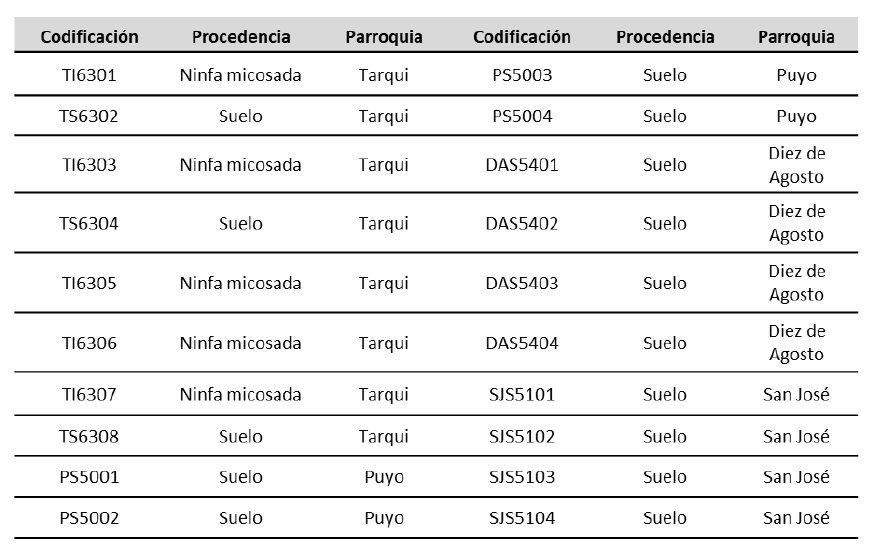
Fuente: Elaboración propia
En el 93,75 % de las muestras de suelo procedentes de cultivo de caña de azúcar se obtuvo la presencia de aislados de Metarhizium spp. Este resultado es similar al reportado por Hernández-Domínguez y Guzmán-Franco (2017), quienes en todas las muestras de suelo con cultivo de caña de azúcar determinaron la presencia de Metarhizium anisopliae. De acuerdo con Schapovaloff et al. (2015), el ambiente del suelo constituye un importante reservorio para una diversidad de hongos entomopatógenos, que pueden contribuir significativamente a la regulación de las poblaciones de insectos. Al realizar el monitoreo de la presencia de M. anisopliae en suelos de cultivo de caña de azúcar, Iwanicki et al. (2019) obtuvieron el 70 % (213 aislados) de aislados del suelo, 23 % (71 aislados) de insectos y 7 % (22 aislados) a partir de las raíces de la caña de azúcar.
Los resultados de esta investigación pudieron estar influidos por las condiciones ambientales presentes en la zona. Erper et al. (2016) señalaron que las lluvias frecuentes y la alta humedad durante todo el año son parámetros ambientales ideales para el desarrollo de hongos entomopatógenos, condiciones que prevalecen en la zona de estudio. Para, Tiago et al. (2012), uno de los factores que influye en la supervivencia del hongo en el suelo es la presencia de insectos en el campo, lo que contribuye a la multiplicación del hongo. Algo similar se pudo evidenciar en nuestro estudio en ninfas de M. andigena micosadas, pero únicamente en la parroquia Tarqui; por lo que se estima que la presencia de plantaciones con mayor densidad de tallos por macolla y de hojas viejas adheridas al tallo, haya generado un microclima húmedo favorable para el desarrollo de epizootias.
Las características morfológicas de los aislados mostraron colonias inicialmente blancas, que al esporular se tornan de color verde, con conidióforos simples o agregados y fiálides en forma de botella. Los conidios son alargados, ovoides a cilíndricos dispuestos en cadenas compactas paralelas, que en masa presentaron color verde olivo (figura 2). Estas características morfológicas coinciden con lo descrito por Humber (2012) y Bischoff et al. (2009), quienes describieron que las colonias del complejo de especies de M. anisopliae son inicialmente blancas, amarillas durante el desarrollo temprano de los conidios (típicamente de 4-7 días) y verdes con la maduración de los conidios (10-14 días). Driver et al. (2000) señalaron que los aislados de M. anisopliae generalmente tienen conidios cilíndricos verdes, de 5 ± 7 µm de largo, que se forman en columnas de cadenas, similar a lo presentado en cada uno de los aislados de este estudio, lo que permitió clasificar a todos los aislados dentro del complejo de especies de M. anisopliae. Hernández-Domínguez et al. (2016) solo encontraron a M. anisopliae infectando salivazos en varias de las plantaciones de caña de azúcar muestreadas en todo México.
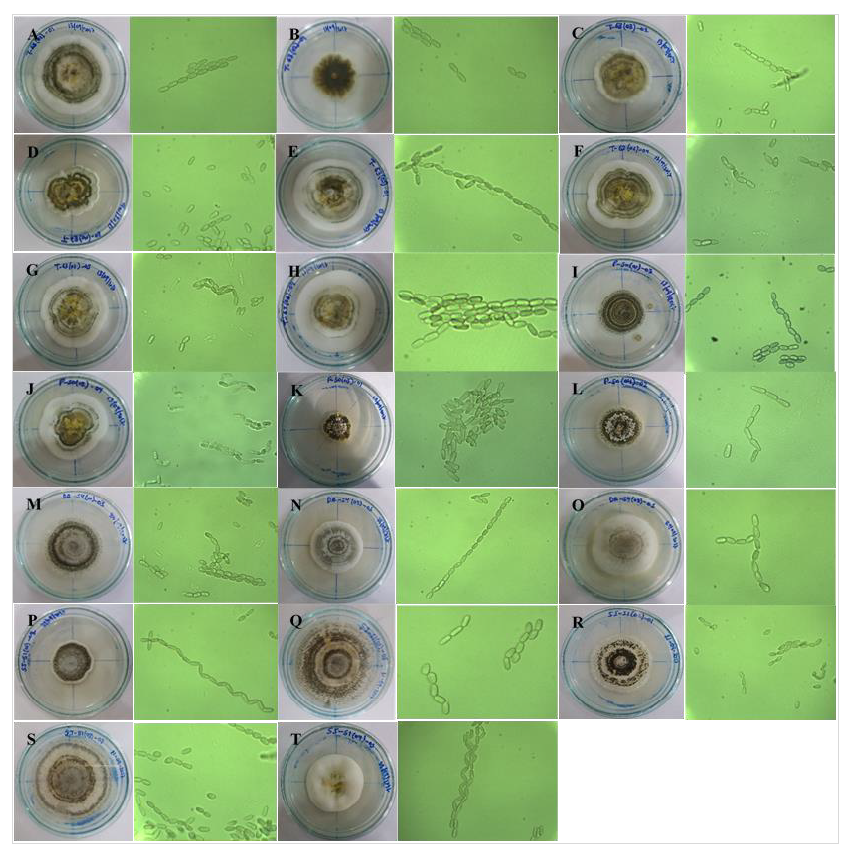
Fotos: Segundo Valle-Ramírez
Figura 2. Características fenotípicas de las colonias y morfología de los conidios de cada aislado nativo de Metarhizium spp. A. TI6301, B. TS6302, C. TI6303, D. TS6304, E. TI6305, F. TI6306, G. TI6307, H. TS6308, I. PS5001, J. PS5002, K. PS5003, L. PS5004, M. DAS5401, N. DAS5402, O. DAS5403, P. DAS5404, Q. SJS5101, R. SJS5102, S. SJS5103, y T. SJS5104.
Los aislados obtenidos presentaron diferencias en el diámetro de la colonia, la tasa de crecimiento, las dimensiones de las estructuras reproductivas y el porcentaje de germinación de los conidios (tabla 2). Las colonias presentaron un crecimiento moderadamente rápido; el aislado DAS5401 alcanzó un diámetro promedio de 67,4 mm a los 20 días de incubación y presentó el mayor diámetro (p< 0,0001) de la colonia, que no difirió significativamente (p > 0,05) de los aislados SJS5103 (62,9 mm), DAS5403 (58,5 mm) y TS6302 (57,4 mm). La diferencia en la tasa de crecimiento fue altamente significativa, al comparar los distintos aislados (p< 0,0001), donde se destacaron el DAS5401 (2,99 mm/día), SJS5103 (2,90 mm/día), DAS5403 (2,68 mm/día) y TS6302 (2,62 mm/día).
La diferencia en el largo y el ancho de los conidios entre los diferentes aislados fúngicos fue altamente significativa (largo p < 0,0001; ancho p < 0,0001). Los más largos se obtuvieron para TS6304 y PS5004, y los más anchos TI6301, PS5001 y DAS5403.
La diferencia en el porcentaje de germinación de los conidios fue altamente significativa (p < 0,0001), con valores superiores al 90 %, excepto en los aislados TI6303 (89,6 %), PS5001 (88,6 %), DAS5403 (88,8 %) y DAS5404 (89,4 %).
Tabla 2. Características de los aislados nativos de Metarhizium spp. obtenidos de muestras de suelos y ninfas de M. andigena de cultivos de caña de azúcar del cantón Pastaza
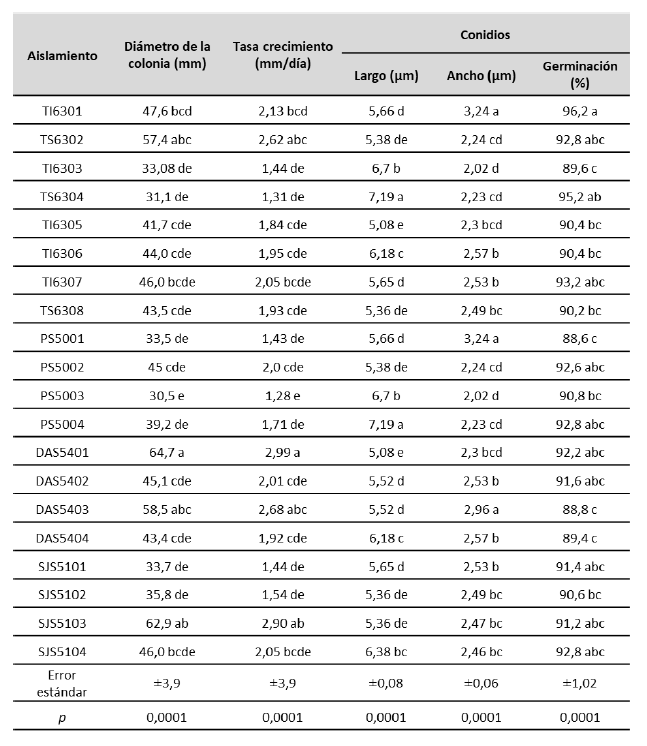
Nota:Letras iguales dentro de las columnas indican que no se presentaron diferencias significativas, según la prueba de Tukey (p < 0,05)
Fuente: Elaboración propia
El desarrollo del micelio es una característica importante para la selección y multiplicación de hongos entomopatógenos (Ekesi et al., 1999). Al respecto, Ummidi et al. (2013) informaron que las cepas más virulentas de Metarhizium presentaron un crecimiento rápido en comparación con las menos virulentas.
Los valores de la tasa de crecimiento obtenidos en el presente estudio son ligeramente superiores a los reportados por García-Gutiérrez et al. (2020), quienes al evaluar el crecimiento radial de diferentes hongos entomopatógenos incluido M. anisopliae registraron una tasa de crecimiento de 2,62 ± 0,08 mm/día.
El tamaño de los conidios de los aislados evaluados, fue de 5,08 a 7,19 µm de largo y de 2,02 a 3,24 µm de ancho, los cuales se enmarcan dentro del rango de los valores de 5,92 (2,77-7,59) × 2,7 (2,03-3,70) µm y 9,22 (7,77-10.93) × 5, 40 (3,88-7,40) µm, reportados para M. anisopliae por Driver et al. (2000), Fernandes et al. (2010) y Humber (2012).
La tasa de germinación permite seleccionar una cepa eficiente y su posterior aplicación en el control biológico (Faria et al., 2015). Vélez et al. (1997) señalaron que uno de los parámetros de calidad de los bioplaguicidas es una germinación del 90 % dentro de las 24 horas de incubación, valores que presentaron 16 aislados dentro del mismo periodo de incubación. Torres de la C. et al. (2013) señalaron que a mayor velocidad existe una mayor oportunidad del hongo para infectar al insecto hospedero, sobre todo cuando las condiciones ambientales son adversas. García et al. (2015) plantearon que para garantizar la calidad de un lote de conidios se debe considerar tanto el porcentaje de germinación, como la capacidad de formar una colonia.
La producción de conidios, a 27±1 °C mostró diferencias significativas (p < 0,0001) entre los aislados a 20 días de desarrollo en PDA. Los aislados TI6301 (1,19×108 conidios/mL), TS6302 (1,09×108 conidios/mL), TS6304 (1,07×108 conidios/mL), SJS5101 (1,04×108 conidios/mL), DAS5401 (9,35×107 conidios/mL) y PS5002 (9,20×107 conidios/mL) presentaron mayor producción respecto a los restantes aislados (figura 3).
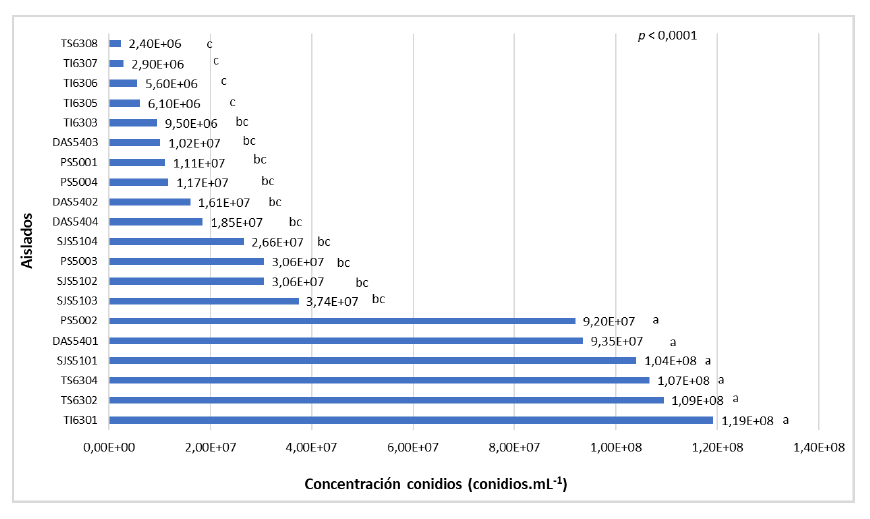
Fuente: Elaboración propia
Figura 3. Concentración de conidios por cada aislado de Metarhizium spp. en medio de cultivo PDA a los 20 días de desarrollo a 27 ± 1°C.Nota: Letras iguales indican que no se presentaron diferencias significativas, según la prueba de Tukey (p < 0,05)
La selección de aislados con buen potencial en cuanto a producción de conidios es un aspecto básico para la producción a escala comercial de hongos entomopatógenos (Castro et al., 2013). En este sentido, García et al. (2012) señalaron que una alta producción de conidios hace más viable su comercialización y reduce los costos de implementación en el campo.
Patogenicidad sobre ninfas de Mahanarva andigena
Se encontraron diferencias significativas (p < 0,0001) para la efectividad patogénica de los aislados de Metarhizium spp. sobre ninfas de M. andigena. Todos los aislados mostraron patogenicidad hacia M. andigena y la mortalidad corregida a los seis días de la aplicación fluctúo de 38,08 % a 97,14%. Los aislados con los mayores valores de mortalidad fueron TI6301 (97,4 %), TS6304 (82,48 %), PS5003 (80,08 %), DAS5401 (69,34 %), SJS5104 (68,76 %) y SJS5102 (63,34 %). El tratamiento químico con tiametoxam provocó el 100 % de mortalidad a las 48 horas de su aplicación.
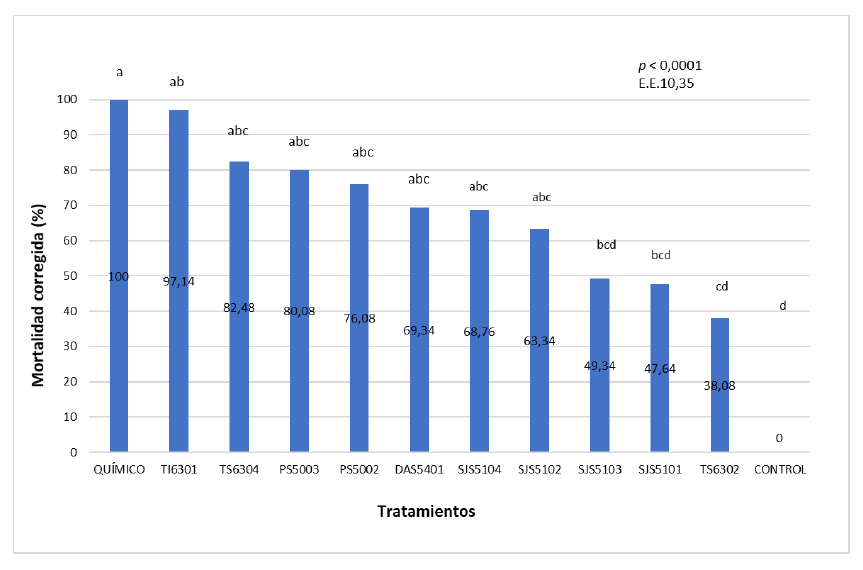
Fuente: Elaboración propia
Figura 4. Mortalidad corregida de los tratamientos a los seis días después de la aplicación sobre ninfas de M. andigenaNota: Letras iguales indican que no se presentaron diferencias significativas, según la prueba de Tukey (p < 0,05)
Los resultados obtenidos con los aislados más patogénicos son superiores a los reportados por Torres de la C. et al. (2013), quienes obtuvieron una efectividad de 31,9 % a 53,6 % al evaluar aislados de M. anisopliae sobre Aeneolamia postica (Walker).
Estos resultados demuestran la importancia de la selección de aislados con base en la patogenicidad debido a su amplia variación entre cepas. El desarrollo de plaguicidas biológicos basados en hongos entomopatógenos requiere seleccionar los aislados más eficaces, que puedan jugar un papel importante en la regulación de la plaga (Barrios et al., 2016).
Por otra parte, es recomendable el uso de aislados nativos en programas de control biológico, ya que pueden tener un reducido riesgo de impacto significativo en organismos no objetivo, en comparación con los aislados exóticos; además, pueden adaptarse al hábitat y los tipos de suelo donde se encuentran, lo cual aumenta las posibilidades de éxito en el control de los insectos plaga (Gürlek et al., 2018). En este contexto, los aislados obtenidos en este estudio son potenciales candidatos para el control de M. andigena en plantaciones de caña de azúcar en Pastaza y pueden validarse en otras condiciones agroclimáticas.
Conclusiones
Los 20 aislados monospóricos de Metarhizium spp., obtenidos de muestras de suelo y a partir de insectos micosados en fincas con caña de azúcar en Pastaza, mostraron variabilidad en cuanto a diámetro de la colonia, tasa de crecimiento, largo y ancho de conidios, germinación y producción de conidios. Siete de los diez aislados evaluados contra ninfas de M. andigena en condiciones de laboratorio mostraron alta patogenicidad, y se seleccionaron como agentes que podrían utilizarse en futuros programas de control biológico de M. andigena en condiciones de campo de la provincia de Pastaza.