Introducción
La familia de angiospermas Orchidaceae posee un gran número de especies, muchas de ellas con un gran potencial ornamental debido a sus atractivas flores, generalmente exuberantes y con una gran variedad de tamaños y colores (Pabst & Dungs, 1975). Existen entre 800 y 850 géneros y entre 20.000 y 25.000 especies, con excepción de los híbridos artificiales que se distribuyen por todo el mundo (Chug et al., 2009; Souza et al., 2008; Arditti & Ernst, 1992). Además, existen especies que son muy apreciadas por su aroma y son utilizadas en la industria (Faria, 2012, citado por Sampaio et al., 2016), entre los géneros más destacados en la economía mundial se encuentra el Phalaenopsis (Hew, 1994; Laws, 1995, citado por Sampaio et al., 2016).
Las especies de orquídeas se encuentran distribuidas por todo el mundo, desde los trópicos hasta las altas montañas y exhiben una increíble gama de diversidad en tamaño, forma y color de sus flores. Aunque las orquídeas se cultivan principalmente como plantas ornamentales, muchas se utilizan también como hierbas medicinales, alimentos y aún otras tienen valor cultural en diferentes partes del mundo (Pant, 2013).
El cultivo de orquídeas es una actividad con alto valor económico, constituyendo una industria multimillonaria (Hew 1994; Laws 1995, citado por Sampaio et al., 2016; Teixeira, 2013). Comercialmente, la producción y la multiplicación a gran escala de híbridos de orquídeas, mediante el uso del cultivo de tejidos, ayudaron a las orquídeas a clasificarse entre las 10 mejores flores cortadas. Actualmente, cultivar orquídeas, más que un simple pasatiempo, es un negocio internacional que cubre alrededor del 8% de la floricultura comercial y tiene el potencial de influir en la situación económica de los países productores. En Brasil, por ejemplo, existen alrededor de 200 géneros y 2500 especies de orquídeas, lo que corresponde aproximadamente al 10% del total de especies en el mundo (Souza et al., 2008; Rotor, 1949), habiéndose consolidado como una importante actividad económica en varias regiones del país (Reis, 2011, citado por Sampaio et al., 2016).
Con el auge en la explotación comercial de las orquídeas, muchas especies enfrentan un peligro extremo de extinción debido a la sobreexplotación y la pérdida de hábitat. La continua pérdida de hábitat para las orquídeas nativas, por ejemplo, en Colombia, y las limitaciones de la germinación en la naturaleza, han llevado a un mayor énfasis en su conservación (Seeni & Latha, 1992). Con el advenimiento de la biotecnología, las plantas más importantes pueden ser clonadas por cultivo de tejidos (Griesbach, 2003; Saiprasad et al., 2004). El cultivo de tejidos vegetales es una de las herramientas alternativas más adecuadas para minimizar la presión sobre la población natural de orquídeas y su uso sostenible (Pant, 2013).
Comercialmente, uno de los géneros de mayor importancia es Epidendrum, el cual tiene aproximadamente mil especies, distribuidas desde el sur de Estados Unidos hasta Argentina (Rasmussen, 1985), con 107 especies representadas en Brasil (Pabst & Dungs, 1975). Sus características distintivas son tallos largos, erectos y delgados, raramente adormecidos en pseudobulbos; las hojas son generalmente distales, los márgenes ventrales del ginostemio coalescen con la unguícula del labelo y el rostelo hendido (Pedroza, 2009), además, todas se pueden cultivar dentro de las casas. Epidendrum obrienianum Rolfe, E. radicans Pav. ex Lindl. y E. Boundii (= E. burtonii × E. radicans) son plantas excelentes para cubrir los extremos de las casas y las paredes traseras.
Minamiguchi & Machado (2007, citados por Sampaio et al. 2016) mencionaron que las orquídeas importantes son monopodiales, con hojas alternas y siempre terminando en meristema vegetativo, cuya propagación vegetativa es lenta, ya que no es común la formación de brotes laterales. Además, el uso del ápice del tallo en la propagación in vitro es extremadamente nocivo para la planta, ocasionando muchas veces su muerte. Por ello, es necesaria la inducción de la morfogénesis mediante cortes vegetativos para evitar la muerte de la planta madre.
Según Bhattacharyya et al. (2016), las bajas tasas de multiplicación de brotes, la inestabilidad clonal, la baja frecuencia de enraizamiento y el alto costo de producción son los principales impedimentos que desafían la micropropagación de orquídeas, por lo tanto, el cultivo in vitro es una herramienta alternativa para la conservación de especies en peligro de extinción (Salazar & Cancino, 2012: Chugh et al., 2009). Se debe tener en cuenta que la micropropagación hace de la multiplicación de orquídeas una alternativa económicamente viable e importante, ya que logra compatibilizar la conservación de las especies con la comercialización y la preservación del medioambiente. Esta tecnología se utiliza en estudios de fisiología vegetal, nutrición mineral, limpieza clonal y fitopatología, criopreservación, producción de metabolitos secundarios, mejoramiento genético y propagación in vitro (Arditti & Ernst, 1992; Buffa et al., 2002; Erig & Schuch, 2005; Souza & Junghans, 2006; Tombolato & Costa, 1998).
Para la multiplicación de las orquídeas, se utilizan medios basales como Murashige and Skoog (ms), Meyer (m) y Phytamax (pm), suplementados con jugo de piña, agua de coco, peptona, y benzilaminopurina (bap) (Mitra, 1987). Mediante el uso de estos medios, diversos autores han logrado la regeneración de plantas en niveles que van del 22% al 100% (Hossain et al., 2010; Salazar & Cancino, 2012). En cuanto a la multiplicación existen numerosos estudios: para Oncidium “Sugar Sweet”, en el que Yang et al. (2010) lograron con éxito la brotación y el enraizamiento, mientras que, para la orquídea híbrida, Arditti and Ernst (1992) desarrollaron un sistema de micropropagación a partir de secciones delgadas de brotes en el medio (Vacin & Went, 1949), suplementado con 20% de agua de coco; con este procedimiento se podrían producir más de 80.000 plantas de un brote en un año.
Para la orquídea endémica en peligro de extinción, Epidendrum elongatum Jacq. (Pedroza, 2009) se logró la propagación en el medio Murashige and Skoog (1962), enriquecido con sacarosa (3%) y mioinositol a 0,1 g/l. Este último estudio describe un protocolo que permite llegar a más de 270.000 plántulas en excelente desarrollo vegetativo en 30 semanas, a partir de una cápsula de esta importante orquídea. Este protocolo, además de ser un modelo para la conservación de especies en peligro de extinción, también permite la propagación a gran escala de E. elongatum (Pedroza, 2009). Otras especies muy importantes en la industria de la flor de orquídea, debido a sus largos periodos de floración y gran tamaño de flor, pertenecen al género Phalaenopsis. En este género, Subramaniam et al. (2009) lograron la regeneración directa de brotes a partir de explantes nodales mediante el uso de sales, al 50%, usando el medio basal MS (Murashige & Skoog, 1962). En este caso, entre las tres citoquininas probadas, BAP produjo el mayor porcentaje de brotes después de ocho semanas de cultivo.
Es claro que la aplicación de biotecnologías para la multiplicación de orquídeas tiene un gran potencial para incrementar las tasas de propagación y conferir una mayor rentabilidad a este tipo de floricultura. Entre estas técnicas se ha escogido la micropropagación con fitorreguladores para su aplicación a la orquídea Epidendrum schomburgkii Lindl., siendo el principal objetivo de esta investigación el evaluar el desarrollo in vitro de plántulas de orquídea del género Epidendrum a diferentes concentraciones de los medios ms y sales de kn. Así, se esperó obtener como producto de la investigación una concentración óptima de los medios de cultivo para el desarrollo de las plántulas.
Materiales y métodos
Material vegetal
Este estudio se adelantó en el Laboratorio de Cultivo de Tejidos de Embrapa-Roraima, ubicado en el municipio de Boa Vista, Brasil. Para ello se obtuvieron semillas sexuales de Epidendrum schomburgkii Lindl., las cuales se germinaron y mantuvieron en medio de cultivo ms (Murashige & Skoog, 1962; Knudson, 1946), suplementado con carbón activado (0,3%), sacarosa (3%) y agar (0,7%). Para la obtención de la semilla, las cápsulas se desinfectaron con una solución acuosa de hipoclorito de sodio (1%) por inmersión durante 15 minutos y, posteriormente, se abrieron bajo flujo de aire estéril y se extrajeron las semillas. Las semillas obtenidas se enjuagaron en una solución alcohólica (50%) y agua estéril y, posteriormente, se sembraron en frascos de vidrio con el medio ms.
Establecimiento de propágulos
De las plantas germinadas se obtuvieron brotes basales de 20 mm de altura, los cuales se sembraron en frascos de vidrio de 320 ml de capacidad que contenían 30 ml del medio nutritivo. En cada frasco se sembraron cuatro brotes, tapando herméticamente cada frasco con cinta tisular de filme transpirable. Las condiciones de crecimiento se mantuvieron constantes a 27 ± 2 °C, con 16 horas de luz y 8 horas de oscuridad, durante 118 días, al final de los cuales se tomaron las variables de crecimiento.
Tratamientos
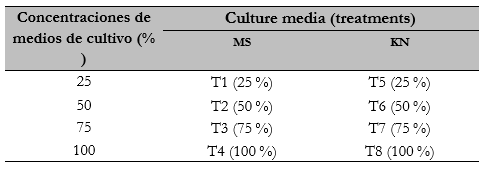
Los tratamientos consistieron en la evaluación del crecimiento de Epidendrum schomburgkii Lindl. bajo condiciones de cultivo de tejidos, utilizando dos sales (ms y kn) a tres concentraciones como medio de cultivo (tabla 1).
Variables estudiadas
El presente estudio se concentró en la evaluación del crecimiento en la fase de establecimiento de plántulas previamente germinadas a partir de semilla sexual de la especie en cuestión. Después de 118 días de cultivo in vitro, se evaluaron las siguientes variables de crecimiento: número de brotes vivos, número de brotes muertos, mayor longitud de raíz y mayor altura del tallo.
Diseño experimental y análisis de datos
El experimento se realizó bajo un diseño completamente aleatorizado (dca) en esquema factorial 2x4, donde el factor A correspondió a los dos medios de cultivo (ms y kn) y el factor B a las cuatro concentraciones de las sales (25%, 50%, 75% y 100% de la concentración original). De lo anterior resultó un experimento con 8 tratamientos, 10 repeticiones y 80 unidades experimentales (la unidad experimental en este caso consistió en los frascos con cuatro propágulos o brotes).
Los datos obtenidos fueron sometidos a cálculos de estadística descriptiva y análisis de varianza, paramétrico y no paramétrico, prueba de medias, análisis de correlación y graficación, con la aplicación de los programas spss, Infostat y Biostat. Para el análisis de varianza se aplicó la prueba de Fisher y la prueba de medias de Duncan, con un nivel de significancia entre 95% y 99% (ᾳ = 0,05 y ᾳ = 0,01). El modelo estadístico utilizado para el análisis fue:
yij = µ + ti + Eij
donde μ = promedio general
ti = efecto del tratamiento
Eij = error experimental
En este ensayo, los niveles del factor B (concentración de sal de cada medio de cultivo) no se cruzan con los niveles del factor A (medio de cultivo), por lo que el factor B se encuentra anidado dentro del factor A.
Resultados y discusión
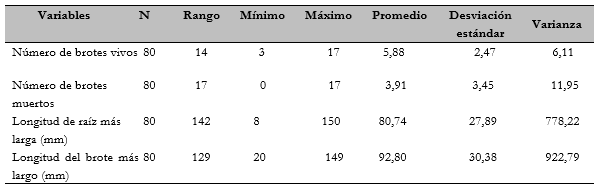
Los valores de dispersión y tendencia central para las cuatro variables en estudio se muestran en la tabla 2.
Tabla 2 Estadística descriptiva de las variables de crecimiento evaluadas
Fuente: Elaboración propia.
El número de brotes vivos varió de 3 a 17 con un promedio de 5,88. A este respecto, en la literatura se encuentra que los estudios que usaron un medio inductor de brotes (Seeni & Latha, 1992), cultivando la base de una hoja de Renanthera imschootiana Rolfe, lograron hasta 40 brotes en el medio Mitra (1987), enriquecido con 10% de agua de coco y 35 g/l-1 de pulpa de plátano maduro. Por otra parte, Bhattacharyya et al. (2016) encontraron que la tasa más alta de proliferación de brotes fue de 21 brotes/explante en medio MS, lo cual representa, hasta la fecha, la mejor frecuencia de inducción de yemas para Dendrobium nobile y una de las más altas reportada entre las orquídeas (Bhattacharyya et al., 2006). Un aspecto del crecimiento de los brotes de Epidendrum schomburgkii Lindl. se muestra en la figura 1.

Fuente: Elaboración propia.
Figura 1 Cultivo in vitro de Epidendrum schomburgkii Lindl 1A Flores en invernadero EmbrapaRoraima 1B Unidad experimental con cuatro brotes basales aislados y 1C Crecimiento después de 118 días en medio de cultivo ms
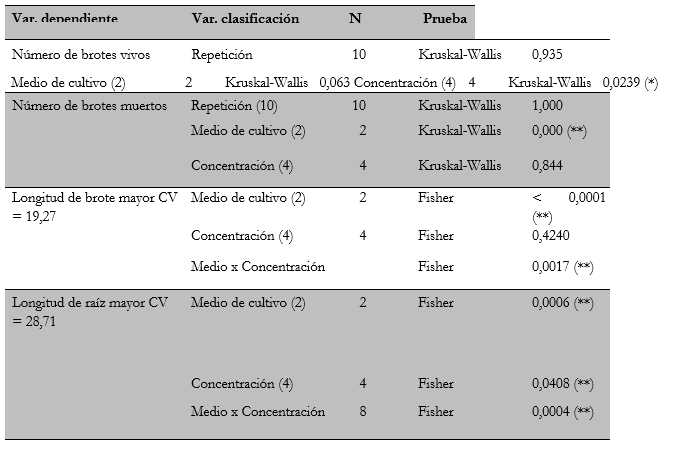
Para los análisis estadísticos, se verificó en primera instancia el cumplimiento de los requisitos del análisis de varianza de Fisher. En la prueba de normalidad (Shapiro & Wilks, 1965), se encontró que la variable “longitud de la raíz” tiene una distribución normal adecuada (W = 0,98, p = 0,7180), mientras que la variable “altura del tallo” requirió de una transformación (Di Rienzo et al., 2012), a partir de lo cual se logró la normalidad (W = 0,96, p = 0,0658). En el caso de las variables de conteo “número de brotes vivos” y “número de brotes muertos”, ninguna mostró una distribución normal aún con las transformaciones realizadas, por lo que para su análisis se aplicó la prueba no paramétrica de Kruskal & Wallis (1952). Los resultados de los análisis estadísticos se muestran en la tabla 3.
Tabla 3 Análisis de varianza y prueba de KruskalWallis para cuatro variables de crecimiento de brotes de Epidendrum schomburgkii Lindl en diferentes concentraciones de sales de ms y kn
(*) y (**) Diferencia estadísticamente significativa.
Fuente: Elaboración propia.
Los resultados de los análisis indicaron que el “número de brotes vivos” no fue afectado por el medio de cultivo, sino por las concentraciones de las sales en el medio. Como se puede observar en la figura 2A, para el medio ms el mayor número de brotes vivos se obtuvo a una concentración de 50%, mientras que para el medio kn los mayores valores se obtuvieron a una concentración del 75%. Con relación al número de brotes muertos, los resultados indicaron un efecto significativo de los medios de cultivo, mas no de las concentraciones, y el menor número de brotes muertos se obtuvo en este caso en el medio de cultivo kn (figura 2B).
En cuanto a la longitud del tallo y de la raíz, se encontraron interacciones significativas entre los medios y las concentraciones, donde la tendencia indica un mayor crecimiento con el uso del medio ms, lo que probablemente refleja mejores condiciones de crecimiento en este medio, sin embargo, al analizar las concentraciones se observa que en el medio ms el mayor crecimiento ocurre a la menor concentración (figuras 2C, D). Por el contrario, en el medio kn para ambas variables la tendencia es positiva a medida que aumenta la concentración del medio. Los anteriores resultados muestran que en el caso de Epidendrum schomburgkii Lindl., el crecimiento tanto de las raíces como del tallo se ve favorecido con el uso del medio de cultivo ms con un nivel óptimo de concentración al 25%. Estos resultados coinciden con lo reportado por Yadollahi et al., 2014), quienes también encontraron una superioridad del medio MS en la multiplicación in vitro de G × N15 (híbrido de almendra × melocotón).
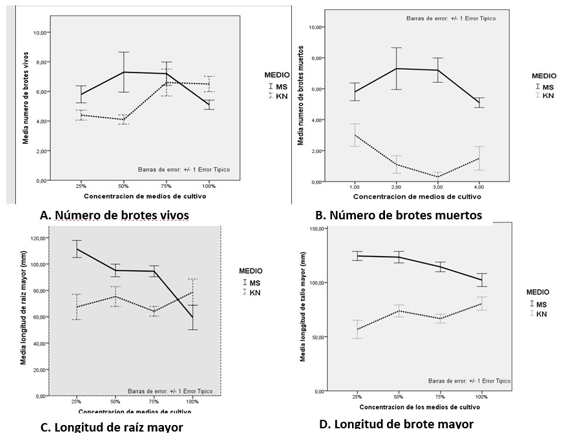
Figura 2 Evaluación de crecimiento de brotes de Epidendrum schomburkii Lindl en diferentes concentraciones de sales de ms y kn con respuesta de A Número de brotes vivos B Número de brotes muertos C Longitud promedio de la raíz mayor y D Longitud promedio del brote mayor
El medio kn tiene una baja concentración de sales y minerales en comparación con el medio MS, por ejemplo, con respecto a P (expresado en mg/l): 61,48 y 360,0; K: 159,4 y 525,6; y Ca: 51,67 y 90,63, respectivamente. Solo en algunos elementos como S, Mn y Na el medio kn contiene niveles más altos: 396,72 y 111,43; 2,61 y 0,1; 215,4 y 173,4, respectivamente (Knudson, 1946; Murashige & Skoog, 1962). Esta diferencia en los niveles nutricionales explica la marcada diferencia en el crecimiento de las plántulas según los medios y las concentraciones. La baja concentración de sal del medio KN fue confirmada por Soares et al. (2009) con el cultivo de Cattleya loddigesii Lindl., quienes encontraron un mayor crecimiento in vitro con 200% de sales. Para Hadrolaelia lobata (Lindl.) Chiron & V.P. Castro × Hadrolaelia purpurata Aco., el medio kn al 200% influyó en el número de hojas y kn al 50% en el número de brotes, pero sin efecto en el crecimiento de la biomasa.
Por su parte, Mercier y Kerbauy (1991) confirmaron una alta relación entre los niveles de nitrógeno (NH4NO3 y urea) y el crecimiento de los protocolos, evidenciada por el aumento significativo en la tasa de crecimiento de los protocolos de E. fulgens. Los contenidos de clorofila y citoquinina endógena también aumentaron con NH4NO3 y (NH4)2SO4; mientras que la posibilidad de sustituir la urea por nitrato de amonio fue estudiada por Ferreira et al. (2012), como una fuente de nitrógeno más económica en el medio de cultivo. Para la propagación de Cattleya bowringiana (O'Brien), Dressler & W.E. Higgins, sustituyeron el nitrato de amonio en las proporciones 0%, 25%, 50%, 75% y 100 % por urea en medio de cultivo de 50% ms. La sustitución total de urea por nitrato de amonio no afectó el número, la altura o la masa fresca de los brotes, pero la sustitución mayor al 25% sí afectó el número y la longitud de las raíces. El reemplazo parcial con 25% de urea se puede utilizar en la propagación in vitro de C. bowringiana.
En general, las respuestas de las orquídeas a los medios nutritivos pueden ser contrastantes, por ejemplo, Stancato et al. (2008) encontraron que las plántulas de la orquídea Laelia longipes Rchb.f., cultivadas con 10:10:10 (npk) + pulpa de banano, presentaron la mayor acumulación de masa y la mínima acumulación correspondió al medio ms para Miltonia spectabilis Lindl. En orden decreciente de acumulación de materia seca total, se encuentran los medios 10:30:20 + pulpa de plátano, seguidos de 10:10:10 + pulpa de tomate, kn (58,3%), Vacin y Went (18,7%), pulpa de manzana (13,2%) y dm (4,1%). Para Laelia tenebrosa [Rolfe] Rolfe, las plántulas cultivadas en el medio con pulpa de plátano incorporaron el mayor contenido de materia seca, seguidas del medio con 10:10:10 (npk), mientras que los otros medios llevaron a una acumulación reducida. Según Bhattacharyya et al. (2016), las bajas tasas de multiplicación de brotes, la inestabilidad clonal, la baja frecuencia de enraizamiento y el alto costo de producción son los principales impedimentos que desafían la micropropagación de orquídeas y otras plantas ornamentales. Estos problemas pueden solucionarse con el uso adecuado de reguladores de crecimiento vegetal (pgr) en el medio.
Con relación a la correlación entre variables, se encontró una correlación positiva y significativa entre el número de brotes vivos, el número de brotes muertos y la longitud del tallo (tabla 4). Lo anterior indica que, a mayor número de brotes vivos, también se incrementa el número de brotes muertos y se obtiene una mayor longitud del tallo. De igual forma, se observó que a medida que se incrementa el número de brotes muertos, también se incrementa la longitud del tallo y de la raíz.
Tabla 4 Correlaciones de cuatro variables en brotes de Epidendrum schomburgkii Lindl en diferentes concentraciones de sales de ms y kn
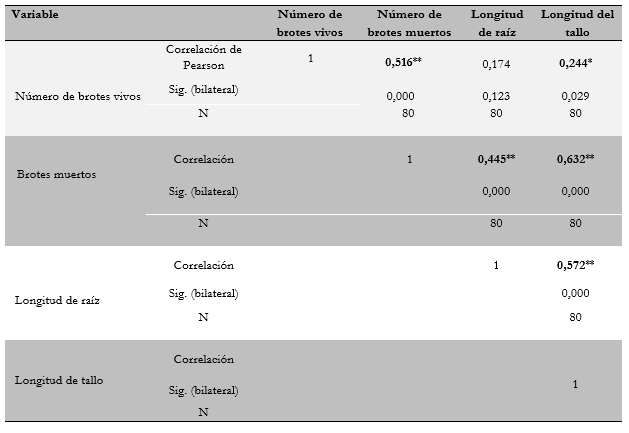
** Correlación significativa a nivel de 0,01 (bilateral) y * correlación significativa a nivel de 0,05 (bilateral).
Fuente: Elaboración propia.
Por otra parte, se encontró que la longitud del tallo se correlaciona positivamente con la longitud de la raíz debido a la correspondencia o simetría natural que se presenta en general en las plantas, entre estas dos variables de crecimiento. La longitud del tallo también corresponde al vigor de la planta y, a su vez, a su capacidad de emitir brotes basales.
La relativa alta proporción de muerte de brotes en este ensayo probablemente tenga que ver con el largo tiempo de cultivo (118 días), lo que ocasionó la escasa disponibilidad de nutrientes con una mayor claridad en el medio ms, debido al mayor crecimiento y, por ende, mayores requerimientos de agua y nutrientes.
Conclusiones
Después de cuatro meses de cultivo in vitro de los propágulos y con base en el análisis de la longitud del tallo y la raíz, se encontró que el medio ms favorece el crecimiento de Epidendrum schomburgkii Lindl., superando al medio kn. En cuanto a las concentraciones de sales, en el medio ms la menor concentración indujo un mayor crecimiento de los brotes, por ello, se recomienda aplicar el medio ms a una concentración del 25% para lograr un crecimiento adecuado de los brotes basales in vitro.
Contribución de los autores
Todos los autores realizaron contribuciones en la escritura y correcciones al manuscrito, en específico cada uno realizó las siguientes contribuciones: Mario Pinedo Panduro: conducción del experimento en laboratorio; Edvan Alves Chagas: elaboración del manuscrito en aspectos generales; Francisco Freitas Luz: aprovisionamiento del material vegetal; Nadia Panduro Tenazoa: identificación taxonómica de la especie; Pollyana Cardoso Chagas: construcción de base de datos; Ricardo Bardales Lozano: elaboración del manuscrito en aspectos específicos, Carlos Abanto Rodríguez: preparación de los medios de cultivo; Elvis Paredes Dávila: evaluación de variables en el laboratorio y Herman Collazos Saldaña: análisis e interpretación estadística.