Introducción
La alimentación de bovinos en el trópico está basada en el pastoreo, sin embargo, la producción de forraje está condicionada a la época del año (Carrera et al., 2014). En el trópico, las condiciones ambientales provocan un rápido crecimiento de pastos, propiciando una alta concentración de pared celular, una baja digestibilidad y la disponibilidad de energía (SánchezSantillán et al., 2021). Además, en la época de sequía, la calidad nutritiva y la disponibilidad de los forrajes es baja (Carrera et al., 2014), esto requiere de estrategias que permitan el desarrollo fisiológico de los becerros durante esta época, ya que el pastoreo se lleva a cabo con ciertas limitaciones nutricionales (Carrera et al., 2014). Una alternativa es la alimentación de becerros mediante una dieta integral, en la cual se puedan incorporar ingredientes de la región para reducir costos, pero sin que se vea afectada la calidad nutritiva.
En el trópico seco se tiene la posibilidad de usar productos regionales como vainas y hojas de leguminosas arbóreas y arbustivas como alternativas para la alimentación de rumiantes, no obstante, es preciso conocer las características fermentativas y su composición bromatológica para establecer ventajas y limitaciones de su uso (García et al., 2006). La M. oleifera es un árbol originario de determinadas regiones de Asia y África, con capacidad de adaptación a territorios de climas calurosos y pluviometrías escasas. Las diferentes estructuras de la planta (hoja, raíz, corteza, flores y vainas) se usan por sus capacidades como antioxidante, antinflamatorio, antimicrobiano y antiséptico (Doménech et al., 2017). González (2013) reportó contenidos de 39,0% de MS, 18,8% de PC, 45,1% de FDN, 24,1% de carbohidratos solubles y 64,7% de digestibilidad in situ de MS, de modo que M. oleifera es una alternativa para la alimentación de rumiantes en el trópico (Folkard & Sutherland, 1996; Meza et al., 2016), mediante su inclusión en dietas integrales o suplementación, porque se recolectan hojas y vainas en la época seca (Folkard & Sutherland, 1996). Por tanto, el objetivo de este estudio fue determinar las características químicas y fermentativas in vitro de vaina y hoja de M. oleifera, con inclusiones de 0%, 10%, 20% y 30% en una dieta integral para becerros de 200 kg de peso vivo. La hipótesis fue que la inclusión de hoja o vaina de M. oleifera en dietas para becerros no modificará la composición química o las características fermentativas in vitro con respecto a una dieta testigo.
Materiales y métodos
El estudio se realizó en el laboratorio de nutrición animal de la Facultad de Medicina Veterinaria y Zootecnia #2 de la Universidad Autónoma de Guerrero, en Cuajinicuilapa, Guerrero, México. Geográficamente, se localiza entre los paralelos 16° 19' y 16° 36' de latitud norte y los meridianos 98° 21' y 98° 44' de longitud oeste.
El presente estudio consistió en dos ensayos: 1) A la hoja y la vaina de M. oleifera se les realizó un análisis químico y fueron evaluadas con la técnica de producción de gas in vitro y 2) se elaboraron dietas integrales para becerros de 200 kg de peso vivo que incluían 10%, 20% o 30% de hoja o vaina de M. oleifera para evaluar sus características fermentativas in vitro.
Muestras
De 10 árboles de moringa, se seleccionaron cuatro ramas al azar en cada árbol y se cosecharon todas las vainas fisiológicamente maduras y las hojas más jóvenes; las hojas y las vainas colectadas se depositaron en bolsas de papel y se trasladaron al laboratorio de nutrición animal para su análisis (Hernández-Morales et al., 2018). La colecta se hizo en la primavera del 2018 en el municipio de Cuajinicuilapa, en Guerrero, México. Las muestras se deshidrataron a 60 °C hasta un peso constante en una estufa (Felisa. FE-293A) y se molieron con una criba de 1 mm en un molino Thomas-Wiley Mill (Thomas Scientific.).
Dietas
Las dietas se elaboraron con ingredientes de la región (tabla 1) y se ajustaron con base en la tasa de crecimiento y la etapa fisiológica para bovinos de 200 kg de peso vivo (NRC, 1996). Las dietas se deshidrataron a 60 °C hasta un peso constante en una estufa y se molieron con una criba de 1 mm en un molino Thomas-Wiley Mill.
Tabla 1 Ingredientes y composición química de dietas para becerros que incluyen cantidades crecientes de hoja o vaina de M oleifera
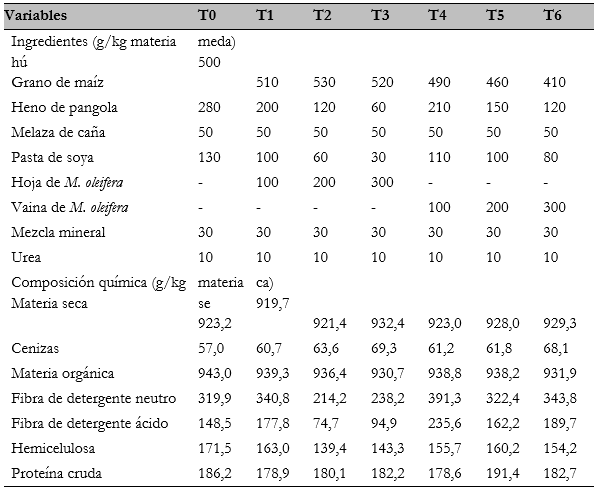
T0 = testigo; T1 = inclusión de 10 % de hoja de M. oleifera; T2 = inclusión de 20 % de hoja de M. oleifera; T3 = inclusión de 30% de hoja de M. oleifera; T4 = inclusión de 10% de vaina de M. oleifera; T5 = inclusión den 20% de vaina M. oleifera; T6 = inclusión de 30% de vaina de M. oleifera.
Fuente: elaboración propia
Análisis químico
A hojas, vainas y dietas se les determinó el contenido de MS (método 930,15) en un crisol a peso constante, donde se agregaron 2 g de muestra y se deshidrataron por 72 h en una estufa a 55 °C. Por su parte, en un crisol a peso constante se agregaron 2 g de muestra y se incineraron en una mufla (Lindberg, 51848) a 600°C por 3 h para cenizas (Ce, método 942,05) y 0,3 g de muestra se sometieron a un proceso de digestión, destilación y titulación en un equipo micro Kjeldahl (Tecnal) (Association of Official Analytic Chemists [AOAC], 1990) para pc (método 920,105).
Además, a 0,5 g de muestra se les determinó fdn y fda con la metodología Ankom ® Technology Method según Van Soest et al. (1991) y lignina detergente ácida (lda) con la metodología AOAC (1990) en un analizador de fibra (Labconco). La hemicelulosa se determinó por diferencia entre fdn y fda y la materia orgánica se obtuvo a restarle 100 el contenido de cenizas.
Producción de gas in vitro
El medio de cultivo contenía 30 ml de fluido ruminal clarificado [líquido ruminal bovino fresco que fue centrifugado durante 10 min. a 12,857 g y esterilizado (All American® 1941X) durante 15 min a 121 °C y 15 psi], 5 ml de solución mineral I [6 g K2HPO4 (J. T. Baker®) en 1 l de agua destilada], 5 ml de solución mineral II [6 g KH2PO4 (J. T. Baker®) + 6 g (NH4)2SO4 (J. T. Baker®) + 12 g NaCl (Meyer®) + 2,45 g MgSO4 (Meyer®) + 1,6 g CaCl-2H2O (Meyer®) en 1 l de agua destilada], 0,1 ml de resazurina al 0,1% (Sigma-Aldrich®), 0,2 g de peptona de soya (MCD Lab®), 0,1 g de extracto de levadura (BD Bioxon®), 4 ml de solución cisteína-sulfido [2,5 g L-cisteína (Sigma-Aldrich®) + 2,5 g de Na2S-9H2O (Meyer®) a pH 10 ajustado con NaOH (2N), [80 g de NaOH (Merck®) y aforado en 100 ml de agua destilada], 5 ml de solución al 8% de Na2CO3 (J. T. Baker®) y 52,6 ml de agua destilada. El medio se esterilizó durante 15 min en autoclave a 121 °C y 15 psi (Sánchez-Santillán et al., 2020).
Los viales trampa para biogás se prepararon colocando una solución salina saturada [350 g de NaCl en 1 l de agua destilada y 5 ml de naranja de metilo (Meyer®) al 0,1%] en viales serológicos de 120 ml. El pH de la solución salina saturada se ajustó a pH 2 con HCl (2N) y un potenciómetro (Hanna® HI2211; calibración pH 7 y 4). Los viales trampa para CH4 se prepararon con solución de NaOH (2N) en 1 l de agua destilada] (Sánchez-Santillán et al., 2020).
Un vial serológico de vidrio (120 ml) con 0,5 g de muestra y 45 ml de medio de cultivo se consideró un biodigestor. Los viales se mantuvieron en condiciones anaeróbicas con CO2, se sellaron herméticamente con un tapón de neopreno (20 mm Ø) y con un arillo de aluminio. Los biodigestores se esterilizaron durante 15 min a 121 °C y 15 psi, y se incubaron por 24 h a 39 °C para verificar su esterilidad en una incubadora (Ecoshel® 9082). Los biodigestores se inocularon con 5 ml de fluido ruminal fresco (se filtró con tres capas de gasa y se centrifugó a 1,257 x g por 3 min) y se incubaron a 39 ˚C por 72 h. La vaca Suiz-Bú canulada se manejó de acuerdo con el reglamento interno de bioética y bienestar de la UAGro con fundamento en la norma oficial (NOM-062-ZOO-1999). La vaca pastó en praderas sin fertilizar de pasto pangola (Digitaria decumbes) con una edad de rebrote de 56 d antes de recolectar el fluido ruminal (Texta et al., 2019).
Los biodigestores se conectaron al vial trampa mediante una manguera de Taygon® (2,38 mm Ø interno y 45 cm de longitud) con agujas hipodérmicas (20 G x 32 mm) en los extremos. En el vial trampa se colocó una aguja (20 G x 32 mm) de manera oblicua como válvula de escape y se colocó invertido sobre una probeta modificada de 50 ml. La producción de biogás o CH4 se cuantificó como desplazamiento de la solución a 24, 48 y 72 h de incubación (Sánchez-Santillán et al., 2020).
Características fermentativas
El pH de los medios de cultivo se determinó a las 72 h de incubación y para el conteo de bacterias totales se usó una micropipeta (Corning®) para extraer 1 ml del medio contenido en el biodigestor con 72 h de incubación en un tubo de ensayo (Pirex®), con 0,25 ml de formaldehido al 10% (Sigma-Aldrich®). La cantidad de bacterias totales se calculó realizando el conteo directo en una cámara Petroff Houser y para el recuento se usó un microscopio óptico (BX31, Olympus) a una magnificación de 1000x (Sánchez-Santillán et al., 2016).
La concentración de nitrógeno amoniacal (N-NH3) se determinó al mezclar 1 ml del medio contenido en el biodigestor con 72 h de incubación con 0,25 ml de ácido metafosfórico al 25% (Meyer®; proporción 4:1) y se centrifugó a 3500x g por 25 min. El sobrenadante se recuperó en viales de 2 ml; 20 µl de este sobrenadante fueron mezclados con 1 ml de solución fenol [10 mg de Na2(NO)Fe(CN)5.H2O (Meyer®) + 10 g de cristales de fenol (Meyer®) aforado en 1 l de agua destilada] y 1 ml de solución hipoclorito [7,5 g de NaOH (Reasol®) + 21,3 g de Na2HPO4 (Meyer®) + 15 ml de hipoclorito (5%; Reasol®) aforado en 1000 ml de agua destilada]. Las muestras se mantuvieron a 37 °C por 30 min en baño maría (Shel Lab®1227), se adicionaron 5 ml de agua destilada para diluir las muestras, se agitaron con un vórtex (Genie 2 G-560) y se midió la absorbancia a 630 nm en un espectrofotómetro UV-VIS (Jenway® 6850) calibrado con un método (r2 = 0,9994) de concentración de nitrógeno amoniacal (McCullough, 1967).
La muestra residual se filtró en bolsas Ankom® a peso constante y las bolsas con muestra se secaron por 24 h a 60 °C en una estufa. La dms se calculó con la formula descrita por HernándezMorales et al. (2018) y Sánchez-Santillán et al. (2015). Las bolsas Ankom® se sellaron con calor y se determinó el contenido de fdn (Van Soest et al., 1991). El porcentaje de degradación de la fdn (% dfdn) se calculó con la formula según Almaraz-Buendía et al. (2019) y Torres-Salado et al. (2019). La energía metabolizable de las dietas experimentales se estimó a partir de la ecuación reportada por Sandoval et al. (2016), em (Mcal kg-1MS) = (2,20 + 0,136GP + 0,057PC) × 0,238846; donde: gp = gas producido por 0,2 g de sustrato en 24 h y pc= contenido de proteína cruda de la muestra.
Análisis estadístico
Las variables de análisis químico y de producción de gas in vitro de las hojas y vainas, así como las variables de producción de gas in vitro de las dietas con inclusión de hasta 30% de hoja o vaina de M. oleifera, se analizaron en un diseño completamente al azar. El procedimiento fue glm (Generalized Linear Models) de SAS (2003) y los promedios se compararon con la prueba de Tukey (P < 0,05).
Resultados y discusión
Caracterización de la hoja y vaina de M. oleifera
El contenido de ms, fdn, fda, lda y mo de la hoja representó 24,8%, 72,9%, 54,5%, 57,2% y 98,2% (P < 0,05) del contenido de la vaina, respectivamente. Además, el contenido de Ce, pc y hemicelulosa de la vaina fue de 86,2%, 55,5% y 71,1% (P < 0,05) respecto al contenido de la hoja (tabla 2). La diferencia entre las hojas y las vainas fue el estado de madurez fisiológico al momento de la recolección, ya que la composición de la pared celular cambia con el proceso de lignificación durante la madurez fisiológica (Hoffman et al., 2007). El contenido en la hoja de pc y mo es similar, mientras fdn y Ce fueron inferiores a lo reportado por Casanova-Lugo et al. (2018) en hoja de M. oleifera (tabla 2). Asimismo, Quintanilla-Medina et al. (2018) publicaron valores similares en pc y mo, y menores en Ce, fdn, fda y hemicelulosa (tabla 2) en hojas de M. oleifera. Además, Díaz-Fuentes et al. (2019) publicaron valores similares de ms en hojas (tabla 2). Melesse et al. (2017) mencionaron que la vaina contiene 10,5%, 17,4%, 45,2%, 46,5% de Ce, pc, fdn, fda, respectivamente, valores similares en Ce, mayores en pc e inferiores en fdn y fda al presente estudio. Las diferencias en el contenido de las hojas o las vainas de M. oleifera se pueden asumir respecto a las condiciones climáticas al momento de la colecta, sitio dentro del árbol de la colecta y época de año de la colecta.
Tabla 2 Composición química y características fermentativas in vitro de la hoja y la vaina de M oleífera
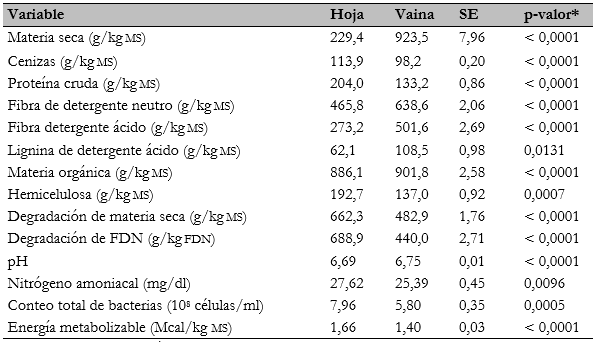
*p-valor de la comparación de medias; ms = materia seca, fdn = fibra de detergente neutro, se = error estándar de la media
Fuente: elaboración propia.
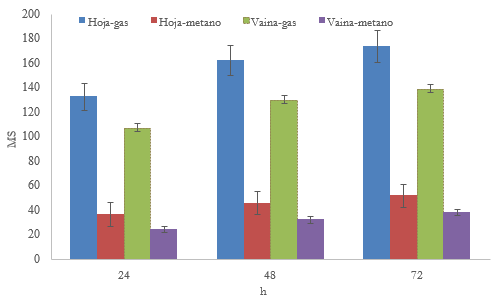
La producción de gas in vitro mostró que la hoja produjo 24%, 30%, 24%, 62% y 25,18% más (P < 0,05) gas que la vaina a las 24, 48 y 72 h de fermentación, respectivamente (figura 1). La producción de gas (CO2 y CH4) es producto de la fermentación de los carbohidratos, de modo que según Texta et al. (2019) y Torres-Salado et al. (2019) en las primeras 24 h se fermentan los carbohidratos no estructurales y a partir de las 24 h se fermentan los carbohidratos estructurales. Valores mayores de gas se reportaron en hojas de Guazuma ulmifolia y Leucaena leucocephala (TorresSalado et al., 2018); así como una menor producción de gas al presente estudio en vainas de Samanea saman Jacq. y Enterolobium cyclocarpum (Torres-Salado et al., 2018).
La hoja produjo 48,00%, 43,75% y 36,84% más de (P < 0,05) CH4 que la vaina de M. oleifera a las 24, 48 y 72 h de fermentación, respectivamente (figura 1). Las diferencias en la producción de CH4 se asumen por las composiciones químicas de la hoja y la vaina (Khang et al., 2019) y los productos de su fermentación (acetato, propionato, butirato, CO2 e H2) (Vanegas et al., 2017; Gang et al., 2020), ya que el CO2 y el H2 son usados por las arqueas metanógenas como estrategia metabólica y producen CH4 como producto final de su ruta metabólica (Torres-Salado et al., 2019).
Fuente: elaboración propia
Figura 1 Volumen máximo de gas y metano (ml/g ms) por la fermentación in vitro de hoja y vaina de M oleifera*Las barras corresponden al error estándar de la media
La hoja presentó un 37,15% y un 56,57% más (P < 0,05) de dms y dfdn que la vaina de M. oleifera (tabla 2) porque contiene un mayor contenido celular y la composición de su pared celular tiene carbohidratos estructurales no lignificados (Ojo et al., 2017). Además, al recolectarse la vaina fisiológicamente madura, la composición de su pared celular fue celulosa y hemicelulosa mezclada con lignina, lo que aumentó la fracción indigestible de la vaina (Luna et al., 2015). La dms y la dfdn de la hoja de M. oleifera (tabla 2) fue mayor a la reportado por Hernández-Morales et al. (2018) en hojas de Guazuma ulmifolia y Leucaena leucocephala, además, la dms de la vaina de M. oleifera (tabla 2) fue menor y la dfdn (tabla 2) fue mayor que las vainas de S. saman . E. cyclocarpum (Hernández-Morales et al., 2018).
El pH del medio del cultivo después de 72 h de fermentación mostró que la vaina fue 0,89% mayor (P < 0,05) que la hoja (tabla 2), mientras que el conteo total de bacterias de la hoja fue 37,24% mayor (P < 0,05) que en la vaina (tabla 2). El conteo total de bacterias se debe a que la hoja posee una mayor disponibilidad de carbohidratos para la fermentación, los mismos que permiten un mayor crecimiento microbiano, lo que produce una mayor cantidad de ácidos como productos de fermentación y que disminuyen el pH del medio del cultivo. La diferencia en la concentración de N-NH3 es por el contenido y la degradabilidad de pc de la hoja o la vaina de M. oleifera (tabla 2), ya que el N-NH3 es el resultado de la degradación de compuestos nitrogenados (Du et al., 2019). El conteo total de bacterias (tabla 2) es inferior a lo publicado por Hernández-Morales et al. (2018) en dos tipos de hoja y cinco vainas de leguminosas arbóreas, incluyendo a M. oleifera (Moringaceae), por lo que la interpretación y la discusión de este apartado da como resultado que la hoja de M. oleifera presente un 18,57% más de (P < 0,05) em que la vaina de M. oleifera.
Caracterización de dietas que incluyen hasta 30% de hoja o vaina de M. oleifera
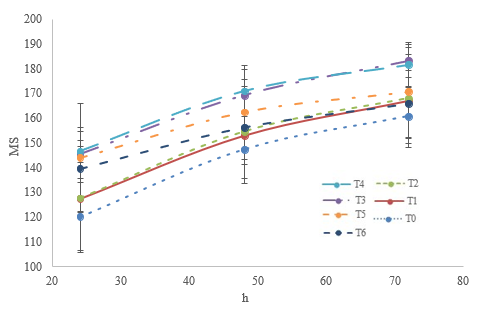
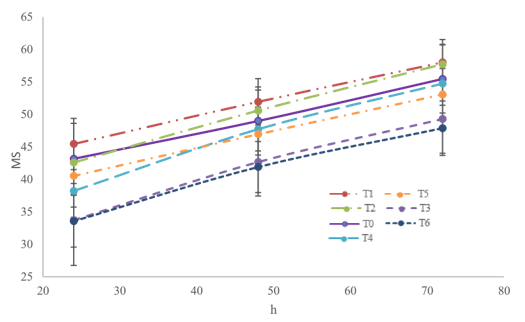
La producción de gas no mostró diferencias (P > 0,05) entre dietas que contenían hoja (T1, T2 y T3) o vaina de M. oleifera(T4, T5 y T6). Asimismo, la dieta con 30% de hoja (T3) y 10% de vaina (T4) produjó más gas (P < 0,05) que la dieta testigo (T1) (figuras 2 y 3), lo que indica que las dietas que contienen 30% de hoja (T3) o 10% de vaina (T4) tienen una mayor disponibilidad de carbohidratos para la fermentación ruminal que la dieta testigo. Soltan et al. (2018) reportaron que la adición de hasta 50 g/kg de corteza de raíz de M. oleifera en una dieta integral para corderos no afecta la producción de gas, discusión similar a la del presente estudio, ya que T0, T1, T2, T5 y T6 no presentaron diferencias (P > 0,05) en la producción de gas (figura 2). Valores superiores de gas al presente estudio fueron reportados en una dieta integral que contenía 10% de hoja de M. oleifera (Elghandour et al., 2017).
Aquellas dietas que contenían una mayor proporción de hoja (T3) o vaina (T6) de M. oleifera mostraron una menor producción (P < 0,05) de CH4 que la dieta testigo (T0) (figura 3). En otras palabras, en la dieta testigo la producción de CH4 representa el 34,52% del total de gas, ocho puntos porcentuales más que la dieta con 30% de hoja (T3) y seis puntos porcentuales más que la dieta con 30% de vaina (T6) (tabla 2). Esto se puede asumir debido al contenido de metabolitos secundarios de M. oleifera que mitigan la emisión de CH4, porque favorecen la síntesis de propionato, afectan la metanogénesis por competencia reducida del hidrógeno, mejoran la eficiencia energética y son tóxicos para los protozoarios ciliados (Sánchez-Santillán et al., 2018; Ku-Vera et al., 2020). Por otra parte, valores inferiores se reportaron en una dieta integral que contenía 50 mg/kg de corteza de M. oleifera (Soltan et al., 2018), así como superiores en una dieta integral con 10% de hoja de M. oleifera (Elghandour et al., 2017).
Fuente: elaboración propia
Figura 2 Volumen máximo de gas (ml/g ms) a las 72 h por la fermentación in vitro de dietas que contienen hasta 30% de hoja o vaina de M oleifera* Las barras corresponden al error estándar de la media
Fuente: elaboración propia
Figura 3 Volumen máximo de metano (ml/g ms) a 72 h por la fermentación in vitro de dietas que contienen hasta 30% de hoja o vaina de M oleífera* Las barras corresponden al error estándar de la media
La dms no mostró diferencias (P > 0,05) entre las dietas que contienen hoja (T1, T2 y T3) o vaina (T4, T5, T6) y el testigo (T0), sin embargo, la dietas con vaina presentaron un menor dms (P < 0,05) que la dieta que contenía 30% hoja de M. oleifera (tabla 3). La dieta con 10% de hoja de M. oleifera mostró mejor dfdn; en contraste, la dieta con 30% de vaina tuvo la menor dfdn (P < 0,05) (tabla 3). Los niveles de degradación se asumen al contenido de fdn, ya que la vaina contiene 37% más que la hoja, lo que interfiere en los niveles de degradación por su composición química (Hoffman et al., 2007). Así, los valores inferiores de dms fueron reportados por Elghandour et al. (2017) en dietas con 10% de hoja de M. oleifera.
El medio de cultivo después de la fermentación mostró que el pH de las dietas que incluían hoja (T1, T2 y T3) no presentaron diferencias (P > 0,05) con el testigo (T0), mientras que las dietas que incluyeron vaina (T4, T5 y T6) presentaron el mayor valor de pH (tabla 3), esto se debe a los ácidos grasos producidos durante la degradación de la ms, ya que a mayor dms, mayor es la producción de ácidos grasos, los cuales disminuyen el valor de pH (Sánchez-Santillán & CobosPeralta, 2016). Por su parte, la concentración de N-NH3 no mostró diferencias entre dietas (tabla 3) (p > 0,05), indicando que las fracciones nitrogenadas de las dietas no fueron diferentes (Texta et al., 2019) porque en el presente estudio se realizaron las dietas isoproteicas, además, los niveles se encuentran dentro del rango para que las bacterias alcancen la máxima tasa de digestibilidad de la ms (Mehrez et al., 1977) y estos valores se reflejaron en el conteo de bacterias, ya que se reportaron 109 células/ml (tabla 3), valores superiores a los recuentos reportados en condiciones in vitro (Hernández-Morales et al., 2018; Sánchez-Santillán et al., 2016). Los valores de em entre dietas no mostraron diferencias (P > 0,05), promediando 1,66 Mcal/kg ms (tabla 3), lo que aporta el 83% de lo demandado por los becerros de 200 kg de peso vivo (NRC, 1996).
Tabla 3 Características fermentativas in vitro de dietas que incluyen hasta 30% de hoja o vaina de M oleifera
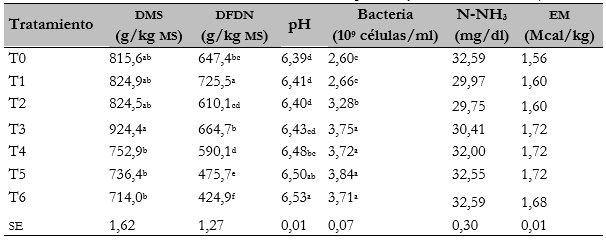
a,b,c,dMedias en la misma columna sin una letra común son diferentes a P < 0,05.T0 = testigo; T1 = inclusión de 10 % de hoja de M. oleifera; T2 = inclusión de 20 % de hoja de M. oleifera; T3 = inclusión de 30 % de hoja de M. oleifera; T4 = inclusión de 10 % de vaina de M. oleifera; T5 = inclusión de 20 % de vaina de M. oleifera; T6 = inclusión de 30 % de vaina de M. oleifera; dms = degradación de la materia seca; dfdn = degradación de la fibra de detergente neutro; pH = potencial de hidrógeno; bacteria = conteo total de bacterias; N-NH3 = nitrógeno amoniacal; em = energía metabolizable y se = error estándar de la media.
Fuente: elaboración propia
Conclusiones
La hoja de M. oleifera contiene una mayor cantidad de carbohidratos fermentables que la vaina de M. oleifera con base en el ensayo in vitro. Además, la inclusión de hasta 30% de su hoja o 10% de su vaina en una dieta integral para becerros no reducen las características fermentativas in vitro, esto comparado con una dieta testigo.
Contribución de los autores
Paulino Sánchez-Santillán: supervisión de la realización del experimento y redacción del artículo; Conchita Rivera-Cristobal: realización de la parte experimental; Nicolás Torre-Salado: análisis estadísticos y redacción del artículo; Issac Almaraz-Buendía: apoyo en la redacción e interpretación de los resultados; Jerónimo Herrera-Pérez: redacción del artículo y desarrollo metodológico de la investigación.














