Introducción
A nivel mundial, la mayor productividad condujo al aumento de la producción de tomate (Solanum lycopesicum), con una dinámica mayor registrada en China e India que, en conjunto con Estados Unidos, produjeron un 50 % de la producción mundial de fruto fresco en 2014; México solo produjo un 2 % y ocupó el décimo lugar (HORTOInfo, 2017).
Recientemente, México contrajo un 0,7 % en la producción del 2018 con respecto al año anterior, que fue de 3,45 millones de toneladas (Fideicomisos Instituidos en Relación con la Agricultura [FIRA], 2019). Entre otros elementos, la insuficiencia de agua, un material genético inadecuado, los eventos biológicos, la disminución de la superficie de cultivo o las condiciones ambientales erráticas características de México, provocaron incertidumbre para el cultivo de tomate y hortalizas. A esto se suma el problema del origen de la semilla de tomate que en su mayor parte es importada: el 95 % de la producción mundial se origina en Estados Unidos, Francia y Holanda (Rodríguez et al., 2001).
El cultivo de tomate en invernadero es un sistema de producción que facilita la atención técnica, garantiza la calidad del producto y genera beneficios importantes (Cadahía, 2000). Así, el productor prefiere cultivar tomate en invernadero, a pesar de los costos altos destinados a la compra de semilla o la dificultad para adquirir la plántula (caso más frecuente), pero demanda una solución nutritiva y un sustrato para favorecer la disponibilidad de nutrimentos por etapa de crecimiento de la planta (Vargas-Tapia et al., 2008).
La productividad y la calidad del fruto del tomate en invernadero ha sido resuelta con el empleo de la solución nutritiva (Arnon & Hoagland, 1940), sin embargo, la producción de semilla de tomate bajo este sistema de producción obedecería a un paquete tecnológico. La solución nutritiva Steiner (Steiner, 1961) fue diseñada para la producción comercial de frutos de tomate, sin embargo, su adopción en la producción de semilla en invernadero requiere el desarrollo de pruebas para garantizar la calidad de esta.
La información técnica sobre producción de semilla de tomate en México es escasa y está resguardada por empresas trasnacionales, debido a ello, las cifras estadísticas existentes sobre semillas son imprecisas. Algunos sistemas de producción de tomate en invernadero producen su propia semilla, la cual se estima en 39 kg ha-1 (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2015). Otra práctica requerida es el mejoramiento genético, el cual permitiría generar, producir y liberar semilla nacional conforme a condiciones locales y reducir el costo de producción de tomate (Ramos et al., 2006).
La calidad de la semilla para siembra está determinada por procesos fisiológicos de las plantas como embriogénesis, crecimiento, resistencia a estrés y transición de semilla a plántula autotrófica (Ouyang et al., 2002; Spanò et al., 2007). Dicha calidad se adquiere durante el desarrollo y la maduración de la semilla, pero puede ser drásticamente afectada por la interacción del material genético y las condiciones ambientales prevalecientes como parte del proceso de adaptación (Huang et al., 2010). Así, la calidad de la semilla comprende diversos atributos como germinación, latencia, vigor de semilla y plántula, uniformidad de tamaño, morfología del embrión y plántula, almacenamiento, ausencia de daño mecánico y capacidad para desarrollar una planta normal y vigorosa (Angelovici et al., 2010; El-Kassaby et al., 2008; Finch-Savage & Leubner-Metzger, 2006).
La germinación estándar y el vigor, como factores que influyen en la calidad fisiológica potencial, gobiernan la capacidad teórica de la semilla para expresar sus funciones vitales bajo condiciones ambientales favorables y desfavorables, como temperatura, aspectos edáficos y sanitarios, disponibilidad de agua y prácticas de manejo (Marcos-Filho, 2015). La germinación es el porcentaje final de semillas que logró el crecimiento intraseminal en condiciones experimentales, lo cual se mide por la emergencia del embrión vivo (Labouriau, 1983) y se emplea para seleccionar las variedades de plantas que se adaptan a diversas condiciones (Ahmed et al., 2019). En cambio, la prueba de vigor permite descifrar las diferencias fisiológicas existentes entre lotes de semillas comerciales con respuesta homogénea en la germinación y garantizar su función durante el almacenamiento o después de la siembra (Marcos- Filho, 2015). El éxito de la germinación, el crecimiento y el rendimiento final dependen en gran medida de la calidad de la semilla para la siembra.
Por otro lado, la incorporación de sustratos modificó para bien el sistema de producción en hidroponía, pero la diversidad de fuentes enfrenta problemas que merecen atención. Además, la caracterización del sustrato por sus propiedades físicas, químicas y biológicas es importante para el manejo de la planta (Castellanos, 2004).
Por su origen y abundancia natural en México, el tezontle (mineral volcánico) se utiliza en la producción hidropónica, pero en la producción de semilla de tomate se desconoce su respuesta. Como sustrato, al tezontle se le fragmenta hasta alcanzar un tamaño granulométrico (Vargas-Tapia et al., 2008) según el cultivo. Por su parte, la fibra de coco como sustrato tiende a adquirir una mayor cobertura, pero se recomienda lavarla antes de emplearla por su contenido de sodio y cloruros que alteran el potencial osmótico de la solución nutritiva (Abad et al., 2002); además, se desconocen los resultados que tendría en la producción de semillas en invernadero. Mientras la producción de tomate comercial en invernaderos de México se fortalece con investigación y pruebas comerciales, la producción de semilla no tiene herramientas suficientes para competir con la semilla importada, por lo que el productor invierte grandes recursos al adquirirla. En cambio, el conocimiento actual sobre la solución nutritiva Steiner y el sustrato de crecimiento para producción comercial de fruto, podría ser aprovechado e integrado a la producción de semilla de tomate en invernadero. Con base en lo anterior, este estudio tuvo como objetivo evaluar el efecto de la solución nutritiva Steiner (normal y modificada) y sustrato de crecimiento en la calidad física y fisiológica de semilla de tomate, bajo la hipótesis de que la producción de semilla de tomate, integrada a un sistema intensivo como el invernadero, permite el manejo eficiente de la solución nutritiva y el sustrato de crecimiento para el mejoramiento de la calidad de semilla.
Materiales y métodos
El experimento se realizó en el invernadero en Celaya, Guanajuato, México, en el periodo de marzo a julio del 2018, situado a 20º 34’ N y 100º 49’ O y 1750 m s.n.m.. El invernadero es tipo túnel, semiautomatizado, con estructura metálica y cubierta plástica, tiene malla antiáfidos en las paredes laterales, tiene ventanas cenitales y suelo descubierto.
Los factores estudiados fueron: a) solución nutritiva Steiner [normal (100 %) y modificada al diluirla (-50 % y -25 %) o concentrarla (+25 % y +50 %)] y; b) sustrato: tezontle rojo y fibra de coco. Las partículas de tezontle tenían 5 mm de diámetro y mostraron un pH casi neutro (7,1), conductividad eléctrica (CE) de 0,16 dS m-1, densidad aparente de 0,85 g cm3, densidad real de 2,63 g cm3 y 57 % de retención de agua. La fibra de coco contiene celulosa (entre 20 % y 30 %), hemicelulosa y lignina (Cruz-Crespo et al., 2013). La fibra de coco de los contenedores slabs o “bolis” presentó las siguientes características: pH de 6,3 a 6,7; conductividad eléctrica de 1,0 a 1,8 dS m-1; densidad aparente de 2,94 g cm-3; 38 % de aireación y 48 % de retención de agua. Ambos valores de CE se consideraron como adecuados en la solución nutritiva.
Los sustratos se desinfestaron con 1 cm3 de Bushan 30W por litro de agua (341 g de i. a. tiocianometiltio benzotiazol), en un riego de pre-plantación. El análisis químico del agua de riego registró 0,23, 0,5, 0,35, 5,1, 0,8 mmol L-1 de NO3, SO4 2- , K+, Ca2+, Mg2+, respectivamente; pH de 6,69 y CE de 0,63 mS cm-1, los cuales se descontaron a la solución nutritiva, elaborada con las fuentes fertilizantes grado comercial: Ca(NO3)2.4H2O, KNO3, MgSO4.7H2O, Mg(NO3)2.6H2O, H2SO4, H3PO4, H3BO3, MnSO4.H2O, ZnSO4.7H2O, CuSO4.5H2O y Fe-EDTA.
La variedad de tomate Cid (Harris Moran®) utilizada es tipo Saladette, hábito indeterminado y vida útil media de cuatro a cinco semanas, es precoz y forma frutos de grandes a extragrandes. Las plántulas de tomate de 30 días de edad (dde), con altura entre 0,20 y 0,25 m, fueron trasplantadas con tezontle contenido en bolsas plásticas/vivero, color negro, de 21 x 13 x 12 cm para 12,5 kg (0,0125 m3) de tezontle y la fibra de coco envasada en contenedores de 100 x 20 x 17 cm (4 kg de fibra).
La combinación de factores formó 10 tratamientos, distribuidos bajo el esquema de un diseño experimental completamente aleatorizado y repetido cuatro veces. La unidad experimental fue de 12 plantas, estableciendo 3,3 plantas/m2 en hileras separadas de 1,40 m, es decir, una planta por bolsa/vivero y tres plantas por contenedor. La solución nutrimental se suministró en el sistema de riego por goteo (4 l h-1), tres veces al día por 15 minutos; el tiempo de riego aumentó hasta 20 minutos con el crecimiento de la planta. El sistema de riego fue abierto, es decir, sin recuperación de solución nutritiva y la temperatura registrada en el invernadero varió entre 30,8 y 38,4 °C durante el ensayo, de marzo a julio, situación que motivó la frecuencia y la duración del riego por goteo indicados.
El manejo del cultivo consistió en la poda de hojas, el tutoreo y el desbrote semanal. El raleo de hasta cuatro frutos se practicó para uniformizar su tamaño en el racimo e inició 47 días después del trasplante (ddt). La polinización matutina se realizó dos veces por semana con aire a presión dirigido a las plantas. Luego, en el laboratorio se llevó a cabo la selección de los frutos cosechados por su coloración rosado/rojo, específicamente la escala 5 (de 6) establecida por la carta de colores de The California Tomato Board [CTB] (1975): los carotenos logran la mayor concentración antes de la maduración completa y el licopeno (rojo) y el β-caroteno (naranja) alcanzan sus respectivos picos (López & Gómez, 2004). Los frutos fueron obtenidos del segundo al sexto corte, cuando la planta tenía 72, 86, 97, 108 y 120 ddt (el ciclo productivo del cultivo se mantuvo hasta 150 ddt). Los frutos se cortaron ecuatorialmente para extraer la pulpa que fermentó por 48 h en bolsas de polietileno con cierre parcial, después se lavaron con agua destilada estéril y la semilla extraída se secó sobre papel de estraza por 48 h, a temperatura ambiente de laboratorio (22 ºC).
En la semilla de tomate se evaluó la calidad física y fisiológica (International Seeds Testing Association [ISTA], 2015). El peso se obtuvo de tres repeticiones de 100 semillas en una báscula electrónica (AND, modelo HM-300), mientras que en la prueba de germinación estándar se emplearon tres repeticiones de 50 semillas. Estas fueron colocadas sobre papel filtro dentro de cajas Petri de 90 x 15 mm e introducidas en la cámara de germinación (Conviron, modelo TC-16) a 25 ºC y 16/8 h de luz/oscuridad. Los recuentos de semilla germinada se realizaron a los cinco y catorce días después de la siembra.
Los datos de las variables dependientes, peso de 100 semillas y germinación estándar de las semillas extraídas de frutos en las distintas etapas de crecimiento de tomate, así como su interacción, fueron sometidos a un análisis de varianza y una prueba de comparación de medias con Tukey (α ≤ 0,05) mediante el paquete estadístico Statistical Analysis System [SAS] (2002), para su validación estadística.
Resultados y discusión
Peso de semilla
Los resultados del análisis de varianza mostraron diferencias significativas (p ≤ 0,05) en el peso de semilla de tomate ante la solución nutritiva Steiner normal o modificada, diferencias que ocurrieron a 97, 108 y 120 días después del trasplante (ddt). El sustrato de crecimiento solo modificó estadísticamente la semilla proveniente del corte realizado a los 97 ddt (tabla 1). El coeficiente de variación (CV) fue de 3,02 % a 6,9 %, valores considerados bajos y de alta confiabilidad para el ensayo (Noriega-Carmona et al., 2019).
Tabla 1. Cuadrados medios del análisis de varianza para peso de semilla de diferentes fechas de corte de fruto de tomate (ddt) en Celaya, Guanajuato, México
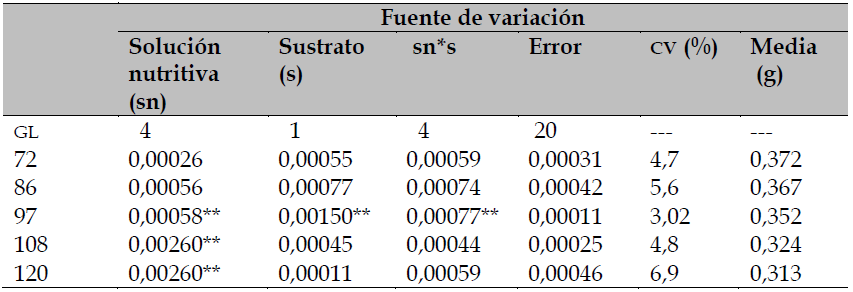
** significativo al 0,01 de probabilidad; GL: grados de Libertad; CV: coeficiente de variación; sn: solución nutritiva; s: sustrato; sn*s: interacción y g: gramos.
Fuente: Elaboración propia
También se observó que el primer corte de frutos produce semillas de mayor peso y el estado de madurez avanzado de la planta indujo la pérdida gradual de peso y calidad fisiológica de la semilla (tablas 1 y 2), como posible disminución de la translocación de nutrimentos y fotoasimilados demandados por la parte aérea de la planta envejecida (Werf, 1996). Por lo tanto, los resultados demuestran que los requerimientos nutricionales de la planta y las semillas formadas fueron cubiertos por el aumento de concentración de la solución nutritiva.
El estado de madurez del fruto también definió el peso de las semillas, asociado al estado 5 de color del fruto cosechado. Se sabe que el contenido de materia seca de semillas de tomate aumenta en frutos de color rojo a los 75 días después de la antesis (dda) (De Souza et al., 2011); incluso se afirma que frutos con 90 % de coloración roja y 75 dda, también contribuyen al aumento de peso de la semilla (Dias et al., 2006). Por su parte, Demir et al. (2008) confirmaron la influencia del ambiente en la ganancia de peso de la semilla de tomate, ya que el peso máximo se adquiere a los 50 dda en primavera, cuando el fruto presenta color rosado sobre el verde. Nuestro trabajo fue desarrollado en una parte de esta etapa del año, entre marzo y julio.
Tabla 2. Comparación de medias para peso de 100 semillas de tomate por efecto de la solución nutritiva Steiner y el sustrato de crecimiento, provenientes de diferentes fechas de corte (ddt) en Celaya, Guanajuato, MéxicoValores con literales distintos en la misma columna son significativamente diferentes; g: gramos.
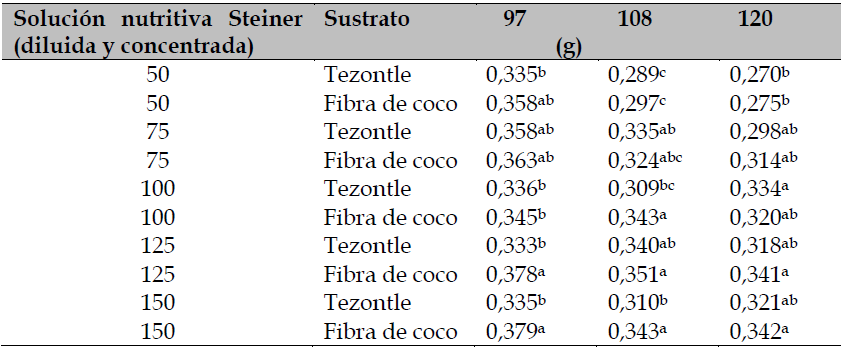
Fuente: Elaboración propia
El tercer corte de fruto, que sucedió a los 97 ddt, fue la etapa en la que hubo una diferenciación significativa en el peso de 100 semillas de tomate, donde el mayor peso fue inducido por la fibra de coco como sustrato de crecimiento (tabla 2). La fibra de coco aparece como la mejor opción para contar con semilla de calidad física mayor, no obstante, posee 48 % de retención de agua. En cambio, Noguera et al. (2003) determinaron un contenido de agua de 70 % a 84 % para fracciones de 0,5 mm de polvo de coco, hecho que puede explicar el mejor balance agua:aire en la raíz de tomate. En el mismo sentido, Raviv et al. (2004) afirman que la morfología y la función de la raíz se ven favorecidas por una relación apropiada de agua y oxígeno y, por lo tanto, se beneficia la absorción de agua, nutrimentos y actividad metabólica de la planta. Asimismo, la fibra de coco se rehidrata con facilidad ante el estrés hídrico, no aporta ni retiene nutrimentos y los libera con facilidad y no interfiere con el desarrollo radical (Londra et al., 2018).
Germinación estándar de semilla
La solución nutritiva ejerció cambios evidentemente significativos (p ≤ 0,05) en la germinación estándar de semillas de tomate, solo en los cortes cuarto y quinto de fruto hechos a 108 y 120 ddt. Por otro lado, el sustrato de crecimiento solo mostró un efecto estadístico significativo (p ≤ 0,05) para esta variable en el tercer corte de fruto, desarrollado a los 97 ddt. Además, no hubo efecto por interacción entre los factores estudiados (tabla 3).
Tabla 3. Cuadrados medios del análisis de varianza para germinación estándar en semilla de tomate proveniente de diferentes fechas de corte (ddt) en Celaya, Guanajuato, México.
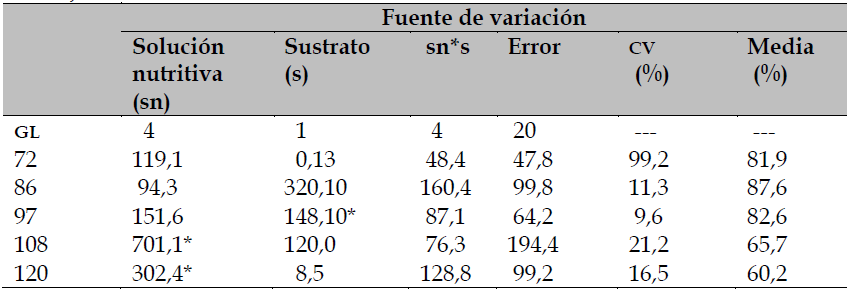
* significativo al 0,05 de probabilidad; GL: grados de libertad; CV: coeficiente de variación; sn: solución nutritiva; s: sustrato y sn*s: interacción.
Fuente: Elaboración propia
En la tabla 4 se presentan los resultados de la prueba de comparación de medias para la germinación estándar en los cortes donde se presentó significancia estadística; aquí se puede apreciar que la fibra de coco como sustrato fue consistente con la mejor respuesta en la germinación con 86,4 % en el cuarto corte realizado a los 97 ddt. Asimismo, la solución nutritiva tuvo un efecto significativo en los cortes 4 y 5, realizados a los 108 y 120 ddt, donde destaca la solución a 125 % con 76 % de plantas germinadas, mientras que las peores respuestas fueron obtenidas por la concentración de 75 % y 50 % (- 25 % y -50 %). Resultados similares se presentaron en la germinación estándar registrada en el último corte (120 ddt), donde la solución nutritiva más concentrada (+50 %) mejoró hasta 20 % la calidad de la semilla con respecto a la concentración nutritiva Steiner normal (100 %). Vidyadhar et al. (2014) obtuvieron 81 % de germinación de semillas de tomate cherry 65 días después de la antesis (dda) y este aumento estuvo asociado al cambio de color verde a rojo con la maduración que se presentó entre los 15 y 65 dda. De forma similar, Demir y Samit (2001a, 2001b) señalan que las semillas de tomate alcanzan la máxima germinación y vigor cuando los frutos se encuentran en etapa rojo-firme (aproximadamente, 70 dda).
Tabla 4. Comparación de medias para porcentaje de germinación de semilla de tomate provenientes de diferentes fechas de corte en Celaya, Guanajuato, México.Valores con literales distintos en la misma columna son significativamente diferentes. DSH: diferencia significativa honesta.
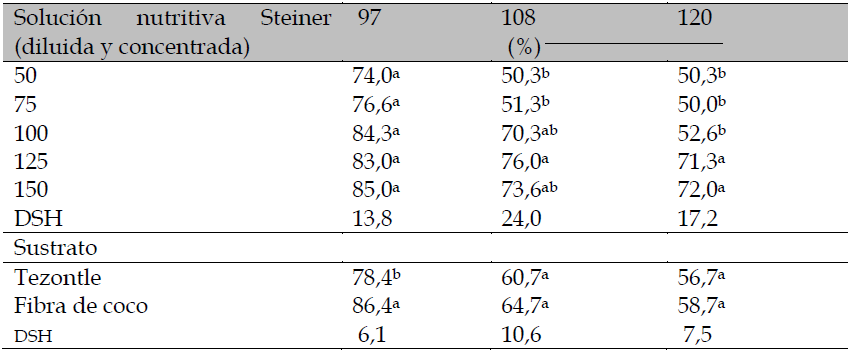
Fuente: Elaboración propia
Los valores porcentuales de germinación estándar en los cortes efectuados a los 108 y 120 ddt revelan que la solución nutritiva Steiner, aumentada a 125 % y 150 %, generó la mejor respuesta con 76 %y 72 %% de semillas germinadas, respectivamente (tabla 4). Cabe hacer notar que en el último corte realizado a los 120 ddt, el porcentaje más bajo (52,6 %) de germinación estándar se obtuvo con la solución nutritiva Steiner normal (100 %). En el mismo sentido, prolongar la cosecha de frutos de 97 a 120 ddt disminuye la germinación de las semillas de tomate; efecto de mayores consecuencias que se manifiestan con el empleo de la solución nutritiva Steiner, al bajar 32 % la germinación. De este modo, la desaceleración paulatina de la capacidad germinativa de las semillas de frutos de tomate es consecuencia del envejecimiento que sufre la planta, lo cual podría ser resuelto parcialmente al incrementar la concentración de la solución nutritiva Steiner en periodos intermedios usados para el corte de frutos.
El ensayo de vigor desarrollado por Tetteh et al. (2018) mostró valores de 43 % a 47 %, obtenidos en cajas Petri (papel filtro) y de 39 % a 48 % (medido como emergencia en el suelo), en respuesta a una extracción de frutos de tomate en estado de maduración temprana que formaron semillas de bajo peso, contrario a Demir y Samit (2001a) que recomiendan extraer la semilla de frutos rojos después de 70 días de la antesis.
Como se mencionó en párrafos anteriores, no hubo efecto estadístico significativo para los factores de estudio en la germinación estándar de semilla en los cortes de fruto de tomate realizados a los 86 y 97 ddt; sin embargo, es importante mencionar que a los 86 ddt se presentó una media general de 87,6 % de germinación y a los 97 ddt los tratamientos con solución nutritiva de 150 % (+50 %) alcanzaron valores normales de 85 %, valor requerido para el comercio de semillas de tomate. En este contexto, el Servicio Nacional de Inspección y Certificación de Semillas [SNICS] (2014) de México, exige un 85 % de germinación como mínimo para categorías de semilla básica, registrada y certificada. Además, el uso de fibra de coco como sustrato fue efectivo al rebasar el 85 % de germinación estándar en el corte realizado a los 97 ddt (tabla 4), por lo que su uso podría ser una alternativa para la producción de semilla de tomate en hidroponía.
Conclusiones
La calidad de la semilla de tomate mejoró parcialmente al subir la concentración de la solución nutritiva Steiner y al emplear fibra de coco como sustrato, sin omitir el grado de influencia que pudieron haber tenido aportes de nutrimentos de los sustratos.
En general, el mayor peso de la semilla de tomate de los tres últimos cortes de fruto (97, 108 y 120 ddt) se obtuvo de plantas que recibieron la solución nutritiva Steiner concentrada (+25 % y +50 %) y plantadas en fibra de coco.
Las semillas de las plantas de tomate tratadas con la solución nutritiva Steiner concentrada (+25 % y +50 %) y la fibra de coco indujeron la mayor germinación estándar en los dos últimos cortes de fruto (108 y 120 ddt).
Por último, se sugiere validar la incorporación de la solución nutritiva Steiner al proceso de producción de semilla de tomate, con algunas variantes en la concentración, y añadir a la evaluación técnica la composición de la solución nutritiva drenada.















