Introducción
En los valles irrigados de la costa árida del Perú se ha encontrado que en más del 30% de su superficie los suelos están afectados por la salinidad o el mal drenaje (Alva et al., 1976; Masson, 1973). Estas zonas afectadas no permiten el desarrollo de la caña de azúcar por tener baja tolerancia a la salinidad (Pinna-Cabrejos et al., 2016; Valdivia-Vega, 1980; Valdivia-Vega & Pinna-Cabrejos, 1980). Por consiguiente, un cultivo azucarero alternativo es la remolacha azucarera, de probada tolerancia a altas concentraciones de sales en el suelo (Larsen, 1980; Valdivia-Vega et al., 2001). Otras ventajas de la remolacha azucarera son que sus raíces pueden almacenar mayor concentración de sacarosa (superior al 18% de su peso fresco) que la caña de azúcar (Fick et al., 1983) y que puede producir más azúcar por hectárea/año (alrededor de 13,7 t/ha de azúcar) (Heno et al., 2018). Además, se perfila como uno de los cultivos más rentables para la extracción de etanol (Zicari et al., 2019). También tiene la ventaja (frente a la caña de azúcar) de que solo requiere seis meses para su cosecha, por lo cual consume la tercera parte del agua, siendo una magnífica planta colonizadora de los terrenos en rehabilitación (Valdivia-Vega et al., 2016), y sus hojas se utilizan para la alimentación del ganado.
El contenido de los nutrientes para las plantas está dado por la capacidad total de cambio (CTC) de los suelos (Pérez-Rosales et al., 2017), que es indirectamente un indicador de la capacidad amortiguadora de los suelos, y que es función del contenido de arcilla y de materia orgánica de los suelos. Este es estudiado desde hace muchos años (Fassbender, 1968) y, ya desde antes, se afirmaba que la arcilla caolinita tiene una CTC de 10 meq 100g-1, la ilita de 30, y la vermiculita de 100, mientras que el humus tiene entre 74 y 207 meq 100g-1.
La cantidad de nutrientes en el suelo no significa necesariamente que puede nutrir las plantas, ya que solo una muy pequeña parte de estos está disponible; por ejemplo, el contenido de P en el suelo varía normalmente entre 500 y 2.000 ppm, mientras que el disponible para las plantas puede ser solamente de unas pocas ppm (Vance et al., 2003). El P no está normalmente disponible, porque rápidamente forma complejos insolubles con los cationes del suelo. La disponibilidad de los nutrientes para las plantas, más que del tipo de suelo, depende de su pH (Castellanos, 2014), del que también depende la asimilación de los nutrientes y de los rendimientos si estos están en déficit.
Los rangos de disponibilidad son igualmente conocidos desde hace muchos años (Fassbender, 1968). Fassbender (1968) y Castellanos (2014) muestran los rangos para los diversos nutrientes, por ejemplo, la mejor disponibilidad del P, se encuentra en un pH entre 6,0 y 6,5; lo que no sucede para pHs inferiores a 6,0. Por su parte pHs entre 6,5 y 7,5 presentan la máxima disponibilidad, y esta disminuye considerablemente en pHs de 7,5 y 8,5; para volver a aumentar, hasta ser casi igual a la máxima entre pHs de 8,5 y 10. Castellanos (2014) indica los pH requeridos para las óptimas condiciones debido a los diversos cultivos; así, por ejemplo, el arándano se desarrolla mejor en suelos ácidos, mientras que la remolacha azucarera lo hace en alcalinos, y no es más que debido a los requerimientos de elementos nutritivos, ya que este último cultivo tiene bajos rendimientos a pH inferiores a 5 (Geng et al., 2021), porque requiere de abundante calcio para su desarrollo (Hadir et al., 2021).
El fósforo es absorbido por las plantas en su forma ortofosfato (H2PO4- y H2 PO 2-), que se acerca a las raíces por difusión más que por flujo de masas (Hinsinger, 2001). Las raíces de las plantas exudan ácidos orgánicos (aniones orgánicos) para aumentar su absorción (Hinsinger, 2001; Vance et al., 2003) y modifican el pH, la concentración de cationes Ca, Fe y Al, y la de aniones competitivos HCO3, y SO4. Cuando el P es deficiente en el suelo, algunas especies también producen raíces proteoides (raíces en racimo), las cuales tienen superabundancia de pelos radiculares (Hinsinger, 2001). El ingreso del P a las plantas en dicho tipo de raíces se efectúa por intermedio de transportadores denominados LaPT1 (Vance et al., 2003), que guardan relación con un grupo de proteínas transportadoras vinculadas con 540 aminoácidos y con un gen con el mismo nombre. Liu et al. (2001) mencionan, además, otro transportador en dicho tipo de raíces, el LaPT2. En general, las plantas adquieren el fosfato inorgánico del suelo por absorción activa a las células epidérmicas y corticales por intermedio de los transportadores, según Chen et al. (2011), quienes también indican que, en el arroz, esa acción la cumple el OsPHF1. Como la remolacha no produce raíces proteoides (Hadir et al., 2021), y solo los transportadores en dicho cultivo para el N son NTR1, NRT2.1 y NRT2.5 (Geng et al. (2021), se debe inferir que el portador del P para la remolacha es similar al del arroz o al de las raíces en racimo.
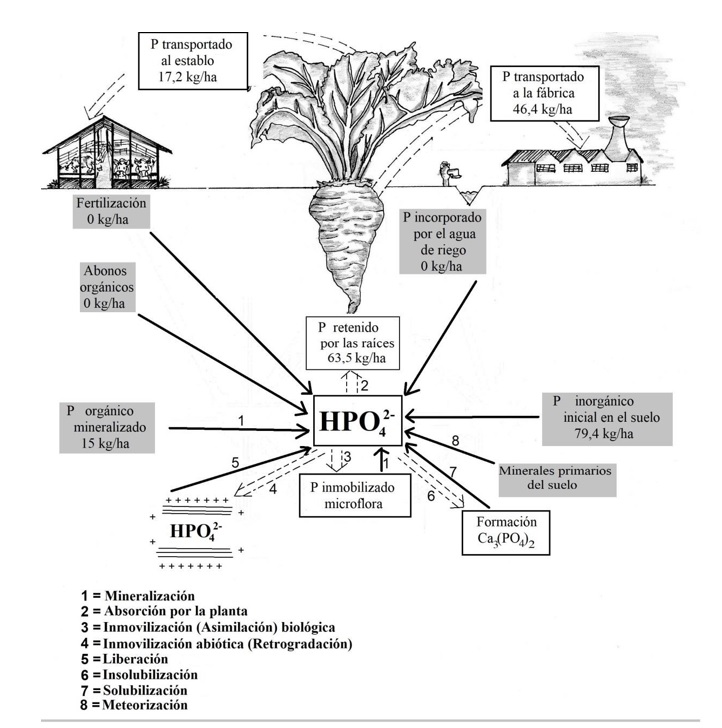
Uno de los objetivos del presente trabajo fue conocer el balance del fósforo en el suelo, con el fin de encontrar las necesidades de este nutriente para la remolacha azucarera, ya que no existe bibliografía al respecto en suelos del Perú y este incrementa el porcentaje de azúcar en los suelos severamente deficitarios (Lorenz & Vittum, 2015), pues aumenta los rendimientos de este cultivo en suelos salinos (Hussain et al., 2014), así como en sorgo (Belouchrani et al., 2020), trigo (Ding et al., 2020) y pimiento (Çimrin et al., 2010). Para ello, se tiene que conocer los aportes y las extracciones del P del suelo por las raíces y por las hojas más “coronas” (parte superior de las raíces, de donde emergen las hojas, y que se retira normalmente al momento de la cosecha, porque su tenor en azúcar es siete a ocho puntos porcentuales menor que el del resto de la raíz) de los cinco cultivares monogermen estudiados.
Materiales y métodos
El experimento estuvo ubicado en un suelo salino (varió de 6,69 a 23,6 dS/m, con una desviación estándar de 4,56) de la parte baja (cercano al mar, a 20 m s.n.m.) del valle aluvial irrigado por el río Chicama, en el campo La Grama (07°53′22″S, 79°17′53″W), de la Empresa Casa Grande, distrito de Casa Grande, Provincia de Ascope, departamento de La Libertad, Perú.
La costa del Perú está clasificada como una región hiperárida (Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura [UNESCO], 1977) y como un desierto subtropical según la clasificación de Holdridge (Tosi, 1960). Esta zona se caracteriza por tener una precipitación anual generalmente menor de 25 mm, con una temperatura media promedio de 20,2 ºC (15-26 ºC), humedad relativa promedio de 82,5% (74%-90%) y una evaporación diaria promedio de 4,5 mm (Valdivia-Vega et al., 2010).
En este campo de la costa árida del norte del Perú, se sembraron cinco cultivares monogermen de remolacha azucarera, en un diseño estadístico en bloques completos al azar con cinco tratamientos: Mono Hy6 de Estados Unidos, Mono 3190 de Suecia, Mono HyD2 de Estados Unidos, HH30 Hybrid de Estados Unidos, Mono 4006 de Suecia, con seis repeticiones por cada cultivar. La finalidad principal fue relacionar su producción con el nivel de sales en el suelo, estudio que ya fue publicado (Valdivia-Vega et al., 2001).
Las parcelas fueron de 32 m² (20 m x 1,6 m), evaluándose únicamente los dos surcos centrales (16 m²). De cada una de las parcelas se tomaron muestras de suelos para sus análisis (tabla 1). En estas muestras se determinó el porcentaje de saturación (contenido de agua para saturar el suelo) con el método de la probeta. El pH se determinó con ayuda de un peachímetro. Por su parte, la conductividad eléctrica del extracto de saturación (CEe) fue medida con un conductivímetro. La materia orgánica (MO) se obtuvo con el método de Walkley Black; el nitrógeno total (Nt), con el método semimicro Kjeldahl; el fósforo disponible (Pd), con el método de Olsen modificado (molibdato de amonio), mientras que el K, Ca, Mg, y Na cambiables fueron extraídos con acetato de amonio 1 N y determinados con un fotómetro de llama que es igualmente colorímetro. Para la determinación de la MO, se analizó el contenido de carbono del suelo y se multiplicó por el factor 1,724 (Estefan et al., 2013).
De las 30 parcelas experimentales, 18 tenían un suelo franco limoso, otras seis, franco arenoso, cinco más, franco, y una, arena franca. Como el porcentaje de saturación está relacionado con la textura del suelo, siendo menor al 20% en suelos arena o arena franca; del 20-35% en franco arenoso; del 35-50% en franco o franco limoso: del 50-65% en franco arcilloso; del 65-135% en arcilla, y mayor al 81% en suelos orgánicos (Estefan et al., 2013), en este trabajo se analizó igualmente el citado porcentaje, que es numérico y no descriptivo, como la textura, que es más fácil de describir estadísticamente, habiéndose calculado el promedio y la desviación estándar de dicho parámetro, de todos las parcelas, al igual que de todos los elementos del suelo analizados.
Tabla 1. Análisis de suelos de todas las parcelas experimentales, en su capa de 0 a 60 cm de profundidad
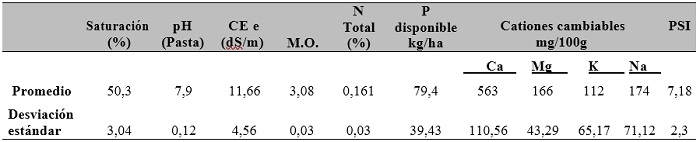
Nota:CEe: conductividad eléctrica del extracto de saturación; MO: materia orgánica; PSI: porcentaje de sodio intercambiable.
Fuente: Elaboración propia
Al campo experimental, se aplicaron 15 riegos con agua de pozo, empleándose la irrigación superficial por surcos, con un volumen total de 5.685 m³/ha. Para poder conocer la cantidad de fósforo incorporado al suelo por el agua de riego, se tomaron tres muestras de agua (en diferentes periodos), en las que se realizó el análisis químico completo, habiéndose determinado el P colorimétricamente con molibdato de amonio (tabla 2).
Tabla 2. Análisis químicos de tres muestras del agua del pozo utilizado para el riego del campo experimental
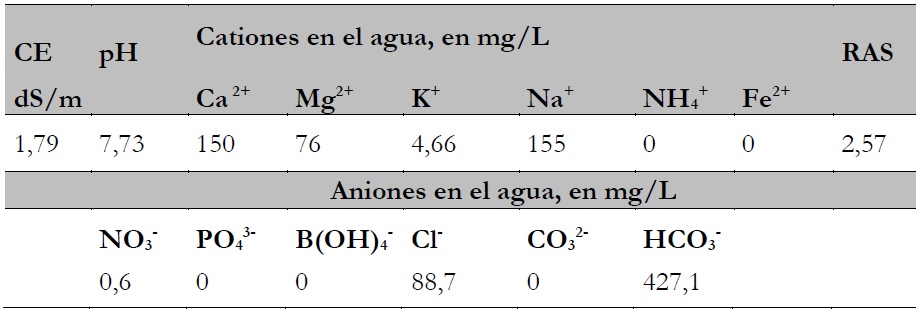
Nota:CE: conductividad eléctrica; RAS: razón de adsorción del sodio
Fuente: Elaboración propia
Para poder conocer la cantidad de P extraído del suelo por la remolacha azucarera, se obtuvo la biomasa subterránea (raíces) y aérea (hojas más coronas), habiéndose determinado en ambas su porcentaje de humedad por gravimetría para poder calcular la biomasa seca. Para encontrar el contenido de fósforo en la planta, se sometió la muestra a un proceso de digestión húmeda y el P se determinó por colorimetría (Estefan et al., 2013). El único fertilizante aplicado al campo fue la urea (180 kg/ha de nitrógeno) y las plantas fueron cosechadas a los 186 días.
Resultados y discusión
Los rendimientos (t/ha) de la biomasa fresca y seca de raíces y de hojas más coronas se presentan en la tabla 3, donde se observa que en las hojas más coronas el fósforo está más concentrado; sin embargo, las raíces tienen más biomasa (casi el doble), por lo cual extraen mayor cantidad de P del suelo que las hojas más coronas. Igualmente, se puede observar que el cultivar HH30 Hybrid superó al resto en rendimiento de raíces en fresco (85,11 t/ha) y en seco (20,80 t/ha), pero el cultivar Mono HyD2 rindió más en hojas + coronas en fresco (49,90 t/ha) y en seco (7,65 t/ha); además, este cultivar extrajo mayor cantidad de P del suelo (75,40 kg/ha). Resultados similares, pero ligeramente mayores, fueron encontrados en cinco cultivares poligermen en otro estudio (Valdivia-Vega et al., 2010).
Tabla 3. Rendimiento, concentración y extracción de fósforo en raíces y hojas más coronas, por cinco cultivares de remolacha azucarera
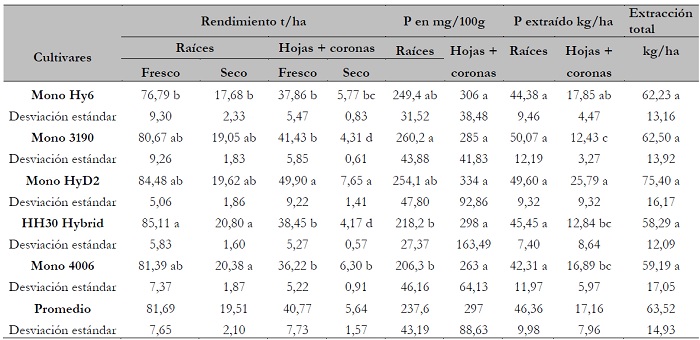
Nota:letras diferentes indican diferencias de medias significativas.
Fuente: Elaboración propia
Principales ganancias de fósforo por el suelo
Cantidad inicial de P inorgánico en los 60 cm superficiales del suelo
Según los resultados del análisis de fósforo disponible en el suelo (método de Olsen modificado), se encontró un contenido de 9,8 ppm de P en su capa de 0-60 cm de profundidad, similar a 10 ppm, considerado nivel crítico (Bertsch et al., 2005). El método mencionado se utiliza para estudios en otros cultivos como trigo (Ding et al., 2020) y pimiento (Çimrin et al., 2010), así como con diversas especies (Morari et al., 2008) en suelos salinos. Esta cantidad equivale a 79,4 kg/ha de P (tabla 1).
Cantidad de P aportado por la mineralización de la materia orgánica del suelo
El aporte de fósforo por la mineralización de la materia orgánica normalmente es insignificante, ya que el P que se mineraliza de la materia orgánica se inmoviliza rápidamente (Bridgham et al., 1998; Oehl et al., 2004). Este proceso de inmovilización es mayor en suelos fuertemente ácidos (pH < 5, donde el P se precipita en complejos de Fe y Al) o en suelos con alta alcalinidad (pH 8,0-8,8, donde el P se precipita con el Ca o el CaCO3 para formar carbonato tricálcico insoluble). Sin embargo, Rao et al. (2004) afirmaron que, en el agroecosistema de sabanas tropicales (Llanos de Colombia), que difiere del presente estudio, existió una absorción del P liberado por el suelo, variable entre 4-18 kg/ha, dependiendo de la cobertura del suelo, y que en el agroecosistema de pendientes andinas (Cauca en Colombia) fue de entre 3,5-11,4 kg/ha. Perrot et al. (1990) indicaron que hay un aporte al suelo del P mineralizado de la materia orgánica de 29 kg/ha de P en un año. Este dato se utilizará en el presente trabajo, pero como se trata de un periodo de cultivo de medio año, el aporte de P por la mineralización es de 15 kg/ha.
Entradas de P al suelo con el agua de riego
Siendo la precipitación pluvial muy escasa en la costa del Perú, y habiéndose encontrado que el agua de riego utilizada no contenía P (tabla 2), las ganancias por esta vía fueron nulas.
Principales pérdidas de fósforo por el suelo
Extracción del P del suelo por las hojas más coronas de la remolacha azucarera
Teniendo las hojas más coronas un rendimiento promedio de biomasa seca de 5,65 t/ha, y un contenido promedio de 297 mg/100 g de P (tabla 3), se encontró que las hojas + coronas extraen 17,16 kg/ha de P.
Extracción del P del suelo por las raíces de la remolacha azucarera
Como puede apreciarse en la tabla 3, la biomasa seca promedio fue de 19,51 t/ha de raíces, y el contenido promedio de P en la biomasa seca fue de 237,6 mg/100 g. Por consiguiente, la extracción de P fue de 46,35 kg/ha. La extracción total promedio de P por la planta fue de 46,35 kg/ha por las raíces, más 17,16 kg/ha por las hojas más coronas, haciendo un total de 63,52 kg/ha.
Balance de fósforo
Al realizar el balance de las ganancias y pérdidas de P por el suelo (figura 1), se encontró que las ganancias superaron las pérdidas en 30,88 kg/ha de P, lo que coincide con Oberson et al. (2001), quienes indicaron que las pasturas basadas en leguminosas, en suelos no salinos, estimulan el ciclo del P, y al final las ganancias de P por los fertilizantes exceden a las pérdidas en las pasturas de leguminosas y en el mono cultivo del arroz. Además, dicho balance indica que el límite crítico del método de Olsen modificado, inferior a 10 ppm (Bertsch et al., 2005) y similar en este caso, es adecuado igualmente en suelos salinos en el cultivo de remolacha azucarera, y que este método de análisis de suelos es utilizable en dichos suelos y en ese cultivo.
Los resultados muestran que en dichos suelos, si el método de Olsen lo indica, no son necesarias aplicaciones de P; sin embargo, queda la interrogante de que, si se hubieran efectuado dichas aplicaciones, el cultivo hubiera rendido más, ya que cuando se aplica dicho elemento en suelos salinos los niveles de Mg y SO4 disminuyen en los tallos, aumentando los de P, lo que mitiga los efectos nocivos de la salinidad y sodicidad, e incrementa los rendimientos (Hussain et al., 2014). Este es un aumento igualmente encontrado en el P en la planta por Wang et al. (2017) y Belouchrani et al. (2020) en sorgo, quienes indican que hay un aumento a la tolerancia a la salinidad, que se manifiesta por un aumento en la absorción de N y P y en la acumulación de prolina.
Al respecto, si no se fertiliza con P en suelos salinos, como aconteció en el presente trabajo, el contenido de este nutriente decrece (Niu & Hao, 2017). Esto se ve incrementado por las aplicaciones del P con enmiendas orgánicas, mitigando los efectos de la salinidad y aumentando el tenor de materia orgánica en el suelo, el agua disponible, la conductividad hidráulica y los macronutrientes disponibles, así como el P disponible (Ding et al., 2020). Ello pudiera haber ocurrido si se fertilizaba el presente estudio con dicho fertilizante. Las aplicaciones de P orgánico aumentan el P disponible en el suelo, así como el K y Mg intercambiables, aunque no afectan el Na y el Ca (Morari et al., 2008).
En plántulas de pimiento, las aplicaciones de P y ácidos húmicos en suelos salinos incrementan los rendimientos y los contenidos de N, P, K, Ca, Mg, S, Mn y Cu, en los tallos de las plántulas, y de N, P, K, Ca, Mg, S, Fe, Mn, Zn y Cu, en las raíces (Çimrin et al., 2010).
En suelos no salinos, en remolacha azucarera, la deficiencia de P afecta la fotosíntesis y aumenta la dispersión de la luz (Rao et al., 1986), actúa sobre la membrana tilacoide (Abadía et al., 1987a), disminuye la materia seca total y el fósforo soluble de las hojas, así como la fijación del CO2 (Abadía et al., 1987b). Esto afecta la disociación de las polifosfatos en almidón, sacarosa y glucosa, las actividades de las enzimas que actúan en el metabolismo del almidón y la sacarosa y la tasa de exportación del carbono de las hojas al resto de la planta (Rao et al., 1987).
La deficiencia de P también tiene un mayor efecto en la superficie de la hoja y en el peso seco de las plantas, que, en la fotosíntesis, lo que influye en las enzimas que actúan en el ciclo de Calvin (Rao & Terry, 1989). Esto último, disminuye la cantidad de sacarosa fosfato soluble en las hojas (Rao et al., 1989), y aumenta los contenidos foliares de almidón, sacarosa, y glucosa (Rao et al., 1990). Como consecuencia la velocidad de la fotosíntesis disminuye (Rao & Terry, 1994), los sacarosa-fosfatos incrementan y se reducen los contenidos de almidón y sacarosa, cuando se repone el P al suelo (Rao & Terry, 1995).
Conclusiones
Los cultivares monogermen de remolacha azucarera produjeron altos rendimientos de raíces (81,73 t/ha) en suelos salinos, donde fracasa la mayor parte de cultivos. Sin embargo, Valdivia- Vega et al. (2010) lograron mayores rendimientos con cultivares poligermen.
Por una parte, las ganancias o entradas de P al suelo fueron las siguientes: por el contenido de P disponible en la capa de 0 a 60 cm, se registraron 79,4 kg/ha; por la cantidad de P mineralizado de la materia orgánica del suelo, se estiman 15 kg/ha; las ganancias por la aplicación de fertilizantes fueron de cero, y por la aplicación del agua de riego, también fue cero, lo que resulta en un total de 94,4 kg/ha de ganancias.
Por otra parte, las pérdidas o salidas de P del suelo fueron las siguientes: por extracción de las hojas más coronas, 17,16 kg/ha, y por extracción de raíces, 46,35 kg/ha, lo que da como resultado una pérdida total de 63,52 kg/ha de P.
Al realizar el balance de las ganancias y pérdidas de P por el suelo, se encontró que las ganancias superaron en 30,88 kg/ha de P a las pérdidas, lo que hace innecesarias las aplicaciones de dicho elemento en este cultivo y en este suelo.