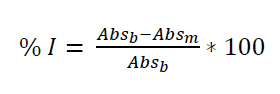Introducción
El ajo (Allium sativum L.) es reconocido por sus aplicaciones medicinales y alelopáticas debido a los compuestos de azufre, tales como disulfuro de dialilo, alilmetilo, dialilo, dialiltrisulfuro, alilmetiltrisulfuro, etc.; estos compuestos son los responsables de las características aromáticas (Pirak et al., 2012, Chalar Vargas et al., 2014).
La alicina (dialil tiosulfinato) es el principal compuesto bioactivo y representa entre un 70 % y 80 % de los compuestos azufrados presentes en el ajo (Amagase et al., 2001; Lawson et al., 2001) y esta se forma a partir de la acción enzimática de las alinasas sobre la aliína (Santhosha et al., 2013). Este compuesto azufrado presenta diversas aplicaciones de interés debido a sus características antimicrobianas y antifúngicas (Pirak et al., 2012), actuando como un potente inhibidor de enzimas como las proteinasas de cisteína y alcohol deshidrogenasas, responsables de las infecciones causadas por bacterias, hongos o virus (Figueroa-López et al., 2014). También se ha reportado su aplicación como inhibidor natural de hongos para el almacenamiento de alimentos para los camarones (Jaramillo, 2019), la incorporación de la alicina en geles para generar la preservación de la actividad antimicrobiana del bioactivo (Tantawan & Jantawat, 2012) e incluso su aplicación como agente microbicida en la supervivencia de ratas Wistar con sepsis abdominal (Arias et al., 2017).
La alicina es un agente antibacteriano natural contra la Escherichia coli O157:H7, el Staphylococcus aureus y la Salmonella Typhi (Pirak et al., 2012) y además se ha reportado un alto poder inhibitorio contra Listeria spp. (Kim et al., 2007; Pinilla et al., 2017). Además, Rasul Suleria et al. (2011) indicaron que este compuesto bioactivo también presenta actividad antioxidante. Los compuestos organosulfurados del ajo, entre ellos la alicina, tienen la capacidad de captar radicales libres y regular la actividad de varias enzimas antioxidantes celulares; asimismo, pueden aumentar las actividades de enzimas como son la catalasa, el superóxido dismutasa y el glutatión peroxidasa, implicadas en la eliminación de radicales libres de oxígeno (ROS) (Moya Salvador, 2020).
Por otra parte, la alicina tiene efectos antioxidantes sobre la oxidación de los tioles proteicos y la interacción con el sistema de glutatión reducido y forma S-alil-mercapto glutatión, compuesto con efectos antioxidantes a largo plazo (Mocayar Marón et al., 2020).
Por último, se conoce que la alicina es usada como un potente agente preventivo en el control biológico de aves e insectos en cultivos como homópteros, lepidópteros, hemípteros, coleópteros, acáridos y ortópteros; este biocompuesto es absorbido a través del sistema vascular vegetal de las plantas, lo cual altera el sistema enzimático de la misma y esto conduce a un enmascaramiento de las feromonas producidas por los insectos, lo que disminuye la natalidad de estos (HMA 4, s. f.).
Las características mencionadas hacen de la alicina un bioactivo de interés para el desarrollo de insumos agrícolas sustentables, no tóxicos y biodegradables, sin embargo, este biocompuesto es termosensible, se degrada por exposición a altas temperaturas y pierde su actividad biológica (Wang et al, 2018; Lawson & Hunsaker, 2018; Tavares & Noreña, 2019). Una alternativa para preservar el bioactivo es el diseño de diferentes tipos de nanosistemas portadores que, a su vez, mejoren la dosificación y la eficiencia del principio activo en su aplicación. Varias técnicas de encapsulación tales como la coacervación (Tavares & Noreña, 2019), la generación de liposomas (Barreto Pinilla et al., 2017) y la formación de complejos con ciclodextrinas (Bai et al., 2010), entre otros, han sido aplicadas con el fin de proteger los compuestos bioactivos del ajo como la alicina, además de enmascarar su olor característico (Tavares & Noreña, 2019).
El quitosano (Qs) es un biopolímero catiónico lineal de aminopolisacáridos; es la forma Ndesacetilada de la quitina que se puede obtener a partir de residuos de la industria pesquera; posee capacidad antimicrobiana, baja toxicidad y biodegradabilidad, con aplicaciones en el sector agrícola (Mármol et al., 2011; Pirak et al., 2012). Por otro lado, el efecto antimicrobiano en bacterias difiere entre las bacterias grampositivas y gramnegativas (Valencia, 2015) debido a las características de la superficie celular (Kong et al., 2010). En las bacterias gramnegativas, el mecanismo de acción del quitosano puede deberse a la interacción con los cationes de los compuestos lipopolisacáridos presentes en la membrana externa, logrando desestabilizarla. Por otro lado, en las bacterias grampositivas se presentan polímeros con carga negativa, tales como el ácido lipoteitoico y peptidoglicanos en sus estructuras externas, los cuales pueden interactuar con el quitosano a través de los grupos -NH3+ (Kong et al., 2010; Valencia, 2015).
El control de enfermedades y plagas que afectan las plantas es efectivo y sus mecanismos de acción están asociados a su estructura química, por lo que pueden actuar sobre el organismo patógeno o inducir mecanismos defensivos en las plantas contra varias enfermedades vegetales antes y después de la cosecha (Velásquez, 2006).
En un artículo del 2017, se ha reportado la aplicación de nanopartículas de quitosano (1000-5000 ppm, masa molecular 161-810 kDa, GD: 75-90 %) con efectos contra Fusarium graminearum, el agente causante del tizón de la cabeza por Fusarium sp. en trigo (Kheiri et al., 2017). También se comprobó la capacidad de suprimir el crecimiento del nematodo Heterodera glycines en la soja (Mwaheb et al., 2017). Por otra parte, favorece el crecimiento y el desarrollo de microorganismos beneficiosos e incrementa la población y la actividad microbiana en el suelo, lo que mejora la disposición de nutrientes y sus propiedades. Además, actúa como regulador del crecimiento, acelerando la germinación de las semillas, el vigor de las plantas y el rendimiento agrícola (Mármol et al., 2011).
En las plantas, los nanoencapsulados formulados con quitosano se utilizan para la protección de diferentes compuestos de interés agrícola como herbicidas, fertilizantes y fungicidas, protegiéndolos contra el medio fisiológico que deteriora el principio activo y permitiendo su liberación controlada (Choudhary et al., 2019; Valderrama et al., 2020).
Una técnica aplicada para obtener nanoencapsulados es la reticulación iónica, la cual permite formar partículas mediante una rápida reacción de reticulación entre el quitosano, el cual actúa como agente policatiónico y contraiones aniónicos multivalentes (Desbrieres et al., 2019). Las partículas sintetizadas a partir de estas reacciones se forman debido a la interacción iónica entre los grupos aminos cargados positivamente del quitosano y las moléculas cargadas aniónicamente.
El tripolifosfato de sodio (TPP) es el reticulante iónico más común utilizado para preparar sistemas de partículas a base de quitosano. Es un polianión que interactúa con el quitosano catiónico mediante fuerzas electrostáticas (Ferrari et al., 2012) y debido a la complejación entre especies con carga opuesta, el quitosano experimenta una gelificación iónica y consecuentemente se precipita para formar partículas.
El estudio de la formación de nanopartículas de quitosano es de importancia agrícola y se ha reportado el incremento en la acción biológica de este biopolímero cuando este se encuentra en soluciones de nanopartículas (Qi et al., 2004; Du et al., 2008; Huang et al., 2009). Se han descrito algunas aplicaciones de sistemas portadores nanoencapsulados con base en quitosano para diferentes aplicaciones agrícolas, tales como el recubrimiento de semillas para la liberación controlada de fertilizantes, mostrando una potente acción bactericida y fungicida (Velásquez, 2006; Mármol et al., 2012).
El objetivo del presente trabajo consistió en sintetizar y caracterizar sistemas nanoencapsulados de quitosano como sistemas portadores del compuesto bioactivo alicina presente en un fitosanitario comercial, para esto, se generó un complejo entre el quitosano y el compuesto bioactivo que contiene alicina y se sintetizó un sistema nanoencapsulado del complejo alicinaquitosano mediante la técnica de gelificación ionotrópica usando tripolifosfato de sodio. Luego, se estudió el efecto de la variación en la relación entre tripolifosfato de sodio y quitosano presentes en la reacción, mediante la caracterización estructural (FTIR-ATR) y fisicoquímica (determinación de tamaño medio de partícula, potencial Z) y además se evaluó la actividad antioxidante mediante el ensayo de inhibición del radical DPPH•.
La aplicación del proceso de reticulación iónica y la variación de la relación TPP:Qs permiten la síntesis de nanoencapsulados del fitosanitario, cuyo compuesto bioactivo es la alicina, en una matriz de quitosano como sistema nanoportador.
Materiales y métodos
Formación del complejo alicina-quitosano
Se obtuvieron complejos alicina-quitosano (All-Qs) adaptando el protocolo propuesto por Pirak et al. (2012), a partir del producto fitosanitario “VG GUARD” (HMA 4, s. f.), cuyo componente principal y activo es la alicina en una concentración de 0,6 % p/v y soluciones de quitosano Qs; Sigma-Aldrich (St. Louis, MO, USA). El quitosano empleado fue caracterizado fisicoquímicamente y su peso molecular fue de 2,83 × 105 g mol-1 , obtenido por el método viscométrico utilizando un viscosímetro capilar de Ostwald. El grado de desacetilación del quitosano fue del 75,3 % (SD = 1,1), determinado por el método FTIR (Brugnerotto et al., 2001) y del 79,5 % (SD = 2,7) determinado por la valoración potenciométrica (Broussignac, 1968).
Se realizaron mezclas con una proporción de 0,2 g de alicina por 1 g de Qs, partiendo de una solución Qs (1 % p/v) preparada en medio ácido (ácido acético glacial (1 % v/v) y el fitosanitario comercial con 0,6 % p/v de alicina; la dispersión formada se sometió a agitación constante de 100 rpm y 30 °C, con tiempo de agitación de 24 horas. Las mezclas obtenidas se dejaron reposar a 4 °C durante 48 h y posteriormente se centrifugaron a 3000 rpm durante 10 minutos, con el fin de retirar la fracción insoluble aportada por el fitosanitario, siendo el sobrenadante el complejo All-Qs formado, el cual fue recuperado para ser usado en la etapa de reticulación.
Para la obtención de los sistemas NQsAll, partiendo de All:Qs, se adicionó por goteo TPP (0,06 % p/v) en dos relaciones de masa de TPP:Qs (5:1 y 3:1), con agitación constante durante 5 s a 100 rpm usando un agitador Velp Classic (Velp Scientifica). Finalizada la adición de la solución de TPP, se llevaron las muestras a agitación durante 90 minutos a una velocidad de agitación de 100 rpm y temperatura ambiente. Posteriormente, las muestras se centrifugaron a 3000 rpm durante 10 minutos y el precipitado se congeló a -40 °C por 24 h previo al secado por liofilización (temperatura = -50 °C; presión = 001 Torr, 48 h) en un equipo HETO Modelo FD 4 y se almacenaron a 4 °C hasta su caracterización.
Caracterización de las muestras
Determinación de sólidos solubles totales (SST; ° Brix) y pH
El contenido de SST de los complejos de Qs-All formados y en solución se determinó con un refractómetro manual Atago N2 (Tokio, Japón) y las determinaciones se hicieron por triplicado. El pH de las muestras de los complejos de Qs-All formados y en solución se midió con un peachímetro Hach Sension+ pH3 Lab (Hach Company, Estados Unidos) a 25 ºC. Finalmente, las mediciones se hicieron por duplicado.
Espectroscopia infrarroja con transformada de Fourier (FTIR) y reflectancia total atenuada (ATR
Los espectros FTIR del quitosano, la alicina presente en el fitosanitario liofilizado y de los nanoencapsulados alicina-quitosano liofilizados obtenidos, se registraron con un espectrómetro Nicolet IS10 (Thermo- Scientific, Estados Unidos) con accesorio de ATR (diamante). Se trabajó en un rango de números de onda desde 4000 a 400 cm-1 y para cada muestra se colectaron 60 barridos con una resolución de 4 cm-1 que fueron acumulados. Los datos obtenidos se procesaron utilizando el software OMNIC TM de Thermo Scientific TM.
Distribución de tamaño de partícula de los complejos All-Qs
Para la evaluación de la distribución del tamaño de los encapsulados All-Qs con diferentes relaciones de TPP:Qs, las muestras en solución se sonicaron durante 60 s usando una punta homogeneizadora ultrasónica OMIN Sonic Ruptor 400, seguido de una dilución 1:10 previa a medición. Las medidas se realizaron en un equipo Nanoparticle Analyzer SZ-100-Z (Horiba Instruments, Japón), provisto de un diodo láser JUNO, modelo 10G-HO (Showa Optronics, Japón) operado a 532 nm, usando una cubeta de cuarzo.
Determinación del potencial-Z (PZ)
La medida del potencial-Z (PZ) consiste en determinar la carga en la superficie externa de una partícula en suspensión (coloide, nanopartícula, etc.), basándose en la teoría de la doble capa eléctrica; permite conocer el comportamiento de la partícula por medio de la movilidad electroforética que experimenta la partícula en suspensión en un campo eléctrico definido, ya que indica el balance entre los cambios en el potencial de la superficie de dicha partícula y las fuerzas de repulsión en su entorno.
Se tomó 1 ml de la suspensión y se mezcló con 0,25 ml de una solución de cloruro de potasio (KCl; 1 mM), con el propósito de ajustar la conductividad eléctrica del medio. Se midió el PZ utilizando un Nanoparticle Analyzer SZ-100-Z (Horiba Instruments, Japón), provisto de un diodo láser JUNO, modelo 10G-HO (Showa Optronics, Japón) operado a 532 nm usando una celda con electrodo de carbono de 6 mm; los datos reportados comprenden el promedio de tres mediciones.
Capacidad de inhibición de las nanopartículas del complejo All/Qs: inhibición del radical DPPH•. (%I)
Se determinó la capacidad antioxidante del quitosano, la alicina presente en el fitosanitario y los nanoencapsulados de All:Qs mediante la inhibición del radical libre 2,2-difenil-1-picril hidracilo (DPPH•) en una solución etanólica, siguiendo la metodología propuesta por Brand Williams et al. (1995). El método DPPH∙ determina actividades de captura de material radicalario en presencia de una sustancia antioxidante, midiendo el potencial de inactivación de dicho radical en medio acuoso. La forma estable del DPPH∙ (violeta) absorbe a una longitud de onda de 517 nm, al ser reducido por un compuesto con actividad antioxidante (AH) u otra especie radical (R∙), la absorción disminuye (amarillo), representando la capacidad antioxidante total del compuesto ensayado.
Para la medición de los antioxidantes se preparó una solución de quitosano al 0,2 % p/v y una dilución del fitosanitario con agua destilada para alcanzar una concentración de alicina de 0,04 % p/v, con el fin de equiparar las concentraciones en el complejo All:Qs (previo a la liofilización). Los nanoencapsulados liofilizados se resuspendieron en agua destilada para equiparar la relación de 0,2 g de alicina cada un (1) g de quitosano. Las muestras se agitaron a 100 rpm, a 20 °C y oscuridad durante 1 h, y finalmente se centrifugaron a 3000 rpm por 10 min y el sobrenadante se reservó a 4 °C y oscuridad hasta su medición.
La técnica aplicada consistió en mezclar una alícuota (0,1 ml) de la muestra con 3,9 ml de la solución DPPH•-etanol (25 mg DPPH•/l) y almacenar en oscuridad. El curso de la reacción se siguió determinando la caída de la absorbancia a 517 nm con un tiempo de reacción de 150 minutos en un equipo espectrofotómetro UV mini-1240 UV-Vis (Shimadzu Scientific Instruments, Japón). Los resultados se expresaron como porcentaje de inhibición (% I), ecuación 1:
Donde, Absb es la absorbancia del blanco (solución del radical DPPH•-etanol) y Absm es la absorbancia medida para la muestra analizada, evaluadas a 150 min.
Análisis estadístico
Se realizaron análisis estadísticos utilizando el software Infostat v. 2013 (InfoStat Group, 2016). La prueba t se aplicó para determinar diferencias estadísticamente significativas entre los valores medios de los resultados correspondientes a la comparación de diámetros medios y potencial Z para dos relaciones TPP:Qs. El análisis de varianza (Anova) se utilizó para establecer diferencias estadísticamente significativas entre las medias, los resultados de la capacidad antioxidante fueron determinados por el método DPPH• (%I) en cinco grupos de muestras, donde las diferencias se compararon mediante la prueba de Tukey usando un nivel de significancia p < 0,05.
Resultados y discusión
Se obtuvieron complejos All-Qs a partir de soluciones de quitosano de concentración 1 % p/v y el fitosanitario “VG GUARD”, mediante la reticulación iónica con tripolifosfato de sodio (TPP) con un contenido de sólidos solubles totales de 2,44 ± 0,01 °Brix.
Los complejos All-Qs nanoencapsulados se llevaron a cabo por medio de la interacción del quitosano y el TPP, donde este último se puede presentar en diferentes especies aniónicas dependientes al pH: P3O10-5, HP3O10-4 y H2P3O10-3. Una solución acuosa de TPP presenta pH = 9, disociándose mayoritariamente en iones P3O10-5, los cuales consecutivamente tienden a formar iones HP3O10-4 y OH-.
El proceso de reticulación iónica entre el quitosano y el TPP se genera cuando entra en contacto la solución de quitosano con la solución del TPP. Debido a las condiciones de solubilización del quitosano, esta solución se encontraba a pH ácido (2,98), por lo cual los grupos aminos de este biopolímero estaban protonados (NH3+); por esta razón, los iones P3O10-5, HP3O10-4 y OH compiten para reaccionar electrostáticamente con los NH3+ (Bhumkar & Pokharkar, 2006). El pH de las suspensiones de las nanopartículas fue de 3,5 y el incremento del pH indicó que el proceso de reticulación iónica se produce con la neutralización de cargas.
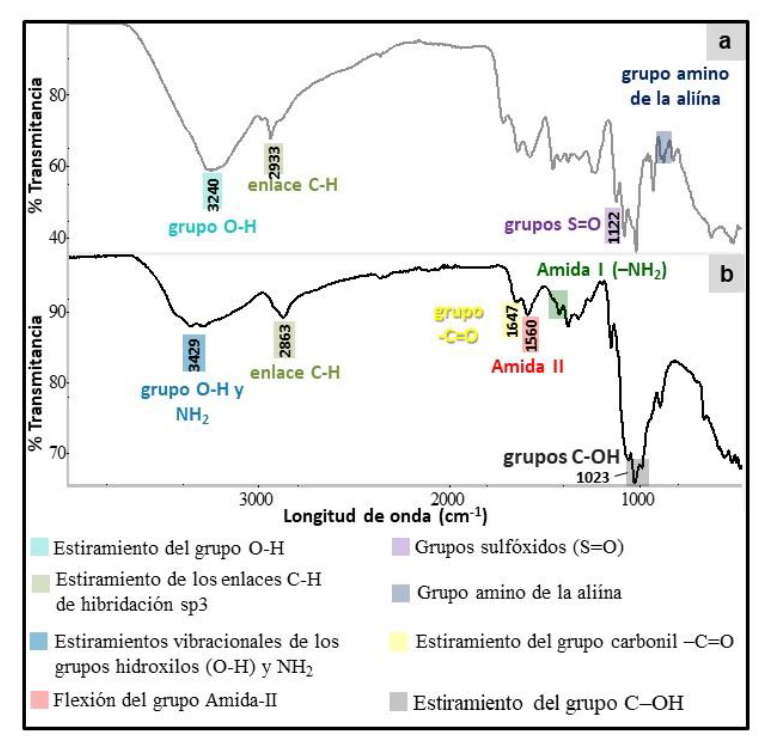
La caracterización estructural del quitosano, la alicina presente en el fitosanitario y los sistemas nanoencapsulados (NQsAll (5:1) y All-Qs NQsAll (3:1)) se realizó mediante FTIR-ATR. En la figura 1 se presentan los espectros de la alicina (presente en el fitosanitario) (a) y el quitosano (b). En el espectro “a” la alicina (figura 1a) se observó un pico correspondiente a la longitud de onda 3240 cm-1, correspondiente al estiramiento del grupo O-H y a 2933 cm-1, un pico correspondiente al estiramiento de los enlaces C-H de hibridación sp3 (Figueroa-López et al., 2014). Las bandas observadas a 1122 y 1078 podrían corresponder a los grupos sulfóxidos (S = O) y a la vibración de estiramiento de las aminas primarias C-N, reportadas por Figueroa-López et al. (2014) para 1130 y 1107 cm-1, respectivamente, las cuales se atribuyen a la aliína y sus productos derivados. El pico observado a 926 cm-1 podría corresponder a la deformación de = CH2, y el pico 820 cm-1 a aminas primarias N-H, los cuales se deben al grupo amino de la aliína (Figueroa-López et al., 2014).
Fuente: Elaboración propia.
Figura 1. Espectros FTIR: a) Alicina presente en el fitosanitario y b) Quitosano.Nota: Las marcaciones en el espectro resaltan algunos grupos funcionales de interés.
En la figura 1b se presenta el espectro FTIR de quitosano en polvo, donde se observó la presencia de la banda ancha ubicada en 3429 cm-1 correspondiente a los picos combinados de los estiramientos vibracionales de los grupos hidroxilos (O-H) y NH2 (Qi et al., 2004), la banda en 2933 cm-1 corresponde a una vibración de tensión del enlace C-H, (Sierra et al., 2013); la banda 1647 cm-1 se atribuye al estiramiento del grupo carbonil -C = O y a 1560 cm-1 se presentó el pico correspondiente a la flexión del grupo amida-II, la cual se solapa con la flexión del grupo amino en 1549 cm-1 (Liu & Zhang, 2015; Tirtom et al., 2012), a 1413 cm-1 grupo amida I (-NH2) y 1358 cm-1 , donde se produce la vibración de flexión simétrica a modo “tijera” del grupo amida I a 1150 cm-1 con vibración de flexión asimétrica C-O-C y a 1023 cm-1, con las bandas correspondientes a las vibración que involucran el estiramiento del grupo alcohólico C-OH, características de los polisacáridos (Kim et al., 2012; Kyzas et al., 2008).
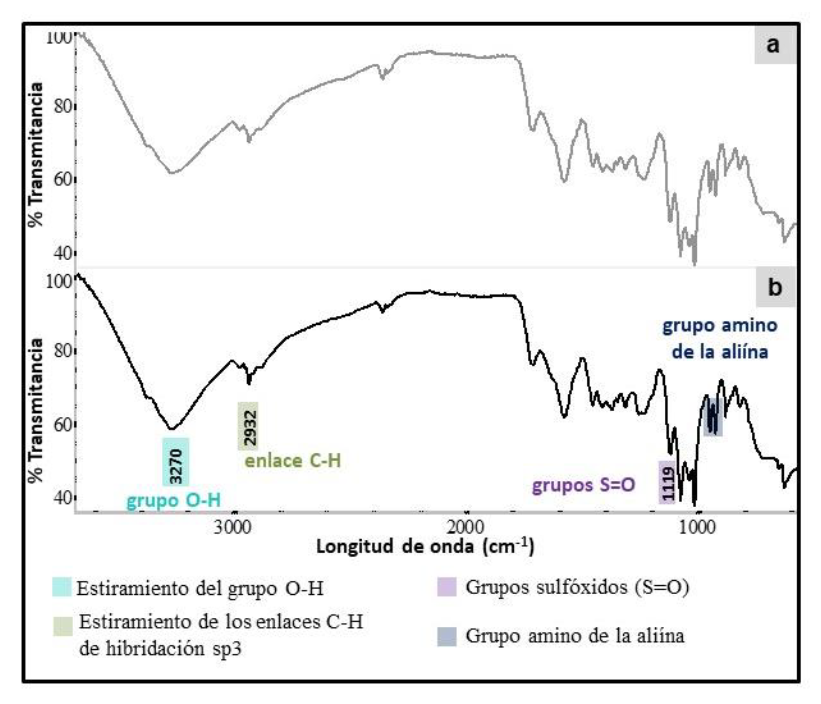
En la figura 2 se presentan los espectros FTIR de los nanoencapsulados quitosano/alicina: a) NQsAll (3:1). y b) NQsAll (5:1). La formación del complejo All-Qs se podría evidenciar en la zona de 1500 a 500 cm-1, donde se observan las bandas correspondientes a los grupos sulfóxidos S = O (1119 cm-1 ) y a la vibración de estiramiento de las aminas primarias C-N (1072 cm-1 ), observadas en el espectro FTIR de la alicina (figura 1a).
El pico observado a 926 cm-1 podría corresponder a la deformación de = CH2, y el pico 820 cm-1 a de aminas primarias N-H, lo cual se debe al grupo amino de la aliína (Figueroa-López et al., 2014). En comparación con el espectro del quitosano (figura 2b), el complejo All-Qs presentó un corrimiento del pico de la flexión del grupo amida-II, que originalmente se presenta para el Qs a 1560 cm-1 y que se observó en el complejo a 1575 cm-1, esto se presenta por la interacción electrostática de los grupos aminos libres del quitosano con los iones del TPP, asimismo, la disminución de las intensidades de la banda a 1647 cm-1 . También se presentan dos nuevas bandas a 1712 cm-1 y 1575 cm-1 , que indican el entrecruzamiento con las moléculas de TPP (Qi et al., 2004) durante la reticulación iónica.
Fuente: Elaboración propia.
Figura 2. Espectros FTIR de los nanoencapsulados : a) NQsAll (3:1) y b) NQsAll (5:1).Nota: Las marcaciones en el espectro resaltan algunos grupos funcionales de interés.
Distribución del tamaño de partícula mediante dispersión de luz dinámica (DLS) y PZ de los nanoencapsulados All-Qs
En la tabla 1 y la figura 3 se presentan los resultados obtenidos de la evaluación del tamaño de partícula de los nanoencapsulados alicina-quitosano para dos relaciones TPP:Qs. Se observó que la relación TPP:Qs influye significativamente (p < 0,05) en la distribución del tamaño de las partículas de los nanoencapsulados All-Qs.
Tabla 1. Distribución de tamaño de partícula obtenidos por distribución de luz dinámica (DSL) y PZ de NQsAll (3:1) y NQsAll (5:1)
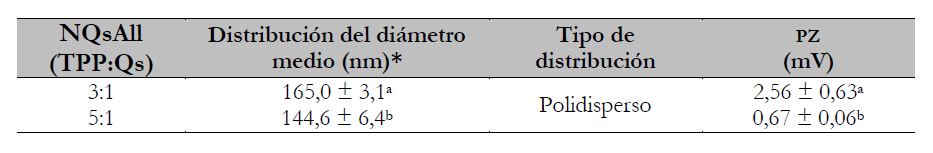
*Resultados expresados como el promedio de 3 lecturas ± desviación estándar.Los valores con superíndices distintos difieren significativamente por tratamiento (a,b) la prueba t (α = 0,05).
Fuente: Elaboración propia.
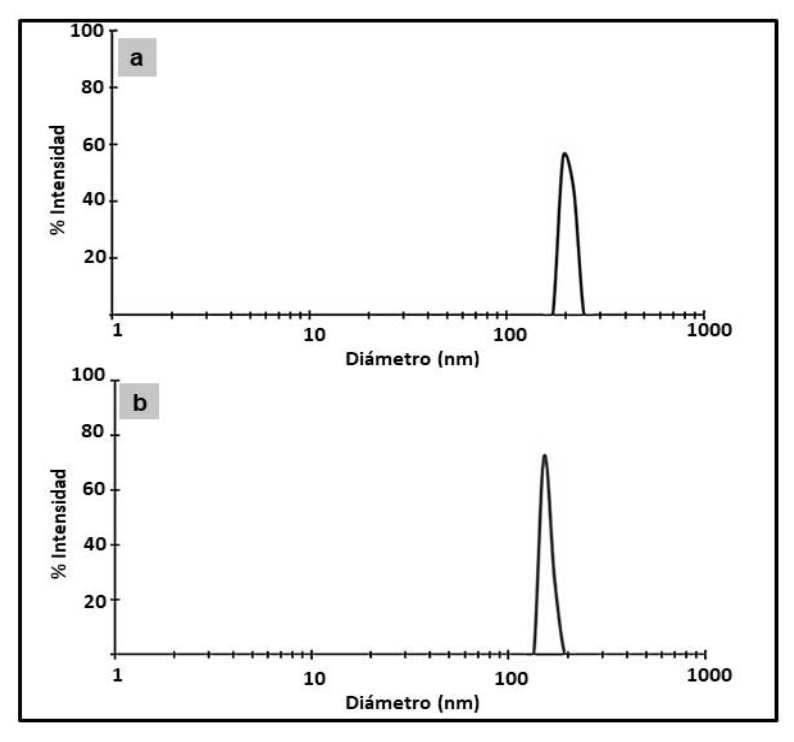
Fuente: Elaboración propia.
Figura 3. Distribución de tamaño de partícula de los complejos a) NQsAll (3:1) y b) NQsAll (5:1).
La menor relación de TPP:Qs llevó a la formación de nanopartículas de mayor tamaño (figura 3a), esto se atribuye a que cuando se agrega una menor proporción del reticulante queda un alto número de cargas positivas en el Qs sin neutralizar, lo cual genera repulsión entre las cadenas del biopolímero y mayores tamaños de las partículas; asimismo se observan mayores valores de PZ.
La formación de los sistemas nanoencapsulados NQsAll se llevó a cabo usando Qs y TPP, ambos compuestos se caracterizan por tener diferentes cargas, siendo positivas para el Qs y negativas para el TPP. El PZ de las soluciones de Qs y TPP usadas para el proceso de reticulación fueron 35,03 ± 0,12 mV y -2,37 ± 0,25 mV, respectivamente. Este resultado muestra las características iónicas de cada uno de los compuestos, donde se comprobó que el PZ para el Qs fue positivo al tratarse de un polielectrolito catiónico, caso contrario fue el del TPP. Para el caso del complejo All:Qs, el PZ fue 17,20 ± 10,7 mV, esto demuestra que existió una reducción del PZ en comparación al del Qs debido a la interacción electrostática entre este policatiónico y la All presente en el fitosanitario.
Se observa una diferencia significativa (tabla 1; p < 0,05) en los de los PZ nanoencapsulados, siendo 0,67 ± 0,06 mV para la relación 5:1, valor cercano a 0 por causa de la falta de repulsión de las cargas indicando la neutralización electrostática; este fenómeno generó un sistema insoluble que correspondió a las nanopartículas, en concordancia con varios autores (Souza et al., 2012 y Tavares & Noreña, 2019); y para la relación 3:1, un PZ de 2,56 ± 0,63 mV, en este caso el PZ de las nanopartículas formuladas con este biopolímero tiende a ser positivo indicando la presencia de grupos aminos superficiales (Jonassen et al., 2012).
Capacidad de inhibición del radical DPPH• (% I) por el complejo de nanopartículas All/Qs
Se determinó la capacidad antioxidante de la alicina, la solución de quitosano (Qs 1 % p/v) y los nanocomplejos NQsAll (5:1) y NQsAll (3:1) (figura 4).
El posible mecanismo de acción del compuesto activo es su participación como donante de hidrógeno o electrones, reduciendo el radical DPPH• a su forma DPPH (Bozin et al., 2008). Los porcentajes de inhibición (% I) obtenidos fueron en todos los casos inferiores al 15 %, la dilución de alicina (0,004 % p/v) y el quitosano (0,2 % p/v) presentaron valores de 12,9 % y 3,7 % de inhibición, respectivamente, evidenciando que la actividad antioxidante está dada principalmente por el compuesto activo: alicina. Diversos autores han reportado la capacidad antioxidante para extractos de ajo, Rasul Suleria et al., (2011) indicaron porcentajes de inhibición medidos mediante DPPH* para extractos acuosos y metanólicos de 73,80 % y 83,83 %, respectivamente; por otra parte, González Ramírez (2019) reportó un 11,99 % de inhibición para muestras de ajo fresco. Cabe recordar que el contenido de alicina reportado en ajo fresco es de 345 mg cada 100 g de ajo (Jeong et al., 2016).
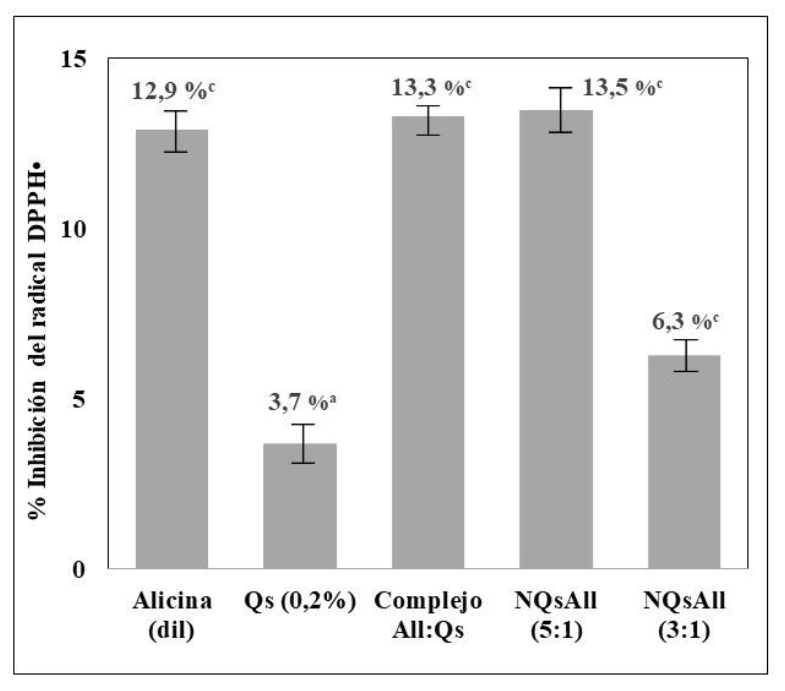
Fuente: Elaboración propia.
Figura 4. Capacidad antioxidante medida mediante la inhibición del radical DPPH• (%I) a 517 nm.Notas: Dilución de alicina (0,04 % p/v), la solución de quitosano al 0,2 %, el complejo All:Qs previo a la liofilización y los nanoencapsulados de NQsAll (5:1) y NQsAll (3:1). Los valores con superíndices distintos (a, b, c) difieren significativamente por tratamiento la prueba de Tukey (p < 0,05).
La capacidad de inhibición del radical DPPH• del complejo All/Qs (preliofilización) y NQsAll (5:1) no presenta diferencias significativas (figura 4; p > 0,05) con respecto al % I de la dilución del fitosanitario (0,004 % p/v), indicando que los procesos de reticulación y nanoencapsulado permiten conservar las propiedades antioxidantes del complejo en solución, asimismo, el empleo del secado por liofilización contribuye a la conservación del compuesto bioactivo. Tavares y Noreña (2019) demostraron la actividad antioxidante de encapsulados de extracto de ajo en micropartíulas de quitosano y aislado de proteínas de suero de leche, obtenidos por coacervación mediante secado por atomización o liofilización; en este ensayo, las micropartículas presentaron una buena capacidad antioxidante aunque menor que en el extracto de ajo sin encapsular y observaron que la actividad también descendió con el secado por atomización en comparación a la liofilización, debido a las temperaturas del proceso de secado.
La capacidad de inhibición del complejo NQsAll (3:1) se redujo significativamente (p < 0,05) como se muestra en la figura 4, indicando que la relación 3:1 presenta una menor capacidad de estabilización del principio activo de la alicina.
Conclusiones
Mediante el proceso de reticulación iónica se logró la síntesis de nanoencapsulados del compuesto bioactivo alicina presente en el fitosanitario comercial, en una matriz de quitosano como sistema nanoportador. La formación de los nanoencapsulados se comprobó mediante la caracterización estructural por FTIR, donde se observaron bandas características correspondientes a la alicina, además de señales asociadas a la interacción electrostática entre los grupos aminos libres del quitosano y el tripolifosfato de sodio (TPP), indicando la reticulación entre las moléculas.
La relación TPP:Qs influyó en la distribución del tamaño de las partículas, el PZ y la capacidad antioxidante del nanocomplejo All-Qs formado, siendo la relación TPP:Qs (5:1) la que presentó un menor tamaño de nanopartículas y las mejores características para formular un sistema nanoportador.
Contribución de los autores
Orjuela-Palacio, Juliana: diseño y elaboración del proyecto, metodología, recopilación y análisis de datos, escritura del manuscrito, edición. Peréz-Calderón, John: diseño y elaboración del proyecto, metodología, recopilación y análisis de datos, escritura del manuscrito, edición. Zaritzky Noemí: diseño y elaboración del proyecto, metodología, análisis de datos, escritura del manuscrito y edición. Directora del proyecto y financiación.