Introducción
Solanum tuberosum (Solanaceae) es una especie originaria del altiplano circundante al lago Titicaca, en la frontera entre Perú y Bolivia (Spooner & Hetterscheid, 2005; Inostroza et al., 2017; Ángeles et al., 2018). Cabe mencionar que en Perú existen más de 5000 variedades de papas, entre comerciales y nativas, donde destacan las de pulpa de color morado por ser consideradas como alimentos nutraceúticos o funcionales, capaces de nutrir y reforzar el sistema inmunológico debido a las altas concentraciones de flavonoides, antocianinas y carotenoides que contienen (Balbín, 2014; CIP & INIA, 2015; Tirado et al., 2018; Tirado & Tirado, 2018).
El empleo de tubérculos como semilla hace referencia a la parte vegetativa del tubérculo que el agricultor utiliza para su propagación y constituye la vía de reproducción vegetativa más empleada hoy en día para este cultivo, al permitir obtener considerables cosechas en cantidad y calidad, pero que aún cuenta con ingentes problemas fitosanitarios (Gil et al., 2019; González & Chavarría, 2016). La biotecnología vegetal, mediante la técnica de cultivos de tejidos vegetales in vitro, constituye una herramienta fundamental para la conservación, el saneamiento y la preservación del germoplasma de esta y otras especies vegetales de importancia económica (Seminario et al., 2017; Albarrán et al., 2019).
En este contexto, la tuberización in vitro aparece como una alternativa prometedora para la generación de “tubérculos-semilla” con mayor potencial productivo, debido a la notable reducción de la carga viral y bacteriana que se logra con estas técnicas, además de conservar el potencial genético de la variedad en investigación. Es así que, Araque et al. (2018) obtuvieron hasta 47 tubérculos in vitro con peso de 143,09 mg promedio en las variedades Diacol Capiro y Parda, empleando 6-bencilaminopurina (6-BAP) y 8% de sacarosa.
Tacoronte et al. (2017) sostienen que el empleo de un medio de cultivo líquido a altas concentraciones de sacarosa y oscuridad constituyen las condiciones más favorables para la inducción de tubérculos in vitro, en variedades de papa comercial. Realidad confirmada por Tapia et al. (2017), quienes manifestaron que el uso de biorreactores empleando el sistema de inmersión temporal maximiza la obtención de un número mayor de minitubérculos a partir de plantas in vitro (Alamilla et al., 2019), verificándose la existencia de una relación directa entre el tamaño de la planta madre con el peso y el número de tubérculos in vitro obtenidos al término del experimento, sobre todo con las variedades comerciales Canchan y Yungay (Barcia, 2020; Carrión, 2017).
La tuberización in vitro es una técnica que ha sido muy trabajada en variedades mejoradas como alternativa para dotar a los agricultores con material de alta calidad y condiciones de manipulación más accesibles y fáciles para ellos, además de poder ser utilizados en la conservación del germoplasma, tanto de variedades mejoradas como nativas y en especial de las de pulpa de color, respecto a las cuales no existen muchas investigaciones (Araque et al., 2018). En tal sentido y conforme a lo estipulado en los párrafos anteriores, se propuso para este trabajo de investigación determinar las condiciones que permitan la tuberización in vitro de Solanum tuberosumvar. “Cochacina” de pulpa de color morado, como una técnica viable en el proceso de producción de semillas saneadas de alta calidad fitosanitaria y su aplicación en la conservación de germoplasma.
Materiales y métodos
Selección de tubérculos de S. tuberosum var. “Cochacina”
Los tubérculos de S. tuberosum var. “Cochacina” fueron transportados de la estación experimental del Instituto de Papa y Cultivos Andinos (Ipaca), de la Universidad Nacional de Trujillo, ubicada en Carabamba, provincia de Julcán, departamento de La Libertad, Perú, hacia el invernadero del Ipaca, ubicado en la Universidad Nacional de Trujillo, La Libertad, Perú, donde se realizó la selección de tubérculos con base en su estado sanitario, seguido de su desinfección con fungicida, para luego ser sembrados en macetas que contenían un sustrato preparado con tierra agrícola cernida, humus de lombriz y arena de duna en proporción 1:1:1, previamente tratados para eliminar sales y posibles microorganismos del suelo (Moreno & Oropeza, 2017; López, Mostacero, Gil, López & De la Cruz, 2019).
Establecimiento in vitro de S. tuberosum var. “Cochacina”, en un medio de cultivo solido
En el laboratorio de biotecnología del Ipaca se preparó un medio de cultivo MS (Murashige & Skoog, 1962), suplementado con ácido indolacético (AIA) y ácido giberélico (AG3), según el diseño propuesto por López, Mostacero, Gil, López & De la Cruz (2019) y López, Mostacero, Gil, López, De la Cruz & Villena (2019), donde se empleó: AIA (0,1 mg/L), AG3 (0,5 mg/L), agar (6 × 103 mg/L ) y sacarosa (3 × 104 mg/L ). Una vez preparado y autoclavado el medio de cultivo, se procedió a la siembra in vitro de entrenudos de S. tuberosum var. “Cochacina” en cámara de flujo laminar. Los explantes procedieron de las plantas madre cultivadas en invernadero de dos meses de edad. Concluida la siembra, los explantes fueron transportados al cuarto de incubación a una temperatura de 18 °C, con fotoperiodo de 16 horas luz y 8 horas oscuridad y humedad relativa del 85%.
Propagación in vitro de S. tuberosum var. “Cochacina”, en un medio de cultivo líquido
Se procedió a preparar y autoclavar el medio de cultivo MS según el diseño propuesto por López et al. (2020), empleando 6- BAP (0 mg/L ) y sacarosa (3 × 104 mg/L). Seguido a ello, se realizó la siembra in vitro de esquejes de S. tuberosum var. “Cochacina”. En tal sentido, se seleccionaron plántulas in vitro de S. tuberosum var. “Cochacina”, las cuales posteriormente fueron conducidas a la cámara de flujo laminar, donde se realizaron los cortes de los esquejes que contuvieran al menos tres nudos, a fin de ser sembrados en medio de cultivo líquido y, finalmente, transportados al cuarto de incubación con luz blanca (40 µmol m-2 .-1), con fotoperiodo de 16 horas de luz y 8 de oscuridad, temperatura de 17 °C ± 3 °C y humedad relativa del 85%, durante 20 días. Cabe destacar que durante la fase de siembra no se empleó ningún desinfectante, toda vez que los explantes empleados procedieron de condiciones in vitro (Budisantoso et al., 2017; García et al., 2019; Borjas et al., 2020).
Preparación del medio de cultivo para la tuberización in vitro de Solanum tuberosum var. "Cochacina"
Para la preparación del medio de cultivo para la tuberización, se requirió MS, sacarosa (8 × 104 mg/L) y diferentes concentraciones de cloruro de mepiquat (CMe) y 6-BAP, siguiendo el diseño experimental: T1 (CMe (0 mg/L ) + 8 × 104 mg/L de sacarosa + 6-BAP (0 mg/L)); T2 (CMe (0 mg/L ) + 8 × 104 mg/L de sacarosa + 6-BAP (2,5 mg/L)); T3 (CMe (1000 mg/L) + 8 × 104 mg/L de sacarosa + 6-BAP (0 mg/L)) y T4 (CMe (1000 mg/L) + 8 × 104 mg/L de sacarosa + 6-BAP (2,5 mg/L)).
Una vez preparado el medio de cultivo, de acuerdo con el diseño indicado anteriormente, se autoclavó para luego proceder a refrescar el medio de cultivo en cámara de flujo laminar. Esta actividad consistió en eliminar el medio de cultivo líquido empleado durante la propagación de S. tuberosum var. “Cochacina”, remplazándolo por el medio de cultivo líquido para tuberización. Concluida esta actividad, los tratamientos se transportaron al cuarto de incubación, el cual estuvo acondicionado en un ambiente oscuro, a una temperatura de 17 °C ± 3 °C y 85 % de humedad relativa, por el espacio de 90 días.
Evaluación estadística
Para el análisis estadístico de los datos obtenidos, se usó el diseño experimental con cuatro tratamientos (dos de ellos, T1 y T2, no reportaron respuesta) y 120 unidades experimentales. Se empleó el software R para estimar el coeficiente de variación, desviación estándar y la prueba t de Student no pareada, debido a que solo se encontró respuesta en los tratamientos 3 y 4. Las variables fueron longitud, peso y ancho de los microtubérculos obtenidos.
Resultados y discusión
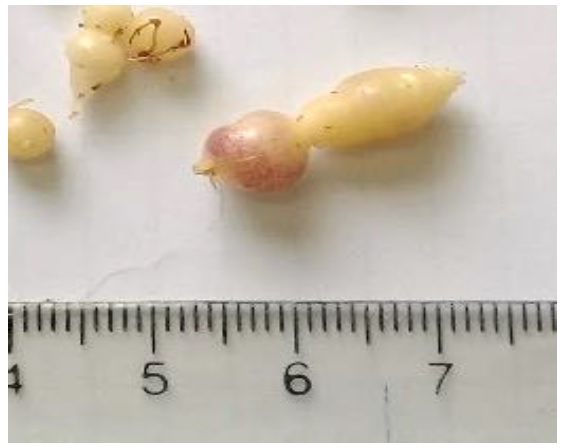
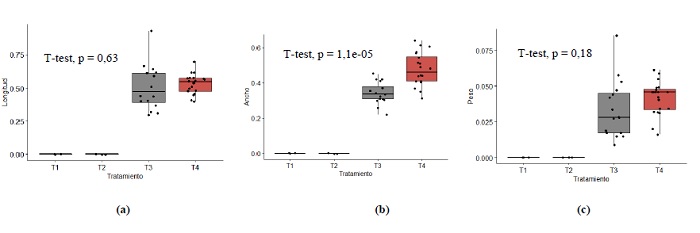
Como se puede verificar en la tabla 1, que muestra la estadística descriptiva del estudio sobre tuberización in vitro de Solanum tuberosum var. “Cochacina” de pulpa de color morado para las variables de longitud, ancho y peso, en los tratamientos 1 y 2 se obtuvieron valores de 0, debido a que el balance hormonal no propició el desarrollo de tubérculos in vitro, caso contrario en los tratamientos 3 y 4, donde sí se obtuvieron resultados de tuberización a los 90 días de inducción (figura 1). A su vez, la figura 2 muestra los resultados sobre la prueba t de Student para la comparación de grupos independientes del estudio sobre tuberización in vitrode Solanum tuberosum var. “Cochacina” de pulpa de color morado en los tratamientos 3 y 4 (Gil et al., 2016).
Tabla 1. Estadística descriptiva del estudio sobre tuberización in vitro de Solanum tuberosum L. var. Cochacina”, de pulpa de color morado; según longitud, ancho y peso por tratamiento
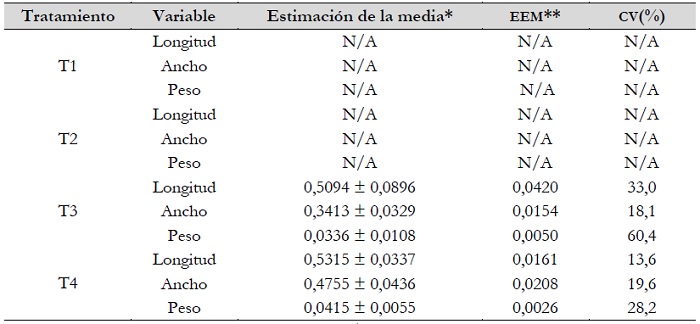
Notas aclaratorias:DE: desviación estándar, N/A: sin respuesta, debido a que no generaron tubérculos in vitro, CV: coeficiente de variación, *estimación de la media al 95,0% de confianza y **error estándar de la media.
Fuente: Elaboración propia
Fuente: Elaboración propia
Figura 1. Tubérculos in vitro de Solanum tuberosum var. “Cochacina”, de pulpa de color morado
Fuente: Elaboración propia
Figuras 2. Box plot y prueba t de Student para la comparación de grupos independientes del estudio sobre tuberización in vitro de Solanum tuberosum var. “Cochacina” de pulpa de color morado según longitud (2a), ancho (2b) y peso (2c) por tratamientoNota aclaratoria: la prueba de comparación de grupos T-test se realizó con base en los tratamientos 3 y 4. En los tratamientos 1 y 2 no hubo respuesta, debido a que no generaron tubérculos in vitro.
Para que el proceso de inducción de tubérculos in vitro de S. tuberosum sea favorecido convenientemente, se requiere del cese del crecimiento de las plántulas in vitro, la alta concentración de carbohidratos y las condiciones ambientales de oscuridad (Pineda et al., 2021), por lo que el cloruro de mepiquat (1000 mg/L) ejerció un efecto positivo en detener el crecimiento, toda vez que es conocido el efecto inhibidor de este fitorregulador en la primera fase de la ruta de biosíntesis de las giberelinas, tal como lo demuestran los estudios de Arias y Aristizábal (2021) y Nolasco (2020). Además de la facilidad de traslocación que presenta este fitorregulador a lo largo de la planta, tanto hacia arriba, con la corriente transpiratoria a través del xilema, como hacia abajo, mediante el fluido del floema, este alcanza su mayor concentración en los puntos de crecimiento como hojas jóvenes y entrenudos y causando una atrofia general en la planta (Cadena, 1999).
Asimismo, se resalta el rol de la sacarosa como el carbohidrato promotor de la inducción de tuberización in vitro, aportando energía a las células en división que ante la presencia de un fitorregulador que impide el alargamiento de yemas y raíces, generando tubérculos in vitro bajo condiciones de oscuridad y temperatura de 17 °C ± 3 °C, esto, por supuesto, dependiendo de la variedad o especie a emplear (Salazar & Soto, 2019). Por otro lado, Araque et al. (2018), Tacoronte et al. (2017) y Donnelly et al. (2003) sostienen que para la generación de tubérculos in vitro se deben tratar de igualar las condiciones ex vitro en las que, de manera natural, los tubérculos son tallos modificados subterráneos almacenadores de almidones para reserva de la planta.
La prueba t de Student mostrada en la figura 2, en cuanto a la variable longitud de tubérculos in vitro, muestra que no existe una diferencia significativa entre la media del tratamiento 3 y la del tratamiento 4. Así también, la prueba t de Student para el peso de los tubérculos in vitro muestra que no hay diferencias significativas entre la media del tratamiento 3 con la del tratamiento 4 en lo que respecta a la variable de peso (Gutiérrez & De la Vara, 2012). Por otro lado, en lo que respecta al ancho del tubérculo, existe una diferencia significativa entre la media del tratamiento 3 y la del 4, donde el mayor promedio muestral se encontró en el tratamiento 4 (figuras 2 y tabla 1).
Del análisis estadístico se afirma que la presencia de un mayor promedio muestral a los 90 días de evaluación permite inferir que el tratamiento 4 solo es mejor en lo que respecta al ancho del tubérculo in vitro, sin embargo, ante la obtención de resultados semejantes con el tratamiento 3, en cuanto a longitud y peso, esto implicaría ausentar el empleo de 6-BAP, por tanto, este tratamiento constituye una alternativa favorable en el proceso de tuberización desde el punto de vista económico, tal como lo confirman las investigaciones de Nolasco (2020) y Tacoronte et al. (2017), quienes corroboran que basta el empleo de una alta concentración de sacarosa en conjunto con fitorreguladores o fitohormonas, que ejercen un efecto positivo sobre la desdiferenciación celular, favoreciendo la generación de tubérculos in vitro de mayor calidad.
Conclusión
Ante los resultados obtenidos, se concluye que tanto el tratamiento 3, constituido por el medio de cultivo MS (1962), sacarosa (8 × 104 mg/L) y cloruro de mepiquat (1000 mg/L) y el tratamiento 4, constituido por el medio de cultivo MS (1962), sacarosa (8 × 104 mg/L), 6-BAP (2,5 mg/L) y cloruro de mepiquat (1000 mg/L), bajo condiciones de oscuridad, favorecen la inducción y la formación de tubérculos in vitro de S. tuberosum var. “Cochacina” de pulpa de color morado, sin embargo, desde el punto de vista económico, el tratamiento 3 resulta más prometedor. Se recomienda que en futuras investigaciones se oriente a evaluar la empleabilidad de los tubérculos in vitro en campo.
Contribución de los autores
Segundo E. López Medina: concepción de la idea del trabajo de investigación, interpretación de los datos y aprobación final del informe; José Mostacero León: concepción de la idea del trabajo de investigación, interpretación de los datos y aprobación final del informe; Armando E. Gil Rivero: ejecución del trabajo de invernadero; Angélica López Zavaleta: ejecución del trabajo de laboratorio; Anthony J. De La Cruz: recolección y procesamiento de los datos; Luigi Villena Zapata: análisis estadístico; Juan Amaro Villacorta: redacción del informe; Wilson Arcenio Maco Vásquez: diseño estadístico y traducción.
Implicaciones éticas
El presente artículo cuenta con el aval 09-2021 del comité de ética de investigación de la Universidad Escuela Colombiana de Ingeniería, radicado el 23 de noviembre del 2021. También se obtuvo el consentimiento de los colaboradores para usar la información suministrada en la documentación del proceso presentado en el artículo.















