Introducción
La papa (Solanum tuberosumspp. andigena) es un tubérculo que se cultiva en los Andes peruanos y que fue domesticado originalmente en América del Sur, distribuyéndose por los Andes desde Colombia hasta Chile (Kumari et al., 2018). Su domesticación data de entre 7000 y 10.000 años (Horton & Samanamud, 2013) y luego de un estudio filogenético, el origen de la papa se ubica en la parte sur de Perú (Spooner et al., 2005).Entre Bolivia, Perú y Ecuador se estima que crecen más de 4000 variedades, de las cuales más de 3000 se encuentran en Perú (Senasa, 2017). Además, la papa es ampliamente consumida y es una fuente de macronutrientes (carbohidratos, proteínas), micronutrientes (vitaminas, minerales) y compuestos bioactivos como polifenoles, antocianinas y propiedades antioxidantes (López-Cobo et al., 2014), incluso y principalmente en papas nativas harinosas se reportó una mayor cantidad de proteína y hierro (de Haan et al., 2019).
En Perú, se estima un consumo de papa de 81,3 kg per cápita para el 2030 (Scott & Kleinwechter, 2017), donde esta posee un rol importante en la nutrición de las personas, incluida la alimentación de los atletas (Kanter & Elkin, 2019), en la seguridad alimentaria (de Haan et al., 2019), el desarrollo económico del país (Wijesinha-Bettoni & Mouillé, 2019) y como suministro para la preparación de diversos platos alimenticios (Benson, 2019). La digestión in vitro es una valiosa herramienta que permite dilucidar la biodisponibilidad y la bioaccesibilidad de los nutrientes, así como estudiar la capacidad antioxidante de sus compuestos bioactivos (Zampedri et al., 2018).
La capacidad antioxidante en la papa está atribuida al contenido de polifenoles, antocianinas y vitaminas, donde estos antioxidantes juegan un papel muy importante en la inhibición de radicales libres y evitan posibles daños a las células (Chauhan et al., 2015). Además, los fitonutrientes y los componentes alimentarios bioactivos se convierten en un alimento funcional para mejorar la microbiota y la salud intestinal (Bibi et al., 2019), incluso poseen propiedades antiinflamatorias (Reddivari et al., 2019).
En papas cultivadas en Seúl, Corea del Sur, se reportaron altos contenidos de fenoles totales, antocianinas y propiedades antioxidantes (Lee et al., 2016). Además, el ácido L-ascórbico o vitamina C es el antioxidante más potente, por poseer en su estructura cuatro grupos OH, el cual puede donar hidrógeno a las especies reactivas como superóxidos, peróxidos, especies reactivas de nitrógeno y oxígeno singlete (Oroian & Escriche, 2015).
El tratamiento térmico por inmersión o proceso de cocción por inmersión en agua se realiza a temperatura promedio de 100 °C a 1 atmósfera, en este proceso la papa se encuentra inmersa en agua en la cual se hidrata y gelifica el almidón, donde algunas vitaminas se desnaturalizan por el tiempo de cocción. La fritura de los alimentos se realiza en aceite o grasa caliente a temperaturas entre los 175 °C y los 185 °C, donde el aceite actúa como transmisor de calor y produce un calentamiento uniforme en el alimento.
El proceso con microondas genera calor del interior del alimento al exterior a través de las vibraciones moleculares, en cambio, con el calentamiento convencional el calor se aplica desde el exterior hacia el interior, incrementando la temperatura en el alimento (Saguy & Dana, 2003). A pesar de los beneficios promovidos por los compuestos bioactivos como la reducción de la oxidación de lípidos, la prevención de la aterosclerosis, la hipertensión arterial y el cáncer, es importante evaluar su estabilidad después del procesamiento, porque factores como la temperatura y el tiempo pueden afectar su actividad y concentración (Mileo & Miccadei, 2016). Existe poca información del contenido en principios activos de papas nativas producidas en la región de Huánuco, así como del efecto de procesos de cocción, fritura y digestión in vitro. Vale resaltar los procesos térmicos a los cuales están sometidos las papas como alimento, los cuales provocarían variaciones en el contenido de antioxidantes. El objetivo de esta investigación fue evaluar el efecto de los tratamientos térmicos de hervido y frito y digestión in vitro de compuestos bioactivos en cuatro variedades de papas nativas.
Materiales y métodos
Muestras. Las muestras de papas nativas fueron elegidas por su aptitud para fritura realizadas en investigaciones previas (Natividad Bardales et al., 2022): clon de pulpa rojo (C1), clon de pulpa azul (C2), variedad Elena 1198 (V4) y variedad Kitipsho (V8), las cuales fueron obtenidas del centro poblado de Huallmish a 3500 m s.n.m., en el distrito de Churubamba, provincia de Huánuco, departamento de Huánuco, Perú.
Análisis fisicoquímicos. Estos se realizaron al tubérculo previo a la cocción: humedad, materia seca, ceniza, pH, sólidos solubles y acidez titulable se hicieron según recomendaciones de la aoac (2023). Los análisis de masa, tamaño y color se realizaron según Tang et al. (2015) (se muestrearon y molieron las papas de color heterogéneo).
Análisis de compuestos bioactivos
Preparación de muestras. Se desarrolló según lo reportado por Hirose et al. (2010). De las diferentes variedades de papa, se pesó 1 g de muestra, el cual se trituró en un mortero y se colocó en tubos Falcon de 50 ml, posteriormente se adicionaron 10 ml de metanol (Spectrum®) y se almacenó a 4 °C por 16 horas. Luego se centrifugó (Eppendorf Mini Spin Plus) a 10.000 rpm por cinco minutos y el sobrenadante (estuvo libre de impurezas) se almacenó a -20 °C (refrigerador Ingenious RMS1540YPR), para el posterior análisis de polifenoles totales, antocianinas, dpph y abts.
Contenido de polifenoles totales. Se empleó azul de Prussian, el cual se hizo reaccionar con 400 µl de solución A (0,5 mM FeCl3.6 H2O (CDH ®) en 0,01 N HCl (Sigma-Aldrich ®) en 400 µl de solución estándar de ácido gálico (Merck ®) en metanol (Spectrum®), de 1 a 20 ug/ml se dejó reaccionar por dos minutos y luego se adicionaron 400 µl de solución B (0,5 mM K3Fe (CN)6 en H2O destilada). Posteriormente, se agitó y se mantuvo en oscuridad, luego de 15 minutos se registró la absorbancia a 725 nm. El contenido de polifenoles totales se reportó en mg de equivalentes de ácido gálico (EAG)/g (Margraf et al., 2015).
Antocianinas. Se determinó por el método de pH diferencial reportado por Rapisarda et al. (2000) y se hizo reaccionar con 400 μl de muestra y 4600 μL de buffer a pH 1(125 ml de 0,2 M KCl y 375 ml de 0,2 M HCl) y buffer a pH 2 (400 ml de 1 M CH3COONa, 240 ml de 1 M HCl y 360 ml H2O). Luego de la reacción se registraron las absorbancias a 510 nm (especrofotómetro UV-vis Genesys 10S). La concentración de antocianinas se expresó en mg de cianidina-3-glucósido/100 g.
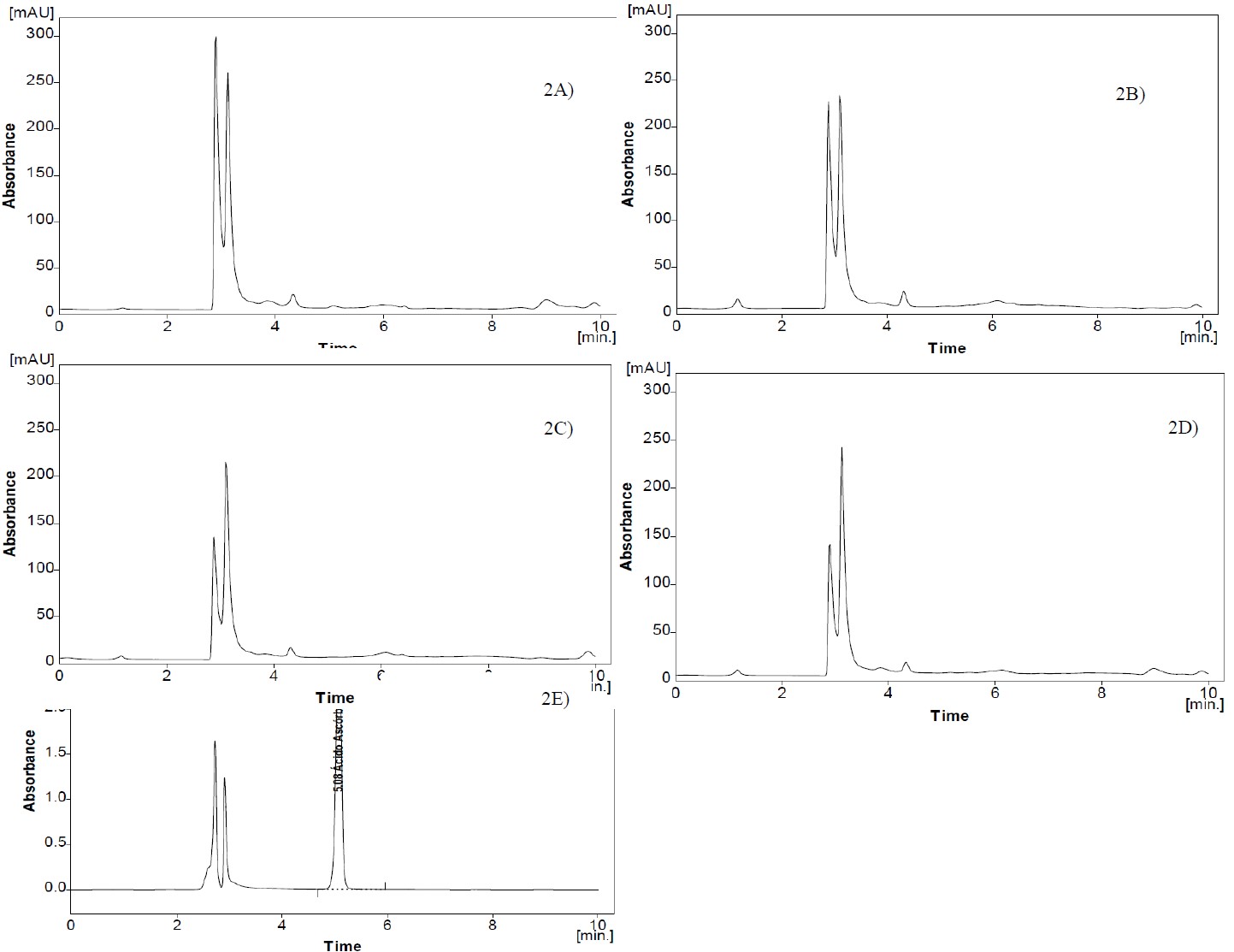
Vitamina C. Para cuantificar el ácido ascórbico, se pesaron 10 gramos de muestra de pulpa de papas frescas y se adicionaron 30 ml de ácido metafosfórico (4,5% en agua ultrapura), la muestra se dejó reposar una hora en un matraz ámbar y luego se centrifugó a 7000 rpm (Eppendorf ®) y se filtró (filtro milipore 0,22 µm Merck ®). La muestra filtrada se puso en viales ámbar de 1,5 ml. Se utilizó hplc (Kanauer) con columna C18 (promosil, EAGla Technologies USA, 250 × 4,6 mm diámetro interno y 5 μm tamaño de partícula), donde la fase móvil fue con ácido acético al 0,1%, flujo 0,8 ml/min a una temperatura de 25 ºC, presión 67 bar y la detección se realizó a 254 nm, luego se preparó una curva estándar de ácido ascórbico a concentraciones de 200 a 1000 mg/ml (Pertuzatti et al., 2015).
Actividad antioxidante, método del 2,2-diphenil-1-picrilhidrazil (dpph). Se realizó según las indicaciones de Hirose et al. (2010), donde se hicieron reaccionar 50 µl de muestra con 950 µl de solución dpph (Sigma-Aldrich ®) en metanol (Spectrum®) a 100 µM, se dejó reaccionar en oscuridad por 30 minutos y luego se registró la absorbancia a 517 nm, donde la capacidad de secuestro del radical dpph se expresó en µg equivalentes de trolox (et)/g y se construyó una curva estándar con Trolox (2,5 a 20,0 mg /100 ml).
Actividad antioxidante, método abts (2, 2'-Azinobis-3-etil-benzo-tiazolina-6-ácido sulfónico). Para la solución stock, se mezclaron 7 mM de abts (Sigma-Aldrich ®) con 88 µl a 144 mM de persulfato de potasio (Sigma-Aldrich ®) en agua, se dejó en oscuridad por 16 horas antes de usar (protegiendo de la luz) y luego la solución de trabajo de abts+ se disolvió en etanol a 95° (~1:40). Posteriormente, se hicieron reaccionar 50 µl de extracto de las muestras con 950 µl de solución abts, se dejó reaccionar en oscuridad por 10 minutos, donde la absorbancia se registró a 734 nm los resultados en µg de et/g. Asimismo se preparó una curva estándar con Trolox de 0 - 20 mg/100 ml (Fellegrini et al., 1999).
Proceso de cocción. Las muestras de papas nativas se sometieron a tratamientos de cocción: frito (cortadas en bastón) en aceite por 12 minutos a 190 ± 10 °C y hervido (papas enteras) por 37 minutos. Luego se sometió a digestión in vitro y se evaluaron los principios activos y la capacidad antioxidante.
Digestión in vitro. Se realizó según lo descrito por Faller et al. (2021), se mezcló 1 g de muestra con solución salina (140 mM de NaCl, 5 mM de KCl y 150 µM de BHT), la cual se aforó a 4,5 ml, posteriormente la mezcla se agitó en vórtex y se acidificó con HCl 0,1 M hasta pH 2. A continuación se realizó la digestión gástrica con la adición de 125 µl de solución de pepsina (200 mg de pepsina (Himedia ®) en 5 ml de HCL 0,1 M), donde la mezcla se sometió a agitación a 37 °C por una hora. Luego la solución se ajustó a pH 6,9 con adición de bicarbonato (NaHCO3 0,1 M) y para la digestión intestinal se adicionaron 625 µl de solución biliar de pancreatina (225 mg de extracto biliar (Himedia ®) y 37 mg de pancreatina (Himedia ®) en 18,7 ml de NaHCO. 0,1 M) y se incubó en agitación a 37 °C por dos horas. Finalmente, el extracto restante se centrifugó (Eppendorf Mini Spin Plus) a 10.000 rpm por cinco minutos y el sobrenadante se empleó para los posteriores análisis de los bioactivos.
Análisis estadístico. Los resultados se reportaron como media ± desviación estándar (n = 6). Se hizo un Anova multifactorial (p < 0,05) para evaluar el efecto de la digestión in vitro, variedades y método de cocción sobre los compuestos bioactivos. Asimismo se aplicó una prueba de comparación múltiple Tukey (p < 0,05). En este proceso se utilizó el programa Statistical Package for the Social Scienses (spss), versión 20 (Hernández-Medina et al., 2008).
Resultados y discusión
Análisis fisicoquímicos. Los resultados de las muestras de papa nativa (figuras 1) mostraron diferencia en la distribución de colores en la pulpa, así como en la intensidad del color.

Fuente: Elaboración propia
Figuras 1. Muestras de papas nativas evaluadas en la investigación: clon 01 de pulpa rojo (C1), clon 02 de pulpa azul (C2), variedad Elena 1198 (V4) y variedad Kitipsho (V8).
Los análisis de peso, longitud, ancho y color (tabla 1) mostraron diferencias significativas (P < 0,05) con respecto a la muestra V8 que mostró mayor peso y ancho con 99,46 ± 1,94 g/unidad de papa, mientras que las muestras C1 y C2 no mostraron diferencia de ancho de papa (P > 0,05). Al respecto, Muhammad et al. (2018) mencionan que las dimensiones en las papas dependen de la variedad, la fecha de siembra, etc.
Por su parte, los pesos de las papas nativas evaluadas se encuentran entre 61,99 ± 1,90 y 99,46 ± 1,94 g/unidad; además, Jiménez et al. (2009) reportó pesos de papas nativas cultivadas en Tucumán, Argentina, desde 11,44 ± 2,83 g/unidad, en variedad Imilla Colorada y 147,48 ± 66,56 g/unidad en variedad Señorita, sin embargo, Galdón et al. (2012) reportaron pesos promedios de 17,3 ± 6 a 39,4 ± 6,0 g/unidad en Solanum tuberosum ssp.
Tabla 1. Medición de pesos, longitud y color de pulpa de papas nativas crudas
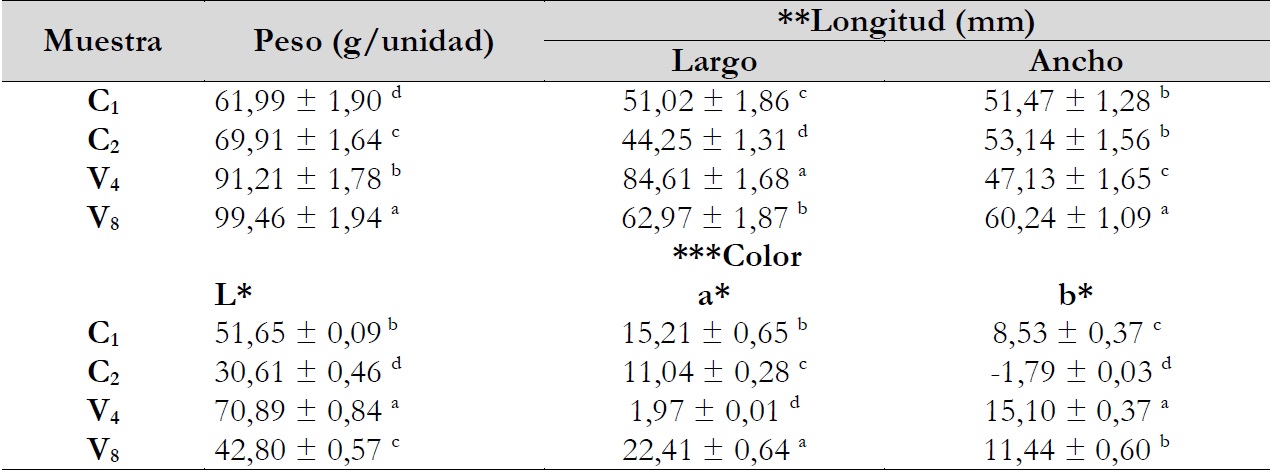
Notas aclaratorias:los resultados expresados son como promedio ± desviación estándar, **n = 10 y ***n = 3 (pulpas muestreadas y molidas); las medias con diferente letra en la misma columna son significativamente diferentes (p < 0,05); C1 = clon de pulpa roja, C2 = clon de pulpa azul, V4 = variedad Elena 1198, V8 = variedad Kitipsho, L*a*b*, donde L* indica la luminosidad y a* y b* son las coordenadas cromáticas rojo/verde y amarillo/azul, respectivamente.
Fuente: Elaboración propia
Los colores de la pulpa (tabla 1) reportaron rangos de valores de L* de 30,61 ± 0,46 a 70,89 ± 0,84; a* de 1,97 ± 0,01 a 22,41 ± 0,64 y b* de -1,79 ± 0,03 a 15,10 ± 0,37 (p < 0,05); al respecto, Zhou et al. (2019) evaluaron seis cultivares de Solanum tuberosum y reportaron valores de L* de 64,15 ± 0,87 a 71,98 ± 0,49, encontrándose V. dentro de este rango con 70,89 ± 0,84; mientras que a* comprendió de -3,07 ± 0,03 a -1,72 ± 0,10 y b* de 20,14 ± 0,60 a 23,10 ± 0,19; por otra parte, Lee et al. (2016) reportaron resultados realizados en Corea del Sur en papas coloradas, donde L* mostró variación de 61,0 ± 0,2 a 82,7 ± 0,2 y a* de -0,5 ± 0,0 a 8,9 ± 0,3, mientras que b* fluctuó de -3,2 ± 0,1 a 75,5 ± 0,1. La conservación de los colores debido al contenido de fitonutrientes es una característica importante en el valor comercial de las papas (Navarre et al., 2019).
En los resultados de los análisis fisicoquímicos (tabla 2) se mostraron diferencias significativas (p < 0,05) y con respecto a sólidos solubles se encontraron valores desde 5,00 ± 0,10 hasta 6,13 ± 0,06 g de sacarosa/100 g de extracto líquido, al respecto, Duarte-Delgado et al. (2015) validaron un método para la cuantificación de sacarosa en Solanum tuberosum empleando cromatografía líquida, en el cual reportaron un mínimo de 0,93 y un máximo de 3,11g de sacarosa/100 g de tubérculo. La humedad varió de 72,04 ± 0,43 a 79,49 ± 0,48 g H2O/100 g, donde la materia seca se encontró en el rango de 20,51 ± 0,48 a 27,96 ± 0,43 g/100 g; por su parte, Kolbe & Stephan-Beckmann (1997) reportaron de 19,0 % a 22,9 % de materia seca, mientras que Zhou et al. (2019) reportaron valores de humedad superiores desde 76,96 ± 0,27 a 85,79 ± 0,27 g H.O/100 g.
Tabla 2. Análisis fisicoquímico de cuatro muestras de papas nativas crudas
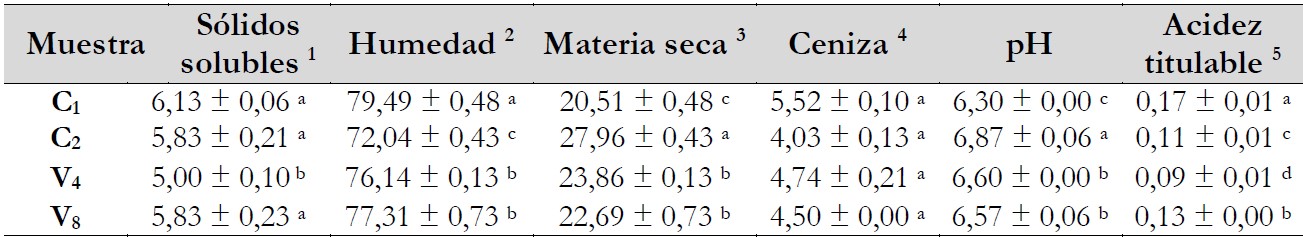
Notas aclaratorias:resultados expresados como promedio ± desviación estándar; medias con diferente letra en la misma columna son significativamente diferentes (p < 0,05), C1 = clon de pulpa roja, C2 = clon de pulpa azul, V4 = variedad Elena 1198, V8 = variedad Kitipsho, (1): g de sacarosa/100g de extracto líquido, (2): g H2O/100g, (3): g/100g, (4): g/100g base seca y (5) g de ácido ascórbico/g de muestra.
Fuente: Elaboración propia
De manera similar, Galdón et al. (2012) obtuvieron valores de humedad desde 70,8 ± 0,7 hasta 78,4 ± 0,3 g H2O /100 g, donde las cenizas presentes estuvieron en un rango de 4,03 ± 0,13 a 5,52 ± 0,10 g/100 g de base seca, al respecto Zhou et al. (2019) reportaron de 4,52 ± 0,04 hasta 5,83 ± 0,05 g/100 g en catorce cultivares de Solanum tuberosumproducidos en China. Por su parte, Narváez-Cuenca et al. (2018) mencionaron valores ligeramente superiores, desde 3,2 hasta 6,9 g/100 g, donde los valores de pH se encontraron desde 6,30 ± 0,00 hasta 6,87 ± 0,06 (p < 0,05) y en acidez titulable (g de ácido ascórbico/g de muestra) de 0,09 ± 0,01 a 0,17 ± 0,01; resultados similares mostraron Kolbe & Stephan-Beckmann (1997) con 102-158 mg de ácido ascórbico/100 g de muestra seca y valores de pH desde 5,7 ± 0,2 hasta 6,3 ± 0,1 y Galdón et al. (2012) reportaron valores de ácido ascórbico desde 10,4 ± 1,7 hasta 31,1 ± 1,1 mg/100 g, pH desde 5,7 ± 0,2 en el cultivar Torrenta y 6,3 ± 0,1 en el cultivar Bonita Negra.
VitaminaC
La vitamina C cumple un rol importante como antioxidante y en los procesos metabólicos del ser humano (Sheraz et al., 2015). Luego del análisis en las papas nativas crudas (figuras 2), no se detectó la presencia de vitamina C, sin embargo, García-Torres et al. (2022) encontraron en papa y hojuela de papa 26,8 y 16,5 mg/100 g de vitamina C (suma de ácido ascórbico y dehidroascórbico) en base seca, en su metodología detallan que fue determinado después de la reducción del ácido dehidroascórbico a ácido ascórbico usando DL-Ditiotreitol. Asimismo, Talley et al. (1984) evaluaron diferentes variedades de papa, entre ellas Centennial Russet, Katahdin, Kennebec, Norchip, Norgoid, Pontiac, Superior, Russet Burbank y White Rose, obtenidas de lugares como California, Maine, North Dakota, Washington e Idaho, donde los resultados reportaron que las variedades Kennebec, Norchip y Superior cultivadas en North Dakota no contenían ácido ascórbico, sin embargo, cuando fueron cultivadas en otras zonas se detectó la presencia de vitamina C.
Se sabe que las plantas tienen ritmos circadianos que responden a cambios ambientales, la fotosíntesis es típicamente rítmica y resulta en una serie de procesos fisiológicos periódicos, como la síntesis de ácido ascórbico (Wang et al., 2013), así como la activación de genes (Ren et al., 2013). Además, la ausencia total del ácido ascórbico estaría relacionada a procesos de oxidación inducidos por los iones de metales libres (reacciones redox) o por la presencia de enzimas como ascorbato oxidasa o ascorbato peroxidasa (Liang et al., 2017; Smirnoff, 2018; Villanueva-Tiburcio et al., 2010; Vinci et al., 1995). Además, Hernández et al. (2006) recomiendan que para garantizar que el análisis por cromatografía líquida sea efectivo, es importante optimizar la extracción del ácido ascórbico en muestras complejas; además, es esencial inactivar las enzimas degradantes que pueden destruir el ácido ascórbico durante la extracción.
Efecto de la digestión in vitro en antioxidantes en papa fresca (previo al tratamiento térmico)
Los resultados del efecto de la digestión en compuestos bioactivos se muestran en la tabla 3. Con respecto al contenido de polifenoles sin digestión, se destaca que la muestra V. tuvo una mayor cantidad de polifenoles con 120,88 ± 0,85mg eag/g base seca y C2 el de menor cantidad con 96,87 ± 0,67 mg eag/g base seca (p < 0,05), luego de la digestión in vitro, se aprecia un ligero descenso de los polifenoles C1, V4 y V8 (82,94 ± 0,32; 23,68 ± 0,67 y 90,55 ± 0,37, respectivamente) y ausencia en C2. La disminución de fenoles totales en la digestión in vitro puede ser consecuencia de la inestabilidad de estos compuestos cuando se exponen a altos valores de pH (Ji et al., 2012); además, los resultados en el presente experimento se encuentran por debajo del rango mencionado por Lee et al. (2016), quienes reportaron de 423,92 a 385,84 mg eag/100g en muestras de papas nativas variedades: Superior, Hongyoung, Jayoung, Jasim, Jaseo y Seohong. Por su parte, Zhou et al. (2019) reportaron variaciones entre 113,11 y 189,30 mg eag/100g de muestra seca en el cultivares de papas Neida 35 y Neida 22.
Tabla 3. Compuestos bioactivos en papas nativas crudas sin y con digestión in vitro

Notas aclaratorias:los valores se dan como media ± desviación estándar (n = 3), eag: equivalente ácido gálico, g b. s.: gramos en base seca; diferentes letras mayúsculas en superíndice indican diferencias significativas entre muestras sin y con digestión in vitro (p ≤ 0,05) y se leen en vertical y, por último, diferentes letras minúsculas en superíndice indican diferencias significativas respecto a las variedades de papa por compuesto activo analizado (p ≤ 0,05) y se leen en horizontal.
Fuente: Elaboración propia
Con respecto al contenido de antocianinas, en papas C1 y V8 sin digestión, se obtuvieron 1,22 ± 0,03 y 2,72 ± 0,06, mientras que en C2 y V4 no se detectaron (ND), luego de la digestión se encontró que el clon C1 y V8 tuvieron 12,19 ± 0,34 y 1,75 ± 0,05 mg de cianidina-3-glucósido/100 g, incrementándose en 999% y disminuyendo en 64%, al respeto, el incremento de antocianinas en la muestra C1 estaría relacionado con el proceso de liberación de antocianinas por efecto de la digestión y la acción de enzimas y pH, otra característica importante sería la reactividad intrínseca tal como lo manifiesta Koh et al. (2020), ya que la presencia de grupos hidroxilos en el anillo B disminuye la estabilidad en medios neutrales; mientras que los grupos metoxi, en el anillo B, incrementan la reactividad de las antocianinas (Liu et al., 2014). Soriano Sancho et al. (2015) mencionan que el contenido de antocianinas se relaciona con el color, los cuales fueron rojos oscuros con mayores valores de a* de 15,2 ± 0,65 y 22,41 ± 0,64 para C1 y V8, mientras que para C2 y V4 probablemente estaría relacionado con la presencia de tocoferoles, debido a que se reportaron su presencia en variedades de papa (Chitchumroonchokchai et al., 2017; Tatarowska et al., 2019).
Por su parte, Lee et al. (2016) reportaron de 89,05 a 83,90 mg cianidina 3 glucósido/100 g b. s., donde los resultados obtenidos en la presente investigación son menores y sostienen que la cantidad de antocianinas depende de la variedad, el tiempo de cosecha y la región de cultivo; además, la intensidad de la luz, la temperatura y la radiación solar juegan un papel importante en la biosíntesis de las antocianinas en papas; al respecto, las muestras de papas utilizadas en este estudio fueron cosechadas en septiembre del 2019 en la región de Huánuco, Perú. El 2,2-difenil-1-picrilhidracilo (dpph) y 2, 2'-Azinobis-3-etil-benzo-tiazolina-6-ácido sulfónico (abts) permiten evaluar las propiedades antioxidantes en frutas y vegetales (Becker et al., 2019). Así, las muestras con digestión in vitro ofrecieron una mayor capacidad antioxidante frente al abts, en dpph sin digestión las muestras C1 y V8 con 153,88 ± 2,72 y 142,89 ± 2,72 µmol et/g base seca (p > 0,05), las cuales tuvieron mayores valores, mientras que frente al abts sin digestión fue la muestra C1, seguida por V8, C2 y V4 la que tenía 453,54± 2,83; 238,32 ± 2,56; 166,35 ± 1,04 y 133,60 ± 1,86 µmol et/g base seca (p < 0,05).
Lo curioso es que no se detectó capacidad antioxidante luego de la digestión según el método de radical dpph, esto se podría atribuir a las interferencias con los reactivos de la determinación de dpph con los empleados en la digestión (Abramovič et al., 2018). Por el método de abts se encontraron interesantes contenidos de capacidad antioxidante desde 607,48 ± 1,41 hasta 998,72 ± 1,64 µmol et/g b. s., correspondientes a las muestras V4 y C1. Por su parte, Floegel et al. (2011) mencionaron que en experimentos de evaluación de mayor capacidad antioxidante entre abts y dpph, donde el abts fue superior a dpph en diversos alimentos que poseían compuestos hidrofílicos, lipofílicos y pigmentos, y donde la mayor actividad antioxidante estaría relacionada con la capacidad del radical libre de reaccionar con los hidrógenos de los polifenoles (Abramovič et al., 2018). Resultados reportados por Lee et al. (2016) mostraron que la mayor capacidad antioxidante en papas coloreadas frente al abts fue la variedad Hongyoung, con 121,39 mg aae/100 g en muestra seca, seguida por la variedad Jayoung con IC50 de 2,76 mg/ml frente al dpph. Asimismo, Ru et al. (2019) obtuvieron resultados similares, donde los polifenoles de fracciones libres tuvieron una mayor capacidad para inhibir el abts con rangos de 21,23 a 309,48 µM et/100 g.
Efecto de los tratamientos térmicos y digestión in vitro en contenido de compuestos bioactivos
Métodos de cocción. Existen diferencias significativas entre tratamientos (frito por 12 minutos de 180 °C a 200 °C y hervido por 37 minutos, alrededor de 95 °C) y de antes y después de la digestión (P < 0,05). Los tratamientos de cocción mediante hervido y fritura indujeron variaciones en el contenido de principios activos (tabla 4), donde el proceso de fritura de las papas ocasionó la degradación de los componentes polifenólicos en comparación con el proceso de cocción por ebullición (Kita et al., 2013).
Compuestos bioactivos. A pesar de los beneficios promovidos por los compuestos fenólicos, como la reducción de la oxidación de lípidos, la prevención de aterosclerosis, hipertensión arterial y cáncer, es importante evaluar su estabilidad después del procesamiento, porque factores como la temperatura y el tiempo en almacenamiento podrían afectar sus propiedades antioxidantes (Huang et al., 2013; Mileo & Miccadei, 2016), así como la formación de compuestos secundarios por la reacción de Maillard (Jansky, 2010). Con respecto al contenido de polifenoles, antocianinas y capacidad antioxidante, existen diferencias significativas (P < 0,05) (tabla 4).
Antocianinas. Luego de la cocción por fritura y el hervido antes de la digestión, el contenido de antocianinas se incrementó en C2 a 25,95 y 32,86, mg de cianidina 3 glucósido/100 g b. s. y V. a 29,03 y 3,51 mg de cianidina 3 glucósido/100 g b. s. (mientras que en papas frescas no se detectaron al ser evaluadas con y sin digestión in vitro) (tabla 3). Al respecto, Bellumori et al. (2017), Burgos et al. (2013) y Tierno et al. (2015) reportaron que las antocianinas en papas nativas se incrementaron después del proceso de cocción por ebullición. Estos resultados de las antocianinas son similares a los reportados por Lemos et al. (2015) con 4,59 mg cianidina 3-glucósido/100 g, donde luego de la digestión in vitroel C1 y el V8 tuvieron diferencias estadísticas de las otras muestras en antocianinas, respecto a los métodos de cocción.
Polifenoles. Con respecto al contenido de polifenoles, solo en el tratamiento con cocción por hervido, las muestras C1, V4 y V8 incrementaron su contenido, siendo estos valores más altos que la muestras antes de la digestión in vitro (Ji et al., 2012; Soriano Sancho et al., 2015). Los polifenoles se vieron reducidos después de la digestión in vitro, al respecto, Granito et al. (2007) mencionaron que un proceso como la cocción puede promover la degradación entre los anillos aromáticos de los compuestos fenoles, lo que lleva a reacciones de polimerización o roturas estructurales, lo cual se refleja en un menor contenido fenólico en las muestras cocidas.
Capacidad antioxidante mediante dpph. En la capacidad antioxidante por dpph antes de la digestión in vitro, las papas nativas sometidas a fritura incrementaron su actividad antioxidante luego de la digestión in vitro a excepción de V4, la cual redujo su actividad antioxidante; mientras que para las muestras sometidas a cocción por hervido, C2, V4 y V8 disminuyeron su capacidad antioxidante frente al radical dpph; estos resultados quizás estén relacionados con el efecto de liberación de los antioxidantes de la pulpa de la papa y la consiguiente degradación por el efecto de la digestión in vitro. Al respecto, Lemos et al. (2015) reportaron que las papas nativas cocidas presentaron una mayor capacidad antioxidante.
Tabla 4. Contenido de compuestos bioactivos de papas nativas (molidas) sometidas a digestiónin vitro, antes y después de tratamiento térmico de hervido y fritura
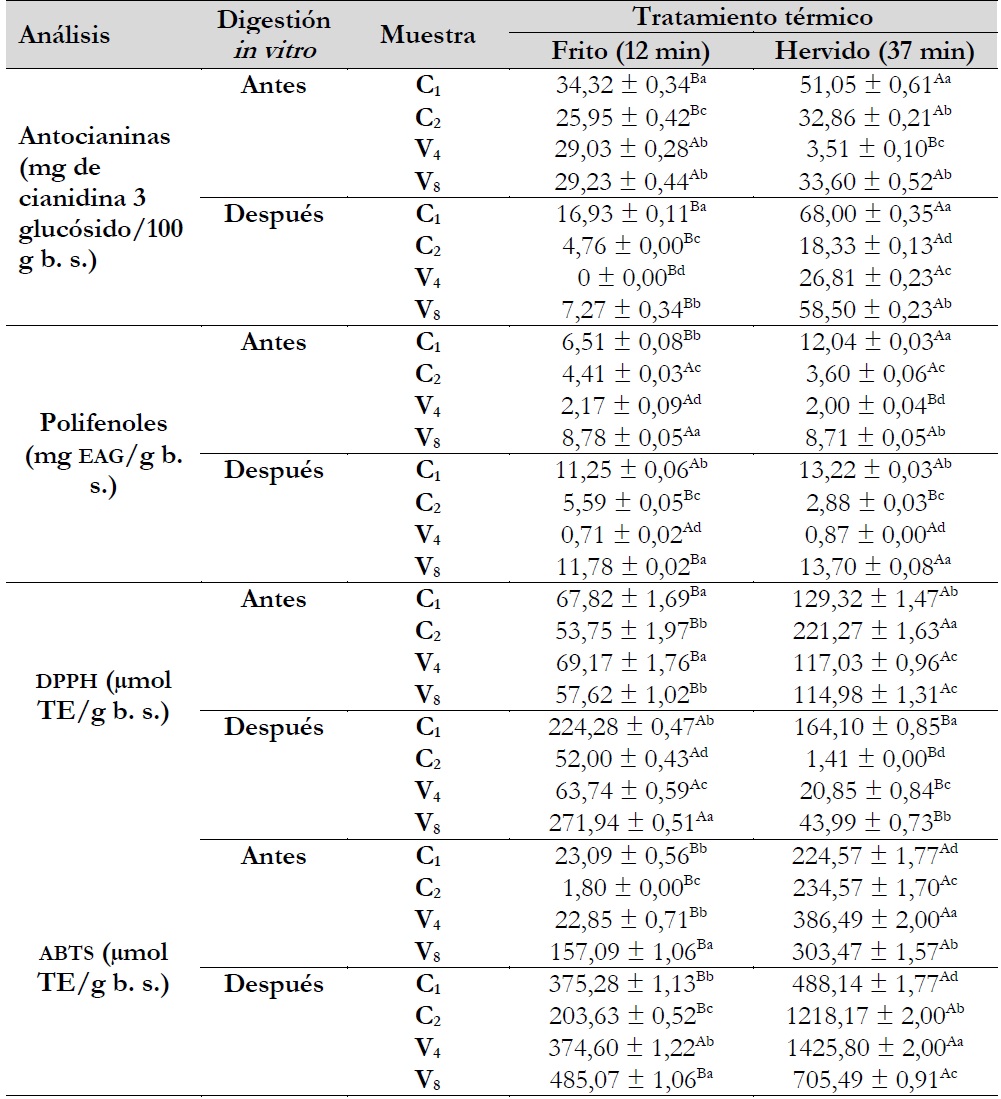
Notas aclaratorias:los valores se dan como media ± desviación estándar (n = 3), donde eag: equivalente ácido gálico, g b. s.: gramos en base seca; además, diferentes letras mayúsculas en superíndice dentro de una fila indican diferencias significativas entre métodos de cocción (p ≤ 0,05) y se leen en vertical y diferentes letras minúsculas en superíndice dentro de una columna indican diferencias significativas entre las variedades de papa para un método de cocción específico (p ≤ 0,05) y se leen en horizontal.
Fuente: Elaboración propia
Capacidad antioxidante mediante abts. La fritura ejerció un efecto positivo en las muestras de papas para secuestrar el catión abts, ya que en todas las muestras se incrementó su actividad antioxidante, este comportamiento estaría relacionado con la sensibilidad del catión abts a ser inhibido por los antioxidantes en las muestras de papas nativas. En un estudio de actividad antioxidante, se encontró que los polifenoles no antocianos mostraron una mayor estabilidad en el pH intestinal, por lo que sugieren que la actividad antirradical puede depender del pH (Tagliazucchi et al., 2010). Además, los análisis realizados en la investigación fueron limitados en cuanto a la población de las zonas de cultivo de papas nativas, sin embargo, ofrecen un panorama básico para seguir desarrollando investigación considerando diversas zonas de producción, así como la inclusión de otras variedades de papas nativas.
Conclusiones
La concentración de compuestos bioactivos como antocianinas, polifenoles totales y capacidad antioxidante en las cuatro variedades de papas nativas frescas y luego de la digestión in vitro, cultivadas en la región Huánuco, fueron afectadas por los procesos de cocción (hervido y fritura), donde el hervido incrementó la capacidad antioxidante de las papas nativas, especialmente en C2 y V4, probablemente por la liberación de principios activos presentes en las pulpas, mientras que la fritura generalmente afectó a los antioxidantes, este fenómeno estaría relacionado con la temperatura, ya que el proceso de fritura ocurre a temperaturas superiores a los 170 °C. Estos resultados ofrecen un panorama básico sobre el comportamiento de principios activos sometidos a diferentes procesos de cocción.
Contribución de los autores
Ángel David Natividad Bardales: responsable del estudio y asesor de los tesistas; Juan Edson Villanueva-Tiburcio: revisor del borrador del manuscrito; Ruth Esther Chamorro Gómez: redacción, análisis e interpretación de los resultados de los bioactivos; César Robert Cueto Rosales: metodología y resultados de la vitamina C; Pilar Rocío Capcha Godoy: análisis en el laboratorio bajo las indicaciones de los docentes; José Luis Paucar Tito: análisis en el laboratorio bajo las indicaciones de los docentes; Alejandro Mendoza Aguilar: trabajo en el campo para la producción de la papas.
Implicaciones éticas
El presente artículo cuenta con el aval de la Resolución Nº0124-2019-UNHEVAL-VRI del 26 de marzo del 2019 de la Universidad Nacional Hermilio Valdizán. También se obtuvo el consentimiento de los colaboradores para usar la información suministrada en la documentación del proceso presentado en el artículo.