Introducción
El trematodo Fasciola hepatica está ampliamente distribuido a nivel mundial y afecta a los animales de producción. En este contexto, los caballos suelen coexistir y compartir los mismos pastos que los rumiantes y se presume que son resistentes a la infección por F. hepatica, donde el periodo prepatente puede ser más amplio o también puede que los huevos nunca se excreten (Alves et al., 1988; Soulé et al., 1989), sin embargo, se ha podido evidenciar que los miembros de la familia Equidae siempre han sido susceptibles al reportarse huevos de este trematodo en paleofecas de onagros persas en un sitio arqueológico al noreste de Irán, el cual data de los años 224 - 651 d. C., además se plantea que la patogenicidad de este parásito contribuyó en la extinción de algunas especies del género Equus (Askari et al., 2018). Actualmente, F. hepaticaafecta a todas las especies del género Equus y se ha descrito en mulas en las que se genera anemia, una fuerte inmunosupresión e incluso puede causar la muerte (Mera y Sierra et al., 2020), en asnos (Vargas-Rocha et al., 2021) y en caballos de diversos países como Chile (Alcaíno et al., 2005; Muñoz et al., 2008), Reino Unido (Howell et al., 2020), Irlanda (Quigley et al., 2020) y México (Villa-Mancera & Reynoso-Palomar, 2020).
En los andes peruanos, la alta presencia del hospedador intermediario (caracoles Lymnaeidae) propicia el cierre del ciclo biológico de F. hepatica e infecta con metacercarias los pozos, las acequias y los ríos en las que beben los equinos; además, los forrajes verdes y los pastos naturales regados con estas mismas aguas agravan el problema (Chávez-Arce & Zamarán, 2021). Por otro lado, el pastoreo conjunto o rotativo de caballos con rumiantes en los predios de zonas endémicas favorece la exposición y eleva el riesgo de ingerir o formar infectantes (Arias et al., 2012; Quigley et al., 2020). Existen otros factores predisponentes como la edad, el clima (tropical) y la especie, siendo más susceptibles las mulas, los asnos a nivel intermedio y los caballos son los menos susceptibles (Villa-Mancera & Reynoso-Palomar, 2020).
El diagnóstico de F. hepatica en caballos mediante técnicas serológicas ha dado buenos resultados (Vargas et al., 2001; Arias et al., 2012; Villa-Mancera & Reynoso-Palomar, 2020), principalmente por algunas proteínas obtenidas de la secreción-excreción del trematodo, como la catepsina L1 que ofrece una alta sensibilidad en los ensayos por inmunoadsorción ligado a enzimas (Elisa) (Salimi-Bejestani et al., 2005; Quigley et al., 2017); sin embargo, los altos costos y la baja disponibilidad en territorio peruano de estas pruebas comerciales representan un gran obstáculo. Por esta razón, los análisis coproparasitológicos como Mini-Flotac, Flukefinder® y la sedimentación natural siguen siendo buenas opciones, ya que alcanzan o superan el 90 % de sensibilidad (Bosco et al., 2023).
No cabe duda de que los diversos protocolos deben complementarse para obtener una mayor precisión en el estudio epidemiológico de las parasitosis en esta especie (Quigley et al., 2020); además, se necesitan medidas de control alternas en el manejo para reducir la exposición de los animales a F. hepatica, más cuando el tratamiento también es un problema por la creciente resistencia a los antiparasitarios (Rathinasamy et al., 2021; Torrel-Pajares et al., 2023). Ante esto, el presente trabajo se desarrolló para conocer la prevalencia de fascioliasis en caballos criollos del norte andino peruano por primera vez y así alertar sobre su control y diseminación a zonas con condiciones óptimas para el desarrollo de la enfermedad.
Materiales y métodos
Área de estudio: la investigación se desarrolló en los distintos puntos de cría de caballos criollos del distrito de Cajamarca, aquí se recolectaron las muestras y se procesaron en el Laboratorio de Parasitología Veterinaria y Enfermedades Parasitarias de la Facultad de Ciencias Veterinarias, de la Universidad Nacional de Cajamarca (figura 1). La zona está a una altitud de 2750 m s.n.m., una temperatura media anual de 14,8 °C, precipitación pluvial anual de 801,8 mm y una humedad relativa promedio anual de 68,9% (Senamhi, 2017); además, la región colinda con Ecuador y por la frontera transitan constantemente especímenes y enfermedades tropicales.
Determinación del tamaño de la muestra: el cálculo del tamaño muestral se dio con base a un antecedente, una población infinita y con un nivel de confianza del 95%, donde la prevalencia propuesta para el cálculo también conformó la hipótesis, la cual fue de 43,62% (Caicedo, 2000; Aguilar-Barojas, 2005; Jaramillo & Martinez, 2010) y de la cual se obtuvo un total de 237,29 (237) animales.
Colección de muestras: las muestras fecales (aproximadamente 100 g) se recolectaron directamente del recto de los caballos no dosificados con antiparasitarios en los últimos tres meses y con edades mayores a un año. Las heces se introdujeron en bolsas individuales de polietileno rotuladas dentro de una caja de poliestireno expandido, conservadas con geles refrigerantes y fueron trasladadas al laboratorio para el respectivo análisis coproparasitológico. Estas actividades tuvieron lugar en las mañanas (6:00 horas) y en algunos casos en las tardes (15:00 horas).
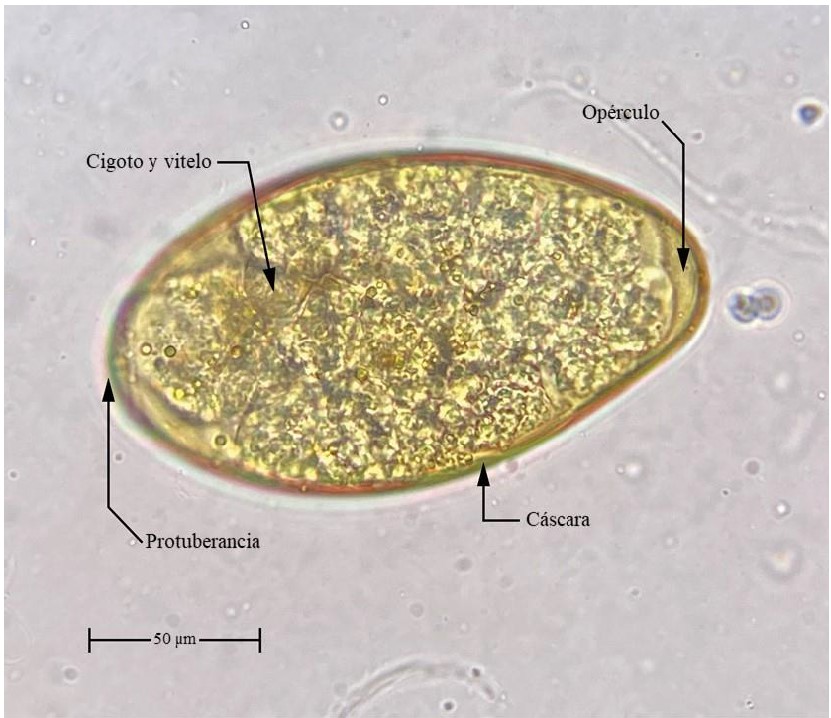
Análisis coproparasitológico: las muestras de heces se procesaron en el laboratorio y se hizo uso de la técnica de sedimentación rápida, descrita por Lumbreras et al. (1962). Esto correspondió a: pesar 3 g de heces y homogeneizar en un vaso con agua corriente para formar una solución que finalmente se tamizó a través de una malla metálica de 200 µm de luz. La solución tamizada reposó por cinco minutos en un vaso de vidrio de fondo cónico y luego se decantó el sobrenadante. El proceso se repitió 3 o 4 veces hasta que la solución estuvo lo más traslúcida posible (con la menor cantidad de detritos) y luego de la última decantación se adicionaron dos gotas de azul de metileno, se traspasó a una placa Petri y se observó en estereomicroscopio binocular a aumento de 3X. La comprobación se hizo pipeteando cuidadosamente los huevos y montándolos en láminas portaobjetos para la observación en un microscopio binocular con potencia de aumento de 10X y 40X. Asimismo, para la correcta identificación se consideraron las claves de Foreyt (2013) (figura 2).
Fuente: Elaboración propia
Figura 2. Huevo de Fasciola hepatica observado en el microscopio a 40XNotas aclaratorias: las flechas negras indican algunos caracteres considerados para la identificación.
Gestión de los datos y análisis estadístico: la investigación fue en ciencias básicas, de tipo transversal y descriptiva. Se usó estadística descriptiva y se calculó la prevalencia al dividir las muestras positivas entre el total de muestras procesadas y multiplicadas por cien (Thrusfield et al., 2018). El contraste de la hipótesis se realizó mediante la prueba Z y cada análisis se realizó en una hoja de cálculo de Microsoft Excel 2016, versión 2305.
Resultados y discusión
La prevalencia reportada en el presente estudio fue de 3,80 ± 2,4% (Zα = 1,96) (tabla 1).
Tabla 1. Prevalencia de Fasciola hepatica en caballos criollos del distrito de Cajamarca

Notas aclaratorias:*unidades epidemiológicas
Fuente: Elaboración propia
Los hallazgos (3,80 ± 2,4 %) difieren por mucho a los encontrados en Arequipa, donde se obtuvo una prevalencia del 52,9% (9/17) (Chávez-Arce & Zamarán, 2021). Incluso, los resultados de estudios realizados en otros países son superiores: se encontró un 6% (40/666) de F.hepatica en caballos fina sangre de carrera en un hipódromo de Chile (Alcaíno et al., 2005) y, en el mismo país, también se obtuvo un 10,41% (28/269) de la presencia de este parásito, encontrando diferencia estadística solamente en relación a la edad (Muñoz et al., 2008), animales menores presentaron una mayor prevalencia, lo cual podría deberse a una pobre resistencia inmunológica por su corta edad, a diferencia de los animales adultos (Soulsby, 1987). Más estudios en Irlanda y México encontraron prevalencias superiores, de 9,5% y 10,4% respectivamente (Quigley et al., 2017; Villa-Mancera & Reynoso-Palomar, 2020).
Respecto a este estudio, en Cajamarca predomina una crianza extensiva y con pastoreos rotativos, por esta razón es posible que el bajo porcentaje de F. hepatica en los resultados obtenidos se deba a que las metacercarias enquistadas en los pastos son consumidas en primera instancia por vacunos y los pocos que quedan son ingeridos por caballos. Un estudio genotípico en Reino Unido demostró que los trematodos de caballos procedían de la misma población de ovinos y vacunos, fenómeno que podría estar ocurriendo en Cajamarca, donde las prevalencias en rumiantes son mucho más altas (Howell et al., 2020). Por otro lado, la prevalencia reportada en el presente estudio difiere ampliamente con la encontrada por Vargas-Rocha et al. (2021) en asnos de la plaza pecuaria de Cajamarca, la cual fue de 28,8 ± 10,4%, esto podría deberse a que el muestreo en ese estudio se desarrolló en un lugar donde los asnos se comercializan siendo de variadas procedencias de Perú, además de que esta especie marginada consume principalmente vegetales y agua de acequias que en su mayoría están contaminadas con metacercarias.
En cuando a la relación con la producción bovina, los parásitos interfieren con la rentabilidad y la productividad de las explotaciones pecuarias (Orjuela et al., 1991) y lo mismo pasa también en equinos de consumo humano, donde esto es una de las principales causas de pérdidas económicas por el decomiso de hígados, ya sea por los daños directos traumáticos generados en la migración enterohepática o por los abscesos formados por bacterias en la migración de fasciolas juveniles y que proliferan en las lesiones (Ibáñez et al., 2018).
Es necesario tener en cuenta el potencial zoonótico de la Fasciola hepatica (Nyindo & Lukambagire, 2015), debido a que es un trematodo transmitido por alimentos y está dentro de las enfermedades neotropicales desatendidas reconocidas por la Organización Mundial de la Salud (Hotez et al., 2014; Torgerson et al., 2015), además de estar vigilantes a su avance y constante evaluación de los aciertos y desaciertos en su control para una mejor toma de decisiones en pro de la salud animal y humana.
Si bien la prevalencia del presente trabajo fue baja, se necesita investigar más sobre los aspectos clínicos de la infección en caballos por F. hepatica y el rol que desempeñan como reservorios o diseminadores del trematodo, al tener en cuenta que los programas sanitarios de la región, para los équidos en general, no conciben el análisis coproparasitológico periódico, donde el Servicio Nacional de Sanidad Agraria (Senasa) en Perú se encarga de la vigilancia pasiva de la enfermedad en el sector pecuario, únicamente descartando muestras sospechosas que los criadores soliciten. Esta política debería ser mejorada a una vigilancia activa en la zona andina, porque la parasitosis afecta a la mayoría de las especies domésticas, genera grandes pérdidas económicas e impacta severamente la salud ambiental, humana y animal. Incluso, para la exportación de caballos de raza o criollos que tienen como destino alguna zona andina o que sea análoga climáticamente a las tierras altas de Perú, estas deberían contar con el certificado sanitario en el que se despeje la presencia de F. hepatica para concretar la movilización de estos especímenes.
Conclusiones
Se reporta por primera vez la presencia de Fasciola hepatica en caballos criollos de la zona norte de Perú. La prevalencia fue de 3,80 ± 2,4% y se rechaza la hipótesis alternativa donde se esperaba una prevalencia del 43,62%.
Contribución de los autores
Blanca Rázuri Munayco: conceptualización, investigación, escritura-revisión y edición; César Murga-Moreno: escritura del borrador original, visualización, revisión y edición; Luis Vargas-Rocha: visualización, análisis formal, escritura, revisión y edición. Juan Rojas Moncada: metodología, curación de datos, validación, escritura, revisión y edición. Severino Torrel Pajares: recursos, supervisión, administración del proyecto, escritura, revisión y edición.
Implicaciones éticas
La presente investigación está sujeta a las normas y códigos éticos de la Ley peruana N.° 30407, artículo 19, que establece los protocolos de bienestar animal y las condiciones en las que los especímenes deben ser incluidos únicamente con fines académicos-científicos. El Comité de Ética de Investigación de la Universidad Nacional de Cajamarca revisó y aprobó los procedimientos descritos. También se dispuso del consentimiento de los propietarios de los animales para el muestreo correspondiente.