Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.18 Bogotá July/Dec. 2009
Modelos de insuficiencia cardiaca en caninos
Heart failure models in canines
Ivan Alvarez Ramírez* / Luis Eduardo Cruz Martinez**
* Médico veterinario. M.Sc. en Fisiología. Departamento de Fisiología y Medicina Interna de Pequeños Animales de la Universidad de La Salle. Correo electrónico: ivalvarez@unisalle.edu.co
** Médico Anestesiólogo e Intensivista. Departamento de Fisiología Universidad Nacional de Colombia. Correo electrónico: lecruzm@unal.edu.co
Fecha de recepción: mayo 8 de 2009
Fecha de aprobación: octubre 5 de 2009
Resumen
Los pequeños animales se han incorporado a las sociedades actuales como miembros de la familia, y una de las afecciones que presentan es la insuficiencia cardiaca. Dada la prevalencia de esta enfermedad, se utilizan caninos para desarrollar el síndrome y utilizarlos como modelos animales para su estudio. La insuficiencia cardiaca se define como un síndrome clínico causado por una enfermedad cardiaca que genera disfunción sistólica-diastólica, que a su vez impide satisfacer las necesidades metabólicas tisulares. Este artículo pretende revisar los diferentes modelos y mecanismos que producen la insuficiencia cardiaca.
Palabras clave: insuficiencia cardiaca, disfunción sistólica y diastólica, caninos, modelos animales.
Abstract
Now days small animals are been incorporated to the society like new members of the family and one the main affections that they present is heart failure, because of the prevalence of the syndrome, dogs are also used like models for the development of these syndrome. We can define heart failure like a clinic syndrome that is caused by a cardiac illness and it can generate systolic and diastolic dysfunction that can not satisfied the metabolic tissue. This article pretends to make a review of the different models and mechanisms that generates heart failure.
Keywords: heart failure, systolic and diastolic disfunction, animal models, dogs.
Introducción
Anteriormente se definía la insuficiencia cardiaca como una incapacidad del corazón para impulsar la sangre a los diferentes tejidos, generándose una alteración sistólica; sin embargo, se ignoran enfermedades como la miocardiopatía hipertrófica o degeneración valvular mixomatosa, en la cual el volumen minuto no siempre está reducido en reposo y el ventrículo izquierdo está engrosado y rígido, causando una disfunción diastólica que termina en congestión y edema (Ettinger, 2007).
Por tanto, la insuficiencia cardiaca se define como un síndrome clínico causado por una enfermedad cardiaca que genera disfunción sistólica, diastólica o ambas, de gravedad suficiente como para contrarrestar los mecanismos compensatorios del aparato cardiovascular. Durante la insuficiencia cardiaca el corazón no puede impulsar la sangre a un ritmo adecuado para satisfacer las necesidades metabólicas tisulares o lo puede hacer elevando las presiones de llenado. Katz (2001) define la insuficiencia cardiaca como un síndrome clínico en el cual una enfermedad cardiaca reduce el gasto cardiaco, incrementa la presión venosa y está acompañada de anormalidades moleculares y muerte celular miocárdica que causan un deterioro progresivo del corazón.
Este síndrome representa un complejo de interacciones de respuestas compensatorias para atender y preservar la función cardiaca y el flujo sanguíneo tisular. Esto va a depender de la severidad de la enfermedad cardiaca subyacente, y allí los mecanismos compensatorios pueden preservar la homeostasis sin alcanzar el punto de la producción de efectos deletéreos (Ettinger, 2007).
El corazón, desde el punto de vista mecanicista, puede fracasar como bomba, ya que no puede eyectar suficiente sangre hacia la aorta o arteria pulmonar para mantener la presión arterial (alteraciones anterógradas), o puede haber alteraciones en el llenado cardiaco o reducción del retorno venoso (alteraciones retrógradas). Los pacientes con falla cardiaca también pueden ser clasificados de acuerdo con el origen de la anormalidad primaria, involucrando el corazón derecho o izquierdo. La insuficiencia cardiaca derecha se asocia con signos de congestión en la circulación sistémica (ascitis, edema periférico), mientras que la insuficiencia cardiaca izquierda ocasiona signos de congestión en la circulación pulmonar (edema pulmonar, disnea). La insuficiencia cardiaca bilateral presenta una combinación de signos de insuficiencia cardiaca derecha e izquierda. Todo esto sugiere que hay varias maneras de clasificar la insuficiencia cardiaca, pero esto es una sobre simplificación, porque el llenado es el mayor determinante de la eyección, y la eyección es un determinante del llenado, y los dos ventrículos operan en serie (Katz, 2001).
Por tanto, la insuficiencia cardiaca en caninos puede ser desencadenada por muchas etiologías (tabla 1), y, en consecuencia, no se puede definir en un simple término universal. Hay etiologías que conllevan a una sobrecarga mecánica de volumen o presión sistólica sobre el corazón, o entidades que generan depresión de la contractilidad miocárdica, o interfieren con el llenado ventricular, o simplemente condiciones que incrementan los requerimientos metabólicos (Knight, 1996).
Clasificación de la insuficiencia cardiaca (IC)
Hay diferentes maneras de clasificar la IC de acuerdo a la severidad de la cardiopatía subyacente, sintomatología clínica, hallazgos anormales por ecocardiografía y actividad física. La clasificación funcional de la New York Heart Association (NYHA) valora la actividad física del paciente con Insuficiencia Cardíaca Congestiva (ICC), definiendo cuatro clases en base a la valoración subjetiva que hace el médico durante la anamnesis sobre la presencia y severidad de la disnea. Esta clasificación funcional tiene un importante valor pronóstico y se utiliza como criterio decisivo en la elección de determinadas intervenciones terapéuticas, tanto médicas como quirúrgicas. La evaluación periódica de la clase funcional permite seguir la evolución y la respuesta al tratamiento (Hurst, 1999).
Esta clasificación fue utilizada en medicina veterinaria durante bastante tiempo para clasificar la enfermedad cardiaca; sin embargo presenta el inconveniente que en caninos no se realizan pruebas de esfuerzo físico, por ello el Consejo Internacional de Salud Cardiovascular en pequeños animales, conocido como ISACHC (International Small Animal Cardiac Health Council) propuso una nueva clasificación en medicina veterinaria de pequeños animales, la cual es actualmente utilizada (Freeman, 2005, Dukes, 2000 Bench, 1999, Isach, 1995) (tabla n.° 2)
Modelos cardiovasculares de la insuficiencia cardiaca
Insuficiencia retrógrada y anterógrada
Estos conceptos de retrógrado y anterógrado son utilizados para caracterizar las causas de la insuficiencia cardiaca porque algunas enfermedades afectan el llenado ventricular y otras afectan directamente la eyección ventricular (tabla n.° 3).
Aunque las definiciones de insuficiencia retrógrada y anterógrada son útiles para el entendimiento de la aparición de los signos, no sirven para describir las anormalidades hemodinámicas, porque un mal llenado reduce la eyección y una mala eyección el llenado. Además, estos modelos hemodinámicos son modificados por efectos circulatorios de la respuesta neurohormonal, por ejemplo, la retención de fluidos incrementa la precarga y, por tanto, empeora la falla retrograda; y el efecto vasoconstrictor de esas respuestas neurohormonales incrementa la poscarga y, en consecuencia, reduce la eyección ventricular, lo cual va a empeorar la falla anterógrada.
Las terapias farmacológicas dirigidas para el tratamiento de la falla cardiaca también pueden modificar estos parámetros, por ejemplo, los vasodilatadores mejoran la falla anterógrada porque reducen la poscarga incrementando la eyección; y los diuréticos mejoran la falla retrógrada, disminuyendo el volumen circulante y la presión venosa (Katz, 2002).
Aunque este modelo de falla anterógrada y retrógrada, entendido como reducción del gasto cardiaco e incremento de la presión venosa, respectivamente, es utilizado para entender la falla cardiaca, se hace insuficiente puesto que la unión entre los cambios hemodinámicos y las anormalidades que involucran la contracción y la relajación no generan una explicación completa, ya que las manifestaciones de anterógrado y retrógrado son influenciados por interacción entre la circulación periférica y las enfermedades del corazón.
Disfunción sistólica y diastólica
La disfunción sistólica hace referencia a anormalidades de la eyección ventricular, la cual puede ser causada por anormalidades bioquímicas que afectan el acortamiento del miocito cardiaco, o cuando los miocitos son remplazados por tejido fibroso, por ejemplo lo que sucede en el infarto de miocardio. La disfunción sistólica puede cuantificarse por la reducción del + dP/dt, fracción de eyección, o por la distensibilidad (complianza) sistólica, entre otros (Jessup, 2003).
La disfunción diastólica se presenta por anormalidades del llenado ventricular, y puede ser causada por anormalidades del miocito cardiaco que hacen más lenta la relajación, por ejemplo, enfermedades que reducen las cavidades cardiacas como la cardiomiopatía hipertrófica, o por anormalidades hemodinámicas como la estenosis mitral, o afecciones que impiden mecánicamente el llenado ventricular como un taponado pericárdico. Este tipo de disfunción pude ser evaluado por la reducción de la -dP/dt, la frecuencia de llenado ventricular o la distensibilidad (complianza) diastólica. Las características clínicas de la falla cardiaca diastólica y sistólica son similares, sin embargo, una serie de parámetros pueden diferenciar una de la otra tal como se ilustra en la tabla n.° 4 (Aurigemma, 2004; Katz, 2001).
En la disfunción sistólica, la contractilidad puede estar deprimida. Cualquier alteración miocárdica puede generar disfunción sistólica, esto se puede observar en la curva de presión-volumen, donde la pendiente al final de la sístole está hacia abajo y corrida a la derecha, como se aprecia en la figura 1 (Aurigemma, 2004; Zile, 2002).
La disfunción diastólica está determinada por propiedades elásticas pasivas del ventrículo izquierdo, y por procesos de relajación activa. Las propiedades elásticas pasivas generalmente son causadas por un incremento de la masa miocárdica y la alteración en la red de colágeno extramiocárdico (Zile, 2002). La afección de los procesos de relajación activa hace que el ventrículo sea rígido, menos distensible, y, como consecuencia, el tiempo de llenado se disminuye y la presión diastólica se eleva, elevando la presión venosa central, o el tono venoso, incrementado la presión hidrostática de los capilares y generando edemas. Esto puede observarse en la curva de presión diastólica ventricular izquierda: en relación con el volumen se corre hacia arriba y a la izquierda (figura 1) (Zile, 2004).
Las diferencias y similitudes entre la falla cardiaca sistólica y diastólica son mostradas en la tabla n.° 4. En la falla diastólica hay disminución del volumen de latido y reducción del gasto cardiaco, a pesar de que la fracción de eyección se mantiene, a diferencia de lo que ocurre en la falla sistólica donde se disminuye la fracción de eyección (Aurigemma, 2004).
Este modelo trata de aproximarse a las alteraciones fisiológicas que ocurren en cada uno de los eventos del ciclo cardiaco, sin embargo, estudios actuales han demostrado la integridad del corazón como una sola banda miocárdica, donde se plantea la diástole como proceso activo (Torrent, 2001). Estudios actuales donde se evalúa la funcionalidad cardiaca con novedosas técnicas han encontrado que pacientes y modelos animales con falla cardiaca con preservación de la fracción de eyección o también denominados disfunción diastólica, presentan alteraciones diastólicas y sistólicas a la vez. Se plantea, por tanto, que la disfunción diastólica y la disfunción sistólica son el mismo concepto y lo que existe es una falla en un corazón integral y global (Brutsaer, 2006).
Falla cardiaca como modelo progresivo
Mecanismos neuroendocrinos
Se ha sugerido que la falla cardiaca puede ser vista como un modelo neurohormonal o neuroendocrino, en el cual la falla cardiaca progresa como resultado de la sobre expresión de moléculas activadas biológicamente que son capaces de ejercer un efecto deletéreo sobre el corazón y la circulación (Sisson, 2004; Mann, 1999; Schrier, 1999; Bristow, 1984). Dentro esa variedad de proteínas se incluye la norepinefrina, angiotensina II, endotelinas, ADH, aldosterona (Dzau, 1981), factor de necrosis tumoral (FNT), entre otras, las cuales contribuyen al progreso de la enfermedad en la falla cardiaca, ya sea reteniendo líquidos o como moléculas vasoconstrictoras que en forma progresiva disminuyen aún más el gasto cardiaco y van generando lo que muchos denominan ciclos viciosos de la falla cardiaca (Bozkurt, 1998).
Durante la insuficiencia cardiaca se observa una reducción del gasto cardiaco, produciendo como resultado final retención de sodio y agua y generando signos tanto de edema y congestión como reducción de la perfusión periférica. En presencia de un defecto en la contracción miocárdica o ante una sobrecarga hemodinámica excesiva sobre el ventrículo, se producen mecanismos compensatorios periféricos cuyo propósito final es mantener la perfusión de los órganos vitales hasta generar un desbalance paradójico. La disminución en la presión arterial sistémica, volumen minuto, perfusión renal o resistencia vascular periférica hace que se liberen una cascada de hormonas como catecolaminas, sistema renina-angiotensina, arginina-vasopresina y otras (Schrier, 1999; Sisson, 2004).
La evidencia que soporta este modelo neuroendocrino ha surgido de dos diferentes líneas de investigación. La primera ha sido de diferentes experimentos en modelos animales, los cuales han mostrado que las concentraciones neurohormonales son suficientes para imitar algunos aspectos de la falla cardiaca, como ejemplo se ilustra la figura 2 (Webber, 2001; Eber, 2001; Tan, 1991; Bozkurt, 1998; Young, 1995). La segunda línea de investigación son los estudios clínicos, los cuales han mostrado que inhibidores o antagonistas de las neurohormonas conducen al mejoramiento clínico de pacientes con falla cardiaca, tanto en humanos como caninos (Amberger, 2004; Bench, 1999; Packer, 1996; Conh, 1991); una explicación lógica de por qué la falla cardiaca es progresiva, la constituyela activación de una variedad de mecanismos neuroendocrinos que producen un daño cardiocirculatorio (Mann, 1999).
A pesar de que hay una gran solidez en el modelo neuroendocrino en términos de explicar el progreso de la enfermedad, y basados en este modelo se han venido desarrollando múltiples fármacos para contrarrestar el deterioro de la falla cardiaca, hay evidencias clínicas que sugieren que el modelo actual falla para explicar la progresión de la enfermedad en la falla cardiaca. Este concepto fue ilustrado por las diferentes curvas de Kaplan- Meyer, que es un análisis estadístico no paramétrico para calcular la supervivencia en el tiempo (figura 3).
En este tipo de figuras se ilustran los datos del porcentaje de muerte en pacientes humanos con falla cardiaca (Solvd, 1991), o el porcentaje de supervivencia en pacientes caninos con falla cardiaca (Bench, 1999), los cuales fueron aleatorizados con placebo e inhibidores de la enzima convertidora de angiotensina (ECA). Se observa que al comienzo del tratamiento empiezan a divergir las curvas, sugiriendo que los inhibidores de la ECA inicialmente previenen el progreso de la enfermedad, sin embargo, a lo largo del tiempo las curvas se van haciendo paralelas. Similares modelos pueden observarse en las curvas de Kaplan-Meyer para los pacientes, quienes recibieron inhibidores ECA y beta-bloqueadores, lo que sugiere que los antagonistas neuroendocrinos pueden ser atenuados a lo largo del tiempo o pierden su efectividad en el progreso de la falla cardiaca.
Aunque los mecanismos precisos de esta atenuación o pérdida de efectividad de los antagonistas neuroendocrinos no son conocidos, hay diferentes hipótesis, por ejemplo, una explicación posible es que no se alcance una inhibición farmacológica completa de los sistemas neuroendocrinos por limitaciones en la dosis farmacológica. Otra posible explicación es la presencia de vías metabólicas alternas para las neurohormonas, así, el paso de angiotensina I a angiotensina II se puede dar por las vías de la kinasas tisulares, y los inhibidores de la ECA no antagonizan completamente este sistema (Sisson, 2004). Una tercera explicación es que estos fármacos no inhiben completamente otras sustancias neuroendocrinas como endotelinas, aldosterona, FNT o, por último, que la falla cardiaca puede progresar independientemente de los mecanismos neuroendocrinos, haciendo que el modelo neuroendocrino sea necesario pero no suficiente para explicar toda la progresión de la enfermedad (Mann, 1999).
Remodelamiento ventricular
El incremento en los niveles de los factores neuroendocrinos no es la única respuesta en la falla cardiaca, además se ha observado un remodelamiento ventricular, definido como los cambios en el tamaño ventricular, su forma y su función, generados por alteraciones mecánicas, neuroendocrinas y, posiblemente, factores genéticos (Cohn, 1995).
Estudios previos han mostrado que el remodelamiento ventricular deteriora la función ventricular y la condición clínica de los pacientes. Aunque algunos investigadores actualmente ven el remodelamiento ventricular simplemente como una respuesta fisiológica de un órgano terminal que ocurre como consecuencia de años de exposición a los efectos tóxicos neuroendocrinos, otros autores han sugerido que el remodelamiento ventricular puede ser generado independientemente de la progresión de la falla cardiaca (Mann, 1999).
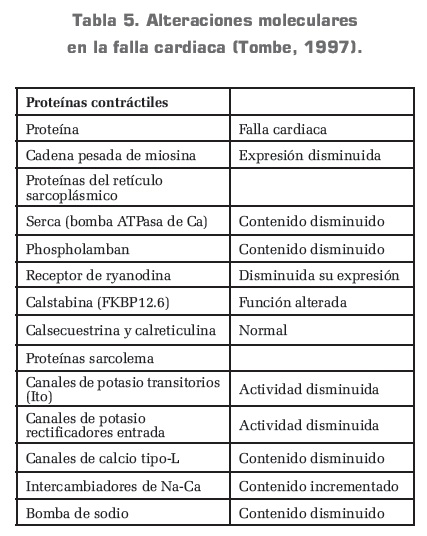
El remodelamiento ventricular ocurre en muchas condiciones clínicas como infarto de miocardio, cardiomiopatía, hipertensión y enfermedad valvular (Jessup, 2003). Aunque los cambios en el remodelamiento ventricular han sido descritos en términos anatómicos, el proceso de remodelamiento ventricular impacta sobre la biología del miocito cardiaco, sobre el volumen de cardiomiocitos, sobre los componentes extra-miocárdicos del corazón, y sobre la geometría y arquitectura de la cámara ventricular, tal como se ve en la tabla n.° 5 (Tombe, 1997; Mann, 1998).
Cada uno de los componentes del proceso de remodelamiento ventricular puede contribuir a la progresión de la falla cardiaca.
En los últimos años se han obtenido grandes progresos en la comprensión de los mecanismos involucrados en la aparición y la evolución de la insuficiencia cardiaca y, con base en ello, en el desarrollo de tratamientos que logran una significativa disminución en la morbi-mortalidad asociada con ella. Aunque la definición tradicional de falla cardiaca como el estado en el cual el corazón es incapaz de bombear la cantidad de sangre necesaria para suplir las necesidades del organismo sigue siendo válida, la diversidad de causas, síntomas y signos, y la variedad de mecanismos involucrados en su aparición y evolución, hacen necesario que en la actualidad deba ser considerada de una manera más amplia y más compleja, como un síndrome clínico caracterizado por disnea y fatiga, inicialmente con el ejercicio y, posteriormente, también en reposo, acompañado de alteraciones funcionales y estructurales del corazón. En la definición se incluye la posibilidad de que también exista dificultad en el llenado del corazón.
En presencia de disfunción ventricular, el corazón trata de mantener su función recurriendo a tres mecanismos básicos: aumento en la precarga (ley de Frank-Starling), hipertrofia ventricular y activación neurohumoral. En las etapas iniciales de la falla cardiaca, la función cardiaca puede ser normal en reposo pero no aumenta adecuadamente con el ejercicio; en estadios avanzados se vuelve anormal también en reposo.
Para comprender el proceso de aparición y desarrollo de la falla cardiaca, es necesario entender que esta representa la interacción de múltiples mecanismos adaptativos, tanto neuroendocrinos como moleculares, que buscan mantener la tensión arterial y la perfusión periférica.
BlBLIOGRAFIA
Amberger, C., Valérie, C., Eric, B., Rougier, S., Woehrlé, F., and Thoulon, F. "Comparison of the effects of imidapril and enalapril in a prospective, multicentric randomized trial in dogs with naturally acquired heart failure". Journal of Veterinary Cardiology 6. 2 (2004): 9-16. [ Links ]
Aurigemma, G. and Gerard, W. Diastolic failure heart. N. Engl. J. Med. 351. (2004): 1097-105. [ Links ]
Bench (Benazepril in Canine Heart disease) Study Group. "The effect of benazepril on survival times and clinical signs of dogs with congestive heart failure: results of a multicenter, prospective, randomized, double-blinded, placebo-controlled, long-term clinical trial". Journal of Veterinary Cardiology 1. 1 (1999): 7-18. [ Links ]
Bristow, M. "The adrenergic nervous system in heart failure". N. Engl. J. Med. 311. (1984): 850-851. [ Links ]
Brutsaert, D. and Keulenaer, G. "Diastolic heart failure: a myth. Current opinion". Cardiology 21. 3 (2006): 240-248. [ Links ]
Cohn, J. N., Johnson, G., Ziesche, S., Cobb, F., Francis, G., Tristani, F., Smith, R., Dunkman, B., Loeb, H.,Wong, M., Bhat, G., Goldman, S., Fletcher, R. D., Doherty, J., Hughes, V., Carson, P., Cintron, G., Shabetai, R., and Haakenson, C. "A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure". N. Engl. J. Med. 325. (1991): 303-310. [ Links ]
Cohn, J. N. "Structural basis for heart failure ventricular remodeling and its pharmacological inhibition". Circulation 91. (1995): 2504-2507. [ Links ]
Dukes-McEwans, J. "Canine dilated cardiomyopathy". Practice 22. (2000): 520-530. [ Links ]
Dzau, V. J., Colucci, W. S., Hollenberg, N. K., and Williams, G. H. "Relation of the renin-angiotensinaldosterone system to clinical state in congestive heart failure". Circulation 63. (1981): 645-651. [ Links ]
Ettinger, S. y Feldman, E. "Fisiopatología de la insuficiencia cardiaca". Tratado de medicina interna veterinaria. Philadelphia: Elsevier Saunders, 2007. [ Links ]
Freeman, L., Rush, J., Farabaugh, A., and Mus, A. "Development and evaluation of a questionnaire for assessing health-related quality of life in dogs with cardiac disease". Journal of the American Veterinary Medical Association 226. (2005): 1864-1868. [ Links ]
Hurst, J. W., Morris, D. C, and Alexander, R. W.. "The use of the New York Heart Association's classification of cardiovascular disease as part of the patient's complete problem list". Clin. Cardiol. 22. 6 (1999): 385-90. [ Links ]
Isachc Appendix 1. "Recommendations for the diagnosis of heart disease and the treatment of heart failure in small animals". Miller, M. S. and Tilly, L. P. (eds.) Manual of canine and feline cardiology. 2nd ed. Philadelphia: W. B. Saunders, 1995. [ Links ]
Jessup, M. and Brozena, S. "Heart failure". New England Journal 348. 20 (2003): 2007-2018. [ Links ]
Karl, E. "Aldosterone in congestive heart failure". N. Engl. J. Med. 345. 23 (2001): 1689-1697. [ Links ]
Katz, A. "Energy utilization. Work and heat". Katz, A. Physiology of the heart. 3rd edition. Philadelphia: Lippincot Williams & Wilkins, 2001. [ Links ]
Katz, A. "Ernest Henry starling, his predecessors, and the 'law of the heart'". Circulation 106. (2002): 2986-2992. [ Links ]
Knight, D. Phatophysiology ofheartfailure and clinical evaluation of cardicac function in textbook of internal medicine in small animals. Philadelphia: Elsevier Saunders, 1996. [ Links ]
Mann, L. Mechanisms and models in heart failure: a combinatorial approach. Circulation 100. (1999): 999-1008. [ Links ]
Packer, M., Bristow, M. R., Cohn, J. N., Colucci, W. S., Fowler, M., Gilbert, E. M., and Shusterman, N. H. "The effect of carvedilol on morbidity and mortality in patients with chronic heart failure". N. Engl. J. Med. 334. (1996): 1350-1355. [ Links ]
Schrier, R. and Braham, W. "Hormones and hemodynamics in heart failure". New England Journal 341. 8 (1999): 577-585. [ Links ]
Sisson, D. "Neuroendocrine evaluation of cardiac disease". Vet. Clin. Small Anim. 34. (2004): 1105-1126. [ Links ]
Tan, L. B., Jalil, J. E., Pick, R., Janicki, J. S., and Weber, K. T. "Cardiac myocyte necrosis induced by angiotensin II". Circ. Res. 69. (1991): 1185-1195. [ Links ]
Tombe, P. "Altered contractile function in heart failure". Cardiovascular Research 37. (1997): 367-380. [ Links ]
Torrent, G. "La mecánica agonista-antagonista de los segmentos descendente y ascendente de la banda miocárdica ventricular". Rev. Esp. Cardiol. 54. 9 (2001): 1091-1102. [ Links ]
Weber, K. "Aldosterone in congestive heart failure". N. Engl. J. Med. 345. 23 (2001): 1687-1697. [ Links ]
Young, M., Head, G., Funder J. "Determinants of cardiac fibrosis in experimental hypermineralocorticoid states". Am. J. Physiol. 269. (1995): 657-E662. [ Links ]
Zile, M. and Brutsaert, D. "New concepts in diastolic dysfuntion and diastolic heart failure: part I". Circulation 105. (2002): 1387-1393. [ Links ]
Zile, M. R., Baicu, C. F., Gaasch, W. H. "Diastolic heart failure-abnormalities in active relaxation and passive stiffness of the left ventricle". N. Engl. J. Med. 350. (2004): 1953-1959. [ Links ]