Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.21 Bogotá Jan./June 2011
Comparación del grado de sedación, profundidad
anestésica y efectos colaterales de cinco protocolos
anestésicos en perros sanos*
Comparison of the Degree of Sedation, Anaesthetic Depth
and Collateral Effects of Five Anaesthetic Protocols
in Healthy Dogs
Sandra J. Gil1 / Camilo L. Ramírez2 / Vladimir Galindo3
* Los resultados de este trabajo fueron presentados en el 8th World Congress of Veterinary Anesthesia. Knoxville, Tennessee. 2003.
1 Médica Veterinaria, práctica privada, Bogotá, Colombia. gilnavet@hotmail.com>
2 Médico Veterinario, práctica privada, Bogotá, Colombia. camiloramirezvet@hotmail.com
3 Médico Veterinario, MSc., profesor asociado, Clínica para Pequeños Animales, Facultad de Medicina Veterinaria y de Zootecnia, de la Universidad Nacional de Colombia. Ciudad Universitaria, Bogotá, Colombia. vgalindoz@unal.edu.co
Recibido: 18 de agosto del 2010 Aceptado: 4 de marzo del 2011
Resumen
El objetivo de este estudio fue comparar el grado de sedación, profundidad anestésica y efectos colaterales de cinco protocolos anestésicos utilizados de rutina en caninos sanos en la Universidad Nacional de Colombia. Se anestesiaron quince caninos adultos (1-5 años de edad), de raza criolla (cinco machos, diez hembras), 15-20 kg de peso, usando los siguientes protocolos: 1. Atropina + xilazine seguidos por tiopental sódico; 2. Atropina + xilazine seguidos por ketamina + diazepam; 3. Acepromazina, seguida por atropina + hidromorfona y luego por tiopental sódico; 4. Atropina + hidromorfona, seguidas por diazepam y luego tiopental sódico y; 5. Atropina + hidromorfona, seguidas por diazepam y luego propofol. Los animales se encontraban sanos y en cada uno se usaron los cinco protocolos anestésicos, con un intervalo mínimo de una semana. No se llevó a cabo ningún procedimiento quirúrgico. Se encontraron diferencias significativas entre protocolos, en cuanto a la necesidad de restricción (p=0,0043), profundidad anestésica (p=0,0183) y analgesia a los 0 y 5 minutos postinducción (p=0,0045 y 0,0233, respectivamente). Con respecto a los efectos colaterales, hubo diferencias significativas en parámetros, como la pérdida de temperatura (p=0,0137) y saturación parcial de oxígeno (p=0,0001). No hubo diferencias significativas en parámetros importantes, tales como la frecuencia de presentación de arritmias (p=0,7404), pero estas fueron más severas al usar el protocolo 1. Los tiempos anestésicos más largos fueron observados con el protocolo 3. Se concluye que el protocolo 5 es superior a los demás, ya que provee adecuada profundidad anestésica, con efectos colaterales menos severos.
Palabras clave: sedación, anestesia, efectos colaterales, protocolo.
Abstract
The purpose of this study was to compare the degree of sedation, anesthetic depth and collateral effects of five anesthetic protocols routinely used in healthy canine patients at the National University of Colombia. Fifteen adult (1-5 years old), mixed-breed dogs (5 males, 10 females), weighting 15-20 kg, were anaesthetized using the following protocols: 1. Atropine + Xylazine followed by Thiopental; 2. Atropine + Xylazine followed by Ketamine + Diazepam; 3. Acepromazine, followed by Atropine + Hydromorphone and then Thiopental; 4. Atropine + Hydromorphone followed by Diazepam and then Thiopental and; 5. Atropine + Hydromorphone followed by Diazepam and then Propofol. The animals were healthy and each one was anaesthetized with the five anesthetic protocols, with an interval of at least one week. No surgical procedures were performed. Significant differences were found in the degree of sedation between protocols, specifically regarding the need for restriction (p=0.0043), anesthetic depth (p=0.0183) and analgesia at 0 and 5 minutes post induction (p=0.0045 and 0.0233, respectively). As far as collateral effects are concerned, there were significant differences in parameters such as temperature loss (p=0.0137) and partial oxygen saturation (p=0.0001). There were no significant differences between protocols regarding important parameters, such as the frequency of arrhythmias (p=0.7404), but they were more severe when using protocol 1. The longest anesthetic times were observed during protocol 3. It is concluded that protocol 5 is superior to the others, since it provided an adequate anesthetic depth, with less severe collateral effects.
Key words: sedation, anesthesia, collateral effects, protocols.
Introducción
En la práctica anestésica, en pequeños animales, costo y disponibilidad son factores importantes al considerar qué fármacos se van a utilizar. En los países en desarrollo, muchos de los fármacos comúnmente reportados en la literatura como la medetomidina y la oximorfona no se encuentran disponibles; adicionalmente, muchos propietarios no podrían pagarlos, incluso, si estuvieran disponibles. Por esto, es muy importante contar con diferentes opciones anestésicas que se puedan ajustar a la condición del paciente, usando fármacos disponibles en un país en particular y que tengan un bajo costo.
Se han llevado a cabo muchos estudios para comparar el grado de sedación, profundidad anestésica y efectos colaterales de prácticamente todos los fármacos anestésicos y muchas de sus combinaciones; sin embargo, todos estos parámetros varían de manera importante, de acuerdo con las dosis utilizadas; además, fármacos como la hidromorfona cuentan con pocas citas en la literatura.
En este estudio se comparan cinco protocolos anestésicos, en cuanto al grado de sedación y profundidad anestésica producido, así como a la frecuencia de presentación y tipo de efectos colaterales, a fin de determinar si alguno de los protocolos es superior a los otros. Los protocolos estudiados son aquellos que rutinariamente se utilizaban en la Clínica para Pequeños Animales de la Universidad Nacional de Colombia, debido a su bajo costo y disponibilidad de los fármacos.
Materiales y métodos
Este estudio fue aprobado por el comité de bioética de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. Se usaron un total de quince caninos (diez hembras y cinco machos), de raza no definida, clasificados como clínicamente sanos mediante un examen clínico y hematológico completo, entre 1 y 5 años de edad (la edad fue establecida mediante cronometría dentaria) y con un peso entre 15 y 20 kg.
Los animales procedían del Centro de Zoonosis de Bogotá D. C. y permanecieron en las instalaciones de la Clínica para Pequeños Animales de la Universidad Nacional de Colombia, alimentados con concentrado comercial (600 g/día) y agua ad libitum; fueron aclimatados durante la semana previa al inicio del estudio. En cada uno de los animales se probaron los cinco protocolos anestésicos con un intervalo de aplicación de una semana; el orden en el cual se administraron cada uno de los cinco protocolos, a cada uno de los animales fue al azar; los evaluadores (Gil y Ramírez) estuvieron ciegos al protocolo anestésico usado en cada momento, para cada animal y, por ende, una tercera persona (Galindo) preparó y administró los medicamentos.
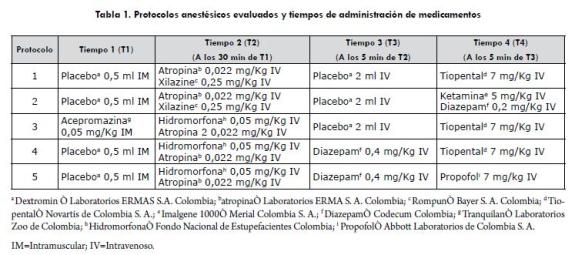
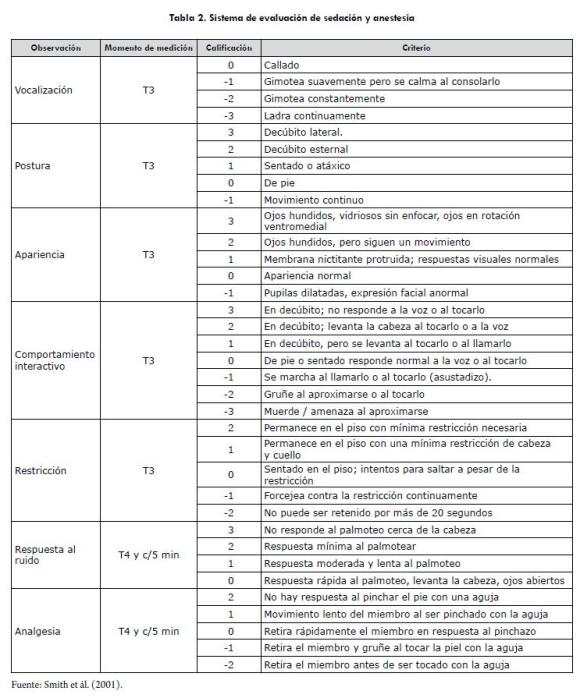
Los medicamentos utilizados y tiempos de aplicación para cada uno de los protocolos se resumen en la tabla 1. Antes de iniciar cada sesión se midieron las constantes fisiológicas y se procedió a aplicar el primer medicamento de cada protocolo (T1) vía intramuscular (IM); a continuación, se insertó un catéter endovenoso (Insyte® Becton Dickinson, Bogotá, Colombia) en la vena cefálica y se inició la administración de líquidos (Solución Ringer Lactato 10 ml/kg/hora). Posteriormente, se puso al paciente sobre una mesa con una manta (la misma para todos los animales), para evitar la pérdida excesiva de calor; pasados 30 minutos se administró un segundo medicamento (T2) vía intravenosa (IV) y se volvieron a medir las constantes fisiológicas; a los 5 minutos se procedió a aplicar el tercer medicamento (T3) IV, se midieron las constantes fisiológicas y se calificó la sedación teniendo como referencia la tabla 2.
A los 5 minutos se procedió a administrar el agente inductor (T4), se posicionó en decúbito lateral derecho, y se puso una sonda endotraqueal; se evaluó la facilidad de intubación (fácil 1, difícil 2) y presencia o ausencia de tos, se tomaron constantes fisiológicas, y a continuación se evaluó la profundidad anestésica (clasificada como: superficial: ojo central con reflejo, quirúrgica ligera: ojo ventromedial sin reflejo y quirúrgica profunda: ojo central sin reflejo) en la que se excluyó al protocolo 2, debido a que con la ketamina permanecen los reflejos. A continuación, se tomó un electrocardiograma (ECG), derivada II por un periodo de 10 segundos (Electrocardiógrafo Burdick® EK10), oximetría de pulso (SpO2) (Oxímetro, Nonin® 8600 V, Nonin Medical Inc.) y presión arterial sistólica indirecta (Ultrasonic Doppler Flow Detector, model 811-B, Parks Medical Electronics, Inc.); se evaluaron comportamientos interactivos: analgesia (usando una pinza hemostática de Kelly en el espacio interdigital de un miembro posterior, la misma pinza e igual presión para todos los animales) y respuesta al ruido mediante una palmada cerca al pabellón auricular, como se explica en la tabla 2. Todos estos parámetros fueron evaluados cada cinco minutos y en el caso de auscultar alguna anormalidad en el latido cardiaco se tomó un ECG adicional. No se llevó a cabo ningún procedimiento adicional en los animales.
Se dio por finalizada la anestesia en el momento en que el paciente empieza a deglutir (extubación), en este momento finalizó el monitoreo y se suspendió la administración de líquidos IV; se tomaron los siguientes tiempos: tiempo total de la anestesia (T1-extubación), tiempo entre T4-extubación, tiempo entre T4-decúbito esternal y tiempo entre extubación-decúbito esternal.
Análisis estadístico
Para la distribución de los protocolos anestésicos a cada uno de los sujetos experimentales se usó el diseño cuadrado latino (Petrie y Watson, 1999). Para aquellos parámetros en los cuales se encontraron diferencias significativas entre grupos (p<0.05), se usó comparación de medias de Tukey.
Para la comparación entre los diferentes protocolos anestésicos, se usó un análisis de varianza (Anova) mediante el test de Kruskal-Wallis en las variables sedación, respuesta a estímulos, efectos colaterales, duración de la anestesia y profundidad anestésica. El error experimental se asumió como variable aleatoria independiente, con una distribución normal, con media cero y varianza s2.
Para las variables presión arterial sistólica determinadas a los 0 y 5 minutos y frecuencia respiratoria a los 5 minutos posinducción, en la que no se cumplieron los supuestos, se realizó transformación por dependencia (Martínez y Martínez, 1997). Se usó la prueba de chi cuadrado (%2) para las variables binomiales: arritmias sí o no, intubación fácil o difícil y presencia de tos sí o no.
Resultados
Sedación
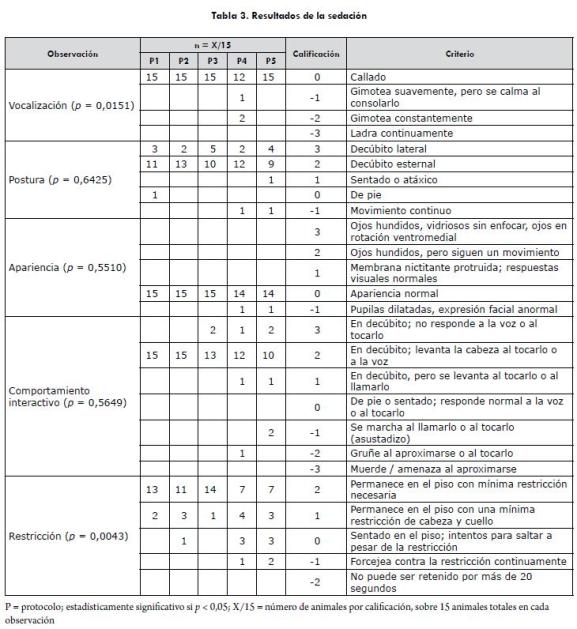
De los parámetros evaluados (tabla 2), la vocalización mostró diferencias estadísticamente significativas entre protocolos (p=0,0151), la cual fue mayor en los protocolos 4 y 5, al momento de administrar diazepam (T3); de igual manera, con estos protocolos se presentó mayor excitación en la evaluación del comportamiento interactivo (p=0,564), aunque estas diferencias no fueron estadísticamente significativas. Se encontraron diferencias significativas entre grupos, con respecto a la necesidad de restricción física (p=0,0043), siendo necesaria solo una mínima restricción al usar los protocolos 1, 2 y 3, en comparación con los protocolos 4 y 5; adicionalmente, la posición de los animales sedados con los protocolos 1, 2 y 3 varió entre decúbito lateral y decúbito esternal (14/15 animales), lo que confirma el mejor grado de sedación observado con estos protocolos. Los resultados de las observaciones evaluadas para la sedación se resumen en la tabla 3.
Anestesia
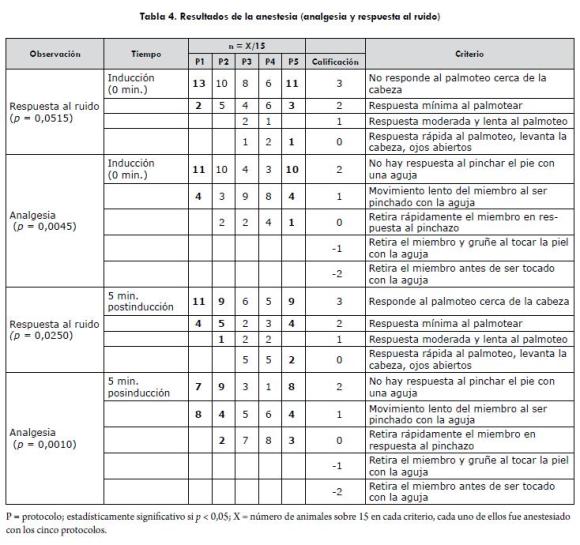
Se encontraron diferencias estadísticamente significativas entre protocolos en cuanto a la profundidad anestésica (p=0,0183), analgesia (p=0,0045) y repuesta al ruido (p=0,0515) en el momento de la inducción (T4): al usar los protocolos 1 y 5 la profundidad anestésica fue adecuada (quirúrgica ligera o quirúrgica profunda); además, se observó un mejor efecto analgésico y la respuesta al ruido fue menor que con los protocolos 2, 3 y 4. También, se observó que los protocolos 1, 2 y 5 brindaron una mejor analgesia (p=0,0010) y una menor respuesta al ruido (p=0,0250) que los protocolos 3 y 4, con 5 minutos posinducción. Los resultados anteriormente descritos se resumen en la tabla 4.
Con respecto a la intubación, se presentó una mayor dificultad para intubar con el protocolo 4, lo cual se relacionó con el menor grado de profundidad anestésica encontrado en este protocolo. Se encontró la mayor presencia de tos al momento de intubar con el protocolo 2.
Entre los diferentes protocolos, el de mayor duración (inducción-decúbito esternal [p=0,0261]) fue el protocolo 3 (media=39,7 minutos) y el de menor duración fue el protocolo 4 (media=20,1 minutos), atribuido a lo anteriormente mencionado con respecto a la poca profundidad anestésica observada con este protocolo. El tiempo de duración de la analgesia estuvo directamente relacionado a la duración anestésica.
Efectos colaterales
Se observó dolor al suministrar hidromorfona (protocolos 3, 4 y 5); la presencia de dolor al administrar este fármaco fue estadísticamente significativa (p=0,0183) al ser comparada con los grupos en los cuales no se administró hidromorfona; después de aplicar este fármaco también se observó jadeo y saboreo. El vómito estuvo presente al usar todos los protocolos, sin evidenciar diferencias estadísticamente significativas (p=0,7147).
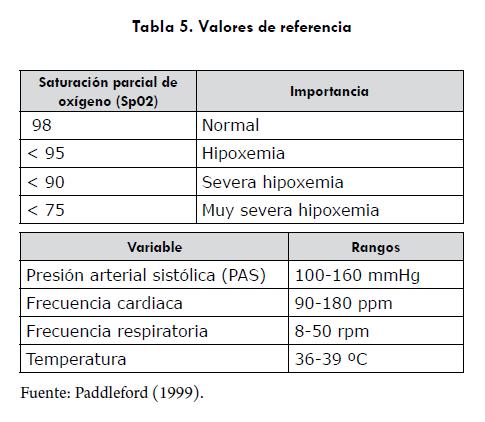
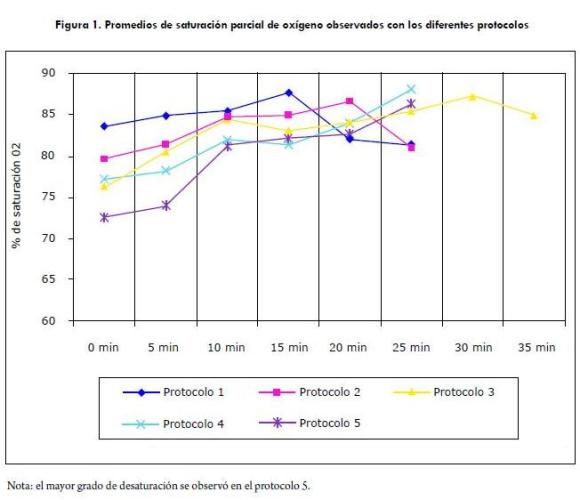
En cuanto a los efectos colaterales respiratorios, en todos los protocolos se encontró un grado elevado de desaturación. Fue evidente una relación entre la presentación de apnea, cianosis y mayor hipoxemia (saturación parcial de oxígeno < 75% [los valores de referencia se encuentran en la tabla 5]) con el protocolo 5; en la figura 1 se ilustra el comportamiento de la saturación parcial de oxígeno en los diferentes protocolos. También se encontraron casos aislados de apnea (3/15 pacientes) en el protocolo 2, al administrar la Ketamina.
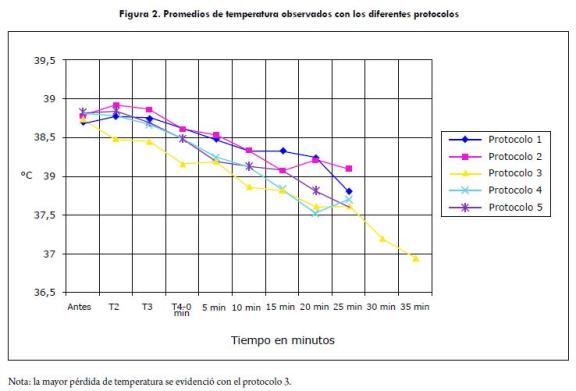
La pérdida de temperatura durante la anestesia fue estadísticamente significativa entre protocolos (p=0,0137), ya que, a pesar de que en todos los protocolos se observó disminución de la temperatura corporal, esta fue más severa con el protocolo 3 (0,9 ± 0,4 °C) (figura 2).
Aunque no hubo diferencias estadísticamente significativas entre grupos, en cuanto a la presencia de arritmias (p=0,7404), y que en todos los protocolos se encontraron arritmias, es importante anotar que las más severas y frecuentes fueron observadas con el protocolo 1 (figuras 3 a 5).
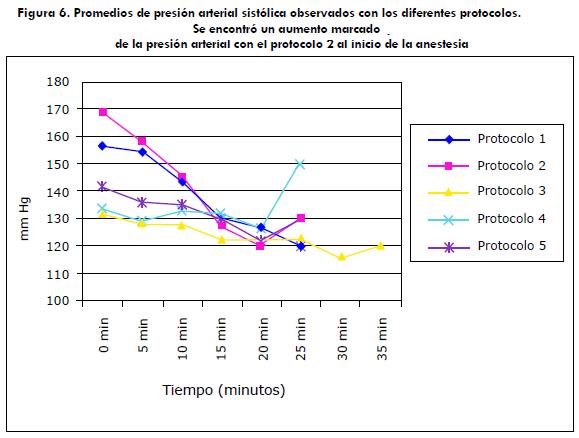
Las frecuencias cardiaca y respiratoria estuvieron dentro de los rangos normales (tabla 5), con algunos casos de bradicardia, con los protocolos 1 y 2. Se encontraron diferencias estadísticamente significativas en la presión arterial sistólica indirecta entre protocolos (p=0,004), con un aumento relevante en los protocolos 1 (promedio=156 mmHg) y 2 (promedio=168 mmHg) (figura 6). Llama la atención que 7/15 animales presentaran un aumento marcado de la presión arterial con el protocolo 2.
Resultados adicionales
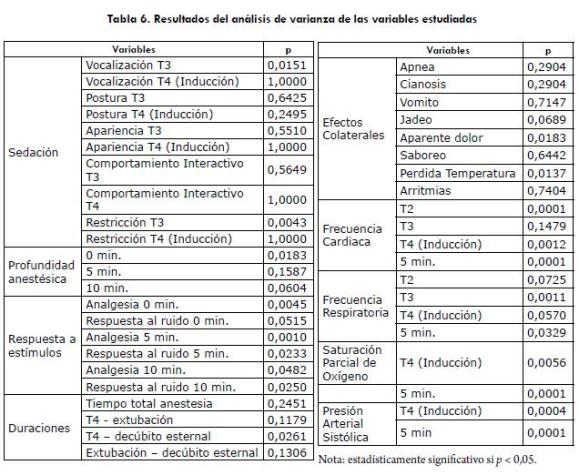
En el protocolo 2, un animal presentó rigidez muscular de cuello con flexión lateral de la cabeza y vocalización a la extubación, lo que se relacionó con el uso de la Ketamina. Con el protocolo 5, tres animales presentaron tremores y rigidez muscular, principalmente, en los miembros anteriores al ser inducidos con propofol. Con el protocolo 4, dos animales presentaron estado de conciencia sin deglutir la sonda. Los resultados del análisis estadístico de todas las variables estudiadas, se observan en la tabla 6.
Discusión
Sedación
La excitación y la vocalización que se observaron al administrar el diazepam probablemente están relacionados con comportamientos de excitación paradójica, la cual ha sido reportada en pacientes sanos, en los que el diazepam no produce una depresión significativa del SNC; también se pudo deber a la presencia de dolor ocasionado por el medio en que se encuentra el diazepam (propilenglicol), lo cual también ha sido previamente reportado (Paddleford, 1999; Perkowski, 2000).
La menor necesidad de restricción y la postura evidenciada con los protocolos 1, 2 y 3 parece que se deben al potente efecto sedante del xilazine, a pesar de la baja dosis utilizada, y a un mayor grado de sedación y restricción, al combinar acepromazina con hidromorfona (Paddleford y Harvey, 1999; Pettifer y Dyson, 2000; Smith et ál., 2001); otros estudios también han mostrado un mayor efecto depresor del SNC al usar hidromorfona, en comparación con otros narcóticos (Álvarez et ál., 2007).
Anestesia
La mayor profundidad anestésica y menor respuesta al ruido, en conjunto, con mayor analgesia encontradas en el protocolo 5, podrían ser atribuidas a la rápida acción hipnótica del propofol y al potente efecto analgésico de la hidromorfona. Los resultados similares obtenidos con el protocolo 1, se relacionaron con una mayor depresión producida por el tiopental y con efecto analgésico del xilazine administrado en la premedicación (Paddleford y Harvey, 1999; Reid y Nolan, 1999; Mathews, 2000; Pettifer y Dyson, 2000).
La mejor calidad en la inducción se observó al usar propofol, aunque este efecto se pudo deber al uso de una dosis demasiado alta, considerando el número de animales que entraron en un plano profundo de anestesia (3/15) y al comparar las dosis usadas en este estudio, con otras reportadas en la literatura (Watney y Pablo, 1992; Bednarski, 2007).
La mejor analgesia y menor respuesta al ruido, 5 minutos posinducción, observados con el protocolo 2, podrían ser atribuibles a la acción analgésica de la ketamina, ya que esta es efectiva para bloquear el dolor somático y prevenir la sensibilización de las vías del dolor, además, de la acción analgésica y depresora del xilazine (Mathews, 2000; Tranquilli et ál., 2004).
La mayor presencia de tos al momento de intubar con el protocolo 2 se relacionó con la permanencia de los reflejos faríngeo y laríngeo al usar ketamina (Reid y Nolan, 1999; White et ál., 2001) y a una menor profundidad anestésica; vale la pena recordar que para este parámetro no se observaron diferencias estadísticamente significativas entre grupos.
La mayor duración anestésica del protocolo 3 podría estar relacionada con el tiempo de acción de la acepromazina (3 a 6 horas) y a su lento metabolismo; además, con este protocolo se observó la mayor pérdida de temperatura (0,94 ± 0,4 °C), lo que pudo hacer más lento el metabolismo de los demás fármacos utilizados (Paddleford, 1999).
Efectos colaterales
El aparente dolor al administrar la hidromorfona (protocolos 3, 4 y 5), así como la presencia de jadeo y saboreo posterior a su administración ha sido observado previamente por los autores; en cuanto al jadeo, este podría ser atribuido al efecto de los opiáceos en el centro termorregulador en el hipotálamo (Papich, 2000; Pettifer y Dyson, 2000); el saboreo se podría deber a un comportamiento de neuroexcitación, que ha sido reportado en animales y en humanos (Perkowski, 2000; Wright et ál., 2001). El vómito encontrado en todos los protocolos se podría deber al potencial emético del xilazine y de los opioides (Paddleford y Harvey, 1999; Pascoe, 2000).
La apnea, con la consecuente desaturación y cianosis, es una complicación común con el uso de propofol, la cual se atribuye al efecto depresor de este sobre el centro respiratorio (Muir y Gadawski, 1998; Short y Bufalari, 1999; Murison, 2001). Es necesario tener en cuenta que este estudio se realizó en Bogotá (localizada a 2650 msnm), donde existe una menor presión atmosférica de oxígeno y que, además, no se suplementó oxígeno a los animales. La experiencia de los autores indica que los valores normales de saturación de oxígeno en caninos sanos jóvenes y conscientes, a la altura de Bogotá, varía entre el 88 y 92%; de esta manera, aunque, en efecto, se presentó una disminución en la saturación de oxígeno en los animales aquí descritos, esta es moderada. Desafortunadamente, no se consideró la medición previa de la saturación de oxígeno en los pacientes de este estudio. Los casos aislados de apnea en el protocolo 2 estarían relacionados a una depresión respiratoria mínima de la ketamina (Johnson, 1999; Lerche et ál., 2000).
La pérdida de temperatura presentada en el protocolo 3 (0,9±0,4 °C), posiblemente, fue debida a la administración conjunta de la acepromazina, hidromorfona y tiopental, los cuales actúan deprimiendo el centro termorregulador; además, con la mayor duración de la anestesia presentada en este protocolo, hay una menor actividad muscular, que contribuye a la pérdida calórica (Paddleford, 1999; Papich, 2000).
La presentación y severidad de las arritmias en el protocolo 1 se podrían atribuir a la combinación de los fármacos xilazine y tiopental a pesar de las bajas dosis utilizadas, los cuales sensibilizan al miocardio a los efectos arritmogénicos de las catecolaminas (Wright et ál., 1987; Hayashi et ál., 1989; Kramer et ál., 1996). También pudo haber contribuido la hipoxemia que se presentó en todos los protocolos, aunque no incluyeran fármacos arritmogénicos.
Las frecuencias cardiaca y respiratoria estuvieron dentro de los rangos normales, pero se notó una tendencia a aumentar con los protocolos 4 y 5, lo que parece relacionado con un menor efecto vagal por parte de los opiáceos y un efecto de taquipnea, producto del estímulo de estos medicamentos en el centro termorregulador, lo que fue anteriormente mencionado (Lukasik, 1999; Papich, 2000; Pascoe, 2000).
El aumento en la presión arterial sistólica, observado con el protocolo 2 (>160 mmHg), posiblemente, se deba a un aumento en el tono del sistema nervioso simpático, efecto comúnmente observado al usar ketamina en animales normales (Lerche et ál. 2000; Perkowski, 2000; White et ál., 2001; Yuriko et ál., 2002).
Observaciones adicionales
Con el protocolo 2, un animal presentó rigidez muscular de cuello con flexión lateral de la cabeza y vocalización a la extubación, lo que se relacionó con el uso de la ketamina, para la cual se ha reportado hipertonicidad muscular y mioclonios (Muir, 1998; White et ál., 2001). Con el protocolo 5, tres animales presentaron tremores y rigidez muscular, principalmente, en los miembros anteriores, al ser inducidos (con propofol); este efecto ha sido reportado en otros estudios, pero su origen es incierto (Watney y Pablo, 1992; Muir y Gadawski, 1998).
Conclusiones
Los resultados del presente estudio permiten concluir que el protocolo 5 (Atropina + Hidromorfona-Diazepam-Propofol) es el más recomendado, ya que produce una aceptable sedación, buena profundidad anestésica y los efectos colaterales menos severos, comparado con los demás protocolos; al usar este protocolo, se debe evaluar la posibilidad de disminuir la dosis de propofol y preoxigenar los pacientes antes de la inducción.
Adicionalmente, se puede concluir que la combinación atropina-xilazine-tiopental (protocolo 1), en las dosis utilizadas en este estudio, no está recomendada, debido a las severas arritmias observadas, las cuales podrían llegar a comprometer la vida del paciente; la combinación atropina-xilazine podría ser una buena alternativa para la restricción química de animales clínicamente sanos, pero no debe hacer parte de un protocolo anestésico que incluya medicamentos arritmogénicos como el tiopental.
Debido a la hipoxemia que se presentó con todos los protocolos, se concluye que puede ser recomendable preoxigenar a todos los pacientes antes de ser sometidos a una anestesia general.
Agradecimientos
Los autores expresan sus agradecimientos a la profesora Nhora Martínez por su asesoría estadística, así como a las firmas que aportaron algunos de los materiales y medicamentos que se usaron en este estudio: Becton Dickinson de Colombia Ltda., Abbott Laboratorios de Colombia S. A., Merial Colombia S. A., Novartis de Colombia S. A., Laboratorios Erma S. A. y Bayer S.A. Colombia.
Referencias
Álvarez, I., Guerrero, C. y Galindo, V. (2007). Evaluación del grado de sedación, presentación de efectos colaterales y variaciones en la dosis de inducción con tiopental sódico producidos por cinco agentes narcóticos usados en la preanestesia en pacientes caninos ASA I y II. Selecciones Veterinarias, 15, 209-220. [ Links ]
Bednarski, R.M. (2007). Dogs and Cats. En WJ. Tranquilli, J.C. Thurmon y K.A. Grimm KA (Eds). Lumb and Jones' Veterinary Anesthesia and Analgesia (4a ed., 705-715). Blackwell Publishing. [ Links ]
Hayashi, Y., Sumikawa, K., Yamatodani, A. et ál. (1989). Myocardial sensitization by thiopental to arrhythmogenic action of epinephrine in dogs. Anesthesiology, 71, 929-935. [ Links ]
Johnson, C. (1999). Patient monitoring. En C. Seymour y R. Gleed (Eds.). Manual of Small Animal Anaesthesia and Analgesia (1a ed., 43-55). Cheltenham, UK: BSAVA. [ Links ]
Kramer, S., Nolte, I. y Jöchle, W. (1996). Clinical comparison of medetomidine with xylazine/1-methadone in dogs. Veterinary Record, 138, 128-133. [ Links ]
Lerche, P., Nolan, A.M. y Reid, J. (2000). Comparative study of propofol or propofol and ketamine for the induction of anaesthesia in dogs. Veterinary Record, 146, 571-577. [ Links ]
Lukasik, V.M. (1999). Premedication and Sedation. En C. Seymour y R. Gleed R (Eds.). Manual of Small Animal Anaesthesia and Analgesia (1a ed., 71-85). Cheltenham, UK: BSAVA. [ Links ]
Martínez, R. y Martínez, N. (1997). Diseños de experimentos. Análisis de datos estándar y no estándar (1a ed.). Bogotá, Colombia: Fondo Nacional Universitario. [ Links ]
Mathews, A.K. (2000). Pain assessment and general approach to management. Veterinary Clinics of North America: Small Animal Practice 30, 729-751. [ Links ]
Muir, WW. (1998). Anesthesia for dogs and cats with cardiovascular disease-Part II. Compendium on Continuing Education for the Practicing Veterinarian, 20, 473-484. [ Links ]
Muir, WW. y Gadawsky, J.E. (1998). Respiratory depression and apnea induced by propofol in dogs. American Journal of Veterinary Research, 50, 157-161. [ Links ]
Murison, P.J. (2001). Effect of propofol at two injection rates or thiopentone on post-intubation apnoea in the dog. Journal of Small Animal Practice, 42, 71-74. [ Links ]
Paddleford, R.R. (1999). Preanesthetic agents, Anesthetic agents. En R.R. Paddleford (Ed.). Manual of Small Animal Anesthesia (2a ed., 12-54). WB Saunders Company. [ Links ]
Paddleford, R.R. y Harvey, R.C. (1999). Alpha2 agonists and antagonists. Veterinary Clinics of North America: Small Animal Practice, 29, 737-743. [ Links ]
Papich, M.G. (2000). Pharmacologic considerations for opiate analgesic and nonsteroidal anti-inflammatory drugs. Veterinary Clinics of North America: Small Animal Practice, 30, 815-837. [ Links ]
Pascoe, P.J. (2000). Opioid analgesics. Veterinary Clinics of North America: Small Animal Practice, 30, 757-771. [ Links ]
Perkowski, S.Z. (2000). Anesthesia for the Emergency Small Animal Patient. Veterinary Clinics of North America: Small Animal Practice, 30, 509-529. [ Links ]
Petrie, A. y Watson, P. (1999). Statistics for Veterinary and Animal Science. London, UK: Blackwell Science. [ Links ]
Pettifer, G. y Dyson, D. (2000). Hydromorphone: A cost-effective alternative to the use of oxymorphone. Canadian Veterinary Journal, 41, 135-137. [ Links ]
Reid, J. y Nolan, A.M. (1999). Intravenous Anaesthetics. En C. Seymour y R. Gleed (Eds.). Manual of Small Animal Anaesthesia and Analgesia (la ed., 87-97). Cheltenham, UK: BSAVA. [ Links ]
Smith, L.J., Ka, Y.U., Bjorling, D.E. et al. Effects of hydromorphone or oxymorphone, with or without acepromazine, on preanesthetic sedation, physiologic values, and histamine release in dogs. Journal of the American Veterinary Medical Association, 218, 1101-1105. [ Links ]
Short, C.E. y Bufalari, A. (1999). Propofol anesthesia. Veterinary Clinics of North America: Small Animal Practice, 29, 747-778. [ Links ]
Tranquilli, W.J., Grimm, K.A. y Lamont, L.A. (2004). Pain Management for the small animal Practitioner (2a ed.). Jackson, WY, USA: Teton New Media. [ Links ]
Watney, C.G. y Pablo, L.S. (1992). Median effective dosage of propofol for induction of anesthesia in dogs. American Journal of Veterinary Research, 53, 2320-2322. [ Links ]
White, K.L., Shelton, K. y Taylor, P.M. (2001). Comparison of diazepam-ketamine and thiopentone for induction of anaesthesia in healthy dogs. Veterinary Anaesthesia and Analgesia, 28, 1-10. [ Links ]
Wright, A.W., Mather, L.E. y Smith, M.T. Hydromorphone-3-glucuronide A more Potent neuro-excitant than its structural analogue, morphine-3-glucuronide. Life Sciences 69, 409-420. [ Links ]
Wright, M. (1987). Heath RB, Wingfield WE. Effects of Xilazine and Ketamine on Epinephrine-Induced arrhythmia in the dog. Veterinary Surgery, 16, 398-403. [ Links ]
Yuriko, T.E., Sergio de Moraes, B.P., Gaido, S.C. et al. Effects of two preanesthetic regimens for ophthalmic surgery on intraocular pressure and cardiovascular measurements in dogs. Veterinary Therapeutics, 3, 81-87. [ Links ]