Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.21 Bogotá Jan./June 2011
Manejo farmacológico de la hiperlipidemia
en caninos
Pharmacological Management of Canine Hyperlipidemia
Anastasia Cruz Carrillo1 / Giovanni Moreno Figueredo2 / Juan Francisco Tobón3
1 MV, MSc, Esp. Docente del Programa de MVZ de la Universidad Pedagógica y Tecnológica de Colombia (Tunja). anastasia.cruz@uptc.edu.co
2 MV MSc, PhD (c). Docente del Programa de MV de la Fundación Universitaria Juan de Castellanos (Tunja). giov_anny@hotmail.com.
3 MVZ, UDCA. zestmono@hotmail.com
Recibido: 13 de octubre del 2010 Aceptado: 4 de marzo del 2011
Resumen
En los caninos, el aumento de los triglicéridos y del colesterol favorece la presentación de enfermedades que pueden ser graves para estos. Aunque la farmacología de los hipolipemiantes se ha desarrollado más en medicina humana, el médico veterinario debe conocer los fármacos útiles para controlar estas situaciones, ya que son comunes en ciertos pacientes. Por lo anterior, el objetivo de esta revisión fue hacer referencia a aquellos fármacos más usados en caninos para el control de las hiperlipidemias. Dentro de los fármacos grupos farmacológicos existentes se destacan las estatinas, los inhibidores del ácido fíbrico, los secuestrantes de ácidos biliares, la niacina, los inhibidores de la absorción de colesterol y el más reciente de uso veterinario, la dirlotapida. Todos ellos pueden ser incluidos dentro de los protocolos de manejo integral de pacientes con hiperlipidemias y obesidad.
Palabras clave: colesterol, obesidad, lipoproteínas.
Abstract
Rise of triglycerides and cholesterol in canines favors the appearance of possibly dangerous diseases. Although hypolipemiants pharmacology has mainly developed in human medicine, veterinarians must know the useful drugs to control this kind of situations, as they are common in certain patients. Thus, the purpose of this review was to make a reference to the most used drugs to control hyperlipidemia in canines. Some of the most important pharmacologic groups for this treatment are statins, fibric acid inhibitors, bile acid sequestrants, niacins, cholesterol absorption inhibitors and the most recently used in veterinary, dirlotapide. All of these drugs may be included in the protocols for the integral treatment of patients with hyperlipidemias and obesity.
Key words: cholesterol, obesity, lipoproteins.
Introducción
La obesidad en los caninos, de acuerdo con lo indicado por Gossellin, es una patología que puede tener una incidencia cercana a 20-40%, en casi todos los países y se define como un estado de sobrepeso, que cursa con aumento del colesterol y de los triglicéridos, lo que desencadena alteraciones del sistema cardiovascular, principalmente. A pesar de que puede ocurrir en cualquier canino, existen factores de riesgo como la raza (labrador, cocker spaniel, dachshunds, beagle, shetland sheepdog, rottweiller y basset haund), la edad y el sexo, siendo más frecuente en hembras jóvenes y en hembras y machos de edad superior a 12 años (Pasquini et ál., 2008; Gossellin et ál., 2007). De manera paralela al desarrollo de la obesidad, se encuentran las patologías denominadas hiperlipidemias e hipercolesterolemias, en las cuales las concentraciones de lipoproteínas y de colesterol, respectivamente, se encuentran aumentadas, por esto, se presentan fallas orgánicas que pueden ser fatales, destacándose la hipertensión, diabetes, insuficiencia cardiaca congestiva, ateroesclerosis, osteoartritis, muerte súbita e hipertensión renal (Zhang y Reisen, 2001).
Debido a la importancia del tema, con este artículo se buscó recopilar información sobre la farmacología y el comportamiento de los hipolipemiantes utilizados para el tratamiento y el control de la obesidad y de las hiperlipidemias en caninos.
Metabolismo de las lipoproteínas
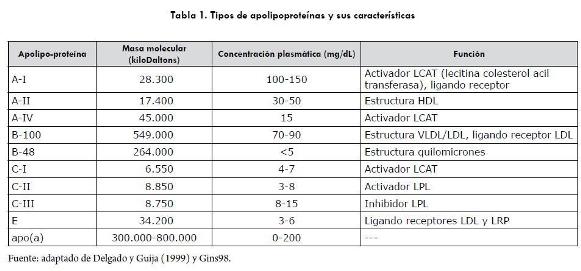
En razón a la insolubilidad en el agua, el transporte de los lípidos en la sangre sería imposible, de no existir las apolipoproteínas o apoproteínas, que por ser anfotéricas, interactúan con medios lipídicos y acuosos, por lo cual se mantienen estables y estructuralmente intactas y que una vez ligadas al colesterol, a los triacilgliceroles (TAG) y a los fosfolípidos constituyen las lipoproteínas, cuya forma subesférica le permite a los lípidos no polares situarse en la porción interna, mientras los fosfolípidos y apolipoproteínas ocupan la parte externa. Por lo anterior, transportan el colesterol y los TAG, del hígado hacia los tejidos y viceversa, así como los carotenoides, el tocoferol y el retinol (Voet et ál, 2008; Voet y Voet, 2005; Nelson et ál., 2000; Delgado y Guija, 1999). Se han identificado cerca de diez tipos de apolipoproteínas (tabla 1).
Las apoproteínas A-1 (apoA-1) se sintetizan en el hígado y en el intestino y hacen parte de las lipoproteínas de alta densidad. La apoA-II se encuentran en menor proporción que las anteriores y la apoA-IV, que se forma en el hígado y en el intestino, se encuentra libre en el plasma y hace parte de las lipoproteínas de alta densidad, HDL (Voet et ál., 2008). La apoB (isoformas apoB-100 y apoB-48) se encuentra en los quilomicrones y en las lipoproteínas remanentes que resultan del metabolismo de los primeros. Las apoB-100 están en las lipoproteínas de muy baja densidad (VLDL), en las de densidad intermedia y en las de baja densidad (LDL) (Nelson et ál., 2000; Voet et ál., 2008). La apoC hace parte de todas las lipoproteínas, excepto las de VLDL (tabla 1). La apoC-1 se encuentra en menor proporción que las otras. La apoC-II actúa como cofactor de la lipoproteína lipasa durante la hidrólisis de los TAG de las lipoproteínas, por lo cual los pacientes humanos o animales con deficiencias de esta apoproteína desarrollan hipertrigliceridemia con las mismas características observadas cuando hay deficiencia de la lipasa. La más abundante es la apoC-III, que inhibe la lipoproteína lipasa. En tal sentido, la apoC-II es activadora y la apoC-III es inhibidora, de la mencionada enzima por lo que la concentración de una y otra determina el efecto hidrolítico o no, sobre las lipoproteínas (Delgado y Martínez, 2010; Voet et ál., 2008; Ettinger, 2005).
Así como se encuentran varias apolipoproteínas, también existen diferentes tipos de lipoproteínas, aunque su estructura química es similar. La única función de las lipoproteínas no es transportar colesterol, TAG y fosfolípidos, sino que también intervienen en la regulación metabólica de los lípidos al interactuar con receptores celulares, lo cual permite que ocurra el metabolismo intracelular de estos (Delgado y Martínez, 2010; Voet et ál., 2008).
Actualmente, las lipoproteínas se han dividido en cuatro clases, quilomicrones, VLDL, LDL y HDL; pero, basados en la acción metabólica de estas se incluyen la subclase, densidad intermedia (IDL) y las subfracciones HDL2 y HDL3 que hacen parte del grupo de las HDL y la lipoproteína(a) que resulta de la fusión LDL con la apolipoproteína(a) (Voet y Voet, 2005). Entre las características y las funciones más relevantes de las lipoproteínas se destacan:
-
Quilomicrones: son los de mayor tamaño y menor densidad, se encuentran cargados de TAG exógeno, fosfolípidos y colesterol en pequeña proporción, proveniente de la dieta, del que sintetiza de novo en los enterocitos y del que se excreta en la bilis. Se forman en el intestino y ayudan a la absorción de los lípidos al emulsificar las grasas (Meng et ál, 2009; Delgado y Guija, 1999).
-
Las VLDL son de menor tamaño que las anteriores y contiene altas cantidades de TAG endógeno, fosfolípidos y colesterol. En la sangre, ceden el colesterol libre a las HDL y reciben de estas el colesterol esterificado.
-
Las LDL o B-lipoproteínas transportan la mayor cantidad de colesterol esterificado y poseen muy pocos TAG (Mead et ál., 2002).
-
Las HDL son las más pequeñas y por ello transportan menos lípidos, son liberadas del hígado a otros tejidos, donde captan el colesterol libre. Las HDL ceden los ésteres de colesterol a las VLDL y a los quilomicrones y reciben de las primeras (TAG), que luego son hidrolizados en el hígado por las lipasas, hepática y lipoproteica, convirtiéndose en HDL (Tardif et ál., 2007). Los ácidos grasos libres no requieren el transporte de las lipoproteínas, debido a que logran ser movilizados unidos a la albúmina (Meng et ál., 2009).
Por su parte, el colesterol proviene de la dieta y, en su mayor parte, es sintetizado en el hígado e intestino mediante un proceso que cuenta con la participación de cerca de veinticinco enzimas diferentes. Esta vía sintética comienza a partir de la acetil CoA y uno de los principales puntos de control corresponde al paso de hidroximetil glutaril CoA (HMG CoA) a mevalonato, proceso catalizado por la HMG CoA reductasa (Piernas-Huerta et ál., 2001).
En condiciones normales, los TAG y el colesterol de la dieta pasan a los quilomicrones, producidos por la linfa mesentérica, y de allí a la circulación general. En el tejido adiposo y en las células musculares, la apoproteína C-II, activa a la lipoproteinlipasa endotelial para que, hidrolice el núcleo de TAG del quilomicrón, liberando ácidos grasos y glicerol. Los primeros difunden a los tejidos cercanos donde se utilizan para construir nuevas moléculas de TAG, que serán almacenados en los adipocitos o utilizadas por la célula muscular para producir energía. Los TAG que quedan en los quilomicrones residuales son utilizados como otros sustratos, para la formación de ácidos biliares en los hepatocitos y los ácidos grasos libres que no fueron oxidados para producir energía son transformados en TAG, empacados en partículas de VLDL y conducidos a la sangre. Estas partículas, igual que los quilomicrones, reciben apoC-II y apoE desde las HDL, posteriormente, ocurre el mismo proceso en el que la lipoproteína lipasa extrae las moléculas de TAG de las VLDL, convirtiendo a esta última en una LDL, rica en fosfolípidos y colesterol, la cual transporta hacia los tejidos, para ser usados en la síntesis de hormonas esteroidales o en la formación de membranas celulares (Ettinger, 2005).
Hiperlipidemia
La hiperlipidemia es una patología que cursa con elevación de la concentración plasmática de colesterol o de TAG. Es normal que los lípidos aumenten después del consumo de alimento, pero al cabo de 7-12 horas se deben normalizar (Xenoulis et ál., 2007). Existen dos tipos de hiperlipemia, la primaria, que es poco frecuente, y cuando no se encuentra una causa definida, se denomina como idiopática (Xenoulis et ál., 2007) y la secundaria que ocurre como consecuencia de obesidad, hipotiroidismo, diabetes Mellitus, pancreatitis, linfoma, colestasis hepática, hiperadrenocorticismo, seudo-Cushing y síndrome nefrótico (Xenoulis et ál., 2007; Bauer, 2000).
Otra forma de clasificar las hiperlipidemias es de acuerdo con las características etiológicas y fisiopatológicas. En caninos y felinos la más común es la posprandial que es una manifestación fisiológica provocada por la producción de quilomicrones ricos en TAG y, normalmente, se resuelve después de 2 a 10 horas de presentarse.
Otro tipo de hiperlipidemias son las patológicas que pueden tener origen genético o familiar o presentarse como secuela de otras enfermedades, en cuyo caso sería de tipo secundario. En las primeras, se destaca la idiopática que se presenta en caninos schanauzer miniatura, en la que se presenta elevación ligera de la concentración de VLDL con o sin quilomicronemia e hipercolesterolemia leve. Asimismo, dentro de las hiperlipidemias primarias, se encuentra la hiperquilomicronemia felina, caracterizada por quilomicronemia en ayunas y elevación ligera de VLDL por una producción anormal de lipoproteín lipasa inactiva. Esta entidad también se ha identificado en caninos y cursa con hipertrigliceridemia, hiperquilomicronemia con concentraciones séricas de colesterol normales.
La tercera entidad es aquella que se presenta en caninos dóberman pinscher y rottweilers, caracterizada por hipercolesterolemia por aumento de las LDL. En el hiperadrenocorticismo también aumentan los TAG sanguíneos por estimulación de la hormona sensible a la lipasa, por lo que se liberan de manera excesiva, ácidos grasos libres a la circulación, que se convierten en VLDL. En la patología, también se inhibe la actividad de la lipoproteína lipasa, lo que disminuyendo la depuración de las lipoproteínas ricas en TAG (Ettinger, 2005). En caninos y felinos, la forma más común de hiperlipidemia es la hipertrigliceridemia, debido a la eliminación disminuida de quilomicrones y de VLDL o bien por la producción exagerada de estas últimas; siendo ambas transportadoras de TAG, cuando se encuentran aumentadas se produce lipemia (Bauer, 2000).
Obesidad
La obesidad es una patología estudiada, diagnosticada y tratada ampliamente en humanos, la cual también se reconoce en animales, especialmente, en caninos, mostrando una tendencia creciente con el paso de los años en diferentes razas (Kirk et ál., 2007). Estudios epidemiológicos desarrollados por Lund et ál., en Estados Unidos, indican que la prevalencia del sobrepeso-obesidad en caninos adultos es de 34,1%, siendo más frecuente en animales castrados y entre 6 y 10 años de edad. Otros factores predisponentes son las patologías del sistema digestivo, artritis y oesteoartritis, enfermedades del sistema músculo-esquelético, cardiorrespiratorias y de las vías urinarias (Lund et ál., 2006).
Por otra parte, ante la obesidad, el organismo sufre algunas modificaciones adaptativas; si bien, en pacientes hipertensos no obesos se observa hipertrofia cardiaca concéntrica, por el aumento de la resistencia vascular y de la poscarga ventricular, en los hipertensos obesos, dicha hipertrofia es excéntrica por aumento del volumen intravascular y de la presión de llenado, que se caracteriza por ventrículos más gruesos e hipertrofiados; por lo anterior, algunos pacientes obesos desarrollan insuficiencia cardiaca congestiva. En la obesidad con o sin hipertensión, se observa disminución de la resistencia vascular renal, aumento del flujo sanguíneo renal, mayor tasa de filtración glomerular, reabsorción tubular de sodio e hipertensión (Zhang y Reisin, 2001).
Manejo de la obesidad
En el control de la obesidad, se busca la reducción del peso del paciente, lo que disminuye la masa lipídica, pero no la masa proteica, porque se altera el funcionamiento de los tejidos (Gossellin et ál., 2007a; Wren et ál., 2007a). Por ello se habla del control integral de la obesidad con dieta y ejercicio y en casos agudos se incluye el uso de fármacos (Zoran y Graves, 2009).
Manejo farmacológico de la Hiperlipidemia
En el manejo de las hiperlipidemias, el primer paso a seguir es diagnosticar si esta es de tipo primario o secundario, en cuyo caso se debe resolver la enfermedad de origen. El tratamiento debe ser integral y requiere la participación activa y permanente del propietario de la mascota e incluye manejo de la dieta, uso de fármacos hipolipemiantes cuando la concentración de TAG sea superior a 500mg/dl, o la de colesterol supere 800 mg/dl. En caso de animales obesos, se sugiere el ejercicio y el uso de fármacos inhibidores de la absorción de los lípidos de la dieta (Kirk et ál., 2007; Ettinger, 2005).
Teniendo en cuenta que las hiperlipidemias, dentro de las que se encuentra la hipercolesterolemia, han constituido una patología de importancia creciente en medicina veterinaria, el desarrollo de fármacos para el tratamiento de estas ha sido notable. Actualmente, se tienen diversas opciones, los inhibidores de la HMG CoA reductasa o estatinas, los secuestrantes de ácidos biliares (resinas), el ácido nicotínico (niacina) y los derivados del ácido fíbrico y recientemente en medicina veterinaria, se introdujo un nuevo fármaco, la dirlotapida, que inhibe la absorción de los lípidos de la dieta en el tracto digestivo (Merritt et ál., 2007a).
Estatinas
Son moléculas de origen natural, actualmente desarrolladas en forma sintética. Dentro de los principios activos, se encuentra: mevastatina, lovastatina, simvastatina, pravastatina, fluvastatina, atorvastatina, cerivastatina (lipofílicas) y rosuvastatina y pitavastatina (hidrofílicas). Este grupo de fármacos se destaca por ser útiles como monoterapia y rara vez requieren ser asociados con otro grupo de fármacos (Satoh, 2008; Goodman y Gilman, 2003; Piernas-Huerta et ál., 2007; Tobert, 1987).
La estructura química de estos fármacos es similar a la de la enzima, reductasa de 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA), que participa en la biosíntesis hepática del colesterol, por lo cual tienen la capacidad de inhibirla. Por lo anterior, se observa una notoria reducción de los niveles de mevalonato plasmático y urinario, en los pacientes tratados (Piernas-Huerta et ál., 2001). De una u otra manera, al disminuir la concentración de colesterol libre en los hepatocitos, se genera un estímulo en el ámbito nuclear que culmina con el aumento de la expresión del gen que codifica los receptores de LDL y con la disminución de la degradación de éstos. Es así como, al haber mayor número de receptores membranales de LDL en los hepatocitos, las LDL abandonan la sangre para ligarse a estos, lo que conduce a una disminución de la concentración sérica de éstos (Mraiche et ál., 2005; Goodman y Gilman, 2003).
Las estatinas fuera de su acción hipolipemiante también generan efecto beneficioso en la disfunción endotelial, en enfermedad coronaria, isquemia del miocardio, en vasoespasmo cerebral y en enfermedad vascular proliferativa, entre otras razones por sus efectos antiinflamatorios y antioxidantes (Mraiche et ál., 2005; Mital y Liao, 2004; Ilker et ál., 2004).
A pesar de que se han considerado fármacos seguros, se insiste en que hacen falta estudios sobre su toxicidad a largo plazo y toxicidad para las diferentes especies de animales (Piernas-Cuesta et ál., 2001).
En caninos, la lovastatina se recomienda en dosis de 10-20 mg vía oral, cada 24 horas, pero se contraindica en paciente con insuficiencia hepática (Ettinger, 2005). Lovastatina y simvastatina han sido utilizadas en caninos por vía oral en diferentes esquemas de tratamiento, utilizando o no secuestrantes de colestiramina, con notorios efectos en la reducción del colesterol plasmático y de la concentración plasmática y urinaria del ácido mevalónico (Alberts, 1990).
Secuestrantes de ácidos biliares
Estos fármacos son los más antiguos dentro del grupo de los hipolipemiantes, así como los más seguros por su escasa o casi nula absorción. Los tres fármacos del grupo son colestiramina, colestipol y colesevelam, que es el más reciente (Goodman y Gilman, 2003).
Los ácidos biliares salen por la bilis a través del conducto biliar hacia el intestino, para luego ser reabsorbidos en el intestino; sin embargo, en caso que dicha reabsorción no ocurra, los ácidos biliares se agotan, lo que aumenta la síntesis de estos. Debido a que la molécula precursora de los ácidos biliares es el colesterol, su síntesis exagerada conduce a disminución de la concentración hepática de este. De igual forma, por su gran tamaño no se absorben en el tracto gastrointestinal, lo que les permite permanecer en su luz, a donde llegan los ácidos biliares, los cuales, una vez unidos al fármaco, son excretados en la materia fecal. Es así como estos fármacos conducen a pérdida exagerada de ácidos biliares con el subsecuente aumento de la síntesis de estos y posterior agotamiento del colesterol hepático (Goodman y Gilman, 2003).
En consecuencia y de manera similar a como lo hacen las estatinas, se produce aumento de los receptores hepáticos de LDL y con ello incremento en la depuración de las LDL y disminución de su concentración. Dicho efecto se ve compensado parcialmente con el aumento de la síntesis de colesterol causado por la regulación ascendente de la HMG-CoA reductasa y por ello, la asociación de un secuestrante con estatinas es favorable, ya que esta última inhibe dicha enzima y aumenta la eficacia del primero (Fleitas, et ál., 2004). En caninos, la colestiramina se utiliza en dosis de 1-2 gr cada 12 horas (Ettinger, 2005).
Derivados del ácido fíbrico
Dentro del grupo se encuentran el clorofibrato o clofibrato, gemfibrozilo, gemfibrato, ciprofibrato, bezafibrato y fenofibrato (Ettinger, 2005; Goddman y Gilman, 2003). Aún no es clara su farmacodinamia, pero se sugiere que actúan con los receptores activados por el proliferador de peroxisomas (PPAR), que regula la transcripción de algunos genes. Se conocen tres isotipos de PPAR, el alfa, el beta y el gamma, de los cuales los fibratos se unen al primero, que se expresa notoriamente en los hepatocitos y en el tejido adiposo pardo y, en menor, proporción en riñones, corazón y músculo estriado. De manera complementaria, se indica que estimulan la beta-oxidación, por lo que disminuye la concentración de los TAG, aumentan la síntesis de la LPL que conduce a mayor depuración de lipoproteínas cargadas de TAG. Asimismo, disminuye la expresión de apoC-III, con lo que se bloquea la lipólisis y aumenta la depuración de VLDL. También se observa que aumenta la concentración del HDL por estimulación de la expresión de apoA-I y apo A-II, a través de la PPAR-alfa (Goodman y Gilman, 2003). En caninos, se indica que disminuye las concentraciones de TAG, porque estimula la actividad de la lipoproteína lipasa y disminuye la concentración de ácidos grasos libres, lo cual disminuye los sustratos para la síntesis de VLDL (Shiroshita-Takeshita et ál., 2007).
Los estudios realizados en caninos, en los que se ha administrado simultáneamente simvastatina y gemfibrozilo, han permitido determinar la posible interacción medicamentosa entre estos dos fármacos, en razón a la activación metabólica que requiere la simvastatina para lograr su efecto farmacológico. Así es como se indica que el gemfibrozilo no afecta la conversión de la simvastatina a su forma hidroxiácida, pero prolonga un poco la glucuronidación, con lo que se prolonga la permanencia del fármaco en los caninos (Prueksaritanont et ál., 2005).
En caninos se reportan como efectos adversos, dolor abdominal, vómito, diarrea y aumento de las transaminasas hepáticas. El gemfibrozilo se usa en dosis de 200 mg cada 24 horas en caninos y en los gatos 10 mg/kg cada 12 horas (Ettinger, 2005).
Ácido nicotínico (niacina)
Este fármaco es muy antiguo y se caracteriza por su versatilidad, debido a que es útil para casi todas las hiperlipidemias. Es una vitamina del complejo B y por ello hidrosoluble, con una forma activa, el dinucleótido de adenina nicotinamida (Goodman y Gilman, 2003).
En el tejido adiposo, la niacina inhibe la lipólisis de los TAG mediada por la lipasa. A nivel hepático disminuye la síntesis de TAG, porque inhibe la síntesis de ácidos grasos y la esterificación de estos con lo que se promueve la desintegración de la apoB. Por lo anterior, disminuye la producción de VLDL y con ello la concentración de LDL (Lipka, 2003).
Debido al aumento de la actividad de la LPL, el fármaco estimula de depuración de quilomicrones y de TAG de las VLDL. Asimismo, aumenta la concentración de HDL, porque disminuye la depuración hepática de apoA-1 en la HDL, por lo cual aumenta el contenido de apoA-1 en el plasma y en transporte inverso de colesterol. Después de cuatro a siete días de tratamiento, la niacina disminuye los TAG en 30-50% y las concentraciones de HDL aumentan de 15-30% en una terapia tradicional (Goodman y Gilman, 2003).
En caninos, los efectos indeseados son relativamente frecuentes y son vómito, diarrea, eritema y prurito, aumento de las transaminasas hepáticas. En esta especie, el fármaco se utiliza en dosis total de 100 mg diarios (Ettiger, 2005).
Inhibidores de la absorción de colesterol
En este grupo, se encuentran dos fármacos y dentro de ellos, el de más reciente introducción en el mercado farmacéutico veterinario, la dirlotapida. En Estados Unidos y posteriormente en Europa, la dirlotapida fue aprobada como fármaco hipolipemiante para uso exclusivo en caninos (FDA, 2007). Inicialmente, fue aislado de microsomas provenientes de hígado bovino y químicamente se caracteriza por ser una proteína heterodimérica soluble, ligada a dos polipéptidos (Wren et ál., 2007a).
A pesar de que en condiciones in vitro, la dirlotapida es un potente inhibidor de todas las MTP, in vivo, únicamente muestra alta selectividad por las de ubicación entérica. En consecuencia, este fármaco disminuye la absorción de los lípidos de la dieta y con ello la concentración sérica de estos. Los estudios experimentales permiten indicar que con dosis de 6 mg/kg de peso en ratones, se logra disminuir la concentración sérica de colesterol en 25% (Wren et ál., 2007a).
Específicamente y de manera similar a como lo hacen otros inhibidores de las MTP, la dirlotapida conduce a que los ácidos grasos, los acilgliceroles y el colesterol, provenientes de la dieta, queden en los enterocitos, por la inhibición del ensamblaje de las lipoproteínas y su posterior liberación en la sangre a través de la linfa, aumentando su eliminación en la materia fecal. Estudios histológicos realizados en caninos tratados con dirlotapida, confirman la presencia de grasa en la mucosa intestinal por lo que se piensa que la grasa acumulada en los enterocitos, al no lograr su absorción, permea hacia la luz intestinal para luego ser eliminada (Wren et ál., 2007a; Wren et ál., 2007b).
De manera complementaria, tras la administración oral, pero no endovenosa de dirlotapida en caninos, se observa disminución del apetito, así se logra una pérdida de peso beneficiosa en pacientes obesos. Se propone que dicho efecto se debe a que la presencia de grasa en la mucosa intestinal promueve la liberación de péptidos gastrointestinales a la circulación general, capaces de estimular los centros hipotalámicos de la saciedad, localizados en el núcleo arcuato o bien que la señal sea mediada a través del nervio vago.
Estas proposiciones han sido estudiadas en biomodelos de roedores tratados con dirlotapida, en los cuales se ha medido la concentración de los péptidos de la saciedad, péptido YY y péptido-1 similar al glucacón, encontrando ascensos de 370% y 126%, respectivamente, en relación con lo encontrado con el placebo. El péptido YY liberado por la presencia de grasa en el íleon pasa a circulación general y de allí atraviesa la barrera hematoencefálica para finalmente, estimular los receptores Y2, esto disminuye la motilidad gastrointestinal y el vaciamiento gástrico por medio de un efecto opioide, serotoninérgico y beta-adrenérgico.
Por su parte el péptido-lsimilar al glucacón, disminuye la producción de ácido clorhídrico y la motilidad gástrica y estimula el centro de la saciedad en el área póstrema y subcortidal del hipotálamo (Gosselin et ál., 2007a; Wran et ál., 2007a). El fármaco no afecta la digestibilidad de la materia seca, de la fibra cruda, de la proteína, ni de los carbohidratos, durante todo el periodo de tratamiento (Kirk et ál., 2007).
Debido a la acción producida por la dirlotapida, disminuye la concentración sérica de colesterol, HDL, vitaminas A y E, nitrógeno ureico sanguíneo, albúmina, globulina y calcio. Asimismo, se encuentra aumento de la actividad sérica de ALT después de 14 días de tratamiento y de la AST después de 28 días, sin embargo, dichos ascensos no son clínicamente significativos (Wren et ál., 2007c; Wren et ál., 2007d). Los efectos farmacológicos son:
-
Reducción de la concentración de lípidos en la sangre. La dirlotapida disminuye la concentración de colesterol sérico cuando se encuentra en altos niveles llevándolo a concentraciones normales (Wren et ál., 2007b).
-
Pérdida de peso corporal. Utilizando dosis de 0,5 mg/kg se observa disminución del peso corporal, efecto que se hace más notorio en las dos primeras semanas de tratamiento (3,3% por semana); luego se puede bajar la dosis a 0,36mg/kg y el descenso del peso continua dándose, pero en menor proporción, en las siguientes dos semanas siendo este de 2,4%, en los siguientes dos meses es de 1,6%; finalizando el tratamiento, la pérdida de peso está aproximadamente en 1-2%, con dosis de 0,2 mg/kg. En estudios prolongados, se encuentra que después de administrar dirlotapida diariamente por tres meses se logra una pérdida de peso total de entre 12,7 y 25,2%; también se demuestra que después de retirado el tratamiento los animales no siguen perdiendo peso (Wreb et ál., 2007b; Wreb et ál., 2007d).
-
Disminución en el consumo de alimento, aunque la dirlotapida induce pérdida de peso, se sabe que parte de este efecto se debe a la disminución del apetito inducida por el fármaco, efecto que facilita el propietario el manejo integral de la obesidad, mejores hábitos alimenticios (Wreb et ál., 2007b).
El fármaco preparado en suspensión se absorbe vía oral con una biodisponibilidad de baja a moderada y equivalente a 24, 36 y 41%, utilizando dosis de 0,05 mg/kg, 0,3 mg/kg y 1 mg/kg, respectivamente. Por esta vía sufre efecto de primer paso y su absorción mejora cuando se administra con el alimento y cuando se utiliza la presentación oleosa. En estudios realizados administrando el fármaco vía oral durante 14 días consecutivos, se observó que el Vd no cambió, pero la Cmax y el AUC fueron superiores el día 14 con respecto al día 1 (Merritt et ál., 2007b).
Después de la administración de 0,3 mg/kg de peso en bolus intravenoso de dirlotapida, se encontró una Cmax de 1600 ng/mL, mientras que para la administración oral utilizando dosis de 0,05 mg/kg, 0,3 mg/kg y 1 mg/kg, las Cmax alcanzadas fueron de 7,5 ng/mL en 0,8 horas, 45,6 ng/mL en 1,8 horas y 96,9 ng/mL en 1,7 horas, respectivamente. Las concentraciones sanguíneas alcanzadas permanecen por cerca de 4-8 horas, momento a partir del cual comienzan a descender. Con base en los análisis estadísticos, se indica que no existe diferencia significativa entre las dosis de 0,05 y 1 mg/kg en relación con el AUC y Cmax (Merritt et ál., 2007b).
La dirlotapida absorbida se biotransforma ampliamente en el hígado, sufriendo, efecto de primer paso. La principal vía metabólica es la oxidativa por N-desalquilación y la fase de conjugación se hace por glucuronidación y sulfatiación (Merritt et ál., 2007a).
Se considera que la selectividad del fármaco por los enterocitos y su baja biodisponibilidad lo hacen seguro para los pacientes. La dosis tolerable en caninos es de 10 mg/kg administrándola cada 24 horas durante 14 días o 2,5 mg/kg cada 8 horas durante 3 meses (Wren et ál., 2007a). A pesar de que los efectos producidos son pérdida de apetito y pérdida de peso, estos ocurren dentro de proporciones deseadas, es decir, que no se llega a estados de anorexia o inanición. Entre los efectos adversos, se destaca emesis, letargia, diarrea y anorexia (Gossellin et ál., 2007b; Wren et ál., 2007a; Wren et ál., 2007c). En relación con la presencia de grasa en la materia fecal, debido al mecanismo de acción de la dirlotapida, esta aumenta entre 25-30% sin que implique alteraciones de la consistencia o volumen producido de esta o en la frecuencia de la defecación (Wren et ál., 2007a).
Por otra parte, en algunos pacientes, aumenta la concentración de transaminasas hepáticas sin ninguna manifestación clínica. Asimismo, a pesar de que los niveles de vitaminas A y E disminuyen, no se evidencia signos clínicos de avitaminosis en los pacientes tratados (Gossellin et ál., 2007b). De manera aislada se encuentra alteración en el pelaje (Wren et ál., 2007c).
En relación con alteraciones morfológicas, los animales tratados con dirlotapida mostraron cierta disminución del tamaño del hígado, riñones y corazón, relacionados con la pérdida proporcional del peso corporal. Histológicamente, se encontró disminución del depósito de glicógeno en los hepatocitos; asimismo, se encontró mayor pigmentación en las células de Kupffer en los animales tratados, debió al mayor depósito de hierro en estas.
Según los estudios, dichas alteraciones se normalizan durante el periodo postratamiento (Wren et ál., 2007c). Los estudios realizados presentan la dirlotapida como un fármaco seguro, aunque el laboratorio creador incluye en el dossier del producto contraindicaciones como, animales en crecimiento, hembras gestantes, porque altera el desarrollo del saco vitelino llevando a embrioletalidad o teratogenicidad. Tampoco se debe utilizar en hembras en lactancia, pacientes con falla hepática, hipersensibilidad a cualquiera de los componentes, obesidad por hipotiroidismo o por hiperadrenocorticismo y felinos (Pfizer, 2007). De igual forma, se contraindica en pacientes caninos o felinos que están siendo tratados en forma crónica con corticoides y en caninos con daño hepático (Zoran y Graves, 2009).
En el mercado la dirlotapida se encuentra como producto comercial en solución oral al 0,5%, diseñado y aprobado para su uso en canino (Pfizer, 2007). En el manejo de la obesidad, el tratamiento con dirlotapida es temporal por lo que se recomienda administrarla hasta que se logre estabilizar el peso corporal y se haya determinado la dieta ideal para el paciente (Wran et ál., 2007a).
Como se dijo anteriormente y basado en los estudios realizados, se recomienda el uso de 0,5 mg/kg de peso para lograr pérdida de peso; sin embargo, después de dos semanas de tratamiento la dosis se puede reducir en un 25%, quedando en 0,36 mg/ kg (Wreb et ál., 2007b). El esquema terapéutico recomendado por el laboratorio productor indica que primero se debe hacer la evaluación general del paciente, con particular atención en el peso y la condición corporal con las cuales el paciente inicia el tratamiento. Es así como se maneja una dosis inicial de 0,05 mg/kg cada 24 horas durante dos semanas, al cabo de las cuales se dobla la dosis durante un mes. Cumplido, el paciente deberá ser pesado para ajustar la dosis de acuerdo con la respuesta, hasta cumplir los 12 meses, sin exceder la dosis de 1mg/kg.
El esquema de ajuste de dosis indicado por el laboratorio Pfizer es muy preciso, por lo que se presenta textualmente así:
Al final de cada mes de terapia, se deberá determinar el porcentaje de peso perdido. Si la pérdida de peso desde la medición de este, el mes anterior, ha sido >3% del peso total por mes (equivalente a un 0,1% del peso total por día); la dosis (ml administrados) debería mantenerse igual. Si la pérdida de peso desde la medición de este, el mes anterior, ha sido <3% peso total por mes, debería aumentarse la dosis independientemente del peso que tenga el perro en ese momento. La primera vez que se requiera un aumento de dosis, este debería ser del 100% (doblarse). En aumentos posteriores, la dosis debería aumentarse en un 50% (aumentando el volumen de dosis a 1,5 veces el volumen administrado en el mes anterior) hasta un volumen máximo de 0,2 ml/kg (1 mg/kg) del peso que presente el perro en ese momento. Estos ajustes deberían continuar hasta que se alcance el peso previsto al inicio del tratamiento. Aunque no se han observado en los ensayos clínicos, en caso de que la pérdida de peso desde la última medición mensual de este haya sido del >12% por mes (equivalente a un 0,4% del peso corporal por día), el volumen de dosis debería reducirse en un 25%).
Se recomienda que una vez sea suspendido el tratamiento, se continúe con dieta restringida y rutina de ejercicio, en razón a que los animales comienzan a ganar peso una vez se culmina la terapia (Pfizer, 2007).
Conclusiones
Las hiperlipidemias y la obesidad son enfermedades complejas, primarias o secundarias, que si no son tratadas correctamente pueden derivar en la muerte del animal o en alteraciones que afectan notablemente su bienestar. Para su tratamiento, se cuenta con los hipolipemiantes, fármacos de uso frecuente en pacientes humanos y menos frecuente en animales, por lo que la disponibilidad de información científica en estos últimos es relativamente escasa, así como la experiencia de los médicos veterinarios en su utilización.
Por otra parte, las posibilidades terapéuticas en medicina veterinaria con el uso de fármacos son tan amplias como en medicina humana, sin embargo, existen muchos grupos farmacológicos que no son usados con frecuencia por no existir productos comerciales de uso veterinario. Los fármacos probados en seres humanos deben ser evaluados en los animales en los que se vayan a utilizar, porque pueden existir variaciones, principalmente, farmacocinéticas, que implique el uso de esquemas terapéuticos específicos para cada especie en procura de la máxima eficacia con los mínimos riesgos. Con premisa, se insiste en que el profesional no debería ajustar una dosis o utilizar un medicamento en una especie en la que no ha sido utilizado previamente en un estudios de investigación seria y veraz.
Referencias
Alberts, A.W. (1990). Lovastatin and simvastatin-inhibitors of HMG CoA reductase and colesterol biosynthesis. 77 -supp 4, 14-21. [ Links ]
Bauer, J.E. (2000). Hyperlipidemias en S.J. Ettinger and Feldman Textobook of Veterinary Internal Medicine (5a Ed., cap. 72). [ Links ]
Delgado, R.L. y Martínez, S.G. (2010). Nuevos enfoques sobre la función de las lipoproteínas plasmáticas en las enfermedades de origen aterotrombótico. Rev Cubana Farm., 44 (2). Recuperado de: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S003475152010000200013&lng=es&nrm=iso [ Links ]
Delgado, B.L. y Guija, P.E.. (1999). Metabolismo de las lipoproteínas. Diagnóstic, 38 (3). [ Links ]
Ettinger, S.J. (2005). Textbook of Veterinary Internal Medicine (6a Ed.). USA: Saunders W. [ Links ]
Fleitas, E.A., Carballo, R.F., Rosabal, B.C. y Rodríguez, F.G. (2004). Actividad de los Receptores Hepáticos apo B, E en conejos hipercolesterolémicos tratados con colestina. Instituto Nacional de Angiología Vascular. Recuperado el 18 de marzo del 2009 de: http://bvs.sld.cu/revistas/ang/vol5_1_04/ang12104.htm. [ Links ]
Goodman y Gilman (2003). Las bases farmacológicas de la terapéutica (10a Ed., vol. II, cap. 36). México: McGraw Hill. [ Links ]
Gossellin, J., Wren, J.A. y Sunderland, S.J. (2007). Canine obesity - an overview. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 1-10. [ Links ]
Gossellin, J., McKelvie, J., Sherington, J., Wren, J. A., Eagleson, J.S., Rowan, T.G. y Sunderland, S.J. (2007a). An evaluation of dirlotapide to reduce body weight of client-owned dogs in two placebo-controlled clinical studies in Europe. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 73-80. [ Links ]
Gossellin, J., Peachey, S., Sherington, J., Rowan, T.G. y Sunderland, S.J. (2007b). Evaluation of dirlotapide for sustained weight loss in overweight Labrador retrievers. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 55-65. [ Links ]
Ilker, G.M., Baykal, Y., Sinmez, A., Bulucu, F., Aydin, A., Sayal, A. y Cokkar, H. (2004). Effects of statins on oxidative stress. Biological Trace Element Research, 98, 119-123. [ Links ]
Kirk, C.A., Boucher, J.F., Suderland, S.J.;,Wren, J.A. (2007). Influence de la dirlotapida, a microsomal triglyceride transfer protein inhibitor, on the digestibility of a dry expanded diet in adult dogs. Journal of Veterinary Pharmacology and Therapeutics, 30 (l), 66-72. [ Links ]
Lipka, L.J. (2003). Ezetimibe: A first-in-class, novel cholesterol absorption inhibitor. Cardiovascular Drug Reviews, 21 (4), 293-312. [ Links ]
Lund, E.M., Armstrong, P.J., Kirk, C.A. y Klausner, J.S. (2006). Prevalence and risk factors for obesity in adult dogs from private us veterinary practices. Intern J Appl Res Vet Med., 4 (2), 177-186. [ Links ]
Mead, J.R., Irvine, S.A. y Ramji, D.P. (2002). Lipoprotein lipase: structure, function, regulation, and role in disease. J Mol Med., 80 (12), 753-769. [ Links ]
Meng, W., YU, F., Zhang, J., Zhang, E., Dian, K. y Shin, Y. (2009). Concentration polarization of high density lipoprotein and its relation with shear stress in an in Vitro model. Journal of Biomedicine and Biotechnology, 1155-1163. [ Links ]
Merritt, D.A., Bessire, A.J., Vaz, A.D., Sams, J.P. y Lynch, M.P. (2007a). Absorption, distribution, metabolism, and excretion of dirlotapide in the dog. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 17-23. [ Links ]
Merritt, D.A., Lynch, M.P. y King, V.L. (2007b). Phamacokinetic of dilotapida in the dog. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 24-32. [ Links ]
Mital, S. y Liao, J. (2004). Statins and the myocardium. Seminars in Vascular Medicine, 4 (4), 377-384. [ Links ]
Mraiche, F., Cena, J., Das, D. y Bollrath, D. (2005). Effectos of statins on vascular function of endothe-lin-1. British J. of Pharmacology, 144, 715-726. [ Links ]
Nelson, D.L., Lehninger, A., Cox, M.M. (2000). Lehninger Principles of Biochemistry (3a Ed., cap. 10, 17 y 21). USA: Worth Publising. [ Links ]
Pasquini, A., Luchetti, E. y Cardini, G. (2008). Plasma lipoprotein concentrations in the dog: the effects of gender, age, breed and diet. Journal of Animal Physiology and Animal Nutrition, 92 (6), 718-722. [ Links ]
Pfizer (2007, 12 de die.). Dossier Slentrol®. [ Links ]
Pfizer (2006). Freedom of information summary Slentrol® oral. [ Links ]
Piernas-Huerta, M.A., Asenjo-Barrón, J.C., Miranda-Zamora, R., Juárez-Oropeza, M.A. y Díaz-Zagoya, J.C.. Las vastatinas, inhibidoras de la biosíntesis del colesterol: eficacia y toxicidad. Rev Fac Med UNAM, 44 (1), 12-17. [ Links ]
Prueksaritanont, T., Mu, L., Michael, K., Richards, K. y Lin, J. Interconversion pharmacokinetics of simvastatin and its hydroxy acid in dogs: effects of gemfibrozil. Pharmaceutical Research, 22 (7), 1101-1109. [ Links ]
Satoh, K., Takaguri, A., Itagaki, M., Kamo, S., Ichihara, K. (2008). Effects of rosuvastatin and pitavastatin on ischemia-induced myocardial stunning in dogs. J Pharmacol Sci, 106, 593-599- [ Links ]
Shiroshita-Takeshita, B., Brundel, B.J.J., Burstein, B., Leung, T.K., Mitamura, H. y Nattel, S. (2007). Effects of simvastatin on the development of the atrial fibrillation substrate in dogs with congestive heart failure. Cardiovascular Research, 74, 75-84. [ Links ]
Tardif, J.C., Gregoire, J., L'allier, P.L., Ibrahim, R., Lespérance, J., Heinonen, T.M., Kouz, S., Berry, C., Basser, R., Lavoie, M.A., Guertin, M.C. y Rodés-Cabau, J. (2007). Effects of reconstituted high-density lipoprotein infusions on coronary atherosclerosis: a randomized controlled trial. Journal of American Medical Association, 297. (15), 1675-1682. [ Links ]
Tobert, J.A. (1987). New developments in lipidlowering terapy: the role of the inhibitores of hydroxymethylglutaryl-coenzime A reductase. Circulation, 76, 534-538. [ Links ]
Voet, D., Voet, J. y Prat, C.W. Fundamentals of Biochemistry: Life at the Molecular Level (3a Ed., cap. 9 y 20). Wiley, John & Sons. [ Links ]
Voet, D. y Voet, J. (2005). Biochemistry (3a Ed., vol. I, cap. 12 y 25). .Wiley, John & Sons, Incorporated. [ Links ]
Wren, J. A., Grossellin, J., Sunderlands, S.J. (2007a). Dirlotapide: a review of its properties and role in the management of obesity in dogs. Journal of Veterinary Pharmacology and Therapeutics, 30 (l), 11-16. [ Links ]
Wren, J.A., King, V.L., Campbell, S.L., Hickman, S.A. (2007b). Biologic activity of dirlotapide, a novel microsomal triglyceride transfer protein inhibitor, for weight loss in obese dogs. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 33-42. [ Links ]
Wren, J.A., King, V.L.;,Krautman, M.J., Gossellin, J., Kerlin, R.L., Hickman, M.A. y Schmahai, J. (2007c). The safety of dirlotapide in dogs. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 43-54. [ Links ]
Wren,J.A., Ramudo, A.A., Campbell, S.L., King, V.L., Eagleson, J.S., Gossellin, S. y Sunderland, J.J. (2007d). Efficacy and safety of dirlotapide in the management of obese dogs evaluated in two placebo-controlled, masked clinical studies in North America. Journal of Veterinary Pharmacology and Therapeutics, 30 (1), 81-89. [ Links ]
Xenoulis, P.G., Suchodolski, S.L., Levinski, M.D. y Steiner, J.M. (2007). Investigation of hypertriglyceridemia in healthy miniature schnauzers. J Vet Intern Med, 21, 1224-1230. [ Links ]
Zhang, R. y Reisin, E. Obesidad-hipertensión: efectos sobre los sistemas cardiovascular y renal. American Journal of Health (Ed. Esp.), 3, 150-156. [ Links ]
Zoran, D. y Graves, T. (2009). Obesity the biggest endocrine disease. Symposium Held at the 2009 North American Veterinary Conference and the 2009 Wester Veterinary Conference. [ Links ]