Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354On-line version ISSN 2389-8526
Rev. Med. Vet. no.23 Bogotá Jan./June 2012
Mortalidad en larvas de Culex quinquefasciatus
y Anopheles albimanus (díptera: culicidae),
causada con un producto de Bacillus sphaericus
(bacteria: bacillaceae) en presentación granulada
en condiciones experimentales
Estrella Cárdenas Castro1 / Álvaro Rozo Bautista2 / Ligia Lugo Vargas3
1 Bióloga. MSc. Docente-Investigadora, Universidad de La Salle, Colombia. ecardenas@unisalle.edu.co
2 Bióloga y química. MSc. Docente Investigador, Universidad de La Salle, Colombia. arozo@unisalle.edu.co
3 Bióloga. MSc. Docente-investigadora, Universidad Santo Tomás, Colombia. Red Nacional de Laboratorios, Instituto Nacional de Salud, Colombia. illugo@ins.gov.co
Recibido: 29 de mayo del 2011. Aceptado: 17 de febrero del 2012
Resumen
El objetivo de este estudio fue ensayar una serie de concentraciones de un producto granulado preparado con Bacillus sphaericus, sobre larvas de Culex quinquefasciatus y Anopheles albimanus en condiciones de laboratorio. Se utilizaron once concentraciones (20, 40, 60, 80, 100, 120, 140, 160, 180, 200 y 500 ppm) sobre larvas de An. albimanus, y ocho concentraciones diez veces menores (2, 4, 6, 8, 10, 12, 14 y 16 ppm) sobre larvas de Cx. quinquefasciatus. Se utilizaron 60 larvas y un control con 20 larvas por concentración. El tiempo de exposición fue de 48 h, a una temperatura de 28 ± 2 °C. Para estimar las concentraciones letales 50 y 95 se utilizó la prueba Probit. Se encontró una CL95 de B. sphaericus entre 6,45 y 7,28 ppm para larvas de Cx. quinquefasciatus; mientras que en larvas de An. albimanus se observó una CL95 entre 450,56 y 466,76 ppm.
Palabras clave: control biológico, microorganismos, mortalidad, mosquitos.
Larval Mortality in Culexquinquefasciatus and Anopheles
albimanus (diptera: culicidae), Caused with a Bacillus
sphaericus (bacteria: bacillaceae) Granulated Product in
Experimental Conditions
Abstract
The purpose of this study was to assay a series of concentrations of a granulated product prepared with Bacillus sphaericus on Culexquinquefasciatus and Anopheles albimanus larvae in laboratory conditions. Eleven concentrations (20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 500 ppm) were used on An. Albimanus larvae and eight concentrations ten times smaller (2, 4, 6, 8, 10, 12, 14, 16 ppm) were used on Cx. quinquefasciatus larvae. Sixty (60) larvae and a control with 20 larvae were used per concentration. The time of exposure was of 48 hours at a laboratory temperature of 28 ± 2 °C. LC50 and LC95 were determined through the Probit tests. A LC95 of B. sphaericus was found between 6,45 and 7,28 ppm for Cx. quinquefasciatus larvae; whereas LC95 was observed between 450.56 and 466.76 ppm in An. albimanus larvae.
Keywords: Biological control, microorganisms, mortality, mosquitoes.
Mortalidade em larvas de Culex quinquefasciatus e Anopheles
albimanus (diptera:culicídeos), causada com um produto de
Bacillus sphaericus (bactéria: bacillaceae) em apresentação
granulada em condições experimentais
Resumo
O objetivo deste estudo foi testar uma série de concentrações de um produto granulado preparado com Bacillus sphaericus, sobre larvas de Culex quinquefasciatus e Anopheles albimanus em condições de laboratório. Utilizaram-se onze concentrações (20, 40, 60, 80, 100, 120, 140, 160, 180, 200 e 500 ppm) sobre larvas de An. albimanus, e oito concentrações dez vezes menores (2, 4, 6, 8, 10, 12, 14 e 16 ppm) sobre larvas de Cx. quinquefasciatus. Utilizaram-se 60 larvas e um controle com 20 larvas por concentração. O tempo de exposição foi de 48h, a uma temperatura de 28 ± 2 °C. Para estimar as concentrações letais 50 e 95 utilizou-se o teste Probit. Encontrou-se uma CL95 de B. sphaericus entre 6,45 e 7,28 ppm para larvas de Cx. quinquefasciatus; enquanto que em larvas de An. Albimanus observou-se uma CL95 entre 450,56 e 466,76 ppm.
Palavras chave: controle biológico, micro-organismos, mortalidade, mosquitos.
Introducción
Se han encontrado en todo el mundo más de 480 especies del género Anopheles; no obstante, cerca de 80 especies se han reportado como vectores de malaria (1).
La especie Culex quinquefasciatus se encuentra ampliamente en zonas tropicales y subtropicales. Esta especie está implicada en la transmisión de las filarias Wuchereria bancrofti y Dirofilaria immitis (2, 3). Además, es vector de varios virus: virus del Nilo occidental y de los virus causantes de la encefalitis de San Luis y la encefalitis equina venezolana (4). En Colombia, C. quinquefasciatus está ampliamente distribuida desde las zonas costeras, llanos orientales, Amazonas, Chocó y las zonas altoandinas (5, 6). En la Sabana de Bogotá se ha constituido en un problema de salud pública puesto que su picadura causa alergias y molestias originadas en la alta densidad de sus poblaciones (6).
La especie Anopheles albimanus presenta una gran distribución geográfica en la zona tropical de las Américas y es vector efectivo de malaria (7-9). En zonas con altas densidad en las poblaciones de esta especie, las hembras adultas se alimentan con sangre humana o de animales domésticos desde las primeras horas de la noche hasta la medianoche (10, 11). En Colombia se han encontrado aproximadamente 45 especies de Anopheles, de las cuales son consideradas vectores de malaria: Anopheles albimanus, An. darlingi y An. nuneztovari; en cuanto a los departamentos en los cuales se ha encontrado mayor presencia de malaria se señalan: Antioquia, Nariño, Córdoba, Chocó, Meta, Guaviare y Putumayo (12).
La utilización de insecticidas organosintéticos para el control de insectos vectores y plagas de cultivos ha generado resistencia en las poblaciones naturales de estos insectos (13). El control biológico utiliza un agente con capacidad para reducir el tamaño de una población de insectos vectores o plagas y se ha considerado como una alternativa para minimizar poblaciones de estos insectos. El agente biológico puede ser un patógeno, un depredador, un competidor o una toxina derivada de microorganismos o de plantas (14).
Bacillus sphaericus es una bacteria que se encuentra en forma natural en todo el mundo. Esta bacteria fue registrada por la Agencia de Protección Ambiental (EPA, por su sigla en inglés) para ser usada como larvicida en diferentes especies de mosquitos. Las larvas de mosquitos ingieren esta bacteria que se libera en el intestino y la toxina se adhiere a sus células, las cuales contienen receptores específicos para la misma, y los mosquitos mueren por intoxicación. Los mamíferos no contienen receptores para esta toxina (15).
Desde que se descubrió que B. sphaericus presentaba toxicidad para larvas de mosquitos (16) se han descrito varias cepas de esta bacteria con propiedades larvicidas. La cepa B. sphaericus-2362 fue aislada de adultos de Simulium damnosum en Nigeria y mostró alta toxicidad en larvas (17), desde entonces ha sido la más ensayada y utilizada como alternativa para el control de mosquitos. Varios autores han demostrado que la cepa 2362 de B. sphaericus presenta alta efectividad tóxica en los géneros Anopheles, Culex y Psorophora, y para algunas especies del género Aedes; mientras que en las especies Ae. aegypti y Ae. albopictus no encontraron efectividad (18-25).
Davidson et ál. (26) reportaron que B. sphaericus es efectivo contra especies de los géneros Anopheles y Culex, y menos efectivo contra especies del género Aedes; además, presenta actividad tóxica y alta persistencia en aguas contaminadas (21). Vilarinhos et ál. (27) demostraron que B. sphaericus-2362 es efectivo contra larvas de Ae. aegypti a concentraciones de 1580 ppb, y Melo et ál. (28) encontraron una mortalidad del 70% en Ae. aegypti en una concentración de 1 g/L de B. sphaericus. Las ventajas que presenta B. sphaericus son las siguientes: baja toxicidad ambiental dada la alta especificidad de sus toxinas, altos niveles de eficacia y persistencia en el ambiente (14). La actividad tóxica de B. sphaericus sobre larvas de mosquitos ha sido ampliamente estudiada en el mundo (23, 24, 27, 29-45).
En Colombia se han realizado varios estudios sobre actividad tóxica de Griselesf B. sphaericus en formulación líquida sobre larvas de mosquitos Cx. quinquefasciatus, Ae. taeniorhynchus y An. albimanus bajo condiciones de campo en Buenaventura (46), y en sumideros de Cali se ha utilizado VectoMax para el control de larvas de mosquitos (47). En Medellín se realizó una investigación para la introducción de genes de B. thuringiensis dentro de B. sphaericus con la finalidad de aumentar la efectividad de esta última contra larvas de mosquitos (48).
La presente investigación procura contribuir a la comprensión de alternativas para el control de mosquitos, que sean amigables con el medio ambiente y que tengan alto potencial para minimizar el uso de insecticidas químicos.
Materiales y método
Colecta y cría de mosquitos
Se realizaron recolecciones de adultos y larvas de Cx. quinquefasciatus en la vereda San Antonio en Villavicencio, Meta (4° 07' 38,21"N;73° 31' 09,34"W, elevación 341 m) y en el embalse del Muña en Sibaté, Cundinamarca (4° 31' 0,2'' N; 74° 15' 05''W, elevación 2568 m), y se trasladaron al laboratorio de Entomología del Instituto Nacional de Salud para su mantenimiento y colonización. Se realizaron observaciones de los especímenes bajo estereomicroscopio, y para la determinación taxonómica de la especie se utilizaron las claves taxonómicas de Cova-García et ál. (49).
Las colonias An. albimanus utilizadas en los ensayos se originaron de colecciones realizadas en Barranquilla y Cartagena en 1978, establecidas y mantenidas en el Laboratorio de Entomología del Instituto Nacional de Salud, y determinadas con las claves taxonómicas de Cova-García y Sutil (50).
Se utilizó una cámara climática Sherer con las siguientes condiciones ambientales: temperatura 28 ± 2 °C, humedad relativa 62 ± 5%, y fotoperiodo 12:12 h (luz/oscuridad) para el mantenimiento de las colonias de ambas especies, tanto larvas como adultos. Los adultos se mantuvieron dentro de jaulas Gerber (polipropileno y angeo fino 30x30x30 cm, provistas de una manga de muselina para introducir los mosquitos) y se les proporcionó glucosa al 30% en motas de algodón. Para la alimentación de las hembras con sangre se les colocó dentro de la misma jaula un ratón (Mus musculus, colonia ICR, Bioterio de Producción del Instituto Nacional de Salud) anestesiado con pentotal sódico (10 mg/kg de peso del animal) cada tercer día y por una hora. Para la oviposición se les proporcionó un recipiente de plástico (1000 ml) con 500 ml de agua destilada. Las posturas fueron transferidas a bandejas plásticas (ancho 22 x 22 cm y alto 10 cm) para la cría de larvas las cuales se alimentaron con rodentina pulverizada.
Bioensayos
Los bioensayos fueron realizados en el Laboratorio de Entomología del Instituto Nacional de Salud de Bogotá con base en la cantidad del ingrediente activo (B. sphaericus) contenido en el producto granulado; se preparó un litro de solución stock (500 ppm) y a partir de esta solución se prepararon las diluciones para los bioensayos. En larvas del cuarto estadio de An. albimanus se ensayaron once concentraciones (20, 40, 60, 80, 100, 120, 140, 160, 180, 200 y 500 ppm), y en larvas del cuarto estadio de Cx. quinquefasciatus se ensayaron ocho concentraciones (2, 4, 6, 8, 10, 12, 14 y 16 ppm). Para ensayar cada concentración se utilizaron cuatro recipientes plásticos (6 cm alto x 8 cm diámetro); en tres recipientes se vertieron 100 ml de la concentración correspondiente y se colocaron 20 en cada uno, y en el recipiente control se vertieron 100 ml de agua destilada y 20 larvas. Luego, los recipientes con los ensayos se llevaron a la cámara Sherer con las mismas condiciones ambientales anotadas anteriormente. Las larvas tratadas se revisaron a las 24 y 48 horas, se registró el número de larvas muertas y se determinó el porcentaje de mortalidad causada por el biolarvicida.
Análisis estadístico
El test Probit se realizó según McCullagh y Nelder (51), y la evaluación de la significancia estadística de los parámetros del modelo Probit se hizo siguiendo a Cox y Hinkley (52). Las concentraciones letal 50 y letal 95, y sus respectivos intervalos de confianza al nivel del 95% se determinaron según Hosmer y Lemeshow (53).
Resultados
En la tabla 1 se observa que el porcentaje de mortalidad en larvas de cuarto instar de las dos colonias An. albimanus fue bajo a las 24 y a las 48 horas, en concentraciones desde 20 hasta 200 ppm la mortalidad estuvo por debajo del 50%, mientras que a 500 ppm la mortalidad estuvo entre el 86,7 y el 100%.
En la tabla 2 se observa que el porcentaje de mortalidad en larvas de cuarto instar de las dos colonias Cx. quinquefasciatus por efecto del producto granulado de B. sphaericus estuvo entre el 18,3 y 80% de mortalidad a las 24 horas; mientras que a las 48 horas, en concentraciones desde 2 ppm hasta 10 ppm la mortalidad estuvo entre el 73,3 y el 100%.
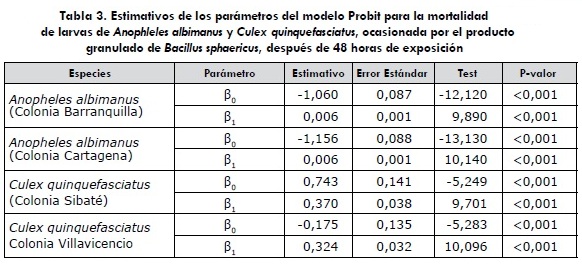
La tabla 3 muestra valores altos en el error estándar para el parámetro (S0, lo cual demuestra alta variabilidad en los datos. Sin embargo, el test de significancia para el parámetro (S1 permite determinar que el producto granulado de B. sphaericus tuvo efecto estadísticamente significativo sobre la mortalidad de las larvas de An. albimanus en las colonias Barranquilla y Cartagena, y sobre las larvas de Cx. quinquefasciatus en las colonias Sibaté y Villavicencio, dado que los valores de P fueron menores a 0,05.
En la tabla 4 se aprecia que las CL50 y CL95 presentaron valores más bajos para larvas de An. albimanus colonia Barranquilla comparados con la colonia Cartagena; mientras que para larvas de C. quinquefasciatus las CL50 y CL95 presentaron valores más altos en larvas de la colonia Villavicencio comparados con la colonia Sibaté.
Discusión
En un primer ensayo se probaron concentraciones entre 5 y 200 ppm del producto granulado B. sphaericus, y a las 24 horas se observó que todas las larvas de Cx. quinquefasciatus habían muerto y todas las larvas de An. albimanus permanecían vivas. Por esta razón, fue necesario ajustar las concentraciones diez veces menores para Cx. quinquefasciatus y subir las concentraciones para An. albimanus. Al respecto, Singh y Prakash (54) utilizaron concentraciones diferentes para evaluar B. sphaericus en larvas de An. stephensi y Cx. quinquefasciatus. Tal como se observa en las tablas 1, 2 y 4; las larvas de Cx. quinquefasciatus fueron más sensibles a concentraciones bajas entre 8 y 12 ppm del producto granulado de B. sphaericus comparadas con las larvas de An. albimanus las cuales mostraron alta toxicidad a concentraciones altas (500 ppm). Estos resultados son acordes con lo reportado por varios autores (18, 20, 26-28, 44, 55, 56), quienes observaron similar acción larvicida de B. sphaericus 2362 y otras cepas, sobre larvas de Cx. quinquefasciatus comparadas con larvas de otras especies de mosquitos.
En el presente trabajo se encontraron valores de CL95 entre 6,4 y 7,3 ppm del producto granulado de B. sphaericus para larvas de Cx. quinquefasciatus; mientras que en larvas de An. albimanus se encontró una CL95 entre 450,5 y 466,7 ppm. Similar tendencia encontraron Vilarinhos et ál. (27) para larvas de Cx. quinquefasciatus con CL90 = 2,15 ppb de B. sphaericus 2362; mientras que en larvas de An. albimanus encontraron una CL90 = 38 ppb; estas observaciones confirman la tendencia diferente de toxicidad de los productos de B. sphaericus en las dos especies de mosquitos.
Los resultados de este estudio muestran que las CL50 y CL95 presentan valores ligeramente más altos para larvas de An. albimanus colonia Cartagena comparados con la colonia Barranquilla; lo mismo se observó en larvas de Cx. quinquefasciatus colonia Villavicencio comparados con la colonia Sibaté. Lo anterior sugiere que la susceptibilidad de las larvas al producto granulado de B. sphaericus varía según la procedencia regional del mosquito.
Agradecimientos
A la Universidad de La Salle, a la Universidad Santo Tomás y al Instituto Nacional de Salud por la financiación de la investigación.
A la doctora Luz Marina Rondón Poveda, por su asesoría en la parte estadística.
Al auxiliar de laboratorio John Muñoz, del Instituto Nacional de Salud, por su colaboración en el mantenimiento de las colonias de mosquitos.
Referencias
1. Mouchet J, Carnevale P, Manguin S. Biodiversity of Malaria in the World. París: John Libbey Eurotext; 2008. [ Links ]
2. Ludlam KW, Jachowski LA, Otto GF. Potential vector of Dirofilaria immitis. J Am Vet Med Assoc 1970; 157:1354-1359. [ Links ]
3. Brito AC, Fontes G, Rocha EMM, Rocha DAM, Regis L. Development of Dirofilaria immitis (Leidy) in Aedes aegypti (L.) and Culex quinquefasciatus (Say) from Maceió, Alagoas, Brazil. Mem Inst Oswaldo Cruz 1999; 94(4):575-576. [ Links ]
4. Savage H, Miller B. House mosquitoes of the USA. Culex pipiens complex. EUA: Win Beats; 1995. [ Links ]
5. Olano V, Brochero H, Sáenz R, Quiñones M, Molina J. Mapas preliminares de la distribución de Anopheles vectores de malaria en Colombia. Biomédica 2001; 1:402-403. [ Links ]
6. Salazar MJ, Moncada LI. Ciclo de vida de Culex quinquefasciatus Say, 1826 (Diptera: Culicidae) bajo condiciones no controladas en Bogotá. Biomédica 2004; 24:385-392. [ Links ]
7. King WV. On the distribution of Anopheles albimanus and this occurrence in the United States. Southern Medical Journal 1937; 30(9):943-946. [ Links ]
8. Breeland S. Studies on the ecology of Anopheles albimanus. Am J Trop Med Hyg 1972; 21:751-754. [ Links ]
9. Faran ME. Mosquito studies (Diptera, Culicidae). XXXIV. A revision of the Albimanus Section of the subgenus Nyssorhynchus of Anopheles. Am Entomol Inst Contrib 1980; 15(7):1-215. [ Links ]
10. Frederickson EC. Bionomics and control of Anopheles albimanus. Tech Paper 34. Pan Am Hlth Organ. Washington, D.C.; 1993. [ Links ]
11. González R, Martínez LM. Nuevo registro de distribución altitudinal de Anopheles albimanus Wiedemann (Diptera: Culicidae) en Colombia. Boletín del Museo de Entomología de la Universidad del Valle 2006; 7(2):19-23. [ Links ]
12. Zambrano P. Informe final de malaria, semanas 1 a 52 Colombia, 2005. Informe Quincenal Epidemiológico Nacional 2006; 11(4):49-53. [ Links ]
13. Brogdon WG, McAllister JC. Insecticide resistance and vector control. Emerging Infectious Diseases 1998; 4(4):605-613. [ Links ]
14. De Barjac H, Sutherland DJ. Bacterial control of mosquitoes and black flies. New Brunswick: Rutgers University Press; 1990. [ Links ]
15. Yousten AA, Benfield EF, Campbell RP, Foss SS, Genthner FJ. (1991). Fate of 'Bacillus sphaericus' 2362 Spores Following Ingestion by Nontarget Invertebrates. Environmental Protection Agency. Report Number EPA/600/J-91/340. http://cfpub.epa.gov [ Links ]
16. Kellen WR, Clark TB, Lindegren JE, Ho BC, Rogoff, MH, Singer, S. Bacillus sphaericus Neide as a pathogen of mosquitoes. Journal of Invertebrate Pathology 1965; 7:442-448. [ Links ]
17. Weiser J. A mosquito-virulent Bacillus sphaericus in adult Simulium damnosum from northern Nigeria. Zentralbl. Mikrobiol 1984; 139:57-60. [ Links ]
18. Mulla MS, Darwazeh HA, Aly C. Laboratory and field studies on new formulations of two microbial control agents against mosquitoes. Bulletin of Society Vector Ecology 1986; 11:255-263. [ Links ]
19. Mulla MS, Darwazeh HA, Tietze NS. Efficacy of Bacillus sphaericus formulations against floodwater mosquitoes. Journal of American Mosquitoes Control Association 1988; 4:172-174. [ Links ]
20. Lacey LA, Singer S. Larvicidal activity of new isolates of Bacillus sphaericus and Bacillus thuringiensis (H-14) against Anopheline and Culicine mosquitoes. Mosquito News 1982; 42:537-543. [ Links ]
21. Lacey LA, Undeen AH. Microbial control of black flies and mosquitoes. Annual Review Entomology 1986; 31:265-296. [ Links ]
22. Lacey LA, Ross DH, Lacey CM, Inman A, Dulmage HT. Experimental formulations of Bacillus sphaericus for the control of anopheline and culicine larvae. Journal of Indian Microbiology 1988; 3:39-47. [ Links ]
23. Nicolas L, Dossou-Yovo J. Differential effects of Bacillus sphaericus strain 2362 on Culex quinquefasciatus and its competitor Culex cinereus in West Africa. Medical and Veterinary Entomology 1987; 1:23-27. [ Links ]
24. Arredondo A, López T, Rodríguez M, Bown D. Small scale field trials of Bacillus sphaericus (strain 2362) against anopheline and culicine mosquito larvae in southern Mexico. Journal of American Mosquito Control Association 1990; 6:300-305. [ Links ]
25. Karch S, Monteny N, Jullien JL, Sinegre G, Coz J. Control of Culex pipiens by Bacillus sphaericus and role of nontarget arthropods in its recycling. Journal of American Mosquito Control Association 1990; 6:47-54. [ Links ]
26. Davidson EW, Urbina M, Payne J, Mulla MS, Darwaseh H, Dulmage HT, Correa JA. Fate of Bacillus sphaericus 1593 and 2362 spores used as larvicides in the aquatic environment. Appl Environ Microbiol 1984; 47:125-129. [ Links ]
27. Vilarinhos PTR, Maruniak JE, Hall DW. Characterization and Biological Activity of a Brazilian Isolate of Bacillus sphaericus (Neide) Highly Toxic to Mosquito Larvae. Memorias do Instituto Oswaldo Cruz 1996; 91(6):771-776. [ Links ]
28. Melo AL, Soccol CR, Thomas-Soccol V, Nogueira M Jr. Evaluation of Bacillus sphaericus bioinsecticide produced with whith soybean meal as culture medium for the control of Culex (Culex) quinquefasciatus. Cadernos de Saude Publica 2009; 25(3):563-569. [ Links ]
29. Yousten A, Davidson E. Ultra structural Analysis of spores and Parasporal Crystal formed by Bacillus sphaericus 2297. Applied and Environmental Microbiology 1982; 44:1449-1455. [ Links ]
30. Mian LS, Mulla MS. Factors influencing activity of de microbial agent Bacillus sphaericus against mosquito larvae. Bulletin of Society Vector Ecology 1983; 8:128-134. [ Links ]
31. Des Rochers B, Garcfa R. Evidence for persistence and recycling of Bacillus sphaericus. Mosquito News 1984; 44(2):160-165. [ Links ]
32. WHO. (1985). Informal Consultation o the development of Bacillus sphaericus as a microbial larvicide. TDR/BCV/Sphaericus/.; 85.3 WHO/VBC/1-24. [ Links ]
33. Lacey LA, Heitzman CM, Meisch M, Billodeaux J. Beecomist applied Bacillus sphaericus for the control of Riceland mosquitoes. Journal of American Mosquito Control Association 1986; 2:548-551. [ Links ]
34. Majori G, Ali A, Sabatinelli G. Laboratory and Field Efficacy o Bacillus thuringiensis var. israelensis and Bacillus sphaericus against Anopheles gambiae S.L. and Culex quinquefasciatus in Ouagadougou. Burkina Faso. Journal of American Mosquitoes Control Association 1987; 3(l):20-24. [ Links ]
35. Jones J, Weathersbee A, Efird P, Meisch M. Evaluation of Bacillus sphaericus 2362 against Culex quinquefasciatus in septic ditches. Journal of American Mosquito Control Association 1990; 6(3):496-499. [ Links ]
36. Baumann P, Clark M, Baumann L, Broadwell A. Bacillus sphaericus as a Mosquito Pathogen: Properties of the Organism and its Toxin. Microbiology Reviews 1991; 55:425-436. [ Links ]
37. Montero G, Díaz M, Marrero A, Castillo A. Resultados de las Aplicaciones en Pilotaje del biolarvicida Bacillus sphaericus 2362 en criaderos de mosquitos del Municipio Santa Cruz del Norte (Provincia La Habana). Revista Cubana de Medicina Tropical 1991; 43(1):39-44. [ Links ]
38. Mulla MS, Singh N, Darwazeh HA. Delayed Mortality and Morphogenetic Anomalies Induced in Culex quinquefasciatus by the Microbial control Agent Bacillus sphaericus. Journal of American Mosquito Control Association 1991; 7(3):412-419. [ Links ]
39. Berry C, Hindley J, Ehrhardt A, Grounds T, Souza L, Davidson E. Genetic determinants of the host range of the Bacillus sphaericus mosquito larvicidal toxins. Journal of Bacteriology 1993; 175:510-518. [ Links ]
40. Castro J, García L, Neyra D. Evaluación del tratamiento con Bacillus sphaericus 2362 en criaderos naturales en zonas de alto riesgo de malaria. Revista Peruana de Epidemiología 1996; 9(2):18-23. [ Links ]
41. Consoli R, De Santos B, Lamounier M, Secundino N, Rabinovitch L, Silva C et ál. Efficacy of a New Formulation of Bacillus sphaericus 2362 against Culex quinquefasciatus (Diptera: Culicidae) in Montes Claros, Minas Gerais, Brazil. Memorias do Instituto Oswaldo Cruz 1997; 92(4):571-573. [ Links ]
42. Blanco SD, Martínez A, Cano OR, Tello R, Mendoza I. Introducción del Bacillus sphaericus cepa-2362 (Griselesf) para el control biológico de vectores maláricos en Guatemala. Revista Cubana de Medicina Tropical 2000; 52(1):37-43. [ Links ]
43. Berti J, Ramírez X, Gonzáles JE, Herrera M. Evaluación de la efectividad de Bacillus sphaericus contra Anopheles aquasalis Curry (Diptera: Culicidae) en curaderos naturales del Estado Sucre, Venezuela. Entomotropica 2002; 17 (1):1-5. [ Links ]
44. Zahiri NS, Federici BA, Mulla MS. Laboratory and simulated field evaluation of a new recombinant of Bacillus thuringiensis ssp. israelensis and Bacillus sphaericus against Culex mosquito larvae (Diptera: Culicidae). Journal of Medical Entomology 2004; 41(3):423-429. [ Links ]
45. De Mendeiros FPM, De Melo Santos MAV, Regis L, Ríos EMM, Neto PJR. Development of Bacillus sphaericus tablet formulation and its evaluation as a larvicide in the biological control of Culex quinquefasciatus. Memorias do Instituto Oswaldo Cruz 2005; 100(4):431-434. [ Links ]
46. Villarreal, L. Bacillus sphaericus: para el control de vectores de enfermedades tropicales. Revista Latinoamericana de Salud Sanitaria y Ambiental 1995; 1:12-14. [ Links ]
47. Pérez M, Ocampo C, Giraldo-Calderón GI, Morales C. Evaluación del triflumuron y la mezcla de Bacillus thuringiensis mas Bacillus sphaericus para el control de las formas imnaduras de Aegypti y Culex quinquefasciatus en sumideros en Cali, Colombia. Biomédica 2008; 28(2):224-233. [ Links ]
48. Thiery I, Hamon S, Delecluse A, Orduz S. The introduction into Bacillus sphaericus of the Bacillus thuringiensis subsp. Medellin Cyt1Ab1 gene results in higher susceptibility of resistant mosquito larva populations to B. sphaericus. Applied Environmental Microbiology 1998; 64(10): 3910-3916. [ Links ]
49. Cova-García P, Sutil E, Rasseau J. Mosquitos (Culicinos) de Venezuela. Caracas: Publicaciones del Ministerio de Sanidad y Asistencia Social; 1966. [ Links ]
50. Cova-García P, Sutil E. Claves gráficas para la clasificación de anofelinos de Venezuela. Maracay: Publicaciones de la División de Endemias Rurales. Dirección de Malariología y Saneamiento Ambiental, MSAS. Venezuela; 1977. [ Links ]
51. McCullagh P, Nelder JA. Generalized Linear Models. En: Volume 37 of Monographs on Statistics and Applied Probability. London: Chapman and Hall; 1989. [ Links ]
52. Cox DR, Hinkley DV. Theorical Statistics. London: Chapman and Hall; 1974. [ Links ]
53. Hosmer DW, Lemeshow S. Applied Logistic Regression. New York: John Wiley; 1989. [ Links ]
54. Singh G, Prakash S. Efficacy of Bacillus sphaericus against larvae of malaria and filarial vectors: an analysis of early resistance detection. Prasitology Research 2009; 104(4):763-766. [ Links ]
55. Ali A, Nayar JK. Efficacy of Bacillus sphaericus Neide against larval mosquitoes (Diptera: Culicidae) and midges (Diptera: Chironomidae) in the laboratory. Florida Entomologist 1986; 69:685-690. [ Links ]
56. Wraight SP, Molloy DP, Singer S. Studies on the Culicine mosquito host range of Bacillus spahericus and Bacillus thuringiensis var. israelensis with notes on the effects of temperature and instar on bacterial efficacy. Journal of Invertebrate Pathology 1987; 49:291-302. [ Links ]