Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.24 Bogotá July/Dec. 2012
Diferenciación de cepas de Mycoplasma gallisepticum a partir de RFLP*
Luis José Carrion1 / Rita Baldrich Ferrer2 / Gloria Consuelo Ramírez Nieto3 / Víctor Julio Vera Alfonso4
* Trabajo realizado por el grupo de Microbiología y Epidemiología de la Universidad Nacional de Colombia y desarrollado con apoyo de Colciencias (Código 1101-405-20223 Contrato 424-2007).
1 MV. Posgrado en Salud y Producción Animal, Universidad Nacional de Colombia. luiscarrion@yahoo.es
2 B, MSc,Instituto de Genética, Universidad Nacional de Colombia. rmbaldrichf@unal.edu.co
3 MV, MSc, PhD. Posgrado en Salud y Producción Animal, Universidad Nacional de Colombia. gcramirezn@unal.edu.co
4 DMV, MSc, PhD. Posgrado en Salud y Producción Animal, Universidad Nacional de Colombia. vjveraa@unal.edu.co
Recibido: 4 de abril de 2012. Aceptado: 30 de agosto de 2012
Resumen
La micoplasmosis aviar es una enfermedad que afecta considerablemente al sector avícola, lo que se ve reflejado en la disminución de parámetros productivos en aves de engorde ponedoras de huevo fértil y ponedoras de huevo comercial. Los costos de su presentación son tan altos que es imposible la supervivencia de la avicultura industrial sin pensar en el control efectivo o en su erradicación. Existe un gran interés en la tipificación de cepas de M. gallisepticum (Mg) tanto vacunales como de campo, aspecto clave para el manejo de la enfermedad, pero aún no existe un método definitivo de caracterización de cepas de Mg. En la actualidad se están estudiando genes relacionados con proteínas de superficie —gapA y mgc2, lipoproteína (lp) — que permitan identificar y caracterizar genómicamente al Mg. En el presente estudio se amplificaron regiones del gen lp a partir de las cepas F y Ts-11 del Mg por la técnica de reacción en cadena de la polimerasa (PCR) que dio un amplicón de 455 pb para cada una de las cepas; a cada uno de los amplicones se les hizo la prueba de polimorfismo de longitud de los fragmentos de restricción (RFLP) con la enzima Taq I, lo que permitió diferenciar cepas vacunales de cepas de campo obtenidas a partir de muestras de hisopos traqueales tomados en granjas de explotación comercial. Se demostró que el PCR-RFLP es un método adecuado de diagnóstico de la micoplasmosis en nuestro medio.
Palabras clave: Mycoplasma, M. gallisepticum, PCR, RFLP.
Differentiation of Mycoplasma gallisepticum Strains through RFLP
Abstract
Avian mycoplasmosis is a disease that considerably affects the poultry sector, which is reflected in the decrease of the production parameters in fertile and commercial egg laying broilers. Presentation costs are so high that it is impossible for the poultry industry to survive without thinking of its effective control or eradication. There is great interest in the type of M. gallisepticum (Mg) strains, both vaccine and field, which are key aspects to handle the disease, but there is still no definitive method for Mg strain characterization. Genes related to surface proteins —gapA and mgc2,lipoprotein (lp)— that make it possible to identify and characterize the Mg genomically are currently being studied. In this study, regions of the lp gene were amplified from strains F and Ts-11 of Mg through the polymerase chain reaction (PCR) technique, which gave an amplicon of 455 bp for each of the strains; each of the amplicons was applied the restriction fragment length polymorphism (RFLP) test with the Taq I enzyme, which made it possible to differentiate vaccine strains from field strains obtained from tracheal swab samples taken at commercial farms. It was demonstrated that PCR-RFLP is an appropriate method of diagnosis of mycoplasmosis in our environment.
Keywords: Mycoplasma, M. gallisepticum, PCR, RFLP.
Diferenciação de cepas de Mycoplasma gallisepticum através de RFLP
Resumo
A micoplasmose aviar é uma doença que afeta consideravelmente o setor avícola, isso se reflete na diminuição de parâmetros produtivos em aves de engorde poedeiras de ovo fértil e poedeiras de ovo comercial. Os custos de sua apresentação são tão altos que é impossível a sobrevivência da avicultura industrial sem pensar no controle efetivo ou em sua erradicação. Existe um grande interesse na tipificação de cepas de M. gallisepticum (Mg) tanto vacinais como de campo, aspecto chave para o manejo da doença, mas ainda não existe um método definitivo de caracterização de cepas de Mg. Na atualidade estão sendo estudados genes relacionados com proteínas de superfície —gapA e mgc2, lipoproteína (lp)— que permitam identificar e caracterizar genômicamente ao Mg. No presente estudo se amplificaram regiões do gen lp a partir das cepas F e Ts-11 do Mg pela técnica de reação em cadeia da polimerase (PCR) que deu um amplicon de 455 pb para cada uma das cepas; a cada um dos amplicons foi feito o teste de polimorfismo de longitude dos fragmentos de restrição (RFLP) com a enzima Taq I, o que permitiu diferenciar cepas vacunais de cepas de campo obtidas a partir de mostras de mostras traqueais tomadas em granjas de exploração comercial. Demonstrou-se que o PCR-RFLP é um método adequado de diagnóstico da micoplasmose em nosso meio.
Palavras chave: Mycoplasma, M. gallisepticum, PCR, RFLP.
INTRODUCCIÓN
La micoplasmosis aviar es una condición limitante y de carácter restrictivo para el mercado internacional. La presentación clínica de la enfermedad está determinada especialmente por complicaciones respiratorias, siendo una condición que afecta el desarrollo de la avicultura comercial (1), lo que hace necesaria la toma de medidas tendentes a controlarla, por lo que su diagnóstico juega un papel importante para la ejecución de las estrategias de prevención o erradicación (2).
En la actualidad se aplican vacunas vivas directamente en el tracto respiratorio buscando obtener una respuesta inmune local que evite la posterior replicación de agentes infecciosos en los receptores locales, lo cual garantiza una mejor protección que la producida por vacunas inactivadas. Lo anterior ha tenido una aplicación directa en el control de la micoplasmosis y hace necesario contar con métodos diagnósticos que permitan diferenciar las cepas vacunales de las cepas virulentas de campo.
Dentro de los métodos diagnósticos, las pruebas más empleadas son las serológicas y el aislamiento del microorganismo. En las pruebas de tipo serológico se destacan la aglutinación rápida en placa (ARP), la inhibición de la hemoaglutinación (HI) y el inmunoensayo ligado a enzimas (Elisa) (3-5).
Las pruebas serológicas son empleadas generalmente para la evaluación de granjas o de ciertas poblaciones de aves, sin embargo, no poseen la especificidad y sensibilidad requeridas (6,7), mientras que el aislamiento de la bacteria es laborioso, costoso y requiere de un tiempo relativamente largo para la confirmación del diagnóstico (5,8).
Actualmente han adquirido importancia las pruebas de tipo molecular como la reacción en cadena de la polimerasa (PCR) y la prueba de polimorfismo de longitud de los fragmentos de restricción (RFLP), entre otras, las cuales ofrecen una rápida detección y diferenciación del agente entre especies o cepas (vacunales-de campo), lo que permite la toma de medidas adecuadas de una forma rápida y efectiva, evitando al máximo la diseminación de la enfermedad por transmisión horizontal o vertical (2,4,5,8-11).
Empleando la técnica de PCR se han amplificado diferentes segmentos del genoma de la bacteria, de tal manera que se pueden detectar genes que codifican proteínas de superficie (pvpA, mgc2, gapA, lp), el segmento 16S de ARN ribosomal y proteínas hemaglutinantes (pMGA1.2) entre otras. Comparando los genes que codifican proteínas de superficie se estableció que el PCR para los cuatro genes mencionados tiene una sensibilidad y especificidad muy similares (5). Existen varios trabajos que utilizan el gen de la lipoproteína (lp) y el gen de mgc2 para la realización de PCR convencional y en tiempo real para el diagnóstico de Mg con resultados equivalentes (5,12).
El diagnóstico por PCR se puede ampliar si a partir del producto de amplificación se le realiza la prueba de RFLP, que consiste en someter al amplicón obtenido por PCR a un tratamiento con enzimas de restricción que lo cortan en sitios específicos generando productos de ADN de diferentes tamaños, los cuales son visualizados por electroforesis en gel de agarosa. Esta prueba se ha empleado generalmente para hacer diferenciación de cepas tanto vacunales como de campo de M gallisepticum amplificando regiones del gen de la lp y haciendo restricción con las enzimas BSH1236I Y PSP1406I (12).
Teniendo en cuenta los desarrollos reportados en la literatura, el presente trabajo se realizó con el fin de normalizar una prueba de RFLP utilizando el gen lp y la enzima Taq I, y detectar e identificar la presencia de cepas de Mg vacunales o de campo en poblaciones aviares comerciales.
MATERIALES Y MÉTODOS
Población avícola evaluada
Se hizo un muestreo en granjas de reproductoras y ponedoras comerciales del centro del país donde se llevaban a cabo planes de vacunación contra M. gallisepticum empleando la cepa F (Intervet-Schering Plough®), así como en pollos de engorde que llegaron al servicio de diagnóstico aviar de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional, con historia y signos clínicos compatibles con micoplasmosis. Las muestras fueron tomadas a partir de un hisopo traqueal por cinco animales, para un total de seis hisopos por granja. Las muestras para pollo de engorde se obtuvieron por hisopo traqueal de una hasta cinco aves siempre y cuando provinieran de una misma granja.
Obtención de controles positivos para el PCR
Se normalizaron las pruebas de PCR tanto para Mg cepa F como para Mg cepa Ts-11, a partir del ADN de Mg de vacunas comerciales. El ADN de Mg cepa F de Schering PloughR y el ADN de Mg cepa Ts-11 de MerialR.
A cada una de las vacunas se le hizo la extracción del ADN utilizando la técnica reportada por Moscoso (4), para lo cual se empleó 1 ml de la vacuna restituida y se centrifugó a 14.000 g por 10 min a 4 °C, luego se descartó el sobrenadante y el centrifugado se resuspendió en 1 ml de PBS y se volvió a centrifugar a 14000 g por 10 min a 4 °C, finalmente el pellet se resuspendió en agua tratada con DEPC (dietilpirocarbonato) al 0,1 %, se llevó a 120 °C por 10 min seguido de 10 min a -20 °C, luego se centrifugó a 14000 g por 10 min a 4 °C, el sobrenadante se transfirió a un tubo libre de nucleasas y se conservó a 4 °C hasta su uso.
Preparación de la muestra para PCR
La mezcla de PCR se preparó de la siguiente manera: 2 µl de buffer 10X (Invitrogen®) para PCR; 1,6 µl de MgCl2 2 mM (Invitrogen®); 0,4 µl de dNTPs (Invitrogen®) 10 mM, 0,4 µl de cada primer 50 uM (Mg-F 5'- CCA ATT CAT TAC TAG AGG GTT GGA- -3' y Mg-R 5'-TCT GAT TTC GAA GAA TCA ACT GTC-3') (Invitrogen®) que codifican para el gen de la lipoproteína (lp); 0,1 µl de Taq polimerasa 5u/µl, 2 µl del control positivo y agua tratada con DEPC para 20 µl de reacción final.
Protocolo para desarrollo del PCR
Para la normalización de la PCR se realizó un gradiente de temperatura de anillamiento de 50 °C, 52 °C, 54 °C, 55 °C, 58 °C, 60 °C, 62 °C y 65 °C, a fin de determinar la temperatura adecuada, seleccionándose 55 °C. En un termociclador (Eppendorf Mastercycler Gradient®) se desarrolló el siguiente protocolo: la desnaturalización inicial se efectuó a 94 °C por 3 min, seguida por 35 ciclos a 94 °C por 30 s, 55 °C por 30 s y 72 °C por 1 min; una extensión final a 72 °C por 5 min. Se hizo electroforesis en agarosa al 1,5 % al producto de PCR y se visualizó con bromuro de etidio bajo luz UV (4).
RFLP a partir de la cepa F, utilizando la enzima Taq I
Para la realización de la prueba de RFLP se seleccionó la enzima de restricción de acuerdo con el programa NEBcutter V 0.2, empleando el producto amplificado por PCR (455 pb) de Mg cepa F, de acuerdo con el siguiente protocolo: la mezcla total para esta prueba fue de 15 µL, compuesta por 8 µL de H2O DDE; 1,5 µL de buffer 10X; 0,5 µL de enzima de restricción (10 U) y 5 µL de producto de la PCR. Luego se llevó a 65 °C por una hora, posteriormente se realizó la electroforesis en gel de agarosa al 1,5 %, se tiñó con bromuro de etidio 0,5 mg/ml y se observaron los fragmentos de restricción bajo luz UV (4).
RFLP a partir de la cepa Ts-11, utilizando la enzima Taq I
Se hizo la prueba de RFLP para Mg cepa Ts-11 de manera similar que para Mg cepa F descrita anteriormente, aunque los cortes sobre el fragmento del gen lp con la Taq I fueron diferentes. El protocolo fue: mezcla total de 15 µL compuesta por 8 µL de H2O DDE; 1,5 de buffer 10X; 0,5 µL de enzimas de restricción (10 U de enzimas de restricción), y 5 µL de producto de la PCR. Luego se llevó a 65 °C por una hora, posteriormente se realizó la electroforesis en gel de agarosa al 1,5 %, se tiñó con bromuro de etidio 0,5 mg/ ml y se observaron los fragmentos de restricción.
RESULTADOS
Normalización de PCR para Mycoplasma gallisepticum cepa F utilizando el gen lp
Se hizo un gradiente de temperatura de anilla-miento de 50 °C, 52 °C, 54 °C, 55 °C, 58 °C, 60 °C, 62 °C y 65 °C; se seleccionó la temperatura de 55 °C, por ser la banda de 455 pb amplificada que fue más nítida (figura 1).
Se obtuvo un amplicón de 455 pb por PCR a partir de muestras tomadas en granjas (ponedoras y reproductoras) con antecedentes de vacunación con Mg cepa F, así como también en granjas en que no se vacunó contra Mg.
RFLP de M. gallisepticum cepa F, con Taq I
A partir del producto de PCR del control positivo (vacuna contra Mg cepa F) y una muestra de campo, se realizó la prueba de RFLP. La enzima Taq I, hizo cortes sobre el fragmento de 455 Pb de la cepa F, con la obtención de dos fragmentos: uno de 341 pb y otro de 114 pb (figura 2), lo que permite su diferenciación de las cepas Ts-11. En la figura 3 se observan los resultados de amplificados por PCR tomados de aves de granja y pollo de engorde y sometidos a RFLP.
RFLP con Taq I de M. gallisepticum cepa Ts-11
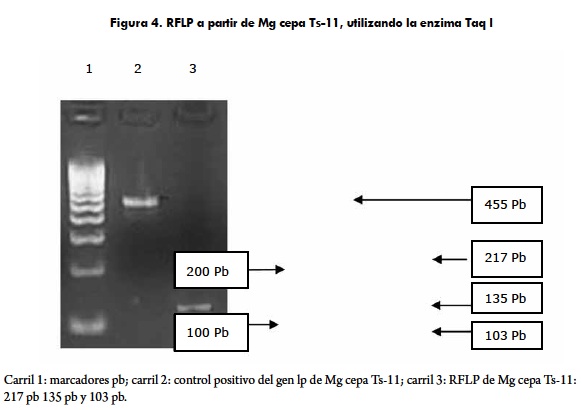
Para Mg cepa Ts-11 se desarrolló el mismo protocolo mencionado anteriormente para Mg cepa FA, obteniéndose un producto de 455 pb. A partir del producto de PCR para el control positivo (vacuna contra Mg cepa Ts-11) como para una muestra de campo, se realizó la prueba de RFLP. La enzima Taq I, hizo 2 cortes sobre el fragmento de 455 Pb, dando tres fragmentos de: 135 pb, 217 pb y 103 pb (figura 4).
Población avícola muestreada
Se estableció que en las granjas vacunadas con Mg cepa F (ponedoras y reproductoras) se amplificó por PCR el fragmento de 455 pb correspondiente al gen lp de Mg cepa F, comprobándose por RFLP (figura 3).
En las muestras procedentes de pollos con diagnóstico presuntivo de micoplasmosis, sin antecedentes de vacunación, igualmente se obtuvieron por PCR-RFLP resultados positivos a la presencia de Mg cepa F.
Dentro de las muestras evaluadas en este estudio no se encontraron resultados positivos para Mg cepa Ts-11.
DISCUSIÓN
En el presente trabajo se detectó Mg cepa F, tanto de tipo vacunal como de campo, de una forma rápida y segura, lo cual no se logra con esta eficiencia cuando se emplean métodos tradicionales como el serológico o el aislamiento por cultivo de la bacteria (4).
El PCR como método de diagnóstico único se viene empleando en diferentes países (8,14), pero presenta limitaciones en diferenciación de las cepas actuantes. La combinación de dos métodos moleculares: el PCR y el RFLP, identifica el agente y permite su diferenciación (2,9,15), lo que se corroboró en el presente estudio y permitió definir la presencia de cepas de Mg en explotaciones comerciales de aves.
Emplear RFLP para el diagnóstico de micoplasmosis da rapidez y seguridad en la diferenciación de cepas de Mg y para este momento en que se ha incrementado el uso de vacunas vivas en las explotaciones comerciales, diferenciar cepas de campo de cepas vacunales es un importante punto de referencia para identificar y controlar la micoplasmosis en explotaciones avícolas (13).
El PCR empleado en el presente estudio no permite comprobar, aun en las granjas con antecedentes de vacunación, si los resultados obtenidos corresponden a la misma cepa vacunal o si existen infecciones mixtas con cepas de campo, aspecto que sí se podría definir empleando pruebas como el PCR tiempo real.
Los resultados de este estudio permiten deducir que hay multiplicación de la cepa vacunal en las poblaciones de ponedoras y reproductoras inmunizadas, y que existe la circulación de la bacteria en aves no vacunadas con Mg, como se encontró en pollos de engorde.
CONCLUSIONES
La implementación de pruebas moleculares como las manejadas en el presente estudio (PCR/RFLP) mejora de manera ostensible el diagnóstico que actualmente se emplea de forma rutinaria en la industria avícola colombiana y permite un manejo más adecuado de la enfermedad. Es lógico pensar que tomará un tiempo hacer que los productores cambien los métodos tradicionales de diagnóstico en micoplasmosis, pero es de esperarse que una vez que se empiece a implementar el PCR/RFLP como prueba de rutina, al futuro se deberán abordar otras pruebas que mejorarán la eficiencia y darán información rápida, como la tipificación genética por análisis de la secuencia de ADN y la prueba de amplificación aleatoria del ADN en los mismos aislamientos de Mycoplasma gallisepticum, así como el PCR en tiempo real, métodos que ya se vienen empleando en otros países.
REFERENCIAS
1. Bradbury JM. Poultry mycoplasmas: sophisticated pathogens in simple guise. British Poultry Science 2005;46(2):125-136. [ Links ]
2. Lysnyansky I, García M, Levisohn S. Use of mgc2-Polymerase Chain Reaction-Restriction Fragment Length Polymorphism for Rapid Differentiation Between Field Isolates and Vaccine Strains of Mycoplasma gallisepticum in Israel. Avian Diseases 2005;49(2):238-245. [ Links ]
3. Salish H, Rill M, Hinz K, Neumman U. Experiences with multispecies polymerase chain reaction and specific oligonucleotide probes for the detection of Mycoplasma gallisepticum and Mycoplasma synoviae. Avian Pathology 1999;28:337-344. [ Links ]
4. Moscoso H, Thayer S, Hofacre C, Kleven S. Inactivation, Storage, and PCR Detection of Mycoplasma on FTA® Filter Paper. Avian Diseases 2004;48(4):841-850. [ Links ]
5. García M, Ikuta N, Levisohn S, Kleven SH. Evaluation and comparison of various pcr methods for detection of mycoplasma gallisepticum infection in chickens. avian diseases 2005;49(1):125-132. [ Links ]
6. Avakian AP, Kleven SH, Glisson JR. Evaluation of the specificity and sensitivity of two commercial enzyme-linked immunosorbent assay kits, the serum plate agglutination test, and the hemagglutination-inhibition test for antibodies formed in response to Mycoplasma gallisepticum. Avian Dis 1988;32:262-272. [ Links ]
7. Glisson JR, Dawe JF, Kleven SH. The effect of oil-emulsion vaccines on the occurrence of non-specific plate agglutination reactions for Mycoplasma gallisepticum and M. synoviae. Avian Dis 1984;28:397-405. [ Links ]
8. Feberwee A, Mekkes DR, De Wit JJ, Hartman EG, Pijpers A. Comparison of culture, PCR, and different serologic tests for detection of Mycoplasma gallisepticum and Mycoplasma synoviae infections. Avian Diseases 2004;49(2):260-268. [ Links ]
9. Kleven SH, Browning GF, Bulach DM, Ghiocas E, Morrow CJ, Whithear KG. Examination of Mycoplasma gallisepticum strains using restriction endonuclease DNA analysis and DNA-DNA hybridisation. Avian Pathol 1988;17:559-570. [ Links ]
10. Hong Y, García M, Levisohn S, Savelkoul P, Leiting V, Lysnyansky I, Ley D, Kleven SH. Differentiation of Mycoplasma gallisepticum Strains Using Amplified Fragment Length Polymorphism and Other DNA-Based Typing Methods. Avian Diseases 2004;49(1):43-49. [ Links ]
11. Liu T, García M, Levisohn S, Yogev D, Kleven S. H. Molecular Variability of the Adhesin-Encoding Gene pvpA among Mycoplasma gallisepticum Strains and Its Application in Diagnosis. Journal of Clinical Microbiology 2001;39(5):1882-1888. [ Links ]
12. Sánchez B, Redondo H, Rodríguez MJ. Diferenciación de cepas vacunales de micoplasma gallisepticum 6/85 (like-6/85), en muestras de campo mediante AP-PCR sobre genes pMGA, RFLP-PCR y secuenciación sobre genes Lp y Mgc2. Sección Española de la Asociación Mundial de Avicultura Científica (AECA). XLII Symposium Científico de Avicultura. Cáceres; 2005. pp. 131-138. [ Links ]
13. Ghorashi SA, Noormohammadi AH, Markham PF. Differentiation of Mycoplasma gallisepticum strains using PCR and high-resolution melting curve analysis. Microbiology 2010;156:1019-1029. [ Links ]
14. Evans JD, Leigh SA. Differentiation of Mycoplasma gallisepticum vaccine strains ts-11 and 6/85 from commonly used Mycoplasma gallisepticum challenge strains by PCR. Avian Dis 2008;52:491-497. [ Links ]
15. Khan MI, Yamamoto R. Differentiation of the vaccine F-strain from other strains of Mycoplasma gallisepticum by restriction endonuclease analysis. Vet Microbiol 1989;19:167-174. [ Links ]