Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.26 Bogotá July/Dec. 2013
Diferencias cinéticas de las plasminas de ocho especies mamíferas:
activaciones y secuencias de los terminales-N
Omaira Cañas Bermúdez1 / Luis Fernando Arbeláez Ramírez2
1 MSc. Miembro del Grupo de Investigación en Química, Departamento de Química, Facultad de Salud, Departamento de Medicina, Universidad de Pamplona, Pamplona, Colombia.
omairacbermudez@hotmail.com
2 PhD. Miembro del Grupo de Investigación en Química, Departamento de Química, Facultad de Salud, Departamento de Medicina, Universidad de Pamplona, Pamplona, Colombia.
lui.ferar@hotmail.com
Recibido: 4 de septiembre del 2013. Aceptado: 19 de septiembre del 2013
Cómo citar este artículo: Cañas Bermúdez O, Arbeláez Ramírez LF. Diferencias cinéticas de las plasminas de ocho especies mamíferas: activaciones y secuencias de los terminales-N. Rev Med Vet. 2013;(26):67-77.
Resumen
El artículo determina los parámetros cinéticos de las plasminas de ocho especies de mamíferos y sus terminales-N. Los ocho plasminógenos fueron purificados por los mismos métodos (cromatografías de afinidad e intercambio iónico), y activados con urocinasa, partiendo de una concentración común y su cinética valorada según las coordenadas de Lineweaver-Burk. Para esto se utilizó la cinética enzimática de Michaelis Menten, ampliamente usada en el estudio de enzimas. Todos los plasminógenos mostraron una pureza superior al 95% y una banda de 92 kDa en la electroforesis, al comparar con el estándar de peso molecular utilizado. Las plasminas del equino y canino mostraron la misma KM por el sustrato cromogénico (0,438 mM), siendo esta la de mayor afinidad en este estudio y la humana la de menor afinidad (5,3 mM). También fueron determinadas la constante catalítica y la velocidad de conversión del sustrato cromogénico a producto. Los terminales-N de los plasminógenos de las ocho especies fueron determinados, y se encontraron diferencias entre el humano y los animales; así mismo entre algunos animales. Solo el porcino y el ovino no mostraron diferencia alguna en su terminal-N (DPPDDY). Se demostró la unificación del método de purificación de los plasminógenos para cualquier especie, las diferencias cinéticas de las ocho plasminas estudiadas, y las similitudes y diferencias en la secuencia de los terminales-N de las ocho especies.
Palabras clave: coagulación, fibrinólisis, plasmina, plasminógeno, urocinasa.
Kinetic Differences of Plasmins from Eight Mammalian Species:
N-Terminal Activations and Sequences
Abstract
The paper determines the kinetic parameters of plasmins from eight species of mammals and their N-terminals. They were purified by the same methods (affinity chromatography and ion exchange) and activated with urokinase, starting from a common concentration and its kinetics judged according to Lineweaver-Burk coordinates. For such purpose, MichaelisMenten enzyme kinetics, which is widely used in the study of enzymes, was implemented. When compared with the molecular weight standard used, all plasminogen showed a purity exceeding 95% and a 92 kDa band on electrophoresis. Equine and canine plasmins showed the same KM due to the chromogenic substrate (0.438 mM), this being the one with the highest affinity in this study, and the human being the one with the lower affinity (5.3 mM). The catalytic constant and the conversion rate of the chromogenic substrate to product were also determined. The N-terminals of the plasminogens of the eight species were determined, and differences were found between humans and animals, as well as between some animals. Only pigs and sheep showed no differences in their N-terminal (DPPDDY). The unification of the method for purification of plasminogens for any species was demonstrated, as well as the kinetic differences of the eight plasmins studied and the similarities and differences in the sequence the N-terminals of the eight species.
Keywords: Coagulation, fibrinolysis, plasmin, plasminogen, urokinase.
Diferenças cinéticas das plasminas de oito espécies mamíferas:
ativações e sequencias dos terminais-N
Resumo
El artigo determina os parâmetros cinéticos das plasminas de oito espécies de mamíferos e seus terminais-N. Estes foram purificados pelos mesmos métodos (cromatografias de afinidade e intercambio iônico) e ativados com uroquinase, partindo de uma concentração comum e sua cinética avaliada segundo as coordenadas de Lineweaver-Burk. Para isto se utilizou a cinética enzimática de Michaelis-Menten, amplamente usada no estudo de enzimas. Todos os plasminogênios mostraram uma pureza superior a 95 % e uma banda de 92 kDa na eletroforese, ao comparar com o padrão de peso molecular utilizado. As plasminas do equino e canino mostraram a mesma KM pelo substrato cromogênico (0,438 mM), sendo esta a de maior afinidade neste estudo e a humana a de menor afinidade (5,3 mM). Também foram determinadas a constante catalítica e a velocidade de conversão do substrato cromogênico a produto. Os terminais-N dos plasminogênios das oito espécies foram determinados, e se encontraram diferenças entre o humano e os animais, da mesma forma entre alguns animais. Somente o suíno e o ovino não mostraram diferença alguma em seu terminal-N (DPPDDY). Demonstrou-se a unificação do método de purificação de os plasminogênios para qualquer espécie, as diferenças cinéticas das oito plasminas estudadas e as similitudes e diferencias na sequencia dos terminais-N das oito espécies.
Palavras chave: coagulação, fibrinólise, plasmina, plasminogênio, uroquinase.
INTRODUCCIÓN
La hemostasia es un mecanismo esencial de protección que depende del delicado balance entre los procesos procoagulantes y anticoagulantes y comprende los estrictamente regulados procesos de coagulación sanguínea, activación plaquetaria y reparación vascular. La hemostasia la promueve como su función principal la cascada de la coagulación, la cual además limita la pérdida de sangre, y responde a daños tisulares (1). La cascada de la coagulación ha sido clásicamente entendida como dos vías convergentes activadas, la una por la vía de contacto del sistema de proteasas, factor XII, precalicreína y cininógeno de alto peso molecular; la otra por la activación del factor VII y X. Cuando el factor tisular es expuesto a los daños vasculares (2-4), los procesos de formación del trombo son regulados simultáneamente por el sistema fibrinolítico, previniendo la formación de coágulos que induzcan una trombosis intravascular masiva. El plasminógeno (plg), el activador tisular del plg (t-PA por sus siglas en inglés) y la α2-antiplasmina (α2-AP por sus siglas en inglés) se incorporan al interior del coágulo mientras se forma (5).
El plg es una serín proteasa sintetizada en el hígado, formada por 791 aminoácidos (a.a.) (6). Se organiza en siete dominios estructurales que comprenden un péptido de pre-activación (a.a. 1-77), cinco dominios kringles con secuencias homólogas y un dominio entre los a.a. 562-791. Los kringles contienen lugares de unión tanto a la lisina (LBS, por sus siglas en inglés) como al amino hexil que desempeñan un papel crucial en el reconocimiento de la fibrina, además a la superficie celular y de la α2-AP.
El gen humano para el plg se localiza en el brazo largo del cromosoma 6, en las bandas q26 o q27 y la longitud del gen es de 52,5 kb. Cada uno de los 5 kringles está formado por 2 exones separados por un único entrón en el medio de cada estructura. El gen está estrechamente relacionado con el de la apo (a). El plg se convierte a plasmina (pli) por la hidrólisis de una unión peptídica entre los a.a. Arg561-Val562, el peso molecular del plg es de 92 kDa y el de la pli de 85 kDa. La concentración plasmática del plg es de 200 mg/l (7). El plg se convierte a pli por la acción de los activadores t-PA o el activador del plg tipo urocinasa (u-PA, por sus siglas en inglés). En el primero esto solo ocurre de forma eficiente en la superficie de la fibrina, donde el activador y el plg están juntos. La función principal de la pli es la degradación de la fibrina insoluble que conforma el trombo a productos solubles de degradación de la fibrina (FDP, por sus siglas en inglés). Sin embargo, también actúa sobre otros substratos constituyentes de la matriz extracelular, como son el colágeno IV y V, proteoglicanos, laminina, fibronectina y vitronectina. También puede activar in vitro las matriz-metalo-proteinasas (MMP) latentes como la I, III, IX, X, XIII (8-10); elastasas, factores de crecimiento del tipo TGF-β (11) o el FGF (12) liberándolo de la matriz a la que está unido en forma latente. FGF es proangiogénico y up-regulador de u-PA, PAI-1 y de la expresión de gelatinasas (13) e inhibe la expresión de TIMP-2 (inhibidor endógeno de MMPs, tipo 2) (14). La pli libre en sangre es inactivada rápidamente por α2-AP; su vida media es de 0,1 segundos. La pli generada en la superficie de la fibrina está parcialmente protegida de esta inactivación, ya que los LBS importantes en la interacción entre la plg/pli y la fibrina están fuera del alcance de la α2-AP. Se han descrito receptores celulares con alta afinidad para unir el plg/pli en varios tipos celulares incluyendo células endoteliales (15). Esta unión está mediada por los LBS de los kringles 1-3 de la molécula del plg/pli, que la protege también de la inhibición por la α2-AP. Si los LBS de la pli están ocupados, la acción de la α2-AP es 50 veces menor.
Se han identificado dos activadores fisiológicos del plg que son el t-PA y u-PA. Estos activadores representan el papel dual del sistema fibrinolítico. El mecanismo que media el t-PA está envuelto inicialmente en la hemostasis de la fibrina y el de la u-PA parece implicar además fenómenos como la migración o la remodelación de tejidos. Como consecuencia de este papel dual tal vez el nombre que expresaría mejor el sistema fibrinolítico, sería el de sistema del plg/pli.
El plg se ha encontrado en otros sistemas fisiológicos como reparación ósea (16), en la penetración del espermatozoide al oocito reduciendo la fertilización de este (17). La importancia del plg/pli en diferentes sistemas fisiológicos del humano ha hecho que este grupo de investigación purifique esta molécula en diferentes especies (18-24). En este estudio se le determina la cinética a la pli de 7 especies animales y se comparan entre ellas y con la pli humana, así como la identificación de estos plg por secuenciamiento del terminal-N.
MATERIALES Y MÉTODOS
Toma y procesamiento de las muestras
Este estudio se realizó bajo las recomendaciones establecidas en la normatividad sobre investigación con sujetos humanos (Declaración Universal de los Derechos Humanos, Helsinki-Tokio y Núremberg) con el consentimiento del Comité de Bioética de la Universidad de Pamplona. Se tuvo en cuenta el criterio de la utilización del consentimiento informado a la hora de la extracción del plasma, establecido en el artículo 30, del Decreto 8430 de 1993.
El plasma humano fue suministrado por el Hospital Erasmo Meoz de la ciudad de Cúcuta, Colombia, analizado y certificado libre de enfermedades infecciosas. Las muestras de los plasmas animales fueron tomadas con la autorización del comité de Bioética de la Universidad de Pamplona (aprobado el 13 de julio de 2004) en la Granja Experimental Villa Marina, propiedad de dicha institución. La toma la hizo un médico veterinario, teniendo en cuenta las recomendaciones contempladas en el título V del Decreto 8430.
Se utilizaron bolsas para extracción sanguínea con solución anticoagulante de citrato trisódico. A la sangre obtenida de esta manera se le añadió fenil-metilsulfonilfluoruro (PMSF) disuelto en dimetil-sulfóxido (DMSO), a una concentración final de 1 mM, con el fin de inhibir la actividad de las serínproteasas. Las muestras se mantuvieron refrigeradas y el plasma separado por centrifugación a 7000 rpm durante 15 min a 4 °C.
Reactivos
PMSF, e-aminoácido capróico (e-ACA) y ácido clorhídrico de (fabroquim), cloruro de sodio (NaCl), DMSO y acetato de sodio anhidro de ( Riedel-de-Haën), N,N'-Metilen-bisacrilamida (Bio-rad), persulfato de amonio (Bio-rad), (β-mercaptoetanol (Bio-rad), sodio dodecil sulfato (SDS) (Fluka), di-hidrógeno fosfato de sodio dihidratado de (Merck), lisina-sefarosa-4B de (Amersham Biosciences), ácido acético concentrado de (Baker), sustrato cromogénico para pli Spectrozyme y urocinasa (u-PA) (110,000 UI/mL) de (Amdiag). El sustrato cromogénico S-2251 se disolvió a una concentración de 5 mM utilizando a partir de esta concentración varias diluciones. El estándar de peso molecular usado contenía: 180 kDa (α2-macroglobulina), 92 kDa (Gluplg), 66 kDa (cadena-α, fibrinógeno humano), 52 kDa (cadena-β, fibrinógeno humano), 46 kDa (cadena-γ, fibrinógeno humano), 23,8 kDa (tripsina) y agua tipo I y III, de los (Laboratorios de Investigación en Química, Universidad de Pamplona).
Purificación de los plasminógenos
Los plg de las ocho especies fueron purificados por cromatografías de afinidad e intercambio iónico (18-24) en una columna de 8 x 2,5 cm (Bio-Rad), equilibrada con tres volúmenes de la solución tampón 0,1 M fosfato 0,15 M de NaCl pH 7,3 (PBS), a una velocidad de flujo de 2 mL/min. Se aplicaron 200 mL de plasma de cada una de las ocho especies. Posteriormente la columna se lavó con PBS, hasta que la absorbancia A280 fue ≤ 0,01. Se eluyó con 100 mL de PBS que contenía 0,05 M de e-ACA y colectado en fracciones de 3 mL en cada tubo. La concentración fue determinada utilizando el coeficiente de absorción (e1%) 1 cm = 1,6 (M-1 cm-1 (25)
Los diferentes plg fisiológicos en los plasmas fueron separados por cromatografía de intercambio iónico de acuerdo con el método de Cañas (24). En el humano se separó el Glu-plg del Lis-plg y en los animales Asp-plg del Arg-plg, en una columna de 5 x 2,5 cm (Bio-Rad), empacada con 4 mL de DEAE sefarosa y equilibrada con solución tampón 0,06 M Tris, 0,06 M NaCl. 0,02 M HCl pH 8,5, (A). Se eluyó con un gradiente lineal usando la solución tampón A y 0,07 M Tris, 0,22 M NaCl, 0,06M HCl pH 7,5. Como solución tampón B y colectada en fracciones de 3 mL a una velocidad de flujo de 1,5 mL/min.
Análisis electroforético
La electroforesis SDS-PAGE al 10% se realizó de acuerdo con el método de Laemmli (26). Las muestras de los 8 plg de 5 mg fueron mezcladas con la solución tampón de muestra en un volumen 1:1 (vol/vol). Fueron tratadas térmicamente por 5 min a 100 °C y visualizadas con tinción de azul brillante de Coomassie.
Transferencia directa de los plg a una membrana de PVDF
Se tomaron varios trozos de membrana PVDF de un tamaño no mayor a 3 x 3 mm. Se humedecieron con metanol al 99,9% durante quince segundos. En ocho tubos para micro-centrifuga, se tomaron 2 μg de cada uno de los 8 plg y se diluyeron en 8 x 500 μl de ácido acético al 0,1% diluido en agua desionizada tipo I.
A cada uno de los ocho tubos se les añadió varios trozos de membrana PVDF, agitando suavemente durante tres minutos. Se incubó a una temperatura de 5 a 8 °C durante dos días, agitando cada 8 a 12 horas. Luego, se sacaron, se lavaron dos veces con metanol al 20% en agua desionizada y luego se secaron. A las proteínas se les determinó la secuencia del terminal-N según el método de Edman (27), en la Universidad de Umeå, Suecia (Europa), amablemente por el doctor Per-Ingvar Olhsson.
Activación de los plasminógenos
Se utilizó 1 mg de cada uno de los plg a una concentración de 1 mg/ mL y a una temperatura constante de 37 °C, a los cuales se les adicionó 6,72 ml de u-PA para una concentración final de 739,2 UI/mL "solución activada". Se monitoreó espectrofotométricamente (A405) así: se tomaron ocho tubos con sustrato (0,3 mM) equivalentes a los diferentes tiempos de incubación (0, 1, 3, 6, 9, 15, 25 y 35 min), a los cuales se les adicionó 3 ml de la "solución activada". Se dejó reaccionar por 12 s, y la reacción se detuvo con la adición de 10 ml de solución tampón acetato (BA) 4 M pH 3,8.
Al minuto 35, la activación de los plg se detuvo y se adicionó a las soluciones del "plg activado" 323 ml de glicerol al 100%, para una concentración final de glicerol de 25%. La solución activada se homogeneizó, alicuotó y almacenó a -80 °C. Se determinó la A c de las ocho incubaciones y se graficó la A405 vs. el tiempo de incubación.
Determinación de la concentración de la plasmina
De acuerdo con el proveedor del sustrato cromogénico, la hidrolización de diez unidades de miliabsorbancias (mA405) a 37 °C corresponde a 1 nM de pli (28).
A los tubos con sustrato 0,3 mM se les agregó 3 ml de la solución final activada y se incubaron por 0,30 y 60 s, respectivamente. La reacción se detuvo adicionando 10 ml de BA; la A405 se determinó para cada tubo.
Cinética de la plasmina
Se estudia la cinética de las ocho especies de pli partiendo de una concentración común (2,7 μM), a una temperatura de 37 °C y un pH 7,3. Su actividad se determinó por la velocidad de transformación del sustrato a producto (A405), utilizando las siguientes concentraciones de sustrato: 0,05, 0,08, 0,10, 0,13, 0,18, 0,25 y 0,30 mM, a los cuales se les adicionó 3 ml de cada pli. La reacción se detuvo con 10 ml de BA. La A405 se determinó y se graficó según la ecuación de Lineweaver-Burk (29).
RESULTADOS
Análisis electroforético
La eficiencia del método de purificación de los plg se demostró (figura 1), donde se visualiza una sola banda alrededor de 92.000 Da, para todos los plg (figura 1 [A-H]), al compararla con la banda número dos del estándar de peso molecular (carril izquierdo de cada imagen [A-H]), correspondiente al plg humano. La pureza de los ocho plg fue determinada superior al 95% por densitometría, utilizando el software Image Analysis v 2003.
Activación de los plasminógenos
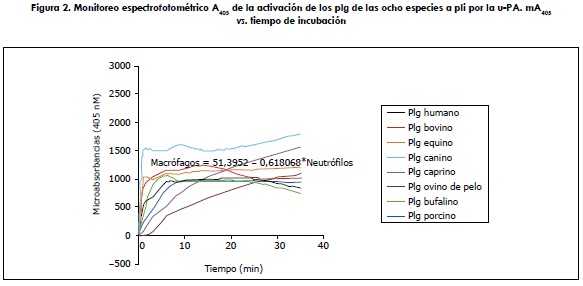
Todos los plg estudiados se activaron bajo las mismas condiciones. La activación de los 8 plg se visualiza en la figura 2. Estos demuestran una tendencia parecida a partir del minuto 10 aproximadamente, alcanzando la mayoría de ellos una activación constante, excepto los plg caprino y ovino de pelo, aunque estos demuestran claramente una tendencia hacia una constante de activación al igual que los demás plg. Solo los plg canino y bovino superaron las 1000 mA405, mientras que el resto de los plg se mantuvo a este nivel.
Cinética de la plasmina
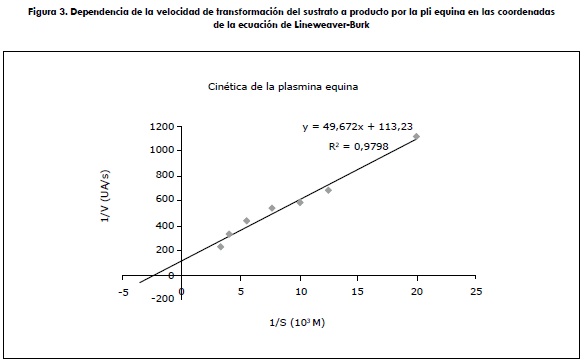
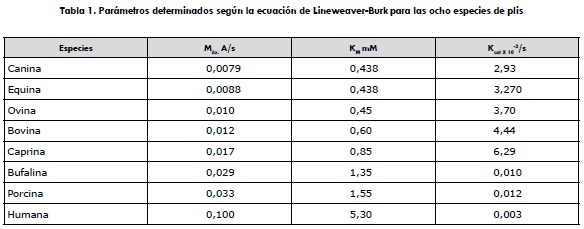
Los parámetros cinéticos de las ocho plis fueron determinados en las coordenadas de Lineweaver-Burk (figura 3), para el plg equino. Si bien todas estas gráficas muestran una tendencia análoga, sus parámetros son diferentes, teniendo el canino por ejemplo a la mayor afinidad y el humano a la menor. De igual forma, los otros parámetros determinados para los ocho plg se comportan diferente, como se puede visualizar (tabla 1).
Secuencia de los terminales-N de los plg
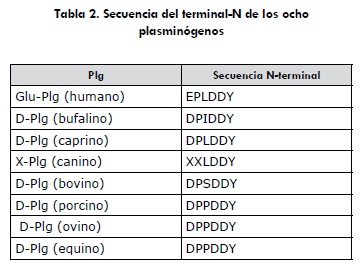
Como primer a.a. en el plg humano se determinó el glutamato (E) en sus terminales-N, en todos los plg animales se determinó el a.a. aspartato (D), otras diferencias en las secuencias se encontraron entre el humano y los animales. Así mismo, los plg de los animales muestran diferencias entre sí, las cuales se muestran en negrilla en la (tabla 2).
DISCUSIÓN
Los plg de diferentes especies como las del canino, ovino, bovino, porcino y equino han sido purificados por diferentes métodos. Común para todos ellos es la complejidad de estas purificaciones y ninguna de ellas igual la una de la otra, lo que ha inhibido la investigación de esta molécula en diferentes especies y en el sistema fisiológico donde desempeña su papel biológico (30-34). El grupo de investigación ha unificado y simplificado todos estos métodos en uno único, hasta la fecha para siete especies animales y la humana (18-24). Se observa además una pureza mayor al 95% en todas las especies aquí estudiadas, lo que demuestra una reproducibilidad y unificación en la purificación de los plg de estos ocho mamíferos. Sin duda alguna, este método de Cañas y colaboradores puede ser utilizado en todas las especies en la cuales esta molécula exista, para estudiarla de forma independiente del sistema donde desarrolla sus funciones biológicas. Esto facilita conjuntamente la comparación de esta molécula y del sistema en el cual desempeña su papel biológico (sistema plg/pli), entre diferentes especies.
Todos los plg de los animales se caracterizaron en la determinación de la secuencia del terminal-N, en que el a.a. en la posición 1 es el aspartato, motivo por el cual los plg de los animales también son conocidos como Asp-plg; excepto el canino que por motivos desconocidos no se le ha podido determinar sus dos primeros a.a., a pesar de habérsele hecho la secuencia del terminal-N en diferentes lotes de purificación. Quizás se trate de una degradación enzimática de estos a.a.
El plg humano difiere con todos los animales entre otras cosas en este primer a.a., el cual para el humano es el glutamato, por lo cual es también conocido como Glu-plg. Lo mismo no se puede decir del a.a. número tres, donde se puede apreciar que en esta posición el humano coincide con el caprino y canino, pero no con las demás especies. Las restantes especies también difieren entre sí. El porcino, el ovino y el caprino no mostraron entre ellos ninguna diferencia en la secuencia del terminal-N.
Todas las especies estudiadas demostraron tener diferentes degradaciones de los plg a nivel fisiológico, en particular el Glu y Lis-plg para el humano y Asp y Arg-plg para los animales (18-24). Estos diferentes plg fisiológicos con diferencias cinéticas (12,19-20) fueron debidamente separados para prevenir alteraciones en las determinaciones cinéticas hechas en este estudio.
La activación de estos plg a plis (Glu-plg humano y Asp-plg animales) en las ocho especies mostró una tendencia muy parecida. Después del minuto 10, todas las activaciones a plis mostraron una clara tendencia a formar una constante a través del tiempo. Esto nos indica que la activación de los plg a plis por hidrolización de la u-PA no es necesario llevarla hasta el minuto 35 de incubación, ya que los riesgos de rompimientos hidrolíticos poco específicos e indeseados se hacen mayores con el correr del tiempo. La pli se puede auto-hidrolizar, motivo por el cual una activación más allá del minuto 15 es totalmente innecesaria, como se demostró en este estudio para cualquiera de las ocho especies.
Los parámetros cinéticos determinados para las ocho especies mostraron un amplio espectro de variación. La velocidad de conversión del sustrato a producto demostró ser inversamente proporcional a la afinidad de las ocho especies estudiadas, siendo el plg/pli humano el de menor afinidad hacia el sustrato cromogénico, hecho precisamente para el plg/pli humano.
Todas las especies animales mostraron menor velocidad de conversión del sustrato que el humano; a la vez mostraron todos los plg animales mayor afinidad por el sustrato. La purificación unificada y los parámetros cinéticos determinados en este estudio para estas ocho especies facilitarán la purificación y determinación de estos parámetros en muchas más especies. También facilitarán el estudio del sistema fibrinolítico de los animales en general y su comparación con el humano. De momento, la realidad mundial ha demostrado que una de las principales causas de muerte del ser humano son los problemas cardiovasculares (21), lo cual está en concordancia con este estudio que demuestran que el plg/pli humano tiene la menor afinidad por el sustrato, clara indicación de que estas proteínas podrían detectar el creciente trombo más tarde de lo que lo harían las animales. Esta virtud de los plg/plis animales resta demostrarla in vitro, analizando el tiempo de disolución de los coágulos formados por la trombina en el plasma humano, en presencia del t-PA y los plg de las siete especies animales, comparándolos con el plg humano y viceversa. La determinación de los tiempos de lisis de los 8 plg/plis indicará si la afinidad de estos por el trombo está directamente relacionada con la disolución del coágulo. Con estos renovados conocimientos sobre los sistemas fibrinolíticos, humano/ animal, con toda seguridad se ampliará el entendimiento de este sistema, se facilitará el tratamiento de humanos y se dilucidarán las condiciones de este sistema en los animales.
AGRADECIMIENTOS
A la Universidad de Pamplona en Colombia, por el financiamiento de esta investigación. A los doctores Torgny Stigbrand y Per Ingvar Olhsson de la Universidad de Umeå en Suecia, por el soporte económico y la determinación de las secuencias respectivamente. Se agradece la donación del plasma humano al Hospital Universitario Erasmo Meoz de Cúcuta, Colombia.
REFERENCIAS
1. McMichael M. New models of hemostasis. Top Companion Anim Med. 2012;(27):40-45. [ Links ]
2. MacFarlane RG. An enzyme cascade in the blood clotting mechanism, and its function as a biochemical amplifier. Nature. 1964;(202):498-499. [ Links ]
3. Davie EW, Ratnoff OD. Waterfall sequence for intrinsic blood clotting. Science. 1964;(145):1310-1312. [ Links ]
4. Colman RW. Contact activation pathway: inflammatory, firinolytic, anticoagulant, antiadhesive and antiangiogenic activities. En: Haemostasis and thrombosis: Basic principles and clinical practice. Philadelphia: J. B. Lippincott Willians and Wilkins; 2001. p. 103-122. [ Links ]
5. Hulin MS, Wakefield TW, Andrews PC, Wrobleski SK, Stoneham MD, Doyle AR, et al. A novel protamine variant reversal of heparin anticoagulation in human blood in vitro. J Vasc Surg. 1997;(26):1043-1048. [ Links ]
6. Sadler JE, Shelton-Inloes BB, Sorace JM, Harlan JM, Titani K, Davie EW. Cloning and characterization of two cDNAs coding for human von Willebrand factor. Proc Natl Acad Sci. 1985;(82):6394-6398. [ Links ]
7. Collen D. The plasminogen (fibrinolytic) system. Thromb Haemost. 1999;(82):259-270. [ Links ]
8. Pendás AM, Knáuper V, Puente XS, Llano E, Mattei MG, Apte S, et al. Identification and characterization of a novel human matrix metalloproteinase with unique structural characteristics, chromosomal location, and tissue distribution. J Biol Chem. 1997;(272):4281-4286. [ Links ]
9. D'Armiento J, Dalal SS, Okada Y, Berg RA, Chada K. Collagenase expression in the lungs of transgenic mice causes pulmonary emphysema. Cell. 1992;(71):955-961. [ Links ]
10. Okada Y, Morodomi T, Enghild JJ, Suzuki K, Yasui A, Nakanishi I, et al. Matrix metalloproteinase 2 from human rheumatoid synovial fibroblasts. Purification and activation of the precursor and enzymic properties. Eur J Biochem. 1990;(194):721-730. [ Links ]
11. Gleizes PE, Rifkin DB. Activation of latent TGF-beta. A required mechanism for vascular integrity. Pathol Biol (París). 1999;47:322-329. [ Links ]
12. Falcone DJ, McCaffrey TA, Haimovitz-Friedman A, Vergilio JA, Nicholson AC. Macrophage and foam cell release of matrix-bound growth factors. Role of plasminogen activation. J Biol Chem. 1993;(268):11951-11958. [ Links ]
13. Pepper MS, Belin D, Montesano R, Orci L, Vassalli JD. Transforming growth factor-beta 1 modulates basic fibroblast growth factor-induced proteolytic and angiogenic properties of endothelial cells in vitro. J Cell Biol. 1990;(111):743-755. [ Links ]
14. Murphy AN, Unsworth EJ, Stetler-Stevenson WG. Tissue inhibitor of metalloproteinases-2 inhibits bFGF-induced human microvascular endothelial cell proliferation. J Cell Physiol. 1993;(157):351-358. [ Links ]
15. Hajjar KA. Cellular receptors in the regulation of plasmin generation. Thromb Haemost. 1995;(74):294-301. [ Links ]
16. Kawao N, Tamura Y, Okumoto K, Yano M, Okada K, Matsuo O, Kaji H. Plasminogen plays a crucial role in bone repair. J Bone Miner Res 2013;(28):1561-1574. [ Links ]
17. Mondéjar I, Grullón LA, García-Vázquez FA, Romar R, Coy P. Fertilization outcome could be regulated by binding of oviductal plasminogen to oocytes and by releasing of plasminogen activators during interplay between gametes. Fertil Steril 2012;(97):453-61. [ Links ]
18. Cañas O, Quijano A, Arbeláez LF, Activación de los Parámetros cinéticos de la plasmina porcina y comparación con la humana. IATREIA. 2011;(25):111-119. [ Links ]
19. Cañas O, Quijano A, Arbeláez LF, Purification and Activation of Caprine and Canine plasminogen: Comparison with Human plasminogen. IATREIA. 2011;(24):117-125. [ Links ]
20. Cañas O, Quijano A, Arbeláez LF, Activación y determinación de parámetros cinéticos de la plasmina humana y ovis aries. MVZ, universidad de córdoba. 2011;(16):2364-2371. [ Links ]
21. Cañas O, Quijano A, Arbeláez LF. Activación y Cinética comparativa de la Plasmina Bufalina con la humana. RCCP. 2010;(23):47-54. [ Links ]
22. Cañas O, Quijano A, Arbeláez LF. Cinética comparativa de la Plasmina canina con la humana, bovina y equina. Bistua. 2007;(5):17-24. [ Links ]
23. Cañas O, Quijano A, Arbeláez LF. Activación y comparación cinética del Plasminógeno Equino con el plasminógeno humano. Bistua. 2007;(5):43-52. [ Links ]
24. Cañas O, Quijano A, Arbeláez LF. Activación y cinética comparativa de dos especies de Plasminógenos (Humano y Bovino). Bistua. 2006;(4):3-12. [ Links ]
25. Appel RD, Bairoch A, Hochstrasser DF. A new generation of information retrieval tools for biologist. Biochem Sci. 1994;(19):258-260. [ Links ]
26. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;(227):680-685. [ Links ]
27. Edman P. Sequence Determination (Review). Mol Biol Biochem Biophys. 1970;(8):211-255. [ Links ]
28. Vinazzer H. Basic and practice in evaluating plasminogen. Haem. 1988;(1):41-45. [ Links ]
29. Lineweaver H, Burk D. The determination of enzyme dissociation constants. J Amer Chem Soc. 1934;(56):658-666. [ Links ]
30. Takeda Y. Plasminogen- 125I responses in dogs to a single injection of urokinase and Typhoid vaccine and to vascular injury. J clin invest. 1972;(51):1363-1377. [ Links ]
31. Castellino FJ, Paoni NF, Violand BN. Isolation and characterization of native and lower molecular weight forms of sheep plasminogen. J Biol Chem. 1977;(252):7725-7732. [ Links ]
32. Schaller J, Moser PW, Dannegger Muller GA, Rosselet SJ, Kampfer U, Rickli EE. Complete amino acid sequence of bovine plasminogen. Comparison with human plasminogen. Eur J Biochem. 1985;(149):267-278. [ Links ]
33. Brunisholz RA, Pichli EE. Primary structure of porcine plasminogen. Isolation and characterization of CNBr-fragments and their alignment within the polypeptide chain. Eur J Biochem. 1981;(119):15-22. [ Links ]
34. Marcum JA, Highsmith RE, Kline DL. Streptokinase-dependent delayed activation of horse plasminogen. BBA. 1982;(709):19-27. [ Links ]