Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de Medicina Veterinaria
versão impressa ISSN 0122-9354
Rev. Med. Vet. no.26 Bogotá jul./dez. 2013
Establecimiento de un protocolo de reproducción para la obtención de especímenes murinos embrionarios/fetales
Diana Marcela Mendoza1 / Liliana Salazar2 / Luis Eduardo Bravo3
1 Estudiante de pregrado, Escuela de Medicina, Universidad del Valle, Cali, Colombia.
dimarmend@hotmail.com
2 Magíster en Morfología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
iliana.salazar@correounivalle.edu.co
3 Especialista en Patología, MSc en Microbiología Médica, Msc en Epidemiología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
bravo.luiseduardo@gmail.com
Recibido: 23 de julio del 2013. Aceptado: 19 de septiembre del 2013
Cómo citar este artículo: Mendoza DM, Salazar L, Bravo LE. Establecimiento de un protocolo de reproducción para la obtención de especímenes murinos embrionarios-fetales. Rev Med Vet. 2013;(26):79-89.
Resumen
La investigación científica utiliza modelos animales en situaciones experimentales en las que es controversial investigar con especímenes humanos; tal es el caso de la investigación con muestras embrionarias/fetales, donde se requieren estrictos protocolos reproductivos que posibiliten un cálculo preciso de la edad gestacional y con ello la obtención de muestras adecuadas. El ratón es el modelo de experimentación más utilizado, pues es de fácil manipulación y eficiencia reproductiva. El objetivo de este trabajo es presentar un protocolo de reproducción que permite determinar con certeza el día de preñez en biomodelo Mus musculus, para la obtención de especímenes embrionarios/fetales.
Palabras clave: reproducción, tapón vaginal, Mus musculus.
Establishment of a Breeding Protocol for Obtaining Embryonic/Fetal Murine Specimens
Abstract
Scientific research uses animal models in experimental situations where it is controversial to research with human specimens; such is the case of research with embryonic/fetal samples, where strict reproductive protocols are required that enable the accurate calculation of gestational age and thus obtaining appropriate sampling. Mice are the most widely used experimental models, as they are easy to handle and are of reproductive efficiency. The purpose of this paper is to present a reproduction protocol that makes it possible to determine the day of pregnancy in Mus musculus biomodel with certainty, in order to obtain embryonic/fetal specimens.
Keywords: Reproduction, vaginal plug, Mus musculus.
Estabelecimento de um protocolo de reprodução para a obtenção de espécimes murinas embrionárias/fetais
Resumo
A pesquisa científica utiliza modelos animais em situações experimentais onde é controverso pesquisar com espécimes humanos, tal é o caso da pesquisa com amostras embrionárias/ fetais, donde se requer de estritos protocolos reprodutivos que possibilitem um cálculo preciso da idade gestational e com isso a obtenção de amostras adequadas. O rato é o modelo de experimentação mais utilizado, pois é de fácil manipulação e eficiência reprodutiva. O objetivo deste trabalho é apresentar um protocolo de reprodução que permite determinar com certeza o dia de prenhez em biomodelo Mus musculus, para a obtenção de espécimes embrionários/fetais.
Palavras chave: reprodução, tampão vaginal, Mus musculus.
INTRODUCCIÓN
El animal de laboratorio es aquel espécimen mantenido bajo condiciones controladas, con el fin de ser utilizado como instrumento de medida en investigación científica. Actualmente representa un elemento crucial en el entendimiento de procesos biológicos, la validación de modelos clínicos y en general en la resolución de interrogantes que contribuyen al desarrollo de la biología humana (1).
El uso de modelos animales es frecuente en la comprensión de procesos cuyo estudio en el hombre es controversial; tal es el caso de trabajos que contemplan obtención de especímenes embrionarios, donde es imperativo el establecimiento de estrictos protocolos reproductivos que posibiliten un cálculo preciso de la edad gestacional y con ello la obtención de muestras adecuadas (2).
El ratón, clase: Mamalia, orden: Rodentia, familia: Muridae, género: Mus, especie: musculus, es considerado por muchos investigadores un modelo animal casi perfecto porque además de su talla pequeña, su corto tiempo generacional, fácil mantenimiento y gran rendimiento a lo largo de todo el año, su genoma es muy similar al de los humanos. En el 2002, cuando se hizo su secuenciación, se encontró que posee más del 99% de genes conservados con el hombre. Por otro lado, padece de síndromes muy similares que lo convierten en un buen candidato para el estudio de patologías como cáncer, diabetes, aterosclerosis, enfermedades endocrinas, disfunciones neurológicas, entre otras (3). Es un mamífero de sangre caliente con hábitos esencialmente nocturnos y un comportamiento influenciado por feromonas, con una dinámica sexual y social dependiente de la interacción de compuestos odoríferos (4).
Las hembras se pueden reproducir en estado salvaje desde la sexta semana, en tanto que la edad mínima reproductiva de los ratones de laboratorio es de sesenta días, con un tiempo de gestación que varía entre los diecinueve y veintiún días. Poseen un útero bicorne unido en su porción caudal; presentan ciclo estral poliéstrico con duración de cuatro a cinco días; su primer estro puede darse a los veinticuatro días, pero la madurez sexual la alcanzan entre la séptima y la novena semana posnatal (5). El ciclo estral puede ser dividido en cuatro fases: proestro, estro, metaestro y diestro; en cada fase se pueden reconocer cambios morfológicos en ovarios, tubas, útero y mamas. Estas etapas pueden ser reconocidas por varios métodos, entre ellos, la citología vaginal, la medición de la impedancia eléctrica, la bioquímica de la orina y la observación visual de los genitales externos.
En hembras menores de quince meses, durante el proestro, los folículos antrales en expansión secretan estrógenos que promueven la proliferación y el consecuente engrosamiento del epitelio vaginal; en la citología se observan células epiteliales nucleadas y pocos leucocitos. Esta característica dura alrededor de doce horas y en ella el orificio vaginal posee un color rosado, es húmedo y dilatado.
En el estro ocurre la ovulación, la hembra aumenta su receptividad, observándose comportamientos proceptivos de búsqueda del macho, así como lordosis, postura dorsoarqueada en respuesta a la monta del macho, lo que permite la intromisión del pene en la vagina (esta postura se utiliza como índice de receptividad sexual). La receptividad sexual dura alrededor de trece horas, usualmente se liberan entre diez y veinte óvulos por ovulación.
Debido a la caída de los niveles de estrógenos, la capas más externas del epitelio vaginal se queratinizan y descaman hacia el lumen. Por este motivo, el frotis vaginal se caracteriza por grandes cantidades de células cornificadas, irregulares y sin núcleo, disminución en las mitosis y ausencia de leucocitos. Aquí el orificio vaginal se encuentra dilatado, menos rosado que en la fase anterior.
En el metaestro existe secreción de progesterona; se observa descamación de las células cornificadas (deterioro del epitelio) y se encuentran leucocitos en la capa superficial del epitelio vaginal. Este momento dura aproximadamente veintiún horas.
En el diestro se presenta un marcado incremento del número leucocitario y reducción de la altura epitelial. En el extendido se observan algunas células epiteliales nucleadas (inicio de la fase proliferativa). Este estado dura entre 56 a 65 h aproximadamente (6).
El número de individuos por camada es de seis a dieciséis según el grado de consanguinidad, edad y cepa; estas características determinan una de las mejores estructuras de producción embrionaria/fetal en el tiempo.
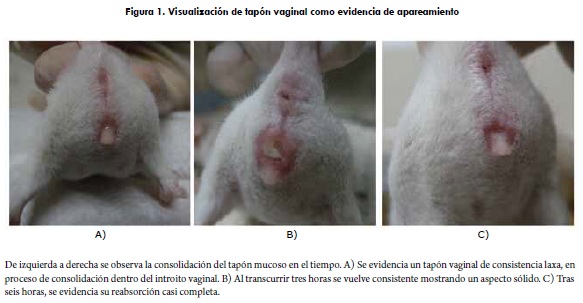
La formación de tapón mucoso en el introito vaginal, como indicador de la fecundación, brinda al observador un parámetro objetivo de este acontecimiento que, combinado con observación de características comportamentales y físicas, proporcionan al investigador herramientas para tener precisión en las edades embrionarias de las camadas (7).
En nuestro medio, específicamente para el caso del bioterio de la Universidad del Valle, Cali, Colombia, la disponibilidad de protocolos de apareamiento es limitada, por lo cual surge la necesidad de estandarizar metodologías que sean útiles a los futuros investigadores en el área de las ciencias biomédicas con interés en la obtención de biomodelos intrauterinos del Mus musculus.
El objetivo de este trabajo es presentar la construcción de un protocolo de reproducción que permitió obtener especímenes embrionarios/fetales murinos del biomodelo animal Mus musculus de los estadios E15, E16, E17, E17.5, E18 y E18.5.
MATERIALES Y MÉTODOS
Para el establecimiento del protocolo de reproducción, se solicitó al bioterio de la Universidad del Valle, el suministro de los biomodelos. Se recibieron veintitrés hembras y seis machos entre la sexta y la octava semana de vida, con pesos estimados de 40 g para las hembras y 50 g para los machos. Todo el proceso de reproducción se realizó en una de las salas del bioterio dispuesta para el proyecto, entre el 23 de diciembre del 2011 y el 1 de marzo del 2012.
Los biomodelos se alojaron en jaulas de policarbonato Arcare, con dimensiones de 44 cm x 20 cm X 21 cm. Se utilizó viruta de madera para el cubrimiento del piso. La alimentación y el agua se suministraron ad libitum. El manual del bioterio no tiene establecida variación en la alimentación al momento de la preñez. El espacio donde se ubicaron los 29 biomodelos mantuvo las condiciones ambientales de luz-oscuridad (12-12 h), temperatura entre 18-22 °C y humedad relativa ambiental de 55-65%.
Se utilizó un estante con cuatro niveles: el nivel inferior se dispuso para las hembras preñadas y en los niveles superiores se tenían las jaulas con los machos que se apareaban con las hembras.
El protocolo se organizó en cuatro etapas: 1) establecimiento del patrón de identificación para cada individuo; 2) formación de los grupos de apareamiento; 3) evidencia de tapón mucoso vaginal y aislamiento, y 4) verificación de edades embrionarias y fetales.
Etapa 1. Establecimiento del patrón de identificación en cada espécimen
Todos los especímenes incluidos en la investigación tuvieron asignado un código único cuya estructura estuvo determinada por una letra y dos dígitos. El primer carácter correspondía a la letra mayúscula H o M que designaba el sexo del espécimen; los dígitos que acompañaban la letra indicaban el orden en que fueron rotulados.
Para la identificación visual de las hembras, se dibujó un carácter gráfico en la cola; de esta forma un símbolo relacionaba cada animal con su código único. El patrón gráfico estuvo compuesto por líneas realizadas con marcador permanente. En los machos, por ser más sensibles a estímulos olfatorios, se omitió la simbolización gráfica de los mismos en el cuerpo; para su identificación se asignó a cada jaula un rótulo que contenía el código de cada uno.
Etapa 2. Formación de grupos de apareamiento
Se utilizó el sistema reproductivo poligámico o harén. Durante el día, los machos permanecieron en jaulas individuales y las hembras se agruparon en cuatro jaulas; en subgrupos de cinco y seis. Los apareamientos se planificaron para las horas de oscuridad, de tal forma que a partir de las 7 p.m. se tenían seis cubículos nocturnos de reproducción, correspondientes a cada uno de los machos.
En el plantel de apareamiento, conocido como harén las hembras, se trasladan a las jaulas de los machos. En el protocolo diseñado, tres hembras fueron trasladadas a cada jaula de los machos; las cinco hembras restantes se agruparon en una misma jaula sin participar del contacto reproductivo; el planteamiento inicial estableció que cuando las reproducciones fueran exitosas se utilizarían estas hembras en el proceso de apareamiento para completar nuevamente el harén de cada macho.
Pasadas ocho horas, se procedía a la revisión del área genital en las hembras, para determinar presencia de tapón mucoso vaginal; quienes lo presentaban, eran llevadas a jaula individual. Aquellas hembras a las que no se evidenciaba presencia del tapón, se devolvían a sus jaulas, pues la cópula se consideraba infructuosa.
Cada noche se varió el grupo de hembras en contacto con los machos, por esta razón fue imperioso el diligenciamiento riguroso de los esquemas reproductivos. Esto constituyó la guía para realizar la rotación de los biomodelos. Al completar un ciclo de seis días donde todos los machos fueron rotados con hembras distintas, se otorgó dos días de receso al proceso de apareamiento, tiempo tras el cual se reanudaron las actividades según lo descrito.
Etapa 3. Evidencia de tapón mucoso vaginal y aislamiento
La evidencia de tapón mucoso en el introito vaginal de la hembra se consideró el parámetro decisivo para apareamiento exitoso (figura 1). Se determinó observar el área genital de la hembra en la mañana, pasadas las ocho horas de contacto nocturno con el macho.
Para reconfirmación de preñez se tuvieron en cuenta otras dos características: a) cambios en comportamiento, visualizados como "nidación" a partir del día seis, y b) cambios físicos, abultamientos laterales en la región abdominal y palpación fetal, caracteres que se hacían evidentes aproximadamente al día doce de la gestación (figura 2) (7).
Se observa la presencia de abultamientos laterales en la región abdominal. La palpación de dichas masas móviles y el incremento significativo de peso, acompañado de cambios comportamentales en el animal, confirman la preñez.
Una vez identificado el tapón se procedía a aislar a la hembra en jaula individual, rotulada con código de la hembra, fecha (dd/mm/aa) y hora de su visualización. De esta manera se prescindió de marcaje gráfico en cola. Permanecían en estas condiciones hasta el cumplimiento de la edad gestacional de interés para la interrupción de la preñez y posterior obtención de los biomodelos embrionarios/fetales.
El proyecto contó con el aval del comité de ética animal de la Universidad del Valle. De esta forma los animales fueron mantenidos bajo la normatividad vigente indicada en la Ley 84 de 1989.
RESULTADOS
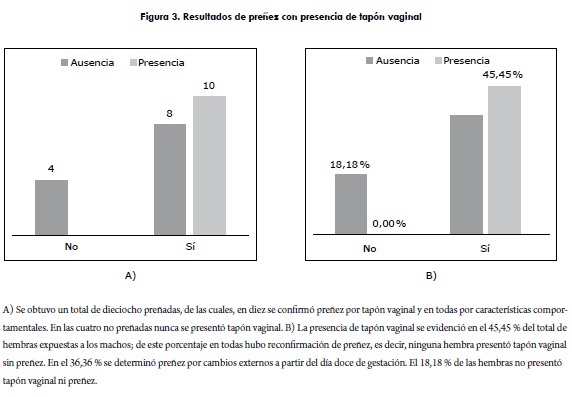
Las veintitrés hembras se sometieron al esquema de apareamiento y de variación periódica de este. Una de las hembras debió ser sacrificada por orden del veterinario (H21). En el primer ciclo de rotaciones (seis días de reproducción y dos de descanso) no se observó aparición de tapón vaginal en ninguna de las hembras; solo a partir del segundo ciclo se evidenció la primera gestación. De las veintidós hembras, dieciocho se preñaron; en diez de ellas se confirmaron los parámetros determinados como evidencia y reconfirmatorio de preñez, presencia de tapón vaginal, cambios en comportamiento y cambios físicos. En ocho hembras se determinó la preñez solo por características comportamentales y físicas (figura 3A).
El número mínimo de especímenes por camada fue de nueve; el número máximo fue de dieciséis, para un total de 227 especímenes (figura 4).
El protocolo de reproducción previamente descrito condujo a un 82% de gestaciones en la población bajo estudio. De ellas, el 56% correspondió a la identificación de tapón vaginal mucoso y reconfirmación posterior.
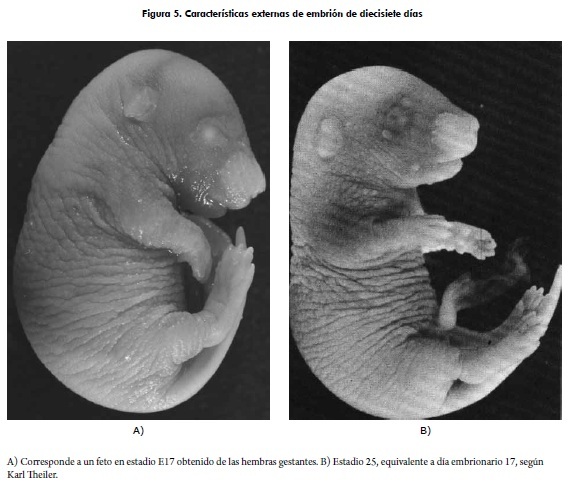
Para la obtención de las edades embrionarias se utilizaron únicamente las diez hembras en que se evidenció tapón vaginal y parámetros reconfirmatorios de preñez. Para la determinación de la edad embrionaria se tomó como día 0 la observación de tapón vaginal, así, se obtuvo un total de 73 embriones para las edades E15, E16, E17, E17.5, E18, E18.5. Las ocho restantes entraron en el grupo de obtención de edades postnatales, donde se tomó como día 0 el momento del parto. Para la verificación de las edades se tuvo en cuenta la descripción realizada en el atlas de Karl Theiler (figura 5).
Se pueden identificar las características externas relevantes: piel arrugada, gruesa; párpados fusionados y gruesos; dedos de pies y manos paralelos; desaparición de hernia inguinal fisiológica.
DISCUSIÓN
Obtener el número de biomodelos en las edades requeridas para las investigaciones biomédicas depende de la efectividad del protocolo de reproducción que se utilice y este, a su vez, depende fundamentalmente del nivel de preparación y años de experiencia que el personal encargado de la colonia tenga alrededor del proceso reproductivo de los murinos. En el protocolo aquí presentado se obtuvo un 82% de gestaciones; valor que per se no se compara con otros estudios debido a las características propias en cuanto al número utilizado. Al realizar el cálculo del PEI (Productivity Efficiency Index), se determina un valor de 0,85, inferior al esperado para la cepa (1,5), valor que podría deberse a factores como la endogamia y la edad de las hembras, la cual, como lo reportan varios laboratorios de producción de biomodelos (8), constituye un determinante en la efectividad reproductiva. Si se compara con el número de camadas por hembra, se puede corroborar el efecto que tiene la endogamia, no solo en la efectividad reproductiva, sino específicamente en el número de camadas por hembra, ya que el promedio de individuos por camada fue de 10,5; valor que resulta inferior al esperado para la cepa.
Por otro lado, en el bioterio donde se realizó el proceso experimental, al momento de requerir los biomodelos, se organizan los procesos de apareamiento de manera aleatoria basados en la influencia del entorno social en la especie, mediante la utilización de apareamiento aleatorio, tipo harén, donde un macho se pone con dos o más hembras. Fundamentalmente se inducen y sincronizan los ciclos estrales de las hembras teniendo en cuenta el efecto Whitten, según el cual se agrupan varias hembras en cercanía de un macho y son las feromonas excretadas por la orina del macho las que actúan sobre el eje hipotálamo-hipófisis-ovarios, sincronizando el ciclo a partir del cuarto día de la exposición (9). Este esquema es útil en cuanto al rendimiento reproductivo si se acompaña de otras estrategias como seguimiento del ciclo estral mediante citología exfoliativa; sin embargo, en las hembras Mus musculus es un proceso dispendioso que requiere pericia en la toma de la muestra, pues el estímulo de la introducción de la pipeta a la vagina puede inducir estado de seudopreñez. En especies como la rata hacer seguimiento de los ciclos estrales a partir de la citología exfoliativa se facilita por la anatomía de la vulva.
Para la determinación de preñez en los ratones Mus musculus en el protocolo, el método definido fue la observación de tapón vaginal (una mezcla de las secreciones de las glándulas sexuales del macho, con secreciones vaginales). La visualización de este hallazgo resultó compleja en las fases iniciales. Así, en la primera semana de inicio no se evidenció presencia de tapón vaginal en ninguna hembra, lo cual podría explicarse por falta de madurez sexual de los biomodelos suministrados, pues la especie Mus musculus alcanza la madurez sexual entre la quinta y la octava semana de edad; las hembras un poco más temprano. Por otro lado, se debe reconocer que al inicio del proceso, la experticia del observador es muy importante para su determinación.
La formación del tapón vaginal es variable en cada individuo y se encuentra sujeto a aspectos como la producción de secreciones (tanto en el macho como en la hembra), el tiempo que lleve en el introito vaginal y la capacidad del observador para diferenciar este carácter de la presencia simple de moco en dicha zona. Su efectividad como predictor de preñez es alta. Los estudios clásicos de Snell (10) mostraron una efectividad del 80 al 90%. En nuestro protocolo su efectividad fue del 100%; en todas las hembras que lo presentaron se pudo confirmar preñez por parámetros reconfirmatorios. En aquellas hembras donde solo se evidenció preñez por parámetros físicos, se asume que hubo presencia de tapón vaginal, pero su periodo de duración pudo ser más corto o se presentó confusión por parte del observador. La sola presencia de tapón vaginal no garantiza la preñez, pues durante el periodo de preimplantación el Mus musculus es extremadamente sensible a los cambios físicos y del entorno, lo cual puede llevar a la interrupción de la gestación, o a lo que también se conoce como bloqueo de la gestación. Dos son los factores principales considerados precipitantes de este bloqueo: el primero, el efecto Bruce, se produce por la exposición de la hembra al olor urinario de un macho desconocido en el periodo postapareamiento. Estas señales provienen de péptidos del complejo mayor de histocompatibilidad (MHC) en la orina del macho extraño (10). El segundo factor es el cambio en el entorno de la hembra, por ejemplo, el aumento del ruido. Los roedores tienen un espectro de sonidos audibles con sensibilidad máxima a frecuencias que son inaudibles al humano. Los efectos del sonido en su fisiología y comportamiento dependerán no solo de su intensidad (volumen), frecuencia, duración y el potencial de vibración, sino también en la edad y la capacidad auditiva de la cepa; los cambios en los olores son también importantes precipitantes de bloqueos en periodo preimplantacional, pues conllevan sobrestímulo al sistema nervioso vegetativo. De ahí la importancia que tiene para el personal encargado del bioterio y los investigadores conocer sobre influencias del entorno en el comportamiento reproductivo de los murinos (10-13).
El 13,64% equivale a cuatro hembras que no presentaron tapón vaginal ni preñez, a pesar de estar en edad reproductiva fértil. Esto puede estar relacionado con el estrés hormonal al que fueron sometidas cada noche. El estrés tiene un efecto supresor sobre la función y el comportamiento de la hembra y puede causar interrupción de la ovulación, deterioro de la maduración uterina necesaria para la implantación o inhibición del comportamiento preceptivo. Pudo deberse también a inducción del efecto Bruce por no reconocimiento del tapón vaginal, por lo cual no se aislaban y continuaban en contacto con diferentes machos cada noche (14-15).
El proceso de obtención de los biomodelos embrionarios y posnatales requeridos en el protocolo de investigación se inició con el marcaje de las hembras, debido a que esto es fundamental para el establecimiento de los esquemas de apareamiento móviles organizados en cada noche. Los machos se identificaron directamente en las jaulas individuales. Existen muchos métodos para la sistematización de la identificación, tales como agujeros en oreja, amputación de un dedo, tatuajes en cola, marcas en el pelo y aplicación de grapas metálicas numeradas, los cuales pueden ser temporales, semitemporales o permanentes, pero es condición de todos que causen el menor disconfort y que no interfieran con el normal funcionamiento del animal. El procedimiento de elección para la identificación en el bioterio es el marcaje con grapas metálicas numeradas. Para el trabajo no se consideró necesario este sistema, pues el tiempo de la investigación no era muy largo; por lo tanto, se pensó en un sistema de marcaje temporal. Inicialmente se realizaron marcas en el cabello; sin embargo, la manipulación del ratón resultó difícil, pues su inmovilización completa le generaba estrés y además tomaba mucho tiempo. El método de elección fue el marcaje temporal, el cual, según el reporte de Kasanen y colaboradores, fue el método de predilección, pues no conlleva cambios en los parámetros cardiovasculares (16).
Al utilizar este sistema se debe tener en cuenta que las tintas no pierdan sus cualidades. Las pocas duraderas se desvanecen y debe realizarse semanalmente el proceso de identificación. Por otro lado, para disminuir la posible influencia del compuesto odorífero presente en el marcador, el proceso se debe ejecutar en las horas de la mañana, de tal forma que en las noches, cuando la hembra entra en contacto con el macho, no esté presente dicho estímulo (17). Al observar presencia de tapón mucoso vaginal se suspendía el marcaje corporal y la identificación se realizaba directamente en la caja donde pasaría su preñez.
En el diseño y la ejecución del protocolo se tuvieron en cuenta los principios de las tres R, establecidos por Russell y Burch, y reconocidos en la normatividad sobre experimentación con biomodelos. Por esta razón, para las edades postnatales, el momento del parto se consideró como P0. Para optimizar el uso de los biomodelos y evitar sacrificios innecesarios, cada camada de neonatos se organizó en subgrupos de cuatro (seleccionados por similitud en peso). Cada subgrupo se usó para la obtención de una edad posnatal distinta.
CONCLUSIONES
Obtener edades embrionarias del ratón Mus musculus o de otra especie de murinos, donde el investigador tenga la certeza de ella, requiere el establecimiento de un protocolo de reproducción riguroso, con optimización del tiempo de reproducción. Para lograr estos objetivos es necesario tener experiencia y conocimiento de los procesos reproductivos de la especie, particularmente del ciclo estral, de los métodos de identificación de las fases, los modelos de apareamiento, el reconocimiento de las características de preñez; hay que tener el compromiso del respeto por los derechos del animal, garantizar el buen trato y la aplicación de los principios éticos.
Los apareamientos programados son útiles cuando se requiere obtener embriones de una etapa precisa, para tener precisión en la fecha de nacimiento, o para producir ratones pseudopreñadas para la transferencia de embriones o la inseminación artificial. Para aumentar el rendimiento reproductivo se recomienda utilizar métodos de seguimiento del ciclo estral de los biomodelos, sin importar el sistema de cría que se utilice. El proceso de apareamiento en condiciones de laboratorio se debe iniciar entre la sexta y la octava semana.
AGRADECIMIENTOS
Los autores de este trabajo agradecen a la Vicerrectoría de Investigaciones de la Universidad del Valle, por la financiación del proyecto "Expresión y aparición de las mucinas gástricas embrionarias y fetales utilizando microarreglos de tejidos", convocatoria interna año 2011.
REFERENCIAS
1. Von Hoosier G. The age of biology: opportunities and challenges for Laboratory Animal Medicine. Scand J Lab Anim Sci. 1999;26(4):176-184. [ Links ]
2. Pérez G. Fundamento del trabajo con animales de laboratorio en proyectos de investigación. Revista del Hospital J. M. Ramos Mejía. 2007;12(3):1-8. [ Links ]
3. Taft RA, Davisson M, Wiles M V. Know thy mouse. Trends in Genetics. 2006;22(12):649-653. [ Links ]
4. Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals. 8a ed. Washington: National Academic Press; 2011. [ Links ]
5. Benavídes FJ, Guenet JL. Manual de genética de roedores de laboratorio. Principios básicos y aplicaciones. En: Sociedad Española para las Ciencias del Animal de Laboratorio (SECAL). Universidad de Alcalá; 2003. [ Links ]
6. Sepúlveda Angulo MT, Sabanero López M, Durán Castro E, Flores Villavicencio LL, Ramírez Emiliano J, Solís Ortiz SM. Ciclo estral del ratón hembra intacto y ovariectomizado. Acta Universitaria. 2012;22(2):5-8. [ Links ]
7. Byers SL, et al. Mouse estrous cycle identification tool and images. PLoS One. 2012;7(4):e35538. [ Links ]
8. A Jackson Laboratory Resource Manual, Breeding Strategies for Maintaining Colonies of Laboratory Mice; 2009. [ Links ]
9. Jemiolo B, Harvey S, Novotny M. Promotion of the Whitten effect in female mice by synthetic analogs of male urinary constituents. Proc Natl Acad Sci U S A. 1986;83(12): 4576-4579. [ Links ]
10. Snell GD. Biology of the Laboratory Mouse. Philadelphia: Blakiston; 1941. [ Links ]
11. Castelhano-Carlos MJ, Baumans V. The impact of light, noise, cage cleaning and inhouse transport on welfare and stress of laboratory rats. Lab Anim. 2009;43(4):311-327. [ Links ]
12. Kelliher KR, Wersinger SR. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 2009;50(1):28-42. [ Links ]
13. Arteaga M, Guzmán R. Comunicación química en animales domésticos. Vet. Mex. 2007;38(1):105-123. [ Links ]
14. Oropeza Meza JM. Estrés por subalimentación, ruido y calor en la eficiencia reproductiva de ratas de la cepa Wistar en Universidad Autónoma de Chihuahua. Chihuahua; 2007. [ Links ]
15. Becker SD, Hurst JL. Female behaviour plays a critical role in controlling murine pregnancy block. Proc Biol Sci. 2009;276(1662):1723-1729. [ Links ]
16. Kasanen IHE, Voipio HM, Leskinen H, Luodonpää M, Nevalainen TO. Comparison of ear tattoo, ear notching and microtattoo in rats undergoing cardiovascular telemetry. Laboratory Animals. 2011;45(3):154-159. [ Links ]
17. Sharp T, Saunders G, Mitchell B. Marking of pest animals used in research. Institute for Laboratory Animal Research Journal. 2007;(44):1-15. [ Links ]