Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.27 Bogotá Jan./June 2014
Criopreservación de embriones equinos y primer reporte de un potro de raza criolla colombiana nacido por transferencia de un embrión equino vitrificado
Nadya Nathalie Martínez1 /Jorge Eliécer Pinzón2 /José Luís Porras3 / Javier Norberto Pérez4 / Edwin Ricardo Buitrago5 / Jorge Luís Zambrano6 / Claudia Jiménez7
1 Estudiante MVZ, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
nadyanathalie@gmail.com
2 MV. Estudiante de Doctorado, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia.
jorgeveter@hotmail.com
3 MVZ, MSc. Profesor asociado, Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
joseluisporrasv@hotmail.com
4 MV. Estudiante de maestría, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia.
jnperezm@unal.edu.co
5 MV. Estudiante de maestría, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia.
erbuitragoh@unal.edu.co
6 MV MPVM, PhD. Profesor asociado, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia.
jlzambranov@unal.edu.co
7 MV MSc, DVSc. Profesora asociada, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia.
cjimeneze@unal.edu.co
Recibido: 22 de enero del 2014. Aceptado: 27 de abril del 2014
Cómo citar este artículo: Martínez NN, Pinzón JE, Porras JL, Pérez JN, Buitrago ER, Zambrano JL, Jiménez C. Criopreservación de embriones equinos y primer reporte de un potro de raza criolla colombiana nacido por transferencia de un embrión equino vitrificado. Rev Med Vet. 2014; (27):21-31.
Resumen
El objetivo de este artículo es informar sobre el éxito de un procedimiento de criopreservación de embriones equinos, a fin de conseguir una preñez viable. Se colectaron embriones equinos al día 6-6,5 (< 300 µm; n = 24) y se sometieron a dos técnicas de criopreservación: grupo 1 (n = 12), vitrificados exponiéndolos a una solución VS1 (Gli [1,4 M]) 5 min, VS2 (Gli [1,4 M] + EG [3,6 M]) y VS3 (Gli [3,4 M] + EG [4,6 M] 1 min. Se empacaron en pajillas de 0,25 ml y se sumergieron en nitrógeno líquido; grupo 2 (n = 12), congelación lenta: expuestos a una solución de congelación (1,8 M de EG + 0,1 M sucrosa) por 10 min, empacados en pajillas de 0,25 ml, llevados al congelador de embriones, exponiéndolos a una curva de congelación y sumergidos en nitrógeno líquido. Posterior a la descongelación, a los 24 embriones se les removió el crioprotector mediante un paso; fueron sumergidos en medio de cultivo DMEM/F12 + 10% de suero fetal bovino (SFB) e incubados bajo atmosfera controlada (5% CO2, 5% N2 90% O2) por 48 h. Se evaluó el desarrollo embrionario en el 75% de los embriones vitrificados (n = 4); el 20% de los embriones fueron sometidos a congelación lenta (n = 1). No se observaron diferencias significativas en los grupos respecto al desarrollo embrionario, pero sí mayor tendencia de supervivencia en los embriones vitrificados. Igualmente, uno de estos embriones vitrificados fue transferido a una receptora, se logró una preñez viable y el nacimiento de un potro vivo.
Palabras clave: congelación lenta, desarrollo, embriones equinos, viabilidad, vitrificación.
Cryopreservation of Equine Embryos and First Report of a Native Colombian Breed Born by Transfer of an Equine Vitrified Embryo
Abstract
The aim of this paper is to report on the success of a cryopreservation procedure of equine embryos to achieve a viable pregnancy. Equine embryos were collected on day 6-6.5 (<300 µm, n = 24) and subjected to two cryopreservation techniques: group 1 (n = 12), vitrified, exposing them to a VS1 (Gli [1.4 M]) 5 min, VS2 (Gli [1.4 M] + EG [3.6 M]) and VS3 (Gli [3.4 M] + EG [4.6 M] 1 min solution. They were packed in 0.25 ml straws and immersed in liquid nitrogen; group 2 (n = 12), slow freezing: exposed to a freezing solution (1.8 M EG + 0.1 M sucrose) for 10 minutes, packed into 0.25 ml straws, brought to the embryos freezer, exposed to a freezing curve and immersed in liquid nitrogen. Following defrosting, cryoprotectants were removed from the 24 embryos in one step; they were submerged in culture medium DMEM/F12 + 10% of fetal bovine serum (FBS) and incubated under controlled atmosphere (5% CO2, 5% N2 90% O2) for 48 h. Embryonic development was evaluated in 75% of the vitrified embryos (n = 4); 20% of the embryos were subjected to slow freezing (n = 1). No significant difference was observed in the groups regarding embryonic development, but a greater survival tendency on the vitrified embryos was noted. Also, one of these vitrified embryos was transferred to a receiver, achieving a viable pregnancy and the birth of a living foal.
Keywords: Equine embryos, slow freezing, vitrification, viability, development.
Criopreservação de embriões equinos e primeiro relatório de um potro de raça crioula colombiana, nascido por transferência de um embrião equino vitrificado
Resumo
O objetivo deste artigo é informar sobre o sucesso de um procedimento de criopreservação de embriões equinos, a finalidade de conseguir uma prenhez viável. Coletaram-se embriões equinos ao dia 6-6,5 (< 300 µm; n = 24) e se submeteram a duas técnicas de criopreservação: grupo 1 (n = 12), vitrificados expondo-os à uma solução VS1 (Gli [1,4 M]) 5 min, VS2 (Gli [1,4 M] + EG [3,6 M]) e VS3 (Gli [3,4 M] + EG [4,6 M] 1 min. Se empacaram em tubos de 0,25 ml e se submergiram em nitrogênio líquido; grupo 2 (n = 12), congelação lenta: expostos a uma solução de congelação (1,8 M de EG + 0,1 M sacarosa) por 10 min, embalados em tubos de 0,25 ml, levados ao congelador de embriões, expondo-os a uma curva de congelação e submergidos em nitrogênio líquido. Posterior à descongelação, aos 24 embriões foi-lhes foi removido o crio protetor mediante um passo; foram submergidos em meio de cultivo DMEM/F12 + 10% de soro fetal bovino (SFB) e incubados bajo atmosfera controlada (5% CO2, 5% N2, 90% O2) por 48 h. Se avaliou o desenvolvimento embrionário no 75% dos embriões vitrificados (n = 4); o 20% de os embriões foram submetidos a congelação lenta (n = 1). Não se observaram diferenças significativas nos grupos com respeito ao desenvolvimento embrionário, mas sim uma maior tendência de sobrevivência nos embriões vitrificados. Igualmente, um destes embriões vitrificados foi transferido a uma receptora, obteve-se uma prenhez viável e o nascimento de um potro vivo.
Palavras chave: embriões equinos, congelação lenta, vitrificação, viabilidade desenvolvimento.
INTRODUCCIÓN
La criopreservación de embriones equinos ha presentado distintos avances en los métodos para mejorar los resultados obtenidos en las tasas de preñez (1). Estudios anteriores en criopreservación (congelación lenta y vitrificación) han demostrado que se obtienen mejores resultados cuando se utilizan embriones cuyo diámetro es menor de 300 µm que cuando se utilizan embriones cuyo diámetro es mayor de 300 µm (tasa de preñez < 20%) (2,3). La baja tolerancia del embrión equino (> 300 µm) a los crioprotectores y el proceso de criopreservación se atribuye posiblemente a la presencia de la cápsula que le rodea al día 7, la cual está constituida por glicoproteínas; esto aparentemente afecta la actividad de los crioprotectores (4,5).
En el caso de los embriones menores de 300 se han utilizado dos técnicas de criopreservación. Una de estas es la congelación lenta (congelación convencional), que es un método de criopreservación que utiliza crioprotectores en baja concentración (1-2 M) para disminuir los daños osmóticos y tóxicos sobre el embrión (6,7). Una vez los embriones se han expuesto al crioprotector, son llevados a un congelador programable donde se someten a una tasa de descenso de la temperatura de 0,3-0,5 °C/min para lograr la deshidratación celular y disminuir la formación de hielo intracelular (6,8).
La segunda de las técnicas que se ha venido implementando hace algunas décadas en distintas especies es la vitrificación (9). Esta es un método de criopreservación rápido, en el que se busca un enfriamiento y un calentamiento rápidos del embrión, el cual es expuesto a crioprotectores con altas concentraciones y con bajos volúmenes de medio. La tasa de enfriamiento en este caso es de 2000-2500 °C/min (10,11). Este método busca generar una alta viscosidad y la rápida solidificación de las soluciones de vitrificación con el fin de disminuir la toxicidad del crioprotector; a la vez que se reduce el tiempo de exposición en los medios de vitrificación (9,12), se busca evitar la formación de cristales de hielo en el espacio intracelular y extracelular del embrión (10,13). La tasa de preñez esperada utilizando embriones con diámetros menores de 300 (mórulas y blastocito tempranos) puede alcanzar hasta un 60% (1,3). Por el contrario, cuando se emplean embriones en estados más avanzados en su desarrollo, y cuyo tamaño es mayor a 300 (blastocito expandido), entonces la tasa de crecimiento embrionario y preñez es menor del 25% (2,14). Hochi y colaboradores (6) obtuvieron una tasa de preñez del 40% (2/5) al día 60, luego de transferir embriones equinos posvitrificación, mientras que Caracciolo di Brienza y colaboradores (15) reportaron 66,6% (4/6) al día 16, luego de transferir embriones menores de 300 µm.
En Colombia no se han reportado estudios de criopreservación de embriones en equinos menores de 300 µm, ni se han reportado estudios de cultivos de embriones equinos posterior a la criopreservación in vitro. El objetivo de este reporte es informar a la comunidad científica sobre el éxito de dos procedimientos de criopreservación de embriones equinos que llevaron a la consecución de una preñez viable.
MATERIALES Y MÉTODOS
Animales
Los animales pertenecían al hatajo equino de la Clínica de la Reproducción de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. Estos fueron mantenidos en condiciones de pastoreo (Kikuyo, [Pennisetumclandestinum]) y suplementados con una mezcla 2:1 de sal mineralizada (Derby sal®, Solla S. A., Colombia) y bicarbonato de calcio. Diez hembras equinas (n = 10) entre los tres y los quince años fueron empleadas como donadoras de embriones. Se realizaron exámenes reproductivos que comprendían palpación rectal y ultrasonografía (US) con el fin de establecer normalidad y funcionalidad reproductiva de las mismas. Posteriormente se programaron para realizar la colecta y la obtención de embriones. En todos los casos la ovulación fue inducida con acetato de deslorelina a una dosis total de 0,9 mg vía IM (Deslorelin Acetato, VM, Bogotá, Colombia) (homólogo liberador de gonadotropinas; deslorelina), la cual fue aplicada una vez. Los animales presentaron un folículo > 35mm y edema II en el útero (16). La inseminación se realizó con semen fresco de un mismo equino con fertilidad previa conocida. En todos los casos se utilizó un volumen seminal de 15 ml, con motilidad individual progresiva (MIP) del 70%, y una concentración de 280 x 106 espermatozoides/ml (spz/ml). La ovulación fue detectada por medio de exámenes ultrasonográficos cada 6 h. El día de la ovulación fue tomado como el día 0 y los embriones fueron colectados al día 6-6,5.
Obtención de embriones
Luego de la desinfección de la zona perineal de la yegua, se introdujo por vía vaginal una sonda tipo Folley modificada (calibre 32 FR), conectada a un sistema de conducción de dos vías. Se introdujo una solución Ringer Lactato enriquecido al 6% con solución de lavado para embriones (Flushing Vigro®, Bioniche Animal Health, Bogart, GA, USA), la cual fue recuperada a través de un filtro provisto de una membrana de 0,75 µm (filtro EmCon, Agtech Inc., NY, Manhattan, USA). El líquido recuperado en el filtro se observó en un estereoscopio 40X (Olympus) y el embrión obtenido fue sometido a diez lavados sucesivos en medio Holding (Nutricell®, FL, USA) para retirar exceso de celularidad uterina.
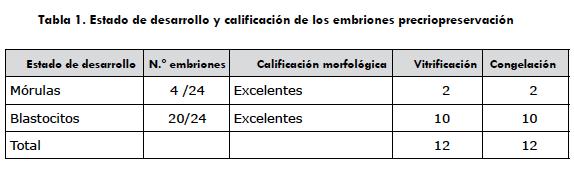
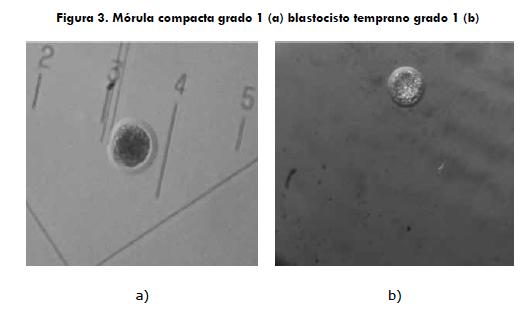
Los embriones obtenidos al día 6-6,5, n = 24 (mórulas compactas y blastocistos tempranos), se dividieron en dos grupos de 12 cada uno, que fueron clasificados morfológicamente y evaluados en su desarrollo según lo descrito por Poitras y colaboradores (8), quienes clasifican los embriones teniendo en cuenta su calidad: grado 1 es excelente; grado 2, bueno; grado 3, regular; grado 4, pobre. La evaluación del estado de desarrollo embrionario se calificó de las siguiente manera: estado 1, mórula; estado 2, blastocisto temprano; estado 3, blastocisto; estado 4, blastocisto expandido. Una vez realizada la evaluación, cada embrión fue sometido aleatoriamente a un tratamiento de criopreservación.
Métodos de criopreservación y descongelación vitrificación
El método utilizado en este estudio fue descrito previamente por Carnevale (17). Se utilizaron dos crioprotectores permeables, glicerol (Gli) (Sigma-Aldrich®, St. Louis, Mo) y etilenglicol (EG), (Sigma-Aldrich®, St. Louis, Mo) y un crioprotector no permeable, galactosa (solución de dilución SD) diluidos en medio salinofosfato buferado modificado (PBSm, Sigma-Aldrich®, St. Louis, MO).
Un total de 12 embriones (n = 12) fueron expuestos a las soluciones de vitrificación (VS) secuencialmente: la primera solución (VS1), compuesta de (Gli [1,4 M]); la segunda (VS2), compuesta de glicerol y etilenglicol (Gli [1,4 M] y EG [3,6 M]), y la tercera (VS3) contenía (Gli [3,4 M] con EG [4,6 M]); todas preparadas en PBSm. Igualmente, se preparó una SD a base de galactosa [0,5 M] para el momento de la descongelación. Los medios se colocaron en las siguientes cantidades: VS1 = 200 µl, VS2 = 200 µl, VS3= 30 µl, y 90 µl de SD dentro de una caja de Petri a temperatura ambiente (22-24 °C). Cada embrión fue expuesto en intervalos precisos de tiempo a cada una de las soluciones (5 min en la primera solución, 5 min en la segunda y 1 min en la tercera). Finalmente, los embriones se cargaron en pajillas de 0,25 ml de pilivinil no irradiada en la SV3 y en los extremo la SD, como muestra la figura 1. Posteriormente se sumergieron en nitrógeno líquido a -196 °C (17).
Calentamiento de los embriones
Cada pajilla que contenía el embrión fue extraída del termo de nitrógeno y mantenida en el aire a temperatura ambiente (20-22 °C) durante 10 s. Luego, la pajilla se sumergió en agua a 20 °C por 10 s (17). El contenido de cada pajilla con el embrión fue inmediatamente transferido a una caja de Petri para permitir la rehidratación del mismo por 5 min. En el procedimiento se perdieron dos embriones y se decidió transferir un embrión, lo que hizo que quedara un n = 9.
Congelación lenta
El método de congelación lenta utilizado en el presente reporte se basó en el procedimiento realizado por Oberstein y colaboradores (18). El crioprotector utilizado fue EG en una solución de congelación (SC) 1,8 M y sucrosa 0,1 M. Un total de 12 embriones fueron expuestos en 50 µl de la SC por 10 min a temperatura ambiente. Cada uno de los embriones fue empacado en pajillas de 0,25 ml polivinil clorada no irradiada (figura 2) en 50 µl de SC y en los extremos se llenaron con SD (Holding, Nutricell®, FL, USA). Las pajillas con el embrión fueron transferidas posteriormente a un congelador de embriones programable Cryologic CL-8000 (Bioniche Animal Health, Bogart, GA, USA). La curva de enfriamiento fue inicialmente de 0,5 °C/min hasta alcanzar una temperatura de -7 °C; de inmediato se procedió a realizar manualmente el seeding (inducción de la formación de cristales), y después se continuó el descenso de temperatura hasta -35 °C a una tasa de 0,3 °C/ min. Luego las pajillas se sumergieron directamente en nitrógeno líquido para su almacenamiento -196°C.
Descongelación de los embriones
Cada pajilla que contenía un embrión se extrajo del tanque de nitrógeno y fue mantenida en el aire (20-22 °C) durante 10 s. Luego se sumergió en agua a 37 °C por 20 s. En el procedimiento se perdió un embrión y se decidió hacer la transferencia de otro embrión, lo que hizo que quedara un n = 10 embriones.
Evaluación de los embriones descongelados o calentados
Cada embrión fue transferido a una caja de Petri para observar su reexpansión, teniendo en cuenta la clasificación y la evaluación morfológica que presentaba cada uno, en un estereoscopio en un aumento de 40X.
Cultivo de embriones
Una vez calentados los embriones del grupo de vitrificación (n = 9) y descongelados los del grupo de congelación lenta (n = 10), se transfirieron a gotas de 300 µl con medio de cultivo (50:50 DMEM/Ham's F-12 + 10% FCS), con un pH de 7,4 y cubiertos con aceite mineral. Los embriones fueron incubados en una atmósfera controlada con 5% O2, 5% CO2, 90% N2 a 38,5 °C por 48 h.
Evaluación de la viabilidad embrionaria
in vitro
Se consideró como signo positivo de viabilidad embrionaria el hecho de que los embriones alcanzaran el estado de blastocito expandido (5). Los embriones fueron evaluados y clasificados según su morfología por medio de un estereoscopio a un aumento de 40X (8).
RESULTADOS
Características de recuperación de embriones
Se realizaron un total de 37 colectas de las cuales se recuperaron 24 embriones, lo que llevó a obtener una tasa de recuperación del 64,8% (tabla 1). Del total de 24 embriones, 4 fueron clasificados como mórulas y 20 como blastocistos tempranos (figura 3). Los embriones se dividieron aleatoriamente en dos grupos: grupo vitrificación (GV) (n = 12) y grupo de congelación lenta (CL) (n = 12).
Evaluación morfológica de los embriones después de ser descongelados o calentados
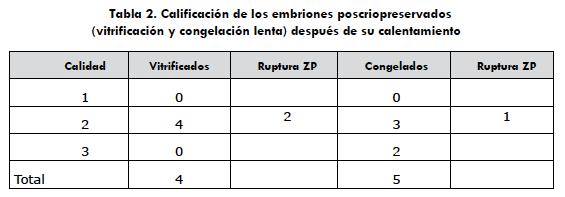
En el momento de la descongelación o el calentamiento de los embriones, se evaluó la morfología y la calificación de cada uno de estos. En las dos técnicas se observó la ruptura de la zona pelúcida (ZP) de algunos embriones y se presentó disminución en la calidad del embrión determinado por un aumento de células extruidas y por la presencia de áreas oscuras en el citoplasma (picnosis), que se consideraron indicativos de daño celular (tabla 2).
El total de embriones obtenidos en el estudio fue de 24, de los cuales solo se pudo medir la viabilidad de 9 de ellos (4 de la técnica de vitrificación y 5 de la técnica de congelación lenta) por medio de cultivo in vitro, debido a las pérdidas presentadas al momento de la manipulación y la exposición al medio. Adicionalmente, se decidió tomar un embrión de cada técnica y transferirlo a dos yeguas, para medir viabilidad in vivo. La ruptura de la ZP de los embriones sometidos a las dos técnicas de criopreservación no fue significativa.
Evaluación embrionaria después de 48 h de cultivo
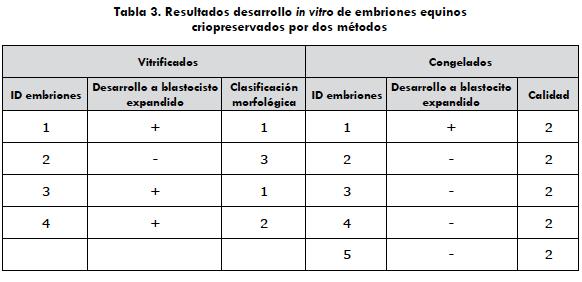
Los embriones, n = 9 (5 congelados y 4 vitrificados), fueron cultivados en DMEM/F12 (Sigma-Aldrich®, St. Louis, MO) + 10% SFB a una temperatura de 38,5 °C en una atm controlada, para evaluar el desarrollo embrionario, en el que se evidenció el desarrollo a blastocistos expandidos después de 48 h de cultivo. Para los embriones vitrificados, se evidenció el desarrollo en el 75% (3/4), mientras que para los congelados se observó el desarrollo en el 20% (1/5); en este grupo se presentó el estallido de 4 pajillas (90%) al sacarlas del termo de nitrógeno, lo que provocó un mayor tiempo de exposición al medio de congelación (tabla 3).
En la figura 4 se muestran algunas imágenes de los embriones equinos criopreservados luego de haber sido sometidos a cultivo por 48 h.
Se puede observar que el embrión (a) es de calidad excelente; presentó celularidad homogénea sin cambios morfológicos celulares, simétrica y esférica con masa celular uniforme en tamaño color y densidad; no se observaron detritos en el espacio perivitelino. Luego de 48 h, presentó desarrollo in vitro (b) en el cual se observa la pérdida de la zona pelúcida debido al crecimiento del embrión. En la imagen (c) se evidencian irregularidades en la forma de la masa del embrión; este muestra detritos en el espacio perivitelino (regular). Luego de 48 h de cultivo en el embrión (d) se observan células extruidas en el citoplasma; no se ha desarrollado blastocisto y presenta vacualización del citoplasma, por lo cual recibe una calificación de malo (8).
DISCUSIÓN
El descenso de los embriones equinos al útero ocurre aproximadamente a las 120-156 h (1,19,20), cuando el embrión se encuentra en estado de mórula compacta o blastocito temprano (19,21). Sin embargo, la recuperación de embriones se realiza comúnmente entre los días 7 y 8, debido a que hay una mayor tasa de recuperación comparada con aquellos recuperados al día 6 (22). Se ha reportado adicionalmente que se pueden lograr mejores tasas de supervivencia posterior a la criopreservación cuando los embriones son colectados hacia el día 6, posiblemente porque no poseen la cápsula (glicoproteína mucina) y su tamaño es menor (23). En el presente estudio se realizaron chequeos reproductivos por medio de palpación rectal y ultrasonografía cada 6 h; se evaluó el tamaño de los folículos hasta el momento de la ovulación considerada el día 0. Posteriormente, las colectas de los embriones fueron realizadas entre las 144 y las 156 h postovulación, lo que llevó a obtener una tasa de recuperación del 64,8%, similar a las obtenidas por Vanderwall (24) y Moussa y colaboradores (22), quienes reportaron entre un 50 y un 63% de recuperación.
La ZP presentó ruptura en embriones vitrificados 4/9 (44,4%) y congelados 2/10 (20%). Este problema se ha reportado en los procesos de criopreservación (18); los embriones sometidos a técnicas de criopreservación durante los descensos de temperatura o durante la descongelación/calentamiento pueden presentar ruptura de la zona pelúcida causada por efectos tóxicos o mecánicos de los crioprotectores (12,25,26).
El cultivo de los embriones (n = 9) posdescongelación o poscalentamiento se realizó en medio DMEM/Ham's F12 + 10% SFB. Estos embriones fueron cultivados en una atmósfera controlada adecuada (5% O2, 5% CO2, 90% N2) para brindarle un ambiente óptimo al desarrollo del embrión (27). Al no presentar estas condiciones, el medio sufre cambios en el pH, produce daños mitocondriales y estrés oxidativo, lo cual genera radicales libres que tienen un efecto nocivo en las membranas celulares (28). En el estudio se obtuvo el desarrollo desde estadios embrionarios tempranos hasta blastocitos expandidos.
De los embriones calentados que se cultivaron, el 75% (3/4) se desarrollaron de blastocistos tempranos a blastocistos expandidos luego de 48 h, a pesar de la ruptura de la zona pelúcida que presentaron al momento del calentamiento. Este resultado es similar al obtenido por Oberstein y colaboradores (18). Por otro lado, de los embriones descongelados que se cultivaron solo 1/5 (20%) presentó desarrollo luego de las 48 h de cultivo. Esto pudo deberse al estallido de las pajillas, lo que ocasionó demoras en el procedimiento de dilución del crioprotector.
El protocolo de descongelación en el laboratorio presentó inconvenientes debido a que las pajillas se estallaban, lo cual demoraba su manipulación y retardaba la dilución en las soluciones de descongelación; por ende, exponían al embrión por más tiempo a los crioprotectores. La causa del estallido de las pajillas no es clara. Por su parte, el protocolo de congelación lenta no puede ser subestimado por los resultados obtenidos en el presente estudio, ya que Martín y Monge (29) usaron una concentración de 1,5 M de etilen glicol 0,1 M de sucrosa con resultados satisfactorios.
Los resultados fueron basados en el desarrollo in vitro que tuvieron los embriones de estadios tempranos (mórula-blastocisto temprano) para tolerar la criopreservación. La diferencia en el porcentaje de desarrollo embrionario es muy cercana a ser significativa y posiblemente se hubiera podido detectar la diferencia si el número de embriones hubiese sido mayor.
Se realizó la transferencia de un embrión por cada técnica. El embrión vitrificado tuvo ruptura de la zona pelúcida al momento de manipularlo luego de 5 min de calentamiento; sin embargo, se transfirió. El embrión conservado por congelación lenta presentó un grado 2 al momento de la transferencia.
El chequeo reproductivo de las yeguas se realizó 8 días después de la transferencia del embrión sometido al método de vitrificación, lo que llevó a obtener la preñez del embrión de 15 días y el nacimiento del potro. Con el embrión que estuvo expuesto a la técnica de congelación lenta no se obtuvo una preñez.
En conclusión, los resultados obtenidos en los embriones sometidos a congelación lenta fueron pobres, posiblemente por el estallido de las pajillas al momento de sacarlas del termo de nitrógeno líquido, lo cual dificultaba la manipulación del embrión, y producía a su vez una mayor exposición al medio de congelación. Los resultados obtenidos con el método de vitrificación en este estudio fueron buenos, ya que presentaron un desarrollo adecuado luego de 48 h de cultivo in vitro; esto llevó a obtener el primer reporte de la preñez y el posterior nacimiento del potro por medio de este método. Esta técnica es de mayor valor práctico, debido a que no se requieren equipos costosos para su realización.
AGRADECIMIENTOS
A los docentes y a la Clínica de Reproducción Animal de la Universidad Nacional de Colombia, sede Bogotá, por su constante colaboración y su apoyo en el desarrollo del proyecto.
Referencias
1. Eldridge-Panuska WD, Caracciolo di Brienza V Seidel GE, Squires EL, Carnevale EM. Establishment of pregnancies after serial dilution or direct transfer by vitrified equine embryos. Theriogenology. 2005; 63(5):1308-19. [ Links ]
2. Slade NP, Takeda T, Squires EL, Elsden RP, Seidel GE, Jr. A new procedure for the cryopreservation of equine embryos. Theriogenology. 1985; 24(1):45-58. [ Links ]
3. Hochi S, Fujimoto T, Choi YH, Braun J, Oguri N. Pregnancies following transfer of equine embryos cryopreserved by vitrification. Theriogenology. 1994; 42(3):1085-94 [ Links ]
4. Tharasanit T, Colenbrander B, Stout TA. Effect of cryopreservation on the cellular integrity of equine embryos. Reproduction. 2005; 129(6):789-98. [ Links ]
5. Barfield JP, McCue PM, Squires EL, Seidel GE, Jr. Effect of dehydration prior to cryopreservation of large equine embryos. Cryobiology. 2009; 59(1):36-41. [ Links ]
6. HochiS, Maruyama K, Oguri N. Direct transfer of equine blastocysts frozen-thawed in the presence of ethylene glycol and sucrose. Theriogenology. 1996; 46(7):1217-24. [ Links ]
7. Mazur P, Leibo SP, Chu EH. A two-factor hypothesis of freezing injury. Evidence from Chinese hamster tissue-culture cells. Exp Cell Res. 1972; 71(2):345-55. [ Links ]
8. Poitras P, Guay P, Vaillancourt D, Zidane N, Bigras-Poulin M. In vivo viability of cryopreserved equine embryos following different freezing protocols. Can J Vet Res. 1994; 58(4):235-41. [ Links ]
9. Saragusty J, Arav A. Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification. Reproduction. 2011; 141(1);1-19. [ Links ]
10. Rall WF. Factors affecting the survival of mouse embryos cryopreservedbyvitrification. Cryobiology. 1987; 24(5):387-402. [ Links ]
11. Maclellan LJ, Carnevale EM, Coutinho da Silva MA, Scoggin CF, Bruemmer JE, Squires EL. Pregnancies from vitrified equine oocytes collected from super stimulated and non-stimulated mares. Theriogenology. 2002; 58(5):911-9. [ Links ]
12. Kasai M. Simple and efficient methods for vitrification of mammalian embryos. Anim Reprod Sci. 1996; 42(1-4):67-75. [ Links ]
13. Campos-Chillòn LF, Suh TK, Barcelo-Fimbres M, Seidel GE, Carnevale EM. Vitrification of earlystage bovine and equine embryos. Theriogenology. 2009; 71(2):349-54. [ Links ]
14. Hochi S, Fujimoto T, Oguri N. Large quine blastocysts are damaged by vitrification procedures. Reprod Fertil Dev. 1995; 7(1):113-7. [ Links ]
15. Caracciolo di Brienza V, Squires EL, Zicarelli L, Carnevale EM. Establishment of pregnancies after vitrification of equine embryos. Reprod Fertil Dev. 2009; 16(2):165. [ Links ]
16. Ferris RA, Hatzel JN, Lindholm AR, Scofield DB, McCue PM. Efficacy of deslorelin acetate (SucroMate) on induction of ovulation in American quarter horse mares. J Equine Vet Sci. 2012; 32(5):285-8. [ Links ]
17. Carnevale EM. Vitrification ofequine embryos.Vet Clin North Am Equine Pract. 2006; 22(3):831-41. [ Links ]
18. Oberstein N, O'Donovan MK, Bruemmer JE, Seidel GE, Carnevale EM, Squires EL. Cryopreservation of equine embryos by open pulled straw, cryoloop, or conventional slow cooling methods. Theriogenology. 2001; 55(2):607-13. [ Links ]
19. Freeman DA, Woods G, Vanderwall DK, Weber JA. Embryo-initiated oviductal transport in mares. J Reprod Fertil. 1992; 95(2):535-8. [ Links ]
20. Betteridge KJ. Comparative aspects of equine embryonic development. Anim Reprod Sci. 2000; 60-61:691-702. [ Links ]
21. Allen W. Fetomaternal interactions and influences during equine pregnancy. Reproduction. 2001; 121(4):513-27. [ Links ]
22. Moussa M, Bersinger I, Doligez P, Guignot F, Duchamp G, Vidament M, Mermillod P, Bruyas JF. In vitro comparisons of two cryopreservation techniques for equine embryos: slow-cooling and open pulled straw (OPS) vitrification. Theriogenology. 2005; 64(7):1619-32. [ Links ]
23. Scott B, Carwell DB, Hill RA, Bondioli KR, Godke RA. Gentry GT. Evaluation of capsule permeability in the equine blastocyst. J Equine Vet Sci. 2012; 32(12):795-8. [ Links ]
24. Vanderwall D. Técnicas actuales de transferencia embrionaria equina. En: Ball BA, editor. Recent Advances in Equine Reproduction. Nueva York: IVIS [internet]. 2000 [citado 2000 abr]. Disponible en: http://www.ivis.org/advances/Reproduction_Ball/embryo_transfer_vanderwall_es/ivis.pdf?iframe=true&width=90%&height=90%_pdf. [ Links ]
25. Vajta G. Vitrification of the oocytes and embryos of domestic animals. Anim Reprod Sci. 2000; 60-61:357-64. [ Links ]
26. Liebermann J, Dietl J, Vanderzwalmen P, Tucker MJ. Recent developments in human oocyte, embryo and blastocyst vitrification: where are we now? Reprod Biomed Online. 2003; 7(6):623-33. [ Links ]
27. Clark KE, Squires EL, McKinnon AO, Seidel GE. Viability of stored equine embryos. J Anim Sci. 1987; 65(2):534-42. [ Links ]
28. Palma GA. Producción in vitro de embriones bovinos. En: Palma GA. Biotecnología de la reproducción. 2a ed. Mar del Plata: Reprobiotec; 2008. p. 13-75. [ Links ]
29. Martín I, Monge A. Congelación de embriones equinos: factores a tener en cuenta y desarrollo de la técnica. Documento procedente del Primer Congreso Solidario de Clínica Equina, Revista Complutense de Ciencias Veterinarias, Centro de Reproducción de Grandes Animales; 2012 abr; Guadalix de la Sierra, Madrid. p. 114-20. [ Links ]