Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.27 Bogotá Jan./June 2014
Efectos quimiopreventivos del jugo de Morindia citrifolia (noni) sobre cáncer mamario experimental en ratas:
estudio preliminar
Ana Milena Serrano Contreras1 / Frank Harry Suárez Sánchez2
1 Médica veterinaria, Universidad de La Salle, Bogotá, Colombia. MSc en Biomedicina, Universidad de Alicante, España.
aserrano55@unisalle.edu.co
2 Médico veterinario, Universidad de La Salle, Bogotá, Colombia. PhD en Ciencias Veterinarias con énfasis en Toxicología y Farmacología, Universidad Complutense de Madrid, España. Investigador, Bogotá, Colombia.
frsuarez@unisalle.edu.co
Recibido: 11 de febrero del 2014. Aceptado: 29 de abril del 2014
Cómo citar este artículo: Serrano Contreras AM, Suárez Sánchez FH. Efectos quimiopreventivos del jugo de Morindia citrifolia (noni) sobre cáncer mamario experimental en ratas: estudio preliminar. Rev Med Vet. 2014; (27):41-57.
Resumen
Este estudio determina el efecto del jugo de Morindia citrifolia (Tahitian Noni®) en el desarrollo de cáncer mamario inducido por el agente carcinogénico 7,12-dimetilbenzantraceno (DMBA) en ratas. Para esto se utilizó el modelo de inducción de cáncer de mama con 1,7-DMBA en ratas nulíparas Spraguey dawley de 35 días de edad, divididas al azar en tres grupos: grupo 1 control, el cual no recibió ningún tratamiento, y los grupos 2 y 3, inducidos con DMBA a una dosis de 55 mg/kg. El último recibió una dosis de jugo de noni de 4 ml/kg por día, durante 90 días. Los resultados mostraron que un porcentaje significativo (83,33%) de las ratas del grupo inducido con DMBA no tratadas con jugo de noni desarrollaron tumores mamarios palpables (≤ 2 cm) de tipo carcinoma ductal in situ e hiperplasia ductal atípica, en comparación con los otros grupos que no desarrollaron tumores de ningún tipo. Así mismo, se encontró que las ratas que desarrollaron cáncer mamario tuvieron una menor ganancia de peso y un mayor consumo de agua significativo (p < 0,05), en comparación con los otros dos grupos. Los resultados de los parámetros hematológicos y bioquímicos no presentaron cambios significativos entre los grupos. Se encontraron cambios histopatológicos compatibles con toxicidad hepática en las ratas tratadas con jugo de noni. En conclusión, en este estudio preliminar se observó que el jugo de noni ejerce efectos positivos en la modulación del desarrollo de cáncer mamario inducido por DMBA.
Palabras clave: 7,12-dimetilbenzantraceno, glucósidos, Morinda citrifolia, neoplasia mamaria, quimioprevención.
Chemopreventive Effects of Morindia Citrifolia Juice (noni) on Experimental Breast Cancer in Rats:
Preliminary Study
Abstract
This study determines the effect of Morindia citrifolia juice (Tahitian Noni®) in the development of breast cancer induced by carcinogen agent 7.12-dimethylbenzanthracene (DMBA) in rats. For this purpose, the breast cancer induction model 1.7-DMBA was used on Spraguey Dawley nulliparous rats of 35 days of age, randomly divided into three groups: group 1 control, which received no treatment, and groups 2 and 3, induced with DMBA at a dose of 55 mg/kg. The latter received a dose of noni juice of 4 ml/kg per day for 90 days. The results showed that a significant percentage (83.33%) of the rats from the group induced with DMBA not treated with noni juice developed palpable breast tumors (≤ 2 cm) of the ductal carcinoma in situ type and atypical ductal hyperplasia, compared to the other groups that did not develop any kind of tumors. In addition, it was found that rats that developed breast cancer had a lower weight gain and significantly increased water consumption (p < 0.05) compared to the other two groups. The results of the hematological and biochemical parameters showed no significant changes between groups. Histopathological changes compatible with liver toxicity were found in rats treated with noni juice. In conclusion, it was found in this preliminary study that noni juice has positive effects in modulating the development of breast cancer induced by DMBA.
Keywords: Morinda citrifolia, glycosides, chemoprevention, mammary neoplasia, 7.12-dimethylbenzanthracene.
Efeitos químico-preventivos do suco de Morindia citrifolia (noni) sobre câncer mamario experimental em ratos:
estudo preliminar
Resumo
Este estudo determina o efeito do suco de Morindia citrifolia (Tahitiam Noni®) no desenvolvimento de câncer mamário induzido pelo agente carcinogênico 7,12-dimetilbenzantraceno (DMBA) em ratos. Para isto se utilizou o modelo de indução de câncer de mama com 1,7-DMBA em ratos fêmeas nulíparas Spraguey dawley de 35 dias de idade, divididas ao acaso em três grupos: grupo 1 controle, o qual não recebeu nenhum tratamento, e os grupos 2 e 3, induzidos com DMBA a uma dose de 55 mg/kg. o último recebeu uma dose de suco de noni de 4 ml/kg por dia, durante 90 dias. Os resultados mostraram que uma porcentagem significativa (83,33%) dos ratos do grupo induzido com DMBA não tratados com suco de noni desenvolveram tumores mamários palpáveis (≤ 2 cm) de tipo carcinoma ductal in situ e hiperplasia ductal atípica, em comparação com os outros grupos que não desenvolveram tumores de nenhum tipo. Da mesma forma, encontrou-se que os ratos que desenvolveram câncer mamário tiveram um menor ganho de peso e um maior consumo de água significativo (p < 0,05), em comparação com os outros dois grupos. Os resultados dos parâmetros hematológicos e bioquímicos não apresentaram mudanças significativas entre os grupos. Encontraram-se mudanças histopatológicas compatíveis com toxicidade hepática nos ratos tratados com suco de noni. Em conclusão, neste estudo preliminar se observou que o suco de noni exerce efeitos positivos na modulação do desenvolvimento de câncer mamário induzido por DMBA.
Palavras chave: Morinda citrifolia, glucósidos, químico prevenção, neoplasia mamária, 7,12-dimetilbenzantraceno.
INTRODUCCIÓN
Los tumores mamarios son neoplasias que se presentan por lo común en varias especies, entre ellas caninos, roedores y humanos. Se detectan rutinariamente en la práctica clínica y constituyen el tipo más frecuente en caninos, en el cual representan de un 25 a un 50% del total encontrado en hembras caninas (1,2). Este tipo de neoplasia maligna es un crecimiento incontrolado de las células que forman el tejido mamario; la mayoría pertenecen al revestimiento interior de los ductos mamarios. Tal crecimiento se da como resultado de mutaciones en los genes responsables de la regulación del crecimiento y el mantenimiento de dichas células. El proceso de carcinogénesis implica principalmente tres etapas: iniciación, promoción y progresión (3,4); cada una de ellas transcurre durante un largo período. Por eso existe una posibilidad de intervención o modulación de cada uno de estos pasos con agentes quimiopreventivos. Para un estudio de este tipo, los agentes potenciales podrían utilizarse ya sea antes o un poco después de la exposición a carcinógenos.
Con frecuencia se emplean carcinógenos químicos como el 7,12-dimetilbenzantraceno (DMBA), para iniciar y promover la transformación neoplásica en animales de experimentación. Este compuesto es un hidrocarburo aromático policíclico (HAP), relacionado con una clase importante de los carcinógenos ambientales, lipofílico que requiere activación metabólica en epóxidos, y forma uniones con residuos de deoxiguanosina y deoxiadenosina que conducen a la reparación por excisión, lo cual genera puntos de mutación de especificidad indefinida. Sin embargo, algunos autores afirman que los tumores de mama inducidos por DMBA probablemente se originan por una mutación en el codón 61 del oncogén Ha-ras (5,6).
Las especies reactivas del oxígeno (ROS) desempeñan un papel importante en el estrés oxidativo relacionado con la patogenia de varias enfermedades. En organismos sanos, la producción de radicales libres es balanceada por el sistema antioxidante de defensa. Sin embargo, cuando hay un desequilibrio se favorece la generación de radicales libres que lleva a estrés y daño oxidativo, que puede iniciar y promover la progresión de algunas enfermedades crónicas, como cáncer (7,8).
En la actualidad, existe un número considerable de productos naturales con actividad quimiopreventiva antioxidante que pueden ser utilizados para fortalecer el organismo y reducir el daño oxidativo. Diversos productos naturales derivados de plantas han sido investigados por sus actividades antioxidantes y anticancerígenas, como es el caso de Morinda citrifolia.
Desde una perspectiva taxonómica, Morinda citrifolia L. (Rubiaceae), conocida comúnmente como noni, es una planta medicinal que se ha utilizado por tradición en toda la Polinesia, y es originaria del sudeste asiático (Indonesia) y Australia. En la actualidad tiene una distribución pantropical, por lo que se encuentra incluso en América Central y del Sur (9). Entre sus efectos terapéuticos se usa como antimicrobiano, analgésico, hipotensor, antiinflamatorio, antineoplásico e inmunoestimulante (10-12).
Se han identificado cerca de 160 compuestos fitoquímicos en el noni, así como micronutrientes como glucósidos, compuestos fenólicos, ácidos orgánicos y alcaloides (11,13,14). Diversos componentes de diferente polaridad pueden contribuir con la actividad antioxidante del extracto de las hojas, el fruto y las raíces de Morinda citrifolia. Entre las propiedades antioxidantes se incluyen xeronina, flavonoides, taxol y quinona reductasa, que pueden tener un efecto sinérgico de más de dos componentes presentes en esta planta, lo cual crea un sistema efectivo de defensa de amplio espectro contra los radicales libres (15). De esta forma, la acción quimiopreventiva del jugo de noni ha sido demostrada en diversos estudios que exponen las propiedades de naturaleza antioxidante capaces de actuar en las fases de iniciación de varios tipos de cáncer, pero ninguno de estos ha sido comprobado en cáncer mamario (7).
En este estudio se determinaron los efectos de quimioprevención del jugo de noni en cáncer mamario en ratas Sprague dawley, por medio de la evaluación del consumo de agua, la ganancia de peso, la incidencia del tumor y el volumen, la presencia de dolor, los parámetros de histopatológicos y los de química sanguínea.
MATERIALES Y MÉTODOS
Animales
Se utilizaron 15 ratas Sprague dawley, hembras vírgenes de 35 días de edad, SPF (libres de patógenos específicos), con un peso inicial entre 80 y 100 g. A su llegada se aclimataron durante 10 días. Fueron alojadas en jaulas de polipropileno (45 x 24 x 15 cm), mantenidas a temperatura ambiente (27 ± 2 °C), 12 h luz/12 h condiciones de oscuridad. Se les administró una dieta estándar de pellets (Amrut Laboratorio de Alimentos para Animales, Mysore RSS Limited) y agua ad libitum con reposición diaria. La experimentación se llevó a cabo en las instalaciones del Bioterio Central de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional de Colombia, Bogotá, Colombia. El manejo de animales y los procedimientos experimentales fueron aprobados por el Comité Ético de Animales de la Universidad de La Salle, y los experimentos se realizaron de acuerdo con la Guía para el cuidado y uso de animales de laboratorio (16).
Inductor carcinogénico y agente quimiopreventivo
Se utilizó como inductor carcinogénico el 7,12-dimetilbenzantraceno adquirido del laboratorio Sigma-Aldrich Co., St. Louis, MO. Como agente quimiopreventivo fue utilizado el jugo de Morinda citrifolia (Tahitian Noni®), suministrado por Tahitian Noni International, UT. Este preparado comercial contiene el 89% de fruta de noni (Morinda citrifolia L.) y el 11% de uva común y concentrados de jugo de arándano y sabores naturales, sin aditivos químicos, ni espesantes ni conservantes (17).
Diseño experimental
Las ratas fueron distribuidas al azar en tres grupos: grupo 1 control, conformado por tres ratas, a las cuales no se les administró el DMBA, ni el tratamiento con jugo de noni; grupo 2, conformado por seis ratas a las que se les administró el DMBA; y grupo 3, conformado por seis ratas a las que se les administró tanto el DMBA como el tratamiento con jugo de noni. La forma de administración del DMBA en los grupos 2 y 3 fue vía oral por gavage, y la del jugo de noni en el grupo 3 fue vía oral por medio de una jeringa. Al final del periodo experimental (12 semanas) todas las ratas se sacrificaron por decapitación cervical. Se tomaron muestras de 2 ml de sangre por exanguinación a cada uno de los animales de los grupos, en tubos con anticoagulante para hemograma y en tubos sin anticoagulantes para diversas estimaciones bioquímicas (18). Posteriormente se realizó la necropsia de los animales, y se tomaron muestras de glándula mamaria, pulmón, hígado y riñón, para análisis histopatológico en frascos con formaldehído al 10% (19).
Inducción de carcinogénesis mamaria
La administración del carcinógeno se realizó después del período de aclimatación. Para esto fueron inoculadas 12 ratas Sprague dawley con 55 mg/kg de DMBA a los 45 días de vida, por intubación gástrica (17). El DMBA se diluyó en 1 ml de aceite de olivo, como se indica en la figura 1. El día en el que se realizó la inducción tumoral fue denominado 1.
Administración de jugo de noni
El jugo de noni fue administrado vía oral por medio de una jeringa de 1 ml a los animales del grupo 3 inducidos con DMBA y tratados con jugo de noni, con una dosis de 4 ml/kg/día, una semana antes de la inducción de cáncer con DMBA y durante los 90 días siguientes a esta.
Evaluación de la ganancia de peso y consumo de agua
Diariamente se realizó pesaje de los animales, del alimento y del agua; de esta forma se determinó el consumo de agua, de alimento y la ganancia de peso diario.
Evaluación del dolor
La valoración del dolor fue realizada semanalmente siguiendo la escala numérica (20), en la cual se toman en cuenta variables fisiológicas específicas y les asignan valores numéricos: 0, 1, 2, 3, de acuerdo con el grado subjetivo (normal, leve, moderado, severo) que se observe en estas.
Evaluación de parámetros hematológicos y de química sanguínea
La evaluación de los parámetros hematológicos se realizó con un hemograma completo. En este se determinó la concentración de hemoglobina (HB), el conteo de eritrocitos (ETO), el hematocrito (HCT), el conteo de plaquetas (PLT), el volumen corpuscular medio (VCM), la hemoglobina corpuscular media (HCM), la concentración de hemoglobina corpuscular media (CHCM) y los leucocitos totales (LEUC), a través de un contador electrónico de células Micros ABX de la firma ABX Diagnostic Systems. El conteo diferencial de leucocitos incluyó conteo de neutrófilos (N), linfocitos (L), monocitos (M), eosinófilos (E) y basófilos (B) (18).
Para la determinación de los parámetros bioquímicos se colectó sangre entera en viales de 1 ml, la cual se dejó coagular a temperatura ambiente y se centrifugó a 12.000 revoluciones por minuto en una centrífuga Eppendorf durante 10 min para luego colectar el suero. Se determinaron dos indicadores bioquímicos: alaninoaminotransferasa (ALAT) y creatinina (CREA), mediante el empleo de un analizador automático Hitachi 704 de la Boehringer Mannheim, utilizando kits comerciales de la misma firma (18).
Evaluación histopatológica
Para el estudio histopatológico, todas las ratas de cada grupo se sometieron a perfusión con solución salina fisiológica, seguida de formalina (formal-dehído al 10%). Los tejidos mamarios, así como los de pulmón, riñón e hígado, fueron extirpados inmediatamente y se fijaron en formalina al 10%. Los tejidos se cortaron y se embebieron en cera de parafina, de 5 de espesor; las secciones se cortaron en un micrótomo de rotación y se tiñeron con hematoxilina y eosina. Los especímenes fueron evaluados con un microscopio óptico. Todos los cambios histopatológicos fueron examinados por el patólogo (19).
El análisis de los resultados de histopatología se realizó siguiendo tres criterios: 1) presencia o no presencia de cambios histopatológicos compatibles con neoplasias; 2) tipo de neoplasia presentada; 3) presentación de respuesta celular (agregados linfocitarios) en cada uno de los órganos tomados como muestra. Además, se determinó la presencia de cualquier otro cambio patológico en cada uno de los órganos.
Análisis estadístico
Todos los datos fueron procesados utilizando el programa estadístico Statistics 8.0 para Windows. Para evaluar la normalidad del conjunto de datos se realizó la prueba de Shapiro-Wilks. Cuando los datos no siguieron una distribución normal se llevó a cabo la prueba de análisis de la varianza (Anova), con el intento de transformar la variable para que los datos se distribuyeran según una normal. Cuando esto no se consiguió se hicieron pruebas no paramétricas como el test de Kruskal-Wallis. Todos estos resultados se expresaron como media ± SD de tres ratas en el grupo 1 y de seis ratas para los grupos 2 y 3, considerando un nivel de significación del 95% (valor p ≥ 0,05). Para el análisis de los resultados cualitativos de histopatología y dolor se utilizó la prueba chi cuadrado.
RESULTADOS
De las 15 ratas que formaron parte del experimento, un total de 14 animales completaron el estudio. La rata que no completó el estudio murió por diversas causas y se excluyó del análisis. Todas las ratas en el grupo de tratamiento con jugo de noni tenían una ganancia de peso corporal significativa.
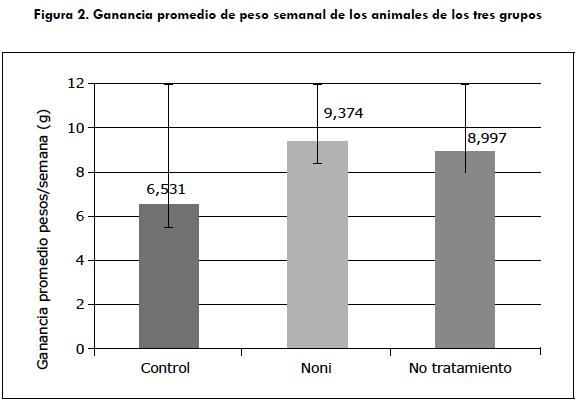
Ganancia promedio de peso
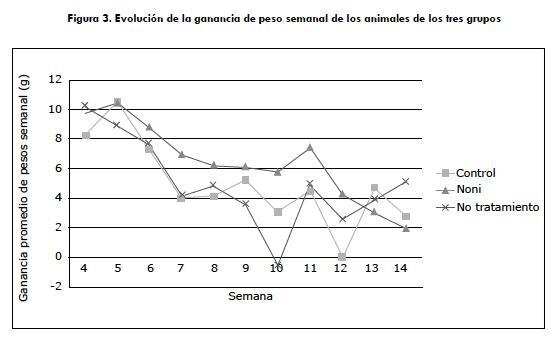
El análisis de la ganancia de peso corporal de los animales de los grupos 1, 2 y 3 se muestra en la figura 2. No se encontraron diferencias estadísticamente significativas entre los grupos (p > 0,05) con respecto a la ganancia de peso. Sin embargo, se puede decir que el grupo de los animales tratados con jugo de noni presentó una ganancia de peso media mayor, en comparación con los otros dos grupos de animales. En la figura 3 se observa la evolución semanal de la ganancia promedio de peso en cada uno de los grupos, en la que se resalta el grupo 3 de las ratas tratadas con jugo de noni que mostró una ganancia de peso semanal estable a lo largo del período de experimentación, en comparación con los grupos 1 y 2.
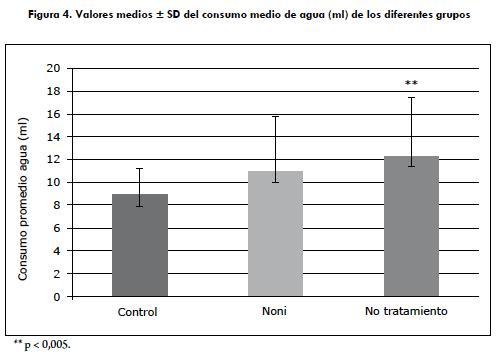
Consumo de agua en cada uno de los grupos
En el análisis del seguimiento del consumo de agua de los animales en los tres grupos —grupo control, grupo tratado con jugo de noni y grupo sin tratamiento—, la media de los valores en este parámetro se presenta en la figura 4. El consumo de agua en los tres grupos presentó diferencia significativa (p < 0,05), ya que hubo un mayor consumo de agua en el grupo de los animales no tratados, en comparación con los otros grupos.
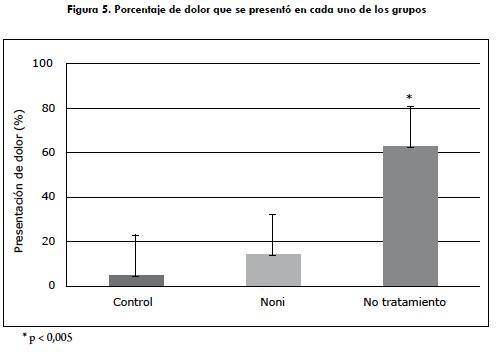
Parámetros del dolor
Del análisis de la presentación de dolor en los animales de los tres grupos se encontraron diferencias estadísticamente significativas entre los grupos. En el grupo 2, de ratas inducidas con DMBA sin tratamiento, se determinó un valor p < 0,05, en comparación con los grupos 1, control, y 3, de ratas tratadas con jugo de noni, como se muestra en la figura 5. Esto evidencia que los animales del grupo 2 no tratados con jugo de noni presentaron un mayor porcentaje de dolor.
Presentación tumoral
Las ratas del grupo inducidas con DMBA sin tratamiento desarrollaron neoplasias mamarias (figura 6). Por eso se observaron 3 nódulos tumorales palpables de 2 cm en 3 de los 6 animales de este grupo. De igual forma, en las ratas que no presentaron neoplasias palpables se observaron cambios histopatológicos compatibles con carcinoma mamario. En las ratas del grupo control, así como en las del grupo inducidas con DMBA tratadas con jugo de noni, no fueron observados nódulos tumorales de ningún tipo y ningún cambio histopatológico compatible con neoplasia mamaria.
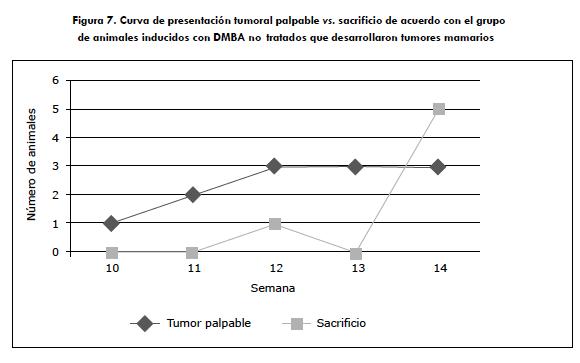
La presentación tumoral del grupo de ratas inducidas con DMBA no tratadas se estableció en una curva de tiempo comparando el inicio de la aparición de los tumores con el tiempo de sacrificio, como se muestra en la figura 7. Aquí se evidencia que en la semana 10 inició la aparición de los tumores palpables y en la semana 11 se llevó a cabo el sacrificio.
Parámetros hematológicos y de química sérica
De acuerdo con el análisis estadístico de los parámetros hematológicos evaluados con las pruebas de Anova y de Kruskal-Wallis, se estableció que no hay diferencias estadísticamente significativas (p > 0,05) entre estos parámetros (eritrocitos, hematocrito, Hb, VCM, HCM, CHCM, leucocitos, linfocitos, neutrófilos, basófilos, monocitos, eosinófilos, plaquetas, PPT, ALT, y creatinina), como se muestra en la figura 8.
Parámetros de histopatología
Los resultados histopatológicos del grupo 1 de ratas inducidas con DMBA sin tratamiento mostraron cambios compatibles con carcinoma ductal in situ (n = 3) e hiperplasia ductal atípica (n = 2). En cuanto al primer tipo, el carcinoma ductal in situ (DCIS), se observó un patrón cribiforme ductular, células pleomórficas con núcleos prominentes, figuras mitóticas numerosas y dispersas. Algunas zonas celulares se encontraron vacuoladas y con cambios degenerativos. También hubo presencia de un número de células inflamatorias entre moderado y alto, principalmente linfocitos, células plasmáticas y eosinófilos. En el tejido pulmonar de una rata del grupo inducido con DMBA sin tratamiento se encontraron depósitos de células metastásicas (figura 9).
En el grupo 1, además de los cambios histopatológicos encontrados en la glándula mamaria, se hallaron otros cambios en órganos como: en la rata 1 se evidenció en el hígado aumento del número de linfocitos en las tríadas portales y la proliferación de conductos biliares en áreas portales; en el pulmón, se evidenció bronconeumonía granulomatosa con infiltrados de bacterias. En la rata 2 se determinó en el pulmón la presencia de una neoplasia incipiente de células epiteliales.
DISCUSIÓN
Diversos estudios recientes exploran el potencial de los antioxidantes de origen natural en la prevención del cáncer y su posible uso en los ensayos de intervención para prevenirlo en seres humanos y en animales. En esta investigación se estudió el efecto antioxidante quimiopreventivo del jugo de noni en carcinogenesis mamaria inducida con DMBA en ratas.
Este estudio preliminar demuestra que el jugo de noni tuvo un efecto modulador en el desarrollo del cáncer de mama inducido por DMBA. Los tipos de tumores en las ratas no tratadas tuvieron un crecimiento rápido significativo. La histología mostró que la mayoría de las células cancerosas de este grupo tenían actividades mitóticas y eran pleomórficas. El estudio que aquí se presenta apoya los resultados de estudios anteriores que exponen los efectos antiproliferativos contra el cáncer pulmonar, hepático y en osteosarcoma humano (21-27).
El jugo de noni parece actuar como un agente quimiopreventivo al tener la capacidad de modular el efecto carcinogénico inducido por el DMBA; por eso no se desarrollaron tumores en el grupo de ratas tratadas con este, mientras que en el grupo de ratas inducidas con DMBA no tratadas se observó el desarrollo de tumores. La acción quimiopreventiva del jugo de noni ha sido demostrada en diversos estudios que exponen las propiedades medicinales del jugo de noni (28-31). Esa es la razón por la cual se ha determinado la presencia de diversos componentes como la xeronina, los flavonoides, el taxol y la quinona reductasa, elementos de naturaleza antioxidante que promueven la eliminación de radicales libres —principalmente del radical anión superóxido (SAR)—, la acción antiangiogénica, que suprime la proliferación del factor de crecimiento vascular (VEGF), y la antigenotóxica, que promueve enzimas inductoras QR de la fase II del metabolismo con potencial oxidativo (7,32,33). En este estudio el mecanismo de prevención ante la acción del DMBA consiste en corregir los daños producidos mediante un sistema de reparación de nucleótidos que dejan sitios apurínicos en el ADN, y probablemente participan en el desarrollo tumoral (7).
Los modelos de inducción química de carcinogénesis mamaria en ratas se han utilizado ampliamente en la investigación preclínica. En este estudio fue utilizado el modelo experimental de inducción de cáncer mamario con DMBA, el cual es uno de los más utilizados (6,34); además, el tipo de cáncer mamario inducido en la rata es predominantemente dependiente de hormonas y de origen ductal, lo cual es similar a la mayoría de los cánceres en hembras caninas (35).
De la evaluación de la ganancia de peso corporal en las ratas, los animales del grupo no tratados que desarrollaron tumores presentaron una menor ganancia de peso, con reducción notable del peso corporal, así como un mayor consumo de agua, en comparación con las ratas de los otros grupos. Esto puede estar asociado al síndrome de caquexia cancerosa, caracterizado por anorexia y saciedad temprana, pérdida de peso y debilidad muscular marcada, anemia de tipo no específico y alteración del metabolismo (36). El síndrome sucede a causa del metabolismo particular de la célula tumoral que permite que esta actúe como una trampa metabólica de los nutrientes, captando los compuestos vitales para el metabolismo del huésped. Esto trae diversas consecuencias con una cosa en común: la reducción de la eficiencia metabólica del huésped, a la que este responde con agotamiento de la proteína muscular, el aumento de la gluconeogénesis y el desacoplamiento de la fosforilación oxidativa, lo que genera un profundo desequilibrio energético que por lo regular termina en caquexia y, finalmente, en la muerte (37).
Por otro lado, las ratas del grupo 3 que recibieron el tratamiento con jugo de noni mostraron un aumento progresivo en el peso corporal, lo cual podría deberse a la presencia de compuestos bioactivos como polisacáridos, triterpenoides, alcaloides y proteínas que median estos cambios favorables debido a sus propiedades antioxidantes, antiperoxidativas y antiinflamatorias (38). De igual forma, un mayor consumo de agua de los animales del grupo 3 en comparación con los del 1 puede deberse a la concentración del jugo de Tahitian noni que corresponde en el 89% a extracto del fruto de Morinda citrifolia, y el 11% restante, a los extractos de uva y arándano (17). En este estudio se administró el jugo puro de noni en una toma diaria sin previa dilución, lo que hizo que los animales requirieran de un mayor consumo de agua, en contraste con otros estudios en los que se ha administrado el jugo de noni en el agua de bebida ad libitum (28), que resulta en una dosis de menor concentración que no altera el consumo de agua.
En esta investigación, la presentación de dolor se observó en mayor proporción en las ratas del grupo 2, inducidas con DMBA sin tratamiento con jugo de noni, en comparación con las ratas de los grupos 1 y 3. En los animales del grupo 2 se observaron con frecuencia signos clínicos compatibles con dolor como pérdida de peso, reducción del consumo de alimento y agua, automutilación, alteración de la posición y la forma de caminar, pelaje hirsuto, lágrimas rojas, costras oscuras alrededor de los ojos, las fosas nasales y los antebrazos, incremento de la frecuencia respiratoria, vocalización, reducción de la actividad y alteración del comportamiento (39). Estos signos clínicos se observaron sobre todo a partir del inicio de la aparición de los tumores. En las ratas del grupo 1 control y del grupo 3 tratadas con noni, se observaron signos clínicos compatibles con dolor pero no por la presencia de tumores sino por causas como el estrés durante el período de adaptación en ambos grupos, y en el caso del grupo 3, estrés por el manejo al momento de la inducción y por una lesión accidental de una rata.
La presencia de estructuras palpables compatibles con tumores se observó a partir de la semana 10 después de la inducción de 55 mg/kg de con DMBA. Estos resultados se asemejan a los obtenidos en otro estudio (40), en el que luego de utilizar una dosis de 5 mg/rata de DMBA se detectaron tumores en la semana 9 después de la inducción con DMBA. Además se obtuvo en la semana 20, luego de la administración de DMBA, una incidencia tumoral del 38%. En comparación con estos resultados, en un estudio en el que utilizaron una dosis menor de 2 mg/rata IV de DMBA, disuelta en una emulsión lipídica, en ratas con edades de 50, 53 y 56 días, la aparición del primer tumor fue en el día 40, es decir, en la semana 6 (41). En otros estudios han utilizado dosis más altas de 20 mg de DMBA, y obtuvieron tumores que eran visibles desde la cuarta semana después de la inducción (42). Al igual que el estudio anterior, en otro estudio se consiguió la aparición de tumores en la semana 16 con una dosis similar de DMBA de 8 mg/100 grs de peso vía intragástrica, dosis similar a la utilizada en este estudio (43).
En el estudio que aquí se presenta, la administración del jugo de noni se inició una semana antes de la inducción de cáncer con DMBA, y se continuó diariamente a una dosis de 4 ml/kg VO durante 90 días siguientes a la inducción del cancerígeno. La dosis utilizada (dosis de principio activo de noni diaria de 3,56 g/kg, dosis a administrar de 4 ml/kg, a una concentración de 10%) para este estudio corresponde con una de las comprobadas como seguras en un estudio en el que se planteó un esquema de dosificación basado en tres dosis preparadas con fruto puro de noni seco y congelado disuelto en agua destilada en concentraciones de 17,2 g/100 ml, 34,3 g/100 ml y 68,6 g/100 ml. Las preparaciones fueron administradas a las ratas por intubación gástrica a una dosis de 10 ml/kg de peso corporal, lo cual resultó en dosis diarias de 1,72, 3,43 y 6,86 g/kg (44).
Los tipos de neoplasias mamarias encontradas en este estudio en las ratas del grupo inducidas con DMBA sin tratamiento con jugo de noni fueron carcinoma ductal in situ e hiperplasia ductal atípica. De acuerdo con el primer tipo, el carcinoma ductal in situ (DCIS) es una forma de cáncer temprano (45). Según otro estudio, esta forma es la precursora del cáncer mamario invasivo (46). Dicha observación también se hizo en estudios anteriores sobre modelos de cáncer mamario inducido por DMBA, aunque es posible que también se formen fibroadenomas, adenomas y papilomas típicos (7,47-49).
Además del carcinoma ductal in situ, se evidenció la presencia de una hiperplasia ductal atípica, que es una condición anormal de las células epiteliales de proliferación ductal que no invade el estroma (50). Esta hiperplasia ductal atípica, que puede ser más agresiva y finalmente llenar el lumen del conducto, se considera como un precursor fisiológico para el desarrollo del carcinoma ductal in situ.
Los cambios histopatológicos compatibles con toxicidad hepática encontrados en el grupo 2 de ratas tratadas con jugo de noni pueden asociarse al consumo de este. Desde hace más de una década se han vendido varias preparaciones de jugo noni como bebidas saludables. Estudios de seguridad a corto plazo en ratas no han producido toxicidad manifiesta. Hasta ahora no se ha informado de los estudios farmacológicos detallados en los ingredientes activos de la planta de noni. Sin embargo, se ha obtenido que uno de los componentes del noni, las antraquinonas, puede causar toxicidad hepática en otros remedios herbales. Un posible mecanismo de la hepatotoxicidad de las antraquinonas fue descrito por el investigador Bironaite, quien estableció que la reína (51-53), presente en las antraquinonas, produce radicales libres derivados del oxígeno por ciclo redox, que resulta en agotamiento intracelular de glutatión reducido, disminución del potencial de membrana mitocondrial, iniciación de lípidos, peroxidación y muerte celular. A pesar de esto, se requieren estudios adicionales para evaluar el mecanismo exacto de toxicidad (17,51,54,55).
Este estudio tiene algunas limitaciones. El número de ratas utilizadas en este modelo fue limitado.
Se requieren estudios mayores en animales sobre los mecanismos específicos del efecto preventivo del jugo en el cáncer mamario. El hallazgo de esta publicación se debe tomar con precaución al relacionarlo con el modelo de tumor de mama de pequeños animales.
CONCLUSIÓN
En conclusión, el consumo diario de jugo de noni a una dosis de 4 ml/kg/día PO, de forma continua durante 90 días a partir de un día después de la administración de DMBA, moduló de forma positiva la progresión del cáncer de mama inducido por DMBA en ratas. El grupo de ratas tratadas con jugo de noni no desarrolló tumores, en comparación con el de ratas no tratadas, las cuales desarrollaron tumores principalmente de tipo carcinoma ductal in situ. Los resultados sugieren que el jugo de noni al contener propiedades nutracéuticas antioxidantes puede tener el potencial para ser utilizado como un agente profiláctico para combatir el crecimiento de cáncer de mama o como adyuvante a la quimioterapia convencional en pequeños animales. De igual forma, se ha reconocido que tiene propiedades inmunomoduladoras que contribuyen al aumento de la respuesta celular y humoral, lo cual aporta grandes beneficios tanto en el estado de salud como en la condición corporal, y conllevan a menores tasas de morbilidad.
REFERENCIAS
1. Rivera P, von Euler H. Molecular biological aspects on canine and human mammary tumors. Vet Pathol. 2011; 48(1):132-46. [ Links ]
2. Durán A, Ortiz JA. Estudio clínico patológico y epidemiológico de neoplasias en caninos en diez clínicas veterinarias de Santafé de Bogotá [tesis de pregrado]. Bogotá: Universidad de La Salle; 1999. [ Links ]
3. Barrett JC. Mechanisms of multistep carcinogenesis and carcinogen risk assessment. Environ Health Perspect. 1993; 100(1):9-20. [ Links ]
4. Russo J, Russo IH. Biology of disease, biological and molecular bases of mammary carcinogenesis. Lab Invest. 1987; 57(2):112-37. [ Links ]
5. Li DH, Wang M, Dhingra K, Hittelman WN. Aromatic DNA adducts in adjacent tissues of breast cancer patients: clues to breast cancer etiology. Cancer Res. 1999; 56(1):287-93. [ Links ]
6. Hirose M, Masuda A, Ito N, Kamano K, Okuyama H. Effects of dietary perilla oil, soybean oil and safflower oil on 7,12-dimethylbenz[a]anthracene (DMBA) and 1,2-dimethyl-hydrazine (DMH)-induced mammary gland and colon carcinogenesis in female SD rats. Carcinogenesis. 1990; 11(5):731-5. [ Links ]
7. Arroyo J, Bonilla P, Ráez E, Barreda A, Huamán O. Efecto quimioprotector de Bidens pilosa en el cáncer de mama inducido en ratas. An Fac Med. 2010; 71(3):153-9. [ Links ]
8. Hirose M, Mizoguchi Y, Yaono M, Tanaka H, Yamaguchi T, Shirai T. Effecs of green tea catechins on the progression or late promotion stage of mammary gland carcinogenesis in female Sprague-Dawley rats pretreated with 7, 12-dimethylbenz(a) an-thrancene. Cancer Lett. 1997; 112(2):141-7. [ Links ]
9. Nelson SC. Species profiles for Pacific Island agroforestry: Morinda citrifolia (noni). Tahitian Noni Publications [internet]. 2006 [citado 2013 oct 31]. Disponible en: http://www.traditionaltree.org/ [ Links ]
10. Chan Blanco Y, Vaillantb F, Pérez A, Reynesc M, Brillouetc J-M, Brat P. The noni fruit (Morinda citrifolia L.): A review of agricultural research, nutritional and therapeutic properties. J Food Composit Anal. 2006; 19(6-7):645-54. [ Links ]
11. Wang MY, Su C. Cancer preventive effect of Morinda citrifolia (Noni). An N Y Acad Sci. 2001; 952(1):161-8. [ Links ]
12. Li J, Stickel SL, Bouton H, Burgin KE, Yu X, Wong DK, Wagner TE, Wei Y. Fermented Noni exudate (fNE): a mediator between immune system and anti-tumor activity. Oncol Rep. 2008; 20(6):1505-9. [ Links ]
13. Heinicke R. The pharmacologically active ingredient of Noni. Bulletin of the National Tropical Botanical Garden. 1985; 15(1):45-52. [ Links ]
14. Wang MY, West BJ, Jensen CJ, Nowicki D, Su C, Palu AK, Anderson G. Morinda citrifolia (Noni): A literature review and recent advances in Noni research. Acta Pharmacol Sin. 2002; 23(12):1127-41. [ Links ]
15. Mohd Zin Z, Abdul-Hamid A, Osman A. Antioxidative activity of extracts from Mengkudu (Morinda citrifolia L.) root, fruit and leaf. Food Chem.2002; 78(2):227-31. [ Links ]
16. Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Washington DC: The National Academies Press; 2011. [ Links ]
17. European Food Safety Authority (EFSA). Opinion on a request from the Commission related to the safety of noni juice (juice of the fruits from Morinda citrifolia). United Kingdom. 2006; 998(1):1-16. [ Links ]
18. León A, Blanco D, Peña A, Ronda M, González B, Arteaga M, Bada A, González Y, Mancebo A. Hematological and biochemical parameters in Sprague Dawley laboratory rats breed in CENPALAB, Cenp SPRD. REDVET. 2011; 12(11):1-10. [ Links ]
19. Pandi M, Manikandan R, Muthumary J. Anticancer activity of fungal taxol derived from Botryodiplodia theobromae Pat. an endophytic fungus, against 7, 12 dimethyl benz(a)anthracene (DMBA)-induced mammary gland carcinogenesis in Sprague dawley rats. Biomed Pharmacother. 2010; 64(1):48-53. [ Links ]
20. Morton DB, Griffiths P. Guidelines on the recognition of pain, distress and discomfort in experimental animals and an hypothesis for assessment. Vet Rec. 1985; 116(1):431-6. [ Links ]
21. Hirazumi A, Furusawa E, Chou SC, Hokama Y. Anticancer activity of Morinda citrifolia (noni) on intraperitoneally implanted Lewis lung carcinoma in syngeneic mice. Proc West Pharmacol Soc. 1994; 37(1):145-6. [ Links ]
22. Furusawa E, Hirazumi A, Story S, Jensen J. Antitumour potential of a polysaccharide-rich substance from the fruit juice of Morinda citrifolia (Noni) on sarcoma 180 ascites tumour in mice. Phytother Res. 2003; 17(10):1158-64. [ Links ]
23. Hiwasa T, Arase Y, Chen Z, Kita K, Umezawa K, Ito H, Suzuki N. Stimulation of ultraviolet-induced apoptosis of human fibroblast UVr-1 cells by tyrosine kinase inhibitors. FEBS Lett. 1999; 444(2):173-6. [ Links ]
24. Arpornsuwan T, Punjanon T. Tumor cell-selective antiproliferative effect of the extract from Morinda citrifolia fruits. Phytother Res. 2006; 20(6):515-7. [ Links ]
25. Wang M, Kikuzaki H, Jin Y, Nakatani N, Zhu N, Csiszar K, Boyd C, Rosen RT, Ghai G, Ho CT. Novel glycosides from noni (Morinda citrifolia). J Nat Prod. 2000; 63(8):1182-3. [ Links ]
26. Sang S, Cheng X, Zhu N, Stark RE, Badmaev V, Ghai G, Rosen RT, Ho CT. Flavonol glycosides and novel iridoid glycoside from the leaves of Morinda citrifolia. J Agric Food Chem. 2001; 49(9):4478-81. [ Links ]
27. Duke JA. Handbook of phytochemicals. Boca Raton, FL: CRC Publishing. 2011; 1(2):1-6. [ Links ]
28. Wang M, Peng L, Anderson G, Nowicki D. Breast cancer prevention with Morinda citrifolia (noni) at the initiation stage. FFHD. 2013; 3(6):203-22. [ Links ]
29. Marchand L. Cancer preventive effects of flavonoids-- a review. Biomed Pharmacother. 2002; 56(6):296-301. [ Links ]
30. Liu G, Bode A, Ma WY, Sang S, Ho CT, Dong Z. Two novel glycosides from the fruits of Morinda citrifolia (noni) inhibit AP-1 transactivation and cell transformation in the mouse epidermal JB6 cell line. Cancer Res. 2001; 61(15):5749-56. [ Links ]
31. Arpornsuwan T, Punjanon T. Tumor cell-selective antiproliferative effect of the extract from Morinda citrifolia fruits. Phytother Res. 2006; 20(6):515-7. [ Links ]
32. Franchi L, Guimarães N, De Andrade L, De Andrade H, Lehmann M, Dihl R, Cunha K. Antimutagenic and antirecombinagenic activities of noni fruit juice in somatic cells of Drosophila melanogaster. An Acad Bras Cienc. 2013; 85(2):585-94. [ Links ]
33. Akihisa T, Matsumoto K, Tokuda H, Yasukawa K, Seino K, Nakamoto K, Kuninaga H, Suzuki T, Kimura Y. Anti-inflammatory and potential cancer chemopreventive constituents of the fruits of Morinda citrifolia (Noni). J Nat Prod. 2007; 70(5):754-7. [ Links ]
34. Currier N, Solomon A, Demicco E, Chang D, Farago M, Ying H, Dominguez I, Sonenshein G, Cardiff R, Jim Xiao Z, Sherr D, Seldin D. Oncogenic signaling pathways activated in DMBA-induced mouse mammary tumors. Toxicol Pathol. 2005; 33(6):726-37. [ Links ]
35. Motoyama J, Yamashita N, Morino T, Tanaka M, Kobayashi T, Honda H. Hyperthermic treatment of DMBA-induced rat mammary cancer using magnetic nanoparticles. Biomagn Re Technol. 2008; 6:1-6. [ Links ]
36. Fearon KC. The mechanisms and treatment of weight loss in cancer. Proc Nutrit Soc. 1992; 51(2):251-65. [ Links ]
37. Argilés JM, Azcón-Bieto J. The metabolic environment of cancer. Mol Cell Biochem. 1988; 81(1):3-17. [ Links ]
38. Leij-Halfwerk S, Dagnelie PC, van Den Berg JW, Wattimena JD, Hordijk-Luijk CH, Wilson JP. Weight loss and elevated gluconeogenesis from alanine in lung cancer patients. Am J Clin Nutr. 2000; 71(2):583-9. [ Links ]
39. Sharp P, La Regina, M. The laboratory rat. Washington: CRC Press; 1998. [ Links ]
40. Ma-Fu D, Ryohei K, Hong Z, Wang PY. Efectos de la promoción de Leche para el desarrollo de tumores de mama inducida por 7,12-dimethylbenz (a) antraceno (DMBA) en ratas. Acta Histochem Cytochem. 2007; 40(1):61-7. [ Links ]
41. Murad T, von Emmerich H. Studies of Mammary Carcinoma Induced by 7,12-Dimethylbenz(a) anthracene Administration. Cancer Res. 1972; 32(7):1404-15. [ Links ]
42. Ferreira L, Silva E, Guimarães N, Almeida A, Untura L, Uemura G. Modelo experimental de carcinoma mamário em ratas induzidas com 7,12-dimetilbenz(a) antraceno. Rev Bras Mastologia. 2010; 20(2):76-9. [ Links ]
43. Corso M, Rivera S, Romero T, Viloria M, Camacho J, Nuñez J. Inducción de cáncer mama en ratas: quimioprevención e inmunomodulación. Rev Cient (Maracaibo). 2001; 11(4):355-66. [ Links ]
44. West BJ, Su CX, Jensen CJ, Prenatal toxicity test of Morinda citrifolia (noni) fruit. J Toxicol Sci. 2008; 33(5):647-9. [ Links ]
45. Silverstein MJ. Ductal carcinoma in situ of the breast. Br Med J 1998; 317(1):734-9. [ Links ]
46. Burstein HJ, Polyak K, Wong JS, et al. Ductal carcinoma in situ of the breast. N Engl J Med. 2004; 350(1):1430-41. [ Links ]
47. Dias M, Cabrita S, Sousa E, França B, Patrício J, Oliveira C. Benign and malignant mammary tumors induced by DMBA in female Wistar rats. Eur J Gynaecol Oncol. 1999; 20(4):285-8. [ Links ]
48. Russo J, Russo H. Atlas and histologic classification of tumors of the rat mammary gland. J Mammary Gland Biol Neoplasia. 2000; 5(2):187-200. [ Links ]
49. Costa I, Solanas M, Escrich E. Histopathologic characterization of mammary neoplastic lesions induced with 7,12 dimethylbenz(alpha) anthracene in the rat: a comparative analysis with human breast tumors. Arch Pathol Lab Med. 2002; 126(8):915-27. [ Links ]
50. Mehta RG, Bhat K, Hawthorne M, Kopelovich L, Mehta RR, Christov K, Kelloff G, Steele V Pezzuto JM. Induction of atypical ductal hyperplasia in mouse mammary gland organ culture. J Natl Cancer Inst. 2001; 93(14):1103-6. [ Links ]
51. Stadlbauer V, Fickert P, Lackner C, Schmerlaib J, Krisper P, Trauner M, Stauber R. Hepatotoxicity of NONI juice: Report of two cases. World J Gastroenterol. 2005; 11(30):4758-60. [ Links ]
52. Li FK, Lai CK, Poon WT, Chan AY, Chan KW, Tse KC, Chan TM, Lai KN. Aggravation of non-steroidal anti-inflammatory drug-induced hepatitis and acute renal failure by slimming drug containing anthraquinones. Nephrol Dial Transplant. 2004; 19(7):1916-7. [ Links ]
53. Itoh S, Marutani K, Nishijima T, Matsuo S, Itabashi M. Liver injuries induced by herbal medicine, syo-saiko-to (xiao-chaihu-tang). Dig Dis Sci. 1995; 40(8):1845-8. [ Links ]
54. West BJ, Su CX, Jensen CJ. Prenatal toxicity test of Morinda citrifolia (noni) fruit. J Toxicol Sci. 2008; 33(5):647-9. [ Links ]
55. European Commission. Commission decision 0f 5 June 2003 authorizing the placing on the market of "Nonie juice" as a novel food ingredient under regulation (EC) Nr. 258/97 of the European parliament and of the council. Official Journal of the European Union. 2003; 12(6):144-8. [ Links ]