Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.28 Bogotá July/Dec. 2014
Fisiopatología de la septicemia neonatal equina
Juan Carlos Ospina Chirivi1 / Mónica Daniela Ronderos Herrera2
1 Médico veterinario zootecnista, Esp. Laboratorio de Patología Veterinaria. Departamento de Salud Animal, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá.
jcospinac@unal.edu.co
2 Médica veterinaria. Universidad de La Salle, Bogotá, Colombia.
mronderos00@unisalle.edu.co
Recibido: 29 de abril del 2014. Aceptado: 15 de julio del 2014
Cómo citar este artículo: Ospina Chirivi JC, Ronderos Herrera MD. Fisiopatología de la septicemia neonatal equina. Rev Med Vet. 2014; (28): 117-25.
Resumen
La septicemia neonatal es la mayor causa de mortalidad y morbilidad en equinos en sus primeros siete días de vida y dentro de su fisiopatología. Es importante tener en cuenta los factores predisponentes extrínsecos e intrínsecos al potro que los hace susceptibles a la entrada de agentes que principalmente son de etiología bacteriana. No obstante, se deben considerar otros tipos de etiología infecciosa (virus y hongos), así como las etiologías de índole no infecciosa. Se menciona una amplia variedad de mecanismos que producen distintas lesiones que deben atenderse con medidas de cuidado crítico neonatal, por lo que es imprescindible para el clínico de equinos conocer los mecanismos de patogenicidad de la enfermedad, la presentación clínica y las lesiones anatomopatológicas. Así, los conceptos del síndrome de respuesta inflamatoria sistémica (SIRS), síndrome de disfunción multiorgánica (MODS) y el colapso circulatorio periférico o shock son algunos de los elementos que se definen como los pilares de la fisiopatología de la septicemia neonatal, y se han estudiado ampliamente en medicina de equinos. Este trabajo muestra una revisión corta de los mecanismos de desencadenamiento de la septicemia neonatal, y resalta la importancia de investigaciones epidemiológicas en Colombia; muestra la necesidad de hacer trabajos retrospectivos y prospectivos y de dar a conocer algunas de las medidas de prevención de la enfermedad en equinos.
Palabras clave: equino, fisiopatología, neonato, septicemia, SIRS, shock.
Pathophysiology of Equine Neonatal Septicemia
Abstract
Neonatal septicemia is a major cause of mortality and morbidity in horses in their first seven days of life and within their pathophysiology. It is important to consider the extrinsic and intrinsic predisposing factors which make foals susceptible to agents of primarily bacterial etiology. However, other types of infectious etiology (viruses and fungi) should be considered too, as well as noninfectious etiologies. The paper mentions a wide variety of mechanisms that produce different injuries that must be addressed with measures of critical neonatal care, so it is imperative for the veterinarian to know the pathogenic mechanisms of the disease, its clinical presentation and anatomo-pathological lesions. Thus, systemic inflammatory response syndrome (SIRS), multiple organ dysfunction syndrome (MODS), and peripheral circulatory collapse or shock are some of the elements defined as the pillars of the pathophysiology of neonatal septicemia, extensively studied in equine medicine. This paper presents a short review of the triggering mechanisms of neonatal septicemia highlighting the importance of epidemiological investigations in Colombia. It shows the need for retrospective and prospective studies and for divulgation of some of the preventive measures of the disease in horses.
Keywords: horses, pathophysiology, neonatal, septicemia, SIRS, shock.
Fisiopatologia da septicemia neonatal equina
Resumo
A septicemia neonatal é a maior causa de mortalidade e morbidade em equinos em seus primeiros sete dias de vida e dentro de sua fisiopatologia. É importante ter em conta os fatores predisponentes extrínsecos e intrínsecos ao potro que os faz suscetíveis na entrada de agentes que principalmente são de etiologia bacteriana. Não obstante, se devem considerar outros tipos de etiologia infecciosa (vírus e fungos), Assim como as etiologias de índole não infecciosa. Menciona-se uma ampla variedade de mecanismos que produzem diferentes lesões que devem atender-se com medidas de cuidado crítico neonatal, por isso é imprescindível para que o clínico de equinos possa conhecer os mecanismos de patogenicidade da doença, a apresentação clínica e as lesões anatomopatológicas. Assim, os conceitos da síndrome de resposta inflamatória sistêmica (SIRS), síndrome de disfunção multiorgânica (MODS) e o colapso circulatório periférico ou shock são alguns dos elementos que se definem como os pilares da fisiopatologia da septicemia neonatal, e estudaram-se amplamente em medicina de equinos. Este trabalho amostra uma revisão curta dos mecanismos de desencadeamento da septicemia neonatal, e destaca a importância de pesquisas epidemiológicas na Colômbia; mostra a necessidade de fazer trabalhos retrospectivos e prospectivos e de dar a conhecer algumas das medidas de prevenção da doença em equinos.
Palavras chave: equino, fisiopatologia, neonato, septicemia, SIRS, shock.
INTRODUCCIÓN
El avance en antibioticoterapia en los últimos 20 años ha sido importante en lo que concierne al tratamiento de la sepsis. Sin embargo, no se han podido demostrar efectos positivos en las nuevas terapias para la septicemia neonatal equina (1). No obstante, las tasas de supervivencia han venido aumentando en los últimos 20 años en proporción al avance de la terapéutica, aunque persiste la idea de que es la principal causa de mortalidad en los primeros siete días de vida, representando uno de los principales problemas desde el punto de vista clínico y económico para la industria equina (2-4).
Esta persistencia en la mortalidad y morbilidad en neonatos equinos es explicada por la naturaleza compleja y multisistémica de la enfermedad, y más específicamente por el síndrome de respuesta inflamatoria sistémica (SIRS) (3). El término septicemia indica la presencia de microorganismos patógenos o sus toxinas en el torrente sanguíneo. No obstante, este concepto no se asocia exclusivamente a causas biológicas. Este evento progresa al SIRS y consecuentemente al síndrome de disfunción multiorgánica (MODS), que se define como el colapso cardiovascular y que tiene como consecuencia final la coagulación intravascular diseminada (CID) (3-5).
Es importante entender los mecanismos fisiopatológicos de este complejo de enfermedad para establecer el reconocimiento clínico y el abordaje terapéutico de los animales en cuidado crítico; por lo cual, el objetivo de este artículo es revisar dichos eventos fisiopatológicos relacionados con la septicemia neonatal equina, además de mencionar las perspectivas en Colombia sobre el estudio de la enfermedad.
FACTORES PREDISPONENTES
Existe una gran variedad de eventos que pueden facilitar la septicemia en el potro y estos se describen teniendo en cuenta factores maternos y posnatales. Los factores maternos incluyen dificultad en el parto (distocia), separación temprana de las membranas de la placenta, placentitis y otras formas de enfermedad como las asociadas a signología de cólico, neumonía, entre otras. La mayoría de los eventos maternos que ocasionan septicemia en el potro son relacionados con placentitis ascendente aguda o crónica (6-8).
Las causas posnatales son relacionadas con las posibles rutas de infección. Sin embargo, existe una gran excepción: la falla en la transferencia pasiva de inmunoglobulinas (principalmente de IgG), que es definida como la inadecuada transferencia de anticuerpos calostrales de la yegua al potro, o como una inadecuada absorción de las mismas por parte del neonato. Se cree que es la mayor causa de predisposición a infecciones y muerte de equinos en sus primeros días de vida.
Las principales causas de este evento inmunológico son carencia de calostro por parte de la yegua, en la que se incluyen las lactancias tempranas, calidad inadecuada del calostro y muerte de la yegua, carencia del consumo y absorción de calostro por rechazo de la madre en animales prematuros y débiles, además de los que nacen con anomalías congénitas. El estrés y la administración de corticoides también han sido involucrados (9-11). En ese sentido, las condiciones de manejo en la granja son importantes. Medidas simples como la limpieza general, manejo de densidades poblacionales, evitar exposición a enfermedades, nutrición de las madres, vacunación y desparasitación son la mejor manera de prevenir la septicemia neonatal, además del manejo del estrés (11,12).
Microorganismos involucrados
Infección es la definición que se da a la presencia de microorganismos (bacterias, virus, hongos, parásitos), que inducen respuesta tisular en el hospedero. Sin embargo, las causas biológicas no son las únicas que desencadenan septicemia. Factores como hipoxia y traumatismos son capaces de inducir respuestas orgánicas con expresión clínica similar a lo descrito en infecciones sistémicas, por lo cual en ciertas ocasiones es difícil inferir sobre la etiología que desencadena el SIRS (1,3).
Aunque de manera menos frecuente que las etiologías bacterianas, se conocen algunos virus que son capaces de inducir septicemia; los dos más frecuentes son el herpes virus equino tipo I y la arteritis viral equina. Entre las etiologías fúngicas se describe a Candida albicans e Histopalsma capsulatum como eventuales causas de infección sistémica en potros neonatos, sobre todo en animales inmunodeprimidos, debilitados o que han recibido un tratamiento prolongado con antibióticos (1,3,13).
Las causas de etiología bacteriana son las más reconocidas según estudios de hemocultivo y en los últimos 20 años se reconocen como a los mayores participantes a bacterias gramnegativas, siendo la más aislada Escherichia coli y a su vez la más estudiada. Respecto a los organismos grampositivos, Streptococcus spp. es la especie más aislada. Sin embargo, se han aislado otras especies (tabla 1) (6,14-17).
RUTAS DE INFECCIÓN PARA SEPTICEMIA
En el medio intrauterino, el feto es expuesto a microorganismos que eventualmente infectan la placenta o que atraviesan la barrera corioplacentaria llegando directamente al torrente sanguíneo fetal. Las bacterias asociadas a placentitis pueden entrar al líquido amniótico y acceder al tracto respiratorio e intestinal. En el posnacimiento, las principales vías de infección son la contaminación del ombligo, ingestión o inhalación y secundarias a heridas. Sin embargo, es frecuente la dificultad en establecer una posible vía de infección (1,3,18).
Patogénesis
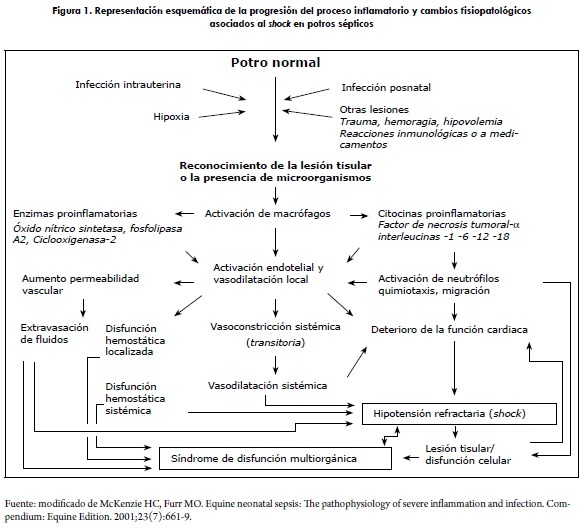
Existen dos fenómenos que confluyen y generan los diferentes signos clínicos en los potros sépticos: el shock y el SIRS (figura 1). Ambos fenómenos interactúan y confluyen en la muerte. Estos se tratarán de manera separada en el texto.
Shock
El shock o colapso cardiovascular es un estado de dishomeóstasis asociado a pérdida del volumen sanguíneo circulante efectivo, reducción del gasto cardiaco e inapropiada resistencia vascular periférica. Las causas son diversas e incluyen hemorragias severas, quemaduras, diarrea, trauma tisular y endotoxemia; sin embargo, los eventos fisiopatológicos son similares, independiente de la causa que lo desencadene (5).
Uno de los principales hallazgos en estados de shock es la hipotensión, la cual se explica por la disminución de la perfusión tisular, que lleva a hipoxia celular, a la activación del metabolismo energético anaeróbico y a la consecuente muerte celular. A pesar de que los eventos son graves, pueden ser reversibles siempre y cuando no se extiendan en el tiempo (5,19). El principal evento circulatorio inicial en la fisiopatología del shock es la maldistribución sanguínea. Esta es caracterizada por disminución de la resistencia vascular periférica con estancamiento de sangre en los tejidos periféricos y desencadenada por vasodilatación inducida neuralmente o por citocinas. Así, la dilatación sistémica de la vasculatura da por resultado el incremento del área micro-vascular, lo que produce disminución del volúmen circulante efectivo sin reducción de la volemia, lo cual produce hipoperfusión (5).
Fases y progresión del shock
Schulz y Drommer (8) describieron tres fases del shock: centralización, activación metabólica refleja e insuficiencia irreversible de la red vascular terminal. Por su parte, Mosier (20) lo divide en fase no progresiva, fase progresiva y estado irreversible.
El shock no progresivo se caracteriza por los mecanismos compensatorios de respuesta frente a la disminución del volumen circulante funcional y disminución de la presión vascular, que a su vez activa barorreceptores para la liberación de epinefrina y norepinefrina, que incrementa el gasto cardiaco y produce vasoconstricción arteriolar en la mayoría de los tejidos, en un intento de elevar la presión vascular. Los órganos que son seleccionados para conservar el flujo sanguíneo en mayor medida son el cerebro, el corazón y los riñones. Los receptores de volumen del atrio izquierdo junto con los osmorreceptores hipotalámicos ayudan a regular la presión por la alteración del balance de agua y sodio. La reducción del volumen plasmático estimula la activación de la hormona antidiurética (ADH) con la consecuente retención de agua y posterior activación de angiotensina II por el sistema renina-angiotensina; esto conlleva la retención de sodio por liberación de aldosterona. Al mismo tiempo, la ADH y la angiotensina II son vasoconstrictores que incrementan la resistencia periférica. La vasoconstricción también resulta de la liberación endotelial de endotelina, por la disminución de la temperatura, incremento del O2 o disminución del CO2. La presión microvascular disminuida de por resultado un aumento de movimiento de fluidos desde el intersticio al espacio intravascular para el incremento del volumen sanguíneo. Los resultados de esas respuestas incrementan la frecuencia cardiaca, el gasto cardiaco y la presión intravascular, mientras que el estímulo sea leve (5,21).
En el caso de que el estímulo sea severo y prolongado en el tiempo, se presenta la fase progresiva, en la que los mecanismos compensatorios son ineficientes. En este estado hay estancamiento de sangre e hipoxia tisular con lesión celular progresiva. El metabolismo aeróbico es ineficiente, por lo cual pasa a ser anaeróbico, reemplaza al piruvato por lactato en el ciclo de Krebs, y esto lleva a acidosis. Los metabolitos resultantes (adenosina y potasio) incrementan la osmolaridad local, la hipoxia y la concentración de CO2, lo cual produce vasodilatación. En el caso de shock séptico, estos eventos son exacerbados por la acción de citocinas proinflamatorias y moléculas vasoactivas. La disminución de las reservas de oxígeno y energía en la célula llevan a daño en los mecanismos de transporte de membrana, liberación de enzimas lisosomales con la consecuente necrosis, que unida a la liberación de mediadores, incluyendo la histamina, cininas, factor de activación plaquetaria (PAF), complemento, y citocinas (TNF, IL-1, IL-8, entre otras) lleva a la falla multiorgánica por medio del SIRS y a la alteración del sistema coagulación-fibrinólisis (5,22,23).
Determinar el punto exacto en el que el shock entra a la fase irreversible no es fácil. En las células, la acidosis metabólica que resulta del metabolismo anaeróbico inhibe los mecanismos enzimáticos para la producción de energía. Esa ineficiencia metabólica permite que se acumulen sustancias vasodilatadoras en los tejidos isquémicos y que haya un descenso mayor de la resistencia periférica y a su vez de la presión vascular. El evento es irreversible cuando se presenta el MODS, lo que afecta principalmente al pulmón, al hígado, al intestino, al riñón y al corazón. El punto final de la manifestación del shock es la CID que es una disfunción severa y paradójica de la homeóstasis, la cual es la expresión más severa del imbalance entre el sistema fibrinolítico y la coagulación, siendo esta la directa responsable de la falla multiorgánica por fenómenos de isquemia (5,24,25).
SIRS y endotoxemia
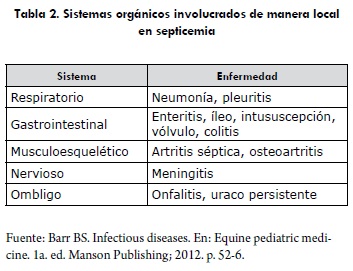
Una vez que el microorganismo penetra en el organismo, independiente de su naturaleza, se puede diseminar y provocar una infección sistémica (bacteremia, viremia, fungemia, parasitemia), o bien invadir un tejido concreto y provocar una infección local (artritis séptica, fisitis, neumonía, diarrea u onfalitis) (tabla 2) (1,3,11,26).
Cuando el antígeno se disemina por el torrente circulatorio va a desencadenar la activación del SIRS, lo cual desarrolla el fenómeno conocido como sepsis o septicemia. Teniendo en cuenta que la mayoría de los aislamientos en la sangre son bacterianos y dependiendo si la bacteremia es inducida por gramnegativas o positivas, la activación de la respuesta inflamatoria se llevará a cabo por subtipos de receptores tipo Toll, pero en todos los casos este receptor es el responsable de la iniciación de la cascada inflamatoria. En el caso de bacterias gramnegativas, las endotoxinas secretadas por estas son las responsables de la activación de este receptor. La activación de este receptor libera una señal intracelular mediada por el factor nuclear kβ (NF-kβ) que tiene como función la síntesis y liberación de sustancias tanto antiinflamatorias como proinflamatorias. Entre las primeras se destacan las interleucinas 4, 10 y 14; y entre las segundas el factor de necrosis tumoral alfa (TNFα), las interleucinas 1β y 6, el interferón gamma (INFϒ), las beta endorfinas, el factor de crecimiento transformante beta (TGFβ), las prostaglandinas, los radicales libres de oxígeno, el óxido nítrico y la endotelina 1. La liberación de estas sustancias proinflamatorias es la responsable de las alteraciones orgánicas observadas en potros con sepsis y, subsecuentemente, de los signos clínicos apreciados en estos. La respuesta defensiva del potro neonato ante la infección se basa en las inmunoglobulinas adquiridas por medio del calostro maternal, las cuales actúan como neutralizadoras, y en una respuesta celular inmadura por parte de los neutrófilos (1,15,16,27,28).
Características clínicas y morfológicas
Las características clínicas son rápidamente progresivas e incluyen hipotensión, pulso débil, taquicardia, hiperventilación con estertores, oliguria e hipotermia o fiebre (5,11,14). Las lesiones macroscópicas son variables dependiendo del estímulo desencadenante y de su naturaleza. La presencia de hemorragias petequiales, equimóticas y efusión de líquidos a cavidades es característica y se asocia al daño vascular severo, en el que los cambios degenerativos y la necrosis en la pared de los vasos y en endotelios son características de animales con shock séptico que a su vez muestra en el microscopio la presencia de microtrombos en varios órganos que explican el evento de CID (5,29).
CONCLUSIÓN Y PERSPECTIVAS EN COLOMBIA
Los mecanismos de patogenicidad de la septicemia neonatal en potros son complejos, y a pesar del avance de la terapéutica en medicina veterinaria, persiste la morbilidad y mortalidad en animales en sus primeros días de vida, por lo cual es importante que los clínicos y los patólogos veterinarios conozcan el comportamiento del síndrome. Para el país no existen reportes epidemiológicos serios del complejo de sepsis neonatal equina; sin embargo, Castillo y Oliver (30) reportan artritis séptica en animales jóvenes y la asocian a este complejo en su infección localizada, apartándolo de forma relativa al síndrome séptico sistémico. Por eso es muy imprescindible promover los estudios retrospectivos del síndrome en clínicas veterinarias de grandes animales y en centros de diagnóstico, con el fin de resaltar el comportamiento de la enfermedad y establecer los datos epidemiológicos. La población equina del país también es adecuada para la implementación de estudios prospectivos con el objeto de aportar datos en tiempos cortos y analizándolos en el futuro. La especie equina debe ser tenida en cuenta en el sentido estricto de la investigación, pues la prevalencia del síndrome de sepsis neonatal, además de otras enfermedades, tiene alta importancia en la casuística, y teniendo en cuenta la variedad de funciones zootécnicas de la especie, debe ser estudiada con el rigor que merece.
REFERENCIAS
1. Barr BS. Infectious diseases. En: Equine pediatric medicine. 1a. ed. Manson Publishing; 2012. p. 52-6. [ Links ]
2. Cohen ND. Causes of and farm management factors associated with disease and death in foals. J Am Vet Med Assoc. 1994;204(10):1644-51. [ Links ]
3. Furr MO. Systemic inflammatory response syndrome, sepsis, and antimicrobial therapy. Clin Tech Equine Pract. 2003;2(1)3-8. [ Links ]
4. Richter C, Lohmann K. Failure of passive transfer in foals: A review. Large Animals Veterinary Rounds. 2005; 5(10):107-11. [ Links ]
5. Marsh PS, Palmer JE. Bacterial isolates from blood and their susceptibility patterns in critically ill foals: 543 cases (1991-1998). J Am Vet Med Assoc. 2001;218(10):1608-10. [ Links ]
6. McKenzie HC, Furr MO. Equine neonatal sepsis: The pathophysiology of severe inflammation and infection. Compendium: Equine Edition. 2001; 23(7):661-9. [ Links ]
7. Sanchez LC, Lester GD. Equine neonatal sepsis: microbial isolates, antimicrobial resistance, and short and long term outcomes. Procedente de The 18th Annual American College of Veterinary Internal Medicine Forum; 2000. Seattle, WA. p. 223-4. [ Links ]
8. Schulz L, Drommer W. Fisiopatología del shock. En: Tratado de anatomía patológica general para veterinarios y estudiantes de veterinaria. 9a. ed. Barcelona: Editorial Labor; 1985. p. 263-71. [ Links ]
9. MacKay RJ. Inflammation in horses. Vet Clin North Am Equine Pract. 2000;6(1):15-27. [ Links ]
10. Powell DG, Donahue M, Ferris K. An epidemiologic investigation of equine salmonellosis in central Kentucky during 1985 and 1986. En: Equine infectious diseases. Powell DG, editor; 1988. p. 231-5. [ Links ]
11. Raidal SL. The incidence and consequences of failure of passive transfer of immunity on a thoroughbred breeding farm. Aust Vet J. 1996;73(6):201-9. [ Links ]
12. Sanchez CL. Equine neonatal sepsis. Vet Clin North Am Equine Pract. 2005;21(2): 273-93. [ Links ]
13. McClure JJ, Addison JD, Miller RI. Immunodeficiency manifested by oral candidiasis and bacterial septicemia in foals. J Am Vet Med Assoc. 1985;186(11):1195-7. [ Links ]
14. Hopper K, Bateman S. An updated view of hemostasis: mechanisms of hemostatic dysfunction associated with sepsis. J Vet Emerg Crit Care. 2005;15(2)83-91. [ Links ]
15. Lester GD. Manifestations and management of disease in foals. En: Large animal internal medicine. 4a. ed. Philadelphia: Mosby Elsevier. 2009; p. 293-5. [ Links ]
16. Russel CM, Axon JE, Blishen A, Begg AP. Blood culture isolates and antimicrobial sensitivities from 427 critically ill neonatal foals. Aust Vet J. 2008; 86(7):266-71. [ Links ]
17. Welty W, Carraway MS, Miller DL, Ortel TL, Ezban M, Ghio AJ, et al. Coagulation blockade prevents sepsis-induced respiratory and renal failure in baboons. Am J Respir Crit Care Med. 2001; 164(10 Pt 1):1988-96. [ Links ]
18. Wilkins PA. Disorders of the foal. En: Equine internal medicine. 3a. ed. Philadelphia: Saunders Elsevier; 2010. p. 1311-63. [ Links ]
19. Robinson JA, Allen GK, Green EM, Fales WH, Loch WE, Wilkerson CG. A prospective study of septicaemia in colostrum deprived foals. Equine Vet J. 1993;25(3):214-9. [ Links ]
20. Mosier DA. Vascular disorders and thrombosis. En: Zachary JF y McGavin MD. Pathologic basis of veterinary disease. 5a ed. Elsevier; 2012. p. 86-8. [ Links ]
21. Vaala WE, House JK, Lester GD. Neonatal infection. En: Large animal internal medicine. 4th ed. Mosby Elsevier. 2009; p. 281-92. [ Links ]
22. Boschler PN, Slauson DO. Inflammation and repair tissue. En: Mechanisms of disease. A text book of comparative general pathology. 3a. ed. St. Louis, MO. Mosby; 2002. p. 193-5. [ Links ]
23. Stewart AJ, Hinchcliff KW, Saville WJ, Jose-Cunilleras E, Hardy J, Kohn CW, et al. Actinobacillus sp bacteremia in foals: clinical signs and prognosis. J Vet Intern Med. 2002;16(4) :464-71. [ Links ]
24. Barton MH, Morris DD, Norton N, Prasse KW. Hemostatic and fibrinolytic indices in neonatal foals with presumed septicemia. J Vet Intern Med. 1998;12(1):26-35. [ Links ]
25. Clabough DL, Levine JF, Grant GL. Factors associated with failure of passive transfer of colostral antibodies in Standard bred foals. J Vet Intern Med. 1991;(5)335-40. [ Links ]
26. Wilson W, Madigan J. Comparison of bacteriologic culture of blood and necropsy specimens for determining the cause of foal septice-mia: 47 cases (1978-1987). J Am Vet Med Assoc. 1989;195(12):1759-63. [ Links ]
27. Barton MH. Septicemia. En: Equine neonatal medicine: A case-based approach. Oxford: Saunders Elsevier; 2006. p. 75-97. [ Links ]
28. Brever BD. Neonatal infection. En: Equine clinical neonatology. Philadelphia: Lea & Febiger; 1990. p. 295-316. [ Links ]
29. Koterba A, Brewer B Tarplee. Clinical and clinicopathological characteristics of the septicemic neonatal foal: Review of 38 cases. Equine Vet J. 1984;16(4):376-83. [ Links ]
30. Castillo I, Oliver OJ. Artritis séptica en equinos. Reporte de 11 casos (2000-2004). Rev Med Vet Zoot. 2009;(56):41-52. [ Links ]