Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.29 Bogotá Jan./June 2015
Determinación del tiempo de lisis del coágulo humano (in vitro) con el plasminógeno/plasmina de cuatro especies:
humano, bovino, caprino y porcino
Determining Human Clot Lysis Time (in vitro) with Plasminogen/Plasmin from Four Species (Human, Bovine, Goat, and Swine)
Determinação do tempo de lise do coágulo humano (in vitro) com o plasminogênio/plasmina de quatro espécies:
humano, bovino, caprino e suíno
Omaira Cañas Bermúdez1 / Diego Andrés Rojas2 / Luis Fernando Arbeláez Ramírez3
1 MSc. Bioquímica. Grupo de investigación en Química, Universidad de Pamplona, Colombia.
omairacbermudez@hotmail.com
2 Químico. Miembro del Grupo de Investigación en Química, Universidad de Pamplona, Colombia.
lrojasdiegol@gmail.com
3 PhD, MSc. Docente asociado, Facultad de Salud, Universidad de Pamplona, Colombia.
lui.ferar@hotmail.com
Recibido: 26 de agosto del 2014 / Aceptado: 1 de octubre del 2014
Cómo citar este artículo: Cañas Bermúdez O, Rojas DA, Arbeláez R amírez JF. Determinación del tiempo de lisis del coágulo humano (in vitro) con el plasminógeno/plasmina de cuatro especies: humano, bovino, caprino y porcino. Rev Med Vet. 2015;(29):11-22.
Resumen
Las enfermedades cardiovasculares son la primera causa de muerte en todo el mundo, entre las cuales las anomalías del sistema del plasminógeno/plasmina son un factor importante en la deficiente lisis de los coágulos sanguíneos. En esta investigación se estudió el sistema fibrinolítico en cuatro especies de mamíferos, entre las que se identificó el plasminógeno humano como el más eficiente en cuanto a su poder trombolítico. Se investigó y se identificó el plasminógeno entre cuatro especies (humano, bovino, caprino y porcino) más eficiente en la lisis del coágulo humano in vitro. Los plasminógenos fueron purificados de forma idéntica por cromatografía de afinidad. El fibrinógeno humano se purificó por fraccionamiento con etanol. Tanto la purificación del plasminógeno como la del fibrinógeno se caracterizaron por electroforesis unidimensional SDS-PAGE al 10 %. La formación del coágulo humano, in vitro, así como su disolución por el plasminógeno/plasmina consistió en la determinación del tiempo de lisis desde la formación del coágulo hasta su dilución. La purificación de las proteínas arrojó una pureza mayor al 95 %; el del plasminógeno humano demostró mayor capacidad de lisis del coágulo que los plasminógenos de los animales. Se determinó que la mayor catálisis y eficiencia corresponden al plasminógeno/plasmina humano, que disuelve el coágulo humano hasta tres veces más rápido que las especies irracionales.
Palabras clave: plasminógeno, plasmina, trombina, activador tisular del plasminógeno, lisis.
Abstract
Cardiovascular disease is the leading cause of death worldwide, including failures in the plasminogen/plasmin system which is an important factor in poor lysis of blood clots. This article studies the fibrinolytic system in four species of mammals, and it identifies human plasminogen with highest thrombolysis efficiency. It examines plasminogen from four species (human, bovine, goat, and swine) and identifies the most efficient one in human clot lysis in vitro. All plasminogens were identically purified by affinity chromatography. Human fibrinogen was purified by fractionation with ethanol. The purification of both plasminogen and fibrinogen was characterized by one-dimensional SDS-PAGE (10%). Human clot formation in vitro and its dissolution by plasminogen/plasmin consisted of determining lysis time from clot formation to its dilution. Purification of proteins showed greater than 95% purity, human plasminogen showed greater ability to lyse clot than animal plasminogen. The article concludes that human plasminogen/plasmin has the greatest catalysis and efficiency, as it dissolves human clot up to three times faster than that of irrational species.
Keywords: plasminogen, plasmin, thrombin, tissue plasminogen activator, lysis.
Resumo
As doenças cardiovasculares são a primeira causa de morte em todo o mundo, entre as quais as anomalias do sistema do plasminogênio/plasmina são um fator importante na deficiente lise dos coágulos sanguíneos. Nesta pesquisa se estudou o sistema fibrinolítico em quatro espécies de mamíferos, entre as que se identificou o plasminogênio humano como o mais eficiente em quanto ao seu poder trombolítico. Realizou-se uma pesquisa e se identificou o plasminogênio entre quatro espécies, (humano, bovino, caprino e suíno) mais eficiente na lise do coágulo humano in vitro. Os plasminogênios foram purificados de forma idêntica por cromatografía de afinidade. O fibrinogênio humano se purificou por fracionamento com etanol. Tanto a purificação do plasminogênio como a do fibrinogênio se caracterizaram por eletroforese unidimensional SDS-PAGE a 10 %. A formação do coágulo humano, in vitro, assim como sua dissolução pelo plasminogênio/plasmina consistiu na determinação do tempo de lise desde a formação do coágulo até a sua diluição. A purificação das proteínas mostrou uma pureza maior a 95 %, o do plasminogênio humano demonstrou maior capacidade de lise do coágulo que os plasminogênios dos animais. Determinou-se que a maior catálise e eficiência correspondem ao plasminogênio/plasmina humana, que dissolve o coágulo humano até três vezes mais rápido do que as espécies irracionais.
Palavras chave: plasminogênio, plasmina, trombina, ativador tissular do plasminogênio, lise.
INTRODUCCIÓN
Las enfermedades cardiovasculares (ECV) son la principal causa de muerte en todo el mundo. Cada año mueren más personas por estas enfermedades que por cualquier otra causa. Se calcula que en 2008 murieron 17,3 millones de personas, lo cual representa un 30 % de todas las muertes registradas en el mundo; 7,3 millones de esas muertes se debieron a la cardiopatía coronaria. Las muertes por ECV afectan por igual a ambos sexos y más del 80 % se producen en países de ingresos bajos y medios. Se calcula que en 2030 morirán cerca de 23 millones de personas por ECV, sobre todo por cardiopatías, y se prevé que sigan siendo el principal motivo de muerte (1). Las causas más importantes de cardiopatías son: una dieta inadecuada, la inactividad física, el consumo de tabaco y alcohol; por otro lado, también se encuentra el mal funcionamiento del sistema plasminógeno/plasmina para disolver el trombo, ya que deja grandes residuos adheridos en las paredes endoteliales y otros circulando que pueden provocar diversas enfermedades del sistema circulatorio.
La hemostasia es un mecanismo esencial de protección que depende del balance delicado entre los procesos procoagulantes y anticoagulantes, y comprende los procesos de coagulación sanguínea regulados estrictamente, la activación plaquetaria y la reparación vascular. La hemostasia promueve como su función principal la cascada de la coagulación, la cual además limita la pérdida de sangre, y responde a daños tisulares (2). La cascada de la coagulación ha sido clásicamente entendida como dos vías convergentes activadas: la una, por la vía de contacto del sistema de proteinasas, factor XII, precalicreína y cininógeno de alto peso molecular; la otra, por la activación del factor VII y X, cuando el factor tisular se expone a los daños vasculares (3-5), los procesos de formación del trombo son regulados simultáneamente por el sistema fibrinolítico, lo cual previene la formación de coágulos que induzcan una trombosis intravascular masiva. El plasminógeno, el activador tisular del plasminógeno (t-PA) y la α2-antiplasmina (α2-AP) se incorporan dentro del coágulo mientras se forma (6).
El plasminógeno es una serinproteasa sintetizada en el hígado, constituida por 791 aminoácidos (a. a.) (7). Se organiza en siete dominios estructurales que comprenden un péptido de preactivación (1-77), cinco dominios kringles con secuencias homólogas y un dominio de proteínas, que comprende los residuos a. a. 562-791. Los kringles contienen lugares de unión a la lisina (LBS) y amino hexil que desempeñan un papel crucial en el reconocimiento de la fibrina, de la superficie celular y de la α2-AP.
El gen humano para el plasminógeno se localiza en el brazo largo del cromosoma 6, en las bandas q26 o q27, y la longitud del gen es de 52,5 kb; cada uno de los 5 kringles está formado por 2 exones separados por un único intrón en el medio de cada estructura. El gen está estrechamente relacionado con el de la apoproteína (a). El plasminógeno se convierte a plasmina por la hidrólisis de una unión peptídica entre los a. a. Arg561-Val562. El peso molecular del plasminógeno es de 92 kDa y el de la plasmina de 85 kDa. La concentración plasmática del plasminógeno es de 200 mg/L (8). El plasminógeno se convierte en plasmina por la acción de los activadores t-PA o el activador del plasminógeno tipo urocinasa (u-PA); en el primero, esto solo ocurre de forma eficiente en la superficie de la fibrina, en la que el activador y el plasminógeno están juntos. La función principal de la plasmina es la degradación de la fibrina insoluble que conforma el trombo a productos solubles de degradación de la fibrina (FDP, por sus siglas en ingles); sin embargo, también actúa sobre otros substratos constituyentes de la matriz extracelular, como son el colágeno IV y V, proteoglicanos, laminina, fibronectina y vitronectina. También puede activar in vitro las metaloproteinasas de matriz (MMP) latentes, como la I, III, IX, X, XIII (9-11), elastasas, factores de crecimiento del tipo TGF-β (12) o el bFGF (13), lo que lo libera de la matriz a la que está unido en forma latente. bFGF es proangiogénico y "up"-regulador de u-PA, PAI-1 y de la expresión de gelatinasas (14) e inhibe la expresión de TIMP-2 (inhibidor endógeno de MMPs, tipo 2) (15). La plasmina libre en sangre es inactivada rápidamente por α2-AP; su vida media es de 0,1 s. La plasmina generada en la superficie de la fibrina está parcialmente protegida de esta inactivación, ya que los LBS importantes en la interacción entre la plasminógeno/plasmina y la fibrina están fuera del alcance de la α2-AP. Se han descrito receptores celulares con alta afinidad para unir el plasminógeno/plasmina en varios tipos celulares, incluyendo células endoteliales (16). Esta unión está mediada por los LBS de los kringles 1 -3 de la molécula del plasminógeno/plasmina, lo cual la protege también de la inhibición por la α2-AP. Si los LBS de la plasmina están ocupados, la acción de la α2-AP es 50 veces menor.
El mecanismo que media el t-PA está envuelto inicialmente en la homeostasis de la fibrina, mientras el de la u-PA parece implicar además fenómenos como la migración o la remodelación de tejidos. Como consecuencia de este papel dual, tal vez el nombre que insinuaría mejor el sistema fibrinolítico sería el de sistema del plasminógeno/plasmina. El plasminóge-no se ha encontrado en otros sistemas fisiológicos como reparación ósea (17), en la penetración del espermatozoide al ovocito, lo cual reduce la fertilización de este (18). La importancia del plasminógeno/plasmina en diferentes sistemas fisiológicos del humano ha hecho que nuestro grupo de investigación purifique esta molécula en diferentes especies (1925), y en este estudio se determina la capacidad de estos plasminógenos de lisis del coágulo humano, como objetivo central de este trabajo.
MATERIALES Y MÉTODOS
Equipos
Espectrofotómetro (ThermoScientific), balanza analítica (Ohaus), centrífuga (Jouan), cromatógrafo (Bio-Rad), freezer (Jouan), electroforesis (Bio-Rad), computador (IBM), hielera (Scotsman), agitador y magneto (ABC), bomba de vacío (LIC), mangera de diálisis (Fisherbrand), cronómetro (Casio), baño serológico (Memmert), bolsas para extracción sanguínea (Terumo).
Reactivos
0,1 M fosfato di sódico pH 7,3 (Merck) / 0,15 M cloruro de sodio (Merck), 0,05 M de ácido 6-aminohe-xanoico (Sigma) en fosfato disódico 0,1 M (Merck) / cloruro de sodio 0,15 M / pH 7,3 (Merck), ácido 6-aminohexanoico (Sigma) 1 M / etanol (Riedelde-Haën), 6,5 % / citrato trisódico 0,055 M pH 6,0 (Analyticals), glicina 1M (Bio-Rad) / etanol 6,5 % / citrato trisódico 0,055 M pH 6,0, citrato trisódico 0,055 M, pH 6,35, cloruro de sodio (Merck) 0,3 M, urea 6,6 M (Riedel-de-Haën)/hidróxido de sodio 0,2 M (Riedel-de-Haën), glicina (Bio-Rad) 1 M. Etanol 99,9 %, acetato de sodio anhídrido al 0,8 M pH 4,0, 0,1 tampón fosfato/0,1 g/l tween 80 (Merck) / pH 7,3 (solución tampón de lisis), 0,05 % azida de sodio. 0,07 M Tris/0,22 M cloruro de sodio/pH 7,5. 0,14 M de aprotinina, 1 mM de fenilmetilsulfonil fluoruro (PMSF), 0,1 M carbonato disódico (Riedel-de-Haën) / 6 M urea, 10 % de dodecil sulfato de sodio (SDS) (Fluka), Tris (hidroximetil) aminometano (Bio-Rad), ácido clorhídrico (Fabroquim), azida sódica (Merck), fluoruro de fenil-metilsulfonico (Fluka), dimetilsulfóxido (DMSO) (Riedel-de-Haën), aprotinina (Sigma), lisina-sefarosa 4B (healthymagination), ácido acético (Riedel-de-Haën), acrilamida (Fluka), N,N'-metileno-bis-acrilamida (Bio-Rad), persulfato de amonio (Riedel-de-Haën), 2-mercaptoetanol (Biorad), glicerol (ICN Biomedicals Inc.), azul de bromofenol (Riedel-de-Haën), N,N,N',N'-tetra-metil-etilendiamina (Bio-Rad), ácido etilendiaminotetraacetato disódico dihidratado (Riedel-de-Haën), activador tisular del plasminógeno humano recombinante (Prospec), trombina humana (Prospec), agua tipo 1 del Laboratorio de Investigación en Química (LIQ), azul de metileno (Bio-Rad). Marcador de peso molecular: 180 kDa (α2-macroglobulina humana), 92 kDa (glu-plasminógeno humano), 66 kDa (cadena α fibrinógeno humano), 52 kDa (cadena β fibrinógeno humano), 46 kDa (cadena γ fibrinógeno humano) y 23 kDa (Tripsina) del LIQde la Universidad de Pamplona (Colombia).
Toma y procesamiento de muestras
El plasma humano fue obtenido del hospital Erasmo Meoz de Cúcuta, Colombia, analizado y certificado libre de antígenos como hepatitis, VIH, Chagas y otras enfermedades infecciosas. Las muestras sanguíneas de los animales de las tres especies se tomaron en la granja experimental Villa Marina, propiedad de la Universidad de Pamplona, por un médico veterinario; se utilizaron bolsas para extracción sanguínea con solución anticoagulante de citrato, fosfato, dextrosa y adenina (CPDA-1). A la sangre obtenida de esta manera se le añadió PMSF disuelto en DMSO, a una concentración final de 1 mM, con el fin de inhibir la actividad serinproteasa. Las muestras se mantuvieron refrigeradas y fueron centrifugadas antes de 2 h.
Las muestras sanguíneas de las tres especies animales se centrifugaron a 7000 r.p.m. durante 15 min a 4 °C e inmediatamente se separó el plasma y se refrigeró a -80 °C hasta su posterior uso. A partir de las muestras sanguíneas separadas, se procedió a purificar tanto el plasminógeno como el fibrinógeno.
Purificación de los cuatro plasminógenos por cromatografía de afinidad
Los plasminógenos de las cuatro especies fueron purificados por cromatografía de afinidad en lisina-sefarosa según el método de cromatografía de afinidad de Cañas y colaboradores (19-25), en una columna de 15 x 2,5 cm (Biorad), equilibrada con tres volúmenes de la solución tampón 0,1 M fosfato disódico pH 7,3 (Merck)/0,15 M cloruro de sodio, a una rata de flujo de 2 ml/min.
En la purificación del plasminógeno humano se aplicaron 325 ml de plasma en la columna de cromatografía y se lavó con 250 ml de la soluciónn 0,1 M fosfato disódico pH 7,3 (Merck) / 0,15 M cloruro de sodio, hasta que la absorbancia A280 fue < 0,01 UA. Consecutivamente se eluyó con 120 ml de solución 0,05 M de ácido 6-aminohexanoico (Sigma) en fosfato disódico 0,1 M y se colectó en fracciones de 3 ml en cada tubo. La concentración fue determinada utilizando el coeficiente absorción de 1,6 (26). El plasminógeno fue concentrado en una celda amicón utilizando membranas de celulosa regenerada de 10 kDa. El plasma des-plasminogenado se guardó a -80 °C hasta su uso posterior.
Los plasminógenos de las especies porcino, bovino y caprino se purificaron siguiendo el mismo procedimiento utilizado en la purificación del plasminógeno humano.
Purificación del fibrinógeno
El fibrinógeno fue purificado de plasma desplasminogenado de acuerdo al método de Blömback y Blömback (27). En resumen: el plasma fue precipitado 6 veces utilizando diferentes concentraciones de etanol frío, mezclando constantemente el precipitado centrifugado y lavado con etanol frío en cada una de las precipitaciones; la preparación de fibrinógeno se disolvió en solución tampón PBS y su concentración determinada a A282 nm, y se utilizó como coeficiente de extinción ε1% = 15 (27,28). La solución de fibrinógeno fue porcionada y conservada a -80°C.
Caracterización del fibrinógeno y los plasminógenos por electroforesis SDS-PAGE al 10 %
La electroforesis SDS-PAGE al 10 % se realizó de acuerdo al método de Laemmli (29). Las muestras de plasminógeno y fibrinógeno fueron mezcladas buffer de muestra en un volumen 1:1 (vol/vol); luego fueron tratadas térmicamente por 5 min a 100 °C. Las muestras se sirvieron en los pozos del gel y se corrieron a 0,02 A, durante aproximadamente 60 min. Las proteínas fueron visualizadas utilizando la coloración de azul brillante de Coomassie. Como estándar se utilizó un marcador de peso molecular producido por el grupo de investigación en Química de la Universidad de Pamplona (véase sección de "Materiales y métodos").
La pureza de los plasminógenos y de los fibrinógenos se determinó con el software de uso libre ImageJ, de dominio público, desarrollado en la National Institutes of Health (30,31).
Diálisis del fibrinógeno y los plasminógenos
Se dializó el fibrinógeno y los plasminógenos de las cuatro especies, tres veces por 2 h en la solución tampón de Lisis (1:100 v/v) y por último se dejó en manguera de diálisis, toda la noche, a 4 °C.
La preparación final se conserva a -80 °C, hasta su posterior uso.
Dilución de las proteínas con la solución tampón de lisis
El fibrinógeno humano se llevó a una concentración final de 2 mg/ml, los plasminógenos de las cuatro especies se llevaron a una concentración final de 0,32 mg/ml. El t-PA se diluyó a una concentración final de 200 IU/ml. La trombina humana se llevó a una concentración final de 100 IU/mL.
Formación y lisis del coágulo humano (in vitro) con los plasminógenos/plasminas de las cuatro especies
Se adicionaron 250 µL de fibrinógeno (2 mg/mL) en un tubo de ensayo y se incubó a 0 °C. Se inició el cronómetro. A los 15 s se agregaron 100 µL de plasminógeno (0,32 mg/mL); a los 30 s se agregaron 100 µL de t-PA (200 IU/mL). Pasados 45 s se agregó 50 µL de trombina (100 IU/ml). Se agitó vigorosamente por 15 s para la formación de burbujas y se incubó a 37 °C. Se pausó el cronómetro al momento en que la última burbuja salió a la superficie. Este procedimiento se realizó por triplicado para cada plasminógeno.
RESULTADOS
Purificación de los cuatro plasminógenos por cromatografía de afinidad
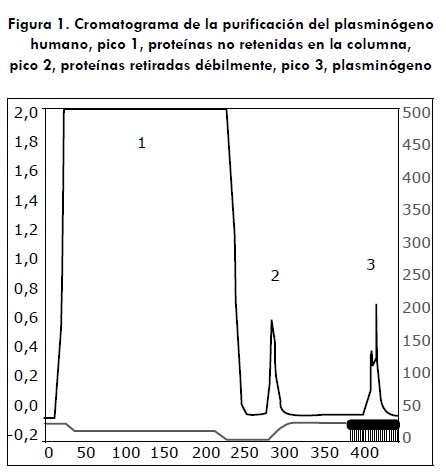
En la figura 1 se observa el cromatograma de la purificación del plasminógeno humano. La línea azul indica la A280 y la roja la conductividad. En el primer pico se eluye con el lavado todas las proteínas del plasma, excepto el plasminógeno. En el segundo pico se eluyen proteínas que se adhieren a la matriz débilmente. El tercer pico presupone la elusión del plasminógeno. De igual forma, se purificaron los plasminógenos de las tres especies animales.
Caracterización electroforética de los plasminógenos
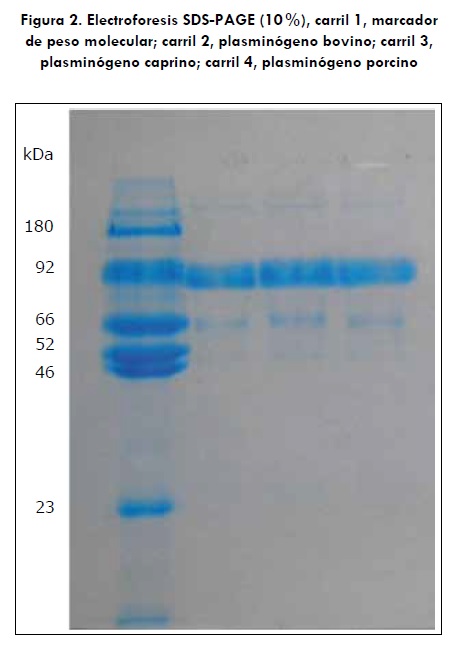
En la figura 2 se visualiza en el carril 1 el marcador de peso molecular (véase sección de "Materiales y métodos"), donde se observa la banda del plasminógeno humano (segunda banda del marcador), carril 2: plasminógeno bovino, carril 3: plasminógeno caprino, carril 4: plasminógeno porcino, todos con un peso molecular de 92 kDa.
Densitometría de la electroforesis del plasminógeno humano
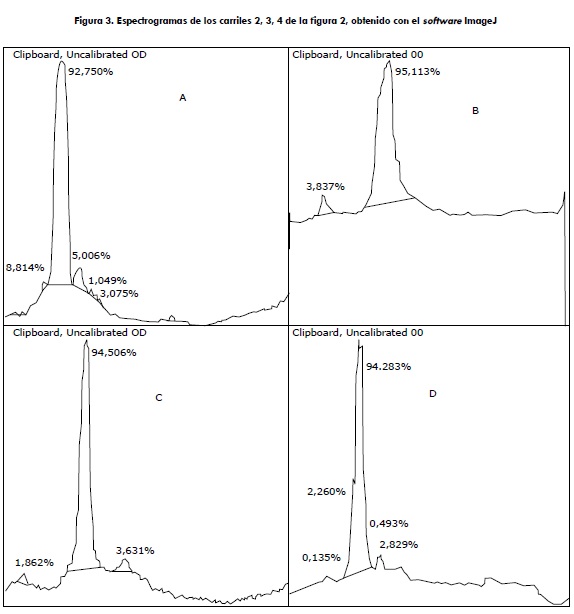
En la figura 3 se observa el escaneo de las bandas de los plasminógenos, para determinar su pureza; varias impurezas con porcentajes insignificantes fueron detectadas. Para los plasminógenos se obtuvo unas purezas de: humano 93 % (figura 3A), bovino 95 % (figura 3B), caprino 94,3 % (figura 3C) y porcino 95 % (figura 3D).
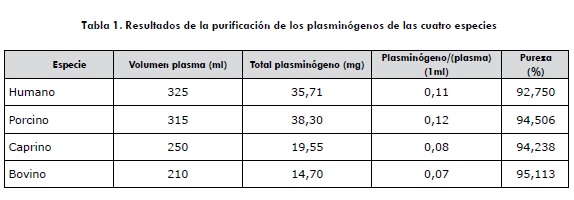
Los diferentes resultados de las purificaciones de los cuatro plasminógenos fueron recopilados en la tabla 1, en la que se pueden observar las cantidades de plasminógeno en miligramos de cada especie, el total de plasma utilizado y los miligramos obtenidos por mililitros de plasma.
Purificación del fibrinógeno
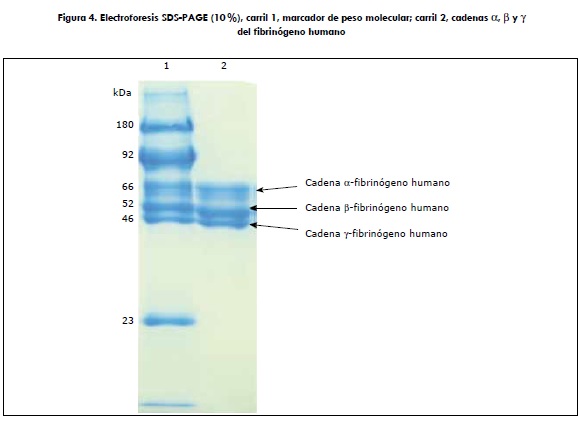
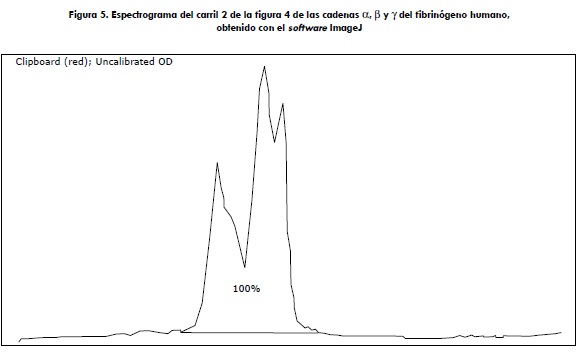
La figura 4 muestra la electroforesis del fibrinógeno purificado; en el carril 2 se pueden visualizar las tres típicas bandas del fibrinógeno, (α, β y γ ) de 66, 52 y 46 kDa, respectivamente, las cuales coinciden a la perfección con las del marcador en el carril 1 (véase la sección "Materiales y métodos"). Estas bandas fueron sometidas a densitometría, como se demuestra en la figura 5, en la cual no se encontraron contaminantes, la pureza que fue determinada en un 100 %.
Tiempo de lisis del coágulo humano con el plasminógeno/plasmina de las cuatro especies
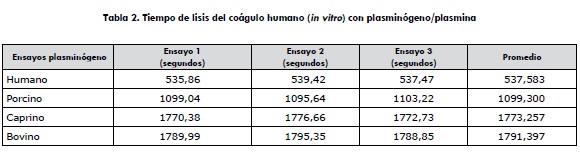
La tabla 2 muestra las determinaciones por triplicado de las lisis de los cuatro plasminógenos, en los que los resultados indican que el plasminógeno humano toma menor tiempo en la disolución del coágulo, comparado con los plasminógenos de los animales, los cuales toman hasta tres veces más tiempo en su disolución.
DISCUSIÓN
Los problemas cardiovasculares han sido estudiados en el contexto global y se ha demostrado que siguen aumentando (32). La causa inmediata de las enfermedades cardiovasculares es la oclusión por un coágulo de un vaso sanguíneo de importancia, siendo vital la disolución rápida del coágulo. En este proceso están incluidas varias proteínas del sistema fibrinolítico, fibrinógeno, t-PA y plasminógeno. Estas proteínas pueden ser determinadas cuantitativamente y de forma individual, además se pueden utilizar como marcadores de la fibrinólisis. En estudios previos de este laboratorio, se estudiaron ocho plasminógenos de especies diferentes, incluyendo la humana (19-25), en la que se demostró que la afinidad del plasminógeno humano por el sustrato cromogénico hecho específicamente para este plasminógeno era menor que la afinidad de los plasminógenos animales por el mismo sustrato cromogénico. Este hecho llevó a plantear el presente estudio, mediante el cual se demostró que el plasminógeno/plasmina humano es el más eficiente en disolver el coágulo (in vitro) que el de las otras tres especies animales estudiadas, lo cual supera a la especie porcina dos veces y a la caprina y bovina tres veces. Se esperaba que el plasminógeno/plasmina de las especies animales fuera más eficiente en disolver el coágulo (in vitro), teniendo en cuenta que el plasminógeno/plasmina de los animales tiene mayor afinidad por el sustrato cromo-génico (14-20).
Se hipotetizó, por tener la menor afinidad hacia el sustrato cromogénico, que el humano era el más afectado por las ECV que las demás especies. Los resultados aquí obtenidos demuestran que el plasminógeno/plasmina humano requiere del menor tiempo para disolver el coágulo (in vitro), de lo cual se puede deducir que el hecho de que tenga menos afinidad por el sustrato no significa que sea menos eficiente en la disolución del coágulo (in vitro) como se creyó al determinar las afinidades de los plasminógenos/plasminas de ocho especies (19-25). Desafortunadamente, no se conocen estudios estadísticos en los animales sobre la prevalencia de ECV en estos, los cuales se podrían realizar en aquellos animales que acompañan al humano durante toda su vida, como el equino, el canino y el felino, ya que los demás animales en el estudio se les acorta la vida para usarlos como alimentación de los humanos.
No obstante, el hecho de que el humano tenga menor afinidad por el sustrato y mayor eficiencia en la disolución del coágulo no significa que el humano no siga siendo la especie más amenazada por los problemas cardiovasculares y tromboticos, ya que si bien demostró mayor eficiencia en la lisis del coágulo (in vitro), el trombo probablemente es más grande cuando es detectado por el plasminógeno/plasmina humano, que el trombo de los animales, puesto que, como se demostró (19-25), estos tienen mayor afinidad. Esto se debe interpretar como una detección temprana de la aparición de coágulos en la circulación de los animales, por parte del sistema plasminógeno/plasmina, lo cual minimiza el riesgos de una obstrucción. Resta demostrar la importancia de una alta afinidad frente a una mayor eficiencia en la disolución del coágulo por los plasminógenos/plasminas. Por lógica, podría esperarse que una temprana detención del coágulo sería mejor que una rápida disolución de este, ya que cuanto más alta es la afinidad, más pequeño es el coágulo al ser detectado por los plasminógenos animales y hay menor probabilidad de un desprendimiento y taponamiento de las arterias.
AGRADECIMIENTOS
A la Universidad de Pamplona en Colombia, por el financiamiento de esta investigación. Se agradece la donación del plasma humano al Hospital Universitario Erasmo Meoz de Cúcuta, Colombia.
CONFLICTO DE INTERESES
En el presente artículo no se presentaron conflicto de interés.
Referencias
1. World Health Organization, Ala A. Global status report on noncommunicable diseases. Ginebra. Library Cataloguing-in-Publication Data; 2011. p. 9-27. [ Links ]
2. Mc Michael M. New models of hemostasis. Top Companion Anim Med. 2012;27(2):40-5. [ Links ]
3. Nigel M. The role of tissue factor and factor VIIa in hemostasis. Anesth Analg. 2009;108(5):1447-52. [ Links ]
4. Hoffman M, Monroe DM. Coagulation 2006: a modern view of hemostasis. Hematol Oncol Clin North Am. 2007;21(1):1-11. [ Links ]
5. Colman RW. Contact activation pathway: inflammatory, firinolytic, anticoagulant, antiadhesive and antiangiogenic activities. in: Haemostasis and thrombosis: Basic principles and clinical practice. Philadelphia: J. B. Lippincott Willians and Wilkins; 2001. p. 103-122. [ Links ]
6. Cesarman-Maus G, Hajjar KA. Molecular mechanisms of fibrinolysis. Br J Haematol. 2005;129(3): 307-21. [ Links ]
7. Kouemo S, Mcmillan E, Doctor V. Mechanism of synergistic effect between oversulfated chondroitin-6-sulfate and lysisne or 6-aminohexanoic acid in enhancing the in-vitro activation of glutamic plasminogen by tissue plasminogen activator or urokinase. Blood Coagul Fibrinolysis. 2010;21(5):425-30. [ Links ]
8. Collen D. The plasminogen (fibrinolytic) system. Thromb Haemost. 1999;82(2):259-70. [ Links ]
9. Deryugina EI, Quigley JP. Cell surface remodeling by plasmin: A new function for an old enzyme. J Biomed Biotechnol. 2012;1-21. [ Links ]
10. Kessenbrock K, Plaks V, Werb Z. Matrix metallo-proteinases: regulators of the tumor microenvironment. Cell. 2010;141(1):52-67. [ Links ]
11. Zhu JY, Pang ZJ, Yu YH. Regulation of trophoblast invasion: the role of matrix metalloproteinases. Rev Obstet Gynecol. 2012;5(3-4):e137-e143. [ Links ]
12. Briassouli P, Rifkin D, Clancy RC, Buyon JP. Binding of anti-SSA antibodies to apoptotic fetal cardiocytes stimulates urokinase plasminogen activator (uPA)/uPAR receptor-dependent activation of TGF beta and potentiates fibrosis. J Immunol. 2011;187(10):5392-401. [ Links ]
13. Cox G, Steward W, O'Byrne K. The plasmin cascade and matrix metalloproteinases in non-small cell lung cancer. Thorax. 1999;54(2):169-79. [ Links ]
14. Qazi Y, Maddula S, Ambati BK. Mediators of ocular angiogénesis. J Genet. 2009;88(4):495-515. [ Links ]
15. Jaworski DM, Pérez L. Tissue Inhibitor of Metal-loproteinase-2 (TIMP-2) expression is regulated by multiple neural differentiation signals. J Neurochem. 2006;98(1):234-47. [ Links ]
16. Miles LA, Plow EF, Waisman DM, Parmer RJ. Plasminogen receptors. J Biomed Biotechnol. 2012; 2012:130735. [ Links ]
17. Kawao N, Tamura Y, Okumoto K, Yano M, Okada K, Matsuo O, Kaji H. Plasminogen plays a crucial role in bone repair. J Bone Miner Res. 2013;28(7):1561-74. [ Links ]
18. Mondéjar I, Grullón LA, García-Vázquez FA, Romar R, Coy P. Fertilization outcome could be regulated by binding of oviductal plasminogen to oocytes and by releasing of plasminogen activators during interplay between gametes. Fertil Steril. 2012;97(2):453-61. [ Links ]
19. Cañas O, Quijano A, Arbeláez LF. Activación de los parámetros cinéticos de la plasmina porcina y comparación con la humana. Iatreia. 2011;25(2) :111-9. [ Links ]
20. Cañas O, Quijano A, Arbeláez LF. Purification and activation of caprine and canine plasminogen: comparison with human plasminogen. Iatreia. 2011;24(2):117-25. [ Links ]
21. Cañas O, Quijano A, Arbeláez LF. Activación y determinación de parámetros cinéticos de la plasmina humana y Ovis aries. Rev MVZ Córdoba. 2011;16(1):2364-71. [ Links ]
22. Cañas O, Quijano A, Arbeláez LF. Activación y cinética comparativa de la plasmina bufalina con la humana. Rev Colom Cienc Pecua. 2010;23(1):47-54. [ Links ]
23. Cañas O, Quijano A, Arbeláez LF. Cinética comparativa de la plasmina canina con la humana, bovina y equina. Bistua. 2007;5(2):17-24. [ Links ]
24. Cañas O, Quijano A, Arbeláez LF. Activación y comparación cinética del plasminógeno equino con el plasminógeno humano. Bistua. 2007;5(1):43-52. [ Links ]
25. Cañas O, Quijano A, Arbeláez LF. Activación y cinética comparativa de dos especies de plasminógenos (humano y bovino). Bistua. 2006;(4):3-12. [ Links ]
26. Appel RD, Bairoch A, Hochstrasser DF. A new generation of information retrieval tools for biologist. Trends Biochem Sci. 1994;19(6):258-60. [ Links ]
27. Blombäck B, Blombáck M. Purification of human and bovine fibrinogen. Arkiv for Kemi. 1956;(9):415-43. [ Links ]
28. Vinazzer H. Basics and practice in evaluating plasminogen. Haemostasis. 1988;18(Suppl 1):41-5. [ Links ]
29. Laemmli, UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227(5259):680-5. [ Links ]
30. Collins TJ. ImageJ for microscopy. Biotechinques. 2007;43(1):25-30. [ Links ]
31. Sultan H, Noor J, Normahayu I. Identification of tumors and other lesion through ImageJ characteristic from ultrasound images. IRJES. 2014;3(2):25-31. [ Links ]
32. Yusuf S., Reddy S, Ounpuu S, Anand S. Global burden of cardiovascular diseases: Part II: variations in cardiovascular disease by specific ethnic groups and geographic regions and prevention strategies. Circulation. 2001;104(23):2855-64. [ Links ]