Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.29 Bogotá Jan./June 2015
Seroprevalencia de Toxoplasma gondii en gatos (Felis catus, Linnaeus 1758) residentes en San Carlos, Chile
Seroprevalence of Toxoplasma gondii in Cats (Felis catus, Linnaeus 1758) Living in San Carlos (Chile)
Soroprevalência de Toxoplasma gondii em gatos (Felis catus, Linnaeus 1758) residentes em Sam Carlos, Chile
Ignacio Eduardo Troncoso Toro1 / Paola Alejandra Uribe Henríquez2 / Karen Constanza Arrué Brenet3 / Adela Antonieta Valenzuela Contreras4 / Christof Fischer Wiethuchter5
1 Médico veterinario. Universidad Santo Tomás, Escuela de Medicina Veterinaria, Concepción, Chile.
ignaciotroncoso@santotomas.cl
2 Médico veterinario. Universidad Santo Tomás, Escuela de Medicina Veterinaria, Concepción, Chile.
paolita_auh@hotmail.com
3 Médico veterinario. Clínica Veterinaria Animal Lover, San Carlos, Chile.
kabvet@gmail.com
4 Médico veterinario. Universidad Santo Tomás, Escuela de Medicina Veterinaria, Concepción, Chile.
adela.medvet@gmail.com
5 Médico veterinario. Universidad Santo Tomás, Escuela de Medicina Veterinaria, Concepción, Chile.
cfischer@santotomas.cl
Recibido: 19 de septiembre del 2014 / Aceptado: 22 de octubre del 2014
Cómo citar este artículo: Troncoso Toro IE, Uribe Henríquez PA, Arrué Brenet KC, Valenzuela Contreras AA, Fischer Wiethuchter C. Seroprevalencia de Toxoplasma gondii en gatos (Felis catus, Linnaeus 1758) residentes en San Carlos, Chile. Rev Med Vet. 2015;(29):23-31.
Resumen
En Chile existen pocos trabajos referidos a seroprevalencia de toxoplasmosis; por eso, el objetivo del artículo fue determinar su seroprevalencia en felinos de la comuna de San Carlos, mediante la técnica serológica Elisa ImmunoComb® y, al mismo tiempo, ver la asociación con las variables sexo, edad, alimentación y hábitat. Para esto se muestrearon aleatoriamente 60 felinos mayores de dos meses de edad. Los sueros fueron analizados con el kit de Elisa ImmunoComb® Biogal Toxo & Chlamydia, que detecta anticuerpos tipo inmunoglobulina G específicos contra Toxoplasma gondii con una sensibilidad del 92,3 % y una especificidad del 100 %. Con ello se evidenció que 29 individuos fueron positivos (48,3 % de seroprevalencia), que al desglosar según sexo correspondieron a 9 machos y 20 hembras (39,1 y 54 %, respectivamente). Mientras que, según la edad, la seropositividad fue mayor en el grupo adult (76,7 %), seguido de los rangos de mayores de 7 años (50 %) y young (25 %). Con respecto a la alimentación, la seropositividad más alta se obtuvo en aquellos alimentados con dieta mixta por sobre la comercial (60 % vs. 47,2 %). Según la variable hábitat, fueron positivos 16 gatos indoor y 13 outdoor (45,7 y 52%), lo que muestra diferencia estadísticamente significativa solo para la variable edad (p < 0,05). Por último, al relacionar la edad con la seropositividad, se evidenció una correlación negativa (r = -0,3), lo cual indica que a mayor edad de los individuos existió una menor seroprevalencia. Los resultados obtenidos demuestran la presencia de anticuerpos contra Toxoplasma gondii en felinos domésticos.
Palabras clave: toxoplasmosis, prevalencia, felinos, Elisa, anticuerpos.
Abstract
There are few studies about seroprevalence of toxoplasmosis in Chile; therefore, this article aims to determine seroprevalence in cats in the district of San Carlos, by ELISA Immuno-Comb® serological technique, and, at the same time, to examine association with variables of sex, age, diet, and habitat. To the effect, 60 cats over 2 months old were randomly sampled. Sera were analyzed using the ELISA ImmunoComb® Biogal Toxo & Chlamydia test kit, which detects specific immunoglobulin G-type antibodies against Toxoplasma gondii with a sensitivity of 92.3% and a specificity of 100%. The study evidenced that 29 individuals were positive (48.3% seroprevalence); when broken down by gender this corresponded to 9 males and 20 females (39.1% and 54%, respectively). By age, seropositivity was higher in the "Adult" group (76.7%), followed by groups "Over 7 years" (50%) and "Young" (25%). With respect to diet, higher seropositivity was obtained in animals fed on mixed diet, as opposed to commercial diet (60% vs. 47.2%). By variable habitat, 16 indoor and 13 outdoor cats were positive (45.7% and 52%), showing statistically significant difference only for the variable age (p <0.05). Finally, through relating age with seropositivity, a negative correlation was evidenced (r = -0.3), indicating that older individuals had lower seroprevalence. The results show the presence of antibodies against Toxoplasma gondii in domestic cats.
Keywords: toxoplasmosis, prevalence, cats, ELISA, antibodies.
Resumo
No Chile existem poucos trabalhos referidos a soroprevalência de toxoplasmose; por isso, o objetivo do artigo foi determinar a sua soroprevalência em felinos da comuna de Sam Carlos, mediante a técnica sorológica ELISA ImmunoComb® e, ao mesmo tempo, ver a associação com as variáveis sexo, idade, alimentação e hábitat. Para isto se amostraram aleatoriamente 60 felinos maiores de 2 meses de idade. Os soros foram analisados com o kit de ELISA ImmunoComb* Biogal Toxo & Chlamydia, que detecta anticorpos tipo imunoglobulina G específicos contra Toxoplasma gondii com uma sensibilidade de 92,3 % e uma especificidade de 100 %. Com isso observou-se que 29 indivíduos foram positivos (48,3 % de soroprevalência), e que ao separar de acordo com sexo corresponderam a 9 machos e 20 fêmeas (39,1 e 54 %, respectivamente). Enquanto que, de acordo à idade, a soro positividade foi maior no grupo Adult (76,7 %), seguido dos rangos de maiores de 7 anos (50 %) e Young (25 %). Em quanto à alimentação, a soro positividade mais alta se obteve naqueles alimentados com dieta mista sobre a comercial (60 % vs. 47,2 %). De acordo com o variável hábitat, foram positivos 16 gatos indoor e 13 outdoor (45,7 e 52%), o que a mostra diferença estatisticamente significativa só para a variável idade (p < 0,05). Por último, ao relacionar a idade com a soro positividade, se evidenciou uma correlação negativa (r = -0,3), o que indica que à maior idade dos indivíduos existiu uma menor soroprevalência. Os resultados obtidos demonstram a presença de anticorpos contra Toxoplasma gondii em felinos domésticos.
Palavras chave: toxoplasmose, prevalência, felinos, ELISA, anticorpos.
INTRODUCCIÓN
Toxoplasma gondii es un protozoo parásito de distribución mundial que afecta aves, mamíferos y al hombre (1). El gato doméstico (Felis catus) es el hospedero definitivo y es la especie clave para el mantenimiento del ciclo biológico de este parásito, ya que puede excretar millones de ooquistes en un corto período de tiempo (una a dos semanas) (2). Esto produce la contaminación fecal del suelo, el alimento o el agua, fuentes de infección para diferentes huéspedes intermediarios, dentro de los que se incluyen pequeños mamíferos (ovinos, caprinos, camélidos, entre otros) y aves (3).
La toxoplasmosis clínica es comúnmente demostrada en gatos, cuyos hallazgos inespecíficos más frecuentes son la fiebre persistente, la ictericia, leucopenia, los desórdenes oculares, pulmonares, hepáticos, neurológicos, gastrointestinales y musculares (4). Es una enfermedad de difícil diagnóstico parasitológico, pues no es fácil demostrar el agente etiológico y establecer la relación entre la infección y la enfermedad; por esta razón, el uso de test serológicos como indicadores indirectos de la infección es indispensable para realizar el diagnóstico del agente etiológico (5), basados en la presencia de anticuerpos tipo inmunoglobulina G o M (IgG o IgM), equivalentes a infecciones en etapa tardía o temprana (fase aguda), respectivamente. El último antecedente en el contexto nacional fue realizado en Valdivia, donde se muestrearon 97 gatos domésticos, de los cuales 32 (33 %) resultaron positivos a la inmunofluorescencia indirecta (IFI) (6).
Debido a los pocos antecedentes actualizados en el país, y a los nulos antecedentes en la VIII región, asociados a la alta cantidad de gatos domésticos presentes en los hogares de la comuna de San Carlos, donde la relación hombre-gato es de 7,2:1, apoyada en el alto porcentaje de gatos que nunca han recibido atención veterinaria (88,4 %) y que el 31,6 % de sus propietarios desconocen las enfermedades que transmiten —consideradas zoonosis (7)—, se propone realizar un estudio de seroprevalencia de toxoplasmosis en felinos de la comuna de San Carlos, mediante el uso de la técnica serológica Elisa ImmunoComb*, y así ver la asociación con las variables sexo, edad, alimentación y hábitat.
MATERIALES Y MÉTODOS
Sitio de estudio
El estudio se efectuó en San Carlos, ciudad que se encuentra ubicada a 24 km al norte de Chillán, VIII región del Bío Bío, Chile, específicamente en una clínica de animales menores ubicada en el centro de la ciudad, entre los meses de julio y agosto de 2013.
Tamaño de muestra
Se realizó un muestreo dirigido a 60 animales que se encuentran incluidos en la base de datos como pacientes felinos de la clínica, la cual presenta una antigüedad de tres años aproximadamente. Este tamaño de muestra es equivalente al 28,57 % del total de la base de datos. Los felinos fueron seleccionados al azar mediante la utilización de un programa de selección aleatoria, el cual permitió indicar el número de ficha del paciente, cuyo único requisito era ser mayor de dos meses de edad. A cada uno de ellos se le realizó una ficha clínica que contenía la siguiente información: edad, sexo, alimentación y hábitat. Se contó con el consentimiento del propietario mediante la firma de una carta de consentimiento informado y de confidencialidad de los resultados.
Obtención de muestras
Las muestras de sangre se obtuvieron mediante la punción directa de la vena cefálica, usando vacutainers sin anticoagulantes y agujas de 23 x 1 pulgadas. Las muestras fueron centrifugadas (2000 r. p. m. por 10 min), y los sueros resultantes se conservaron en congelación a -20 °C hasta su procesamiento.
Método diagnóstico
Se utilizó el método serológico ImmunoComb* Biogal Toxo & Chlamydia, una prueba Elisa modificada, que detecta anticuerpos tipo IgG contra T. gondii en suero o plasma, presenta una sensibilidad del 92,3 % y una especificidad del 100 % (8), siguiendo las recomendaciones del fabricante.
Distribución de variables
Para el análisis de las variables, se procedió a dividir a los animales en dos grupos según sexo: macho y hembra. De acuerdo con la edad, se constituyeron tres grupos etarios: el primero para individuos menores de un año de edad (jóvenes), el segundo entre uno y siete años (adultos), el tercero para mayores de siete años (geriatras) (9). Según el tipo de alimentación, se constituyeron dos grupos: comercial o mixto. En cuanto al hábitat, se formaron dos grupos: confinados y semiconfinados o libres.
Análisis estadístico
Teniendo en cuenta que fue un estudio descriptivo, se consideró la frecuencia de presentación como porcentajes. Para determinar si existían diferencias significativas entre individuos de diferente edad, sexo, alimentación y hábitat se aplicó el test de Fisher, con un grado de significancia del 95 % y un margen de error del 5 %. Además se utilizó la correlación de Spearman, para establecer la relación entre edad y seropositividad.
RESULTADOS
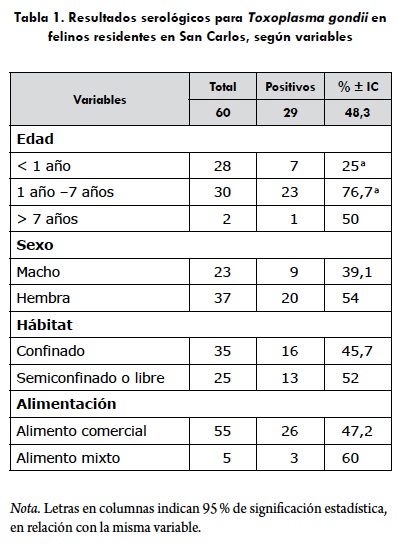
El número de animales positivos fue 29/60 (48,3 %). Se consideró como positivo a todo aquel suero que estuviese sobre el punto de corte (C+ o S3), de la Comb Scale, equivalente al título IgG de 1:32.
Dentro de la población analizada, se encontraban un total de 23 machos y 37 hembras, equivalentes al 38,3 y 61,7 %, respectivamente. En el primer grupo se evidenciaron 9 individuos seropositivos, lo cual equivale al 39,1 %, mientras que en el segundo grupo se obtuvo que 20 de ellas fueron seropositivas, correspondientes al 54 % (tabla 1).
Al desglosar por rango etario a los felinos muestreados, se evidenció de forma decreciente que la categoría con mayor cantidad de representantes fue adult con 30 felinos, seguido de young, con 28, y finalmente con dos individuos para aquellos mayores de 7 años, lo cual corresponde al 50, 46,7 y 3,3 %, respectivamente. Ahora bien, si lo asociamos con la seropositividad, esta fue mayor en el grupo adult (76,7 %), seguido de los rangos de mayores de 7 años (50 %) y young (25 %) (tabla 1).
Del total de gatos muestreados, 55 de estos consume alimento de tipo comercial, mientras que los cinco restantes consumen una alimentación mixta, lo que da como resultado 91,7 y 8,3 % del total respectivamente. De estos 26 fueron seropositivos, lo cual equivale al 47,2 % para los de tipo comercial y de un 60 % (3/5) para los de tipo mixta (tabla 1). Por último, para la variable hábitat, 35 eran indoor y 25 lo hacían outdoor, equivalente al 58,3 y 41,7 % respectivamente. Se pudo determinar que 16 de ellos presentaban anticuerpos dentro del primer grupo (45,7 %) y 13 en el segundo (52 %) (tabla 1).
Para analizar la relación entre las variables edad y seropositividad, se utilizó el coeficiente de correlación de Spearman, el cual evidenció una correlación negativa (r = -0,3), lo que indica que a mayor edad de los individuos existe una menor seropositividad.
DISCUSIÓN
Los resultados reflejan un 48,3 % de seropositividad en la población muestreada, valor superior al obtenido por Ovalle y colaboradores (2000) en Valdivia, quienes demostraron una positividad del 33 % a la técnica de IFI (32/97). Vale la pena mencionar que este último consideró tanto animales sanos (83,5 %) como enfermos (16,5 %), siendo seropositivos el 28,3 y el 56,2 % respectivamente (6). Los animales enfermos presentaban como sintomatología: diarrea (6/16), neumonía (3/16), compromiso general (3/16), lesiones oculares (2/16) y anemia (2/16).
Dentro de los estudios nacionales, se destacan el realizado por Lorca y colaboradores (1982), quienes analizaron 32 gatos provenientes de Santiago, de los cuales resultaron positivos 19 (59,3 %), con el uso de la técnica de Sabin Feldman (10), y el de Schenone y colaboradores, (1987) quienes obtuvieron años después una seropositividad del 54,6 % (11), con la técnica diagnóstica de hemaglutinación indirecta, ampliamente utilizada para el diagnóstico de la toxoplasmosis en animales, considerada como una de las técnicas más específicas (90,3 %) y sensibles (82,9 %) (12).
La frecuencia de anticuerpos contra Toxoplasma es muy variada en la población felina y está relacionada con el tipo de población, el comportamiento, los hábitos alimenticios, las costumbres de los dueños y la infraestructura hídrica y sanitaria, entre otros (13). Los animales de este estudio eran gatos con domicilio conocido y la mayoría recibía alimento casero, por lo que el porcentaje de serorreactores resulta inferior al hallado en la mayoría de poblaciones de gatos callejeros; sin embargo, es mayor a lo obtenido en el último estudio publicado en el contexto nacional por Ovalle y colaboradores, lo cual puede explicarse por el bajo conocimiento de los propietarios sobre las enfermedades zoonóticas felinas (68,4 %), el bajo porcentaje de felinos que ha recibido al menos una atención veterinaria en su vida (11,6 %), la baja aplicación de medidas sanitarias preventivas como vacunación antirrábica (1,7 %) o desparasitación interna (30,7 %) (7); todo esto, sumado a las condiciones climáticas de la ciudad, con una temperatura promedio anual de 15 °C, con una amplitud térmica importante de los valores medios, que alcanzan de 13 a 14 °C, y una humedad promedio del 60 %, adecuadas para la sobrevivencia de los ooquistes que pueden ser eliminados por los hospedadores definitivos, explicaría la frecuencia alta encontrada.
En el ámbito internacional hay estudios como el realizado por Miró y colaboradores (2004) en España, quienes usaron la técnica de (IFI), cuyos valores fueron inferiores al nuestro con un 32,3 % de seropositividad (189/585), siendo los felinos en un 54,1 % callejeros, 8,2 % de granja y 37,7 % domésticos (14), a diferencia del nuestro, en el que el 100 % eran felinos con propietario y el 47,2 % de hábitos indoor. En Portugal, Lopes y colaboradores (2008) demostraron un 35,8 % de seropositividad, en el que 73/204 gatos fueron positivos a la técnica de IFI (15). En Bélgica, De Craeye y colaboradores (2008), en su estudio realizado mediante la técnica IFI, obtuvieron un 25% de prevalencia, siendo 142/567 positivos T. gondii; los animales muestreados correspondieron a gatos domésticos, todos sanos a la hora del muestreo, cuyas edades fluctuaban entre tres meses y siete años (16).
López y colaboradores (2011), en Argentina, evaluaron 513 gatos, siendo 116 de ellos positivos, equivalente a una seroprevalencia del 22,6 %; sin embargo, los animales analizados fueron aquellos que ingresaron al servicio de cirugía para la esterilización quirúrgica durante un periodo de un año (17). Sandoval y Yáñez (2012) realizaron un estudio en Ecuador, cuyo objetivo era comparar las técnicas diagnósticas de Inmuno Elisa e InmunoComb para IgG, para el cual utilizaron 40 felinos, siendo 23 de ellos seropositivos a InmunoComb IgG, lo que da una prevalencia de 56 % (18). El estudio más reciente fue llevado a cabo por Sukhumavasia y colaboradores (2012) en Tailandia mediante IFI; esta investigación reveló que 35/348 gatos resultaron positivos, lo que da una prevalencia del 10,1 % (19), cifra muy inferior a las anteriormente descritas.
Es necesario recalcar que la mayoría de estudios mencionados utiliza como técnica de diagnóstico la IFI, la cual presenta una sensibilidad del 99 % y una especificidad del 100 %; por tanto, es una técnica muy confiable que nos puede garantizar sus resultados. Sin embargo, tiene desventajas, por ejemplo, necesita de equipo altamente especializado y, a su vez, personal capacitado para utilizarlo; mientras que, nuestra técnica Elisa modificado InmunoComb de Biogal* consta de una sensibilidad del 92,3 % y especificidad del 100 %, no es tan compleja de llevar a cabo, ya que es muy simple de realizar, no necesita equipamiento o tecnología muy sofisticada (20).
Con respecto a la variable sexo, difiere de lo obtenido por Jones y colaboradores (1957), quienes demostraron una predominancia de los machos sobre las hembras con un 52,5 y un 41,2 % respectivamente (21). Sin embargo, coincide con lo realizado en Valdivia por Ovalle y colaboradores (2000), cuya prevalencia en machos alcanzó un 30,4 % y en hembras un 35,3 % (6). En el ámbito internacional también se recalca que no existen diferencias para el factor sexo como lo describe el trabajo efectuado en España (14) mediante IFI, en el que resultaron positivas 31,1 % de las hembras y 34 % de los machos. También coincide con lo realizado por Lopes y colaboradores (15) en Portugal, en cuyo estudio resultó una prevalencia para los machos del 35,6 % (104/204) y para hembras del 36 % (100/204). En ninguno de los estudios anteriormente mencionados se demostró diferencia estadísticamente significativa para esta variable.
La elevada prevalencia en machos se podría deber a los hábitos territoriales asociados a ellos, porque estos tienen un área de operación más amplia que las hembras, con una mayor predisposición por hábitos outdoor, lo cual podría permitir el acceso al consumo de carne mal cocida (22) o a cacería de animales infectados (23).
En relación con la edad, en el estudio nacional realizado en 2000 (6), la prevalencia fue de 20,5 % en individuos de 0-1 año, de 38,3 % para 2-4 años y de 54,6 % en los felinos mayores de 5 años, con lo cual se observa una correlación estadística con la edad, lo que demuestra que a mayor edad mayor prevalencia. Esto discrepa con lo obtenido en este estudio, lo que podría explicarse por la baja representatividad muestral de animales pertenecientes al grupo de mayores de 7 años (3,3 %), y que no se efectuó un muestreo de tipo proporcional de cada rango etario (n = 20).
También lo describe en Lopes y colaboradores (15), quienes postulan y dejan en claro que existe mayor prevalencia a mayor edad; en su estudio consideran cuatro grupos etarios: 2-11 meses 48/204, 12-35 meses 57/204, 36-71 meses 58/204 y 72-180 meses 41/204 con las correspondientes prevalencias: 14,6, 26,3, 51,7 y 51,2 %.
El estudio realizado en Bélgica por De Craeye y colaboradores (16) demostró, en gatos menores de 12 meses, que solo el 2 % presentó anticuerpos, mientras que felinos entre 12 meses y 5 años alcanzaron un 26 % de prevalencia. Los resultados de mayor importancia se dan en el grupo etario de 7 años de edad con un 44 % de prevalencia, lo cual puede deberse, como lo mencionan Akhtardanesh y colaboradores (24), a que el riesgo de exposición a toxoplasmosis del gato aumenta 2,87 veces por cada año de vida.
En el estudio de López y colaboradores (17), en Argentina, se consideraron tres rangos etarios: 0-1 año, 1-3 años y más de 3 años, en los que se encontraron los siguientes porcentajes se seropositividad, respectivamente: 1/40 4,3 %, 16/40 69,6 % y 6/40 26,1 %. En un estudio más reciente, efectuado en Tailandia (18), dentro de los seropositivos había 9 gatos entre 1 y 5 años, 4 gatos entre 6 y 10 años y uno de más de 10 años de edad, mientras que en los restantes 21 gatos no se contaban con dicho registro. En nuestro estudio, los rangos young y adult se asemejarían al primer grupo, por lo que serían similares a los resultados obtenidos en la presente investigación, en la que se postula que la mayor seroprevalencia se encuentra en los gatos de entre 1 y 5 años.
Finalmente, en Rumania (20) se realizó un estudio de prevalencia en 236 felinos en el que se usaron distintos rangos etarios al nuestro, que se desglosaron de la siguiente manera: kitten (2-6 meses) [47], en el que 12 individuos resultaron positivos con una prevalencia del 25,5 %; juvenile (más de 6-12 meses) [37] en el cual 18 gatos resultaron positivos, lo cual dio una prevalencia del 48,6%; adulto (más de 12 meses a 10 años) [142], en el que 75 animales resultaron positivos, equivalentes a una prevalencia del 52,8 %, y, por último, geriatric (mayores a 10 años) [10], que registra 6 gatos que resultaron positivos con una prevalencia del 60 %.
De acuerdo con Lopes y colaboradores (15), la dieta es un factor importante, ya que influye en los valores de prevalencia, según lo demuestran sus resultados, en los que en el grupo que consumen una dieta comercial estricta se obtuvo una prevalencia de 22,9 %, y para una dieta mixta se obtuvo un 53,5 %. Estas cifras avalan los resultados obtenidos en el presente estudio, en el que la mayor seropositividad se obtuvo en aquellos que consumen dieta mixta, los cuales tienen un alto riesgo de cazar roedores o aves infectadas o consumir carne cruda, debido a esto su grado de seropositividad podría ser mayor (23,25). Györke y colaboradores (2011) también demuestran en su trabajo la dieta como un factor importante en la prevalencia de T. gondii, puesto que de los felinos que consumen alimento seco (n = 61) solo 18 presentaron anticuerpos para el agente, lo que da un 29,5 % de prevalencia, mientras que los gatos que consumían una dieta mixta (n = 93), 44 de ellos presentaban anticuerpos para el agente, con una prevalencia del 47,3 % (20).
Según el hábitat, los resultados obtenidos no coinciden con lo realizado en España (14), en los que se encontraron diferencias significativas entre la seroprevalencia de las diferentes poblaciones de felinos, siendo en gatos callejeros del 36,9 %, gatos de granja, 33,3 %, y de casa 25,5 %; las dos primeras subpoblaciones se consideran como de hábitos outdoor. Lo mismo demostraron Lopes y colaboradores (15), quienes en el grupo indoor obtuvieron una prevalencia del 7,7 % para gatos, y en outdoor, una prevalencia de 45,4 %. Esto puede estar asociado al hecho de que estos últimos podrían tener acceso a la cacería de animales infectados, entre los que se incluyen las aves silvestres, los roedores y las placentas infectadas o fetos nacidos muertos (23,25). También Gyõrke y colaboradores (2011) avalan los resultados anteriores, puesto que los gatos que tenían acceso al aire libre (outdoor) fueron 144 en total y de estos 85 resultaron positivos, con una prevalencia de 59 %; en cambio, del total de gatos indoor (71), solo 19 resultaron positivos, con una prevalencia de 26,8 % (20).
CONCLUSIONES
Mediante este trabajo se demostró la presencia de anticuerpos tipo IgG contra Toxoplasma gondii en felinos de la comuna de San Carlos, lo cual se evidencia por el 48,3 % de seroprevalencia obtenido; solo la variable edad fue estadísticamente significativa con respecto a la tasa de exposición.
AGRADECIMIENTO
Al personal administrativo y profesional de la Clínica Veterinaria. El estudio fue financiado por la Universidad Santo Tomás, sede Concepción.
REFERENCIAS
1. Dubey JP. The history and life cycle of Toxoplasma gondii. En: Weiss LM, Kim K, eds. Toxoplasma gondii the model apicomplexan: perspectives and methods. Londres: Academic Press; 2007. p. 1-17. [ Links ]
2. Dubey JP. Toxoplasmosis. J Am Vet Med Assoc. 1994;205:1593-8. [ Links ]
3. Dubey JP, Beattie CP. Toxoplasmosis of animals and man. Boca Raton, FL: CRC Press; 1988. [ Links ]
4. Durlach R, Martino P. Toxoplasma gondii: Infección en perros y gatos. En: Temas de zoonosis IV. Cap. 42 [internet]. Asociación Argentina de Zoonosis; 2009 [citado 2014 abr 15]. Disponible en: http://cnia.inta.gov.ar/helminto/Zoonosis/toxoplasmosis4.htm [ Links ]
5. Martín-Hernández I, García-Izquierdo S. Toxoplasmosis en el hombre. Bioquimia. 2003;28(3):19-27. [ Links ]
6. Ovalle F, García A, Thibauth J, Lorca M. Frecuencia de anticuerpos anti-toxoplasma gondii en gatos de la ciudad de Valdivia. Bol Chil Parasitol. 2000;55(3-4):94-9. [ Links ]
7. Alvarado SA. 2002. Caracterización de las poblaciones caninas y felinas en la ciudad de San Carlos, VIII región. Chillán, Chile: Universidad de Concepción. [ Links ]
8. Eurovet. Diagnóstico clinico: catálogo general [internet]. Madrid: Eurovet; 2008 [citado 2014 mar 24]. Disponible en: http://www.euroveterinaria.com/pdf/catalogo_diagnosticoclinico08.pdf [ Links ]
9. Hand M, Thatcher C, Remillard R, Roudebush P. Nutrición clínica de los pequeños animales. 4a. ed. Colombia: Mark Morris; 2000. p. 1341. [ Links ]
10. Lorca E, González I, León L, Mella I, Lorca M, Thiermann E. Infección por T. gondii en gatos. Revisión del tema y estudio serlógico en 32 gatos de Santiago. Bol. Hosp. San Juan de Dios. 1982;29(6):333-7. [ Links ]
11. Schenone H, Contreras MC, Castro M, Villarroel F, Rojas A. Epidemiología de la toxoplasmosis en Chile, IV. Prevalencia de la infección en mamíferos domésticos de localidades rurales-periurbanas de las siete primeras regiones de Chile, 1982-1985. Bol Chil Parasitol. 1987;42(3-4):72-9. [ Links ]
12. Dubey JP, Rollor EA, Smith K, Kwok OCH, Thulliez P. Low seroprevalence of Toxoplasma gondii in feral pigs from a remote island lacking cats. J Parasitol. 1997;83(5):839-41. [ Links ]
13. Tenter A, Heckeroth A, Weiss L. Toxoplasma gondii: from animals to humans. Int J Parasitol. 2000;30(12-13);1217-58. [ Links ]
14. Miró G, Montoya A, Jiménez S, Frisuelos C, Mateo M, Fuentes I. Prevalence of antibodies to Toxoplasma gondii and intestinal parasites in stray, farm and household cats in Spain. Vet Parasitol. 2004;126(3):249-55. [ Links ]
15. Lopes AP, Cardoso L, Rodrigues M. Serological survey of Toxoplasma gondii infection in domestic cats from northeastern Portugal. Vet Parasitol. 2008;155(3-4):184-9. [ Links ]
16. De Craeye S, Francart A, Chabauty J, De Vriendt V, Van Gucht S, Leroux I, Jongert E. Prevalence of Toxoplasma gondii infection in Belgian house cats. Vet Parasitol. 2008;157(1-2):128-32. [ Links ]
17. López C, Daprato B, Zampolini S, Mazzeo C, Cardillo N, Sommerfelt I. Risk factors and prevalence of IgG antibodies to Toxoplasma gondii in domestic cats: La Matanza, Buenos Aires, Argentina. Rev Ibero-Latinoam Parasitol. 2011;70(1):29-34. [ Links ]
18. Sandoval D, Yañez J. Determinación de la reacción antígeno y anticuerpo para toxoplasma en perros y gatos de la zona sur de Quito, provincia de Pichincha. Memoria de título. Guaranda, Ecuador: Universidad Estatal de Bolivar; 2012. [ Links ]
19. Sukhumavasi W, Bellosa ML, Lucio-Forster A, Liotta JL, Lee AC, Pornmingmas P, et al. Serological survey of Toxoplasma gondii, Dirofilaria immitis, Feline Immunodeficiency Virus (FIV) and Feline Leukemia Virus (FeLV) infections in pet cats in Bangkok and vicinities. Vet Parasitol. 2012;188(1-2):25-30. [ Links ]
20. Györke A, Opsteeghb M, Mirceana V Iovua A, Cozmaa V. Toxoplasma gondii in Romanian household cats: Evaluation of serological tests, epidemiology and risk factors. Prev Vet Med. 2011;102(4):321-8. [ Links ]
21. Jones F, Eyler D, Gibson C. The prevalence of toxoplasmosis in the domestic cat. Am J Trop Med Hyg. 1957;6:820-26. [ Links ]
22. Smith KE, Zimmerman JJ, Patton S, Beran GW, Hill H. The epidemiology of toxoplasmosis on Iowa swine farms with an emphasis on the roles of free-living mammals. Vet Parasitol. 1992;42(3-4):199-211. [ Links ]
23. Hill SL, Cheney JM, Taton-Allen GF, Reif JS, Bruns C, Lappin MR. Prevalence of enteric zoonotic organisms in cats. J Am Vet Med Assoc. 2000;216(5):687-92. [ Links ]
24. Akhtardanesh B, Ziaali N, Sharifi H, Rezaei S. Feline immunodeficiency virus, feline leukemia virus and Toxoplasma gondii in stray and household cats in Kerman-Iran: seroprevalence and correlation with clinical and laboratory findings. Res Vet Sci. 2010;89(2);306-10. [ Links ]
25. Frenkel JK. Transmission of toxoplasmosis and the role of immunity in limiting transmission and illness. J Am Vet Med Assoc. 1990;196(2):233-9. [ Links ]