Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.30 Bogotá July/Dec. 2015
Riesgos a la salud por el uso de clorhidrato de clembuterol:
una revisión
Health Risks Due to the Use of Clenbuterol Hydrochloride:
a Review
Riscos à saúde pelo uso de cloridrato de clembuterol:
uma revisão
Benjamín Valladares-Carranza1 / Rómulo Bañuelos-Valenzuela2/ Silvia Denisse Peña-Betancourt3 / Valente Velázquez-Ordóñez4 / Francisco Guadalupe Echavarría-Cháirez5 / Alberto Muro-Reyes6 / César Ortega-Santana7
1 Facultad de Medicina Veterinaria y Zootecnia. Centro de Investigación y Estudios Avanzados en Salud Animal, Universidad Autónoma del Estado de México, Toluca, México. Unidad Académica de Medicina Veterinaria y Zootecnia. Universidad Autónoma de Zacatecas, Zacatecas, México.
benvac2004@yahoo.com.mx
2 Unidad Académica de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Zacatecas, Zacatecas, México.
apozolero@hotmail.com
3 Departamento de Producción Agrícola y Animal, Laboratorio de Toxicología, Universidad Autónoma Metropolitana, Xochimilco, México, Distrito Federal.
silvia_dpb@hotmail.com
4 Facultad de Medicina Veterinaria y Zootecnia. Centro de Investigación y Estudios Avanzados en Salud Animal, Universidad Autónoma del Estado de México, Toluca, México.
vvo@uaemex.mx
5 Unidad Académica de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Zacatecas, Zacatecas, México.
echavarria.francisco@inifap.gob.mx
6 Unidad Académica de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Zacatecas, Zacatecas, México.
amurey@hotmail.com
7 Facultad de Medicina Veterinaria y Zootecnia. Centro de Investigación y Estudios Avanzados en Salud Animal, Universidad Autónoma del Estado de México, Toluca, México.
cos_mx@hotmail.com
Recibido: 29 de enero del 2015 / Aceptado: 12 de marzo del 2015
Cómo citar este artículo: Valladares-Carranza B, Bañuelos-Valenzuela R, Peña-Betancourt SD, Velázquez-Ordoñez V, Echavarría-Cháirez FG, Muro-Reyes A, Ortega-Santana C. Riesgos a la salud por el uso de clorhidrato de clembuterol: una revisión. Rev Med Vet. 2015;(30): 139-49.
Resumen
En este trabajo se analiza y valora la información sobre las características y riesgos del uso de clorhidrato de clembuterol (CCL) por su potencial efecto tóxico, debido a su inclusión en la alimentación animal (bovinos, cerdos, ovinos y aves) con la finalidad de mejorar parámetros productivos-reproductivos, pero que descuidan la inocuidad alimenticia. Por eso es necesario revalorar los peligros potenciales que puede ocasionar al emplearse tanto en medicina humana como en veterinaria. El CCL es un (β-adrenérgico sintético, polvo blanco, anhidro, muy soluble en agua y altamente estable a temperatura ambiente. Es utilizado en forma clandestina en animales de engorde destinados al consumo humano. Terapéuticamente, se utiliza como un medicamento broncodilatador (pacientes con asma); en competencias deportivas se ha detectado su uso ilegal (dopaje), y en fisicoculturismo es utilizado por su efecto anabólico. Su administración en el ganado para abasto modifica e incrementa el crecimiento de masas musculares, y disminuye la acumulación de grasa; se acumula en diferentes órganos. En personas con antecedente del consumo de hígado de bovino contaminado con CCL se ha registrado temblor, dolor muscular, mareos, cefalea y taquicardia. En México, de manera ilegal y clandestina, hay distribución, comercialización y uso de CCL; sin embargo, el trabajo de las organizaciones ganaderas para el registro de unidades de producción libres de esta sustancia garantizará el consumo de los productos cárnicos. Proponer el uso de otras sustancias de las cuales hasta el momento no se tiene indicios de toxicidad propiciará una productividad sustentable, segura e inocua en las unidades de producción pecuaria.
Palabras clave: riesgo, inocuidad, salud pública, salud animal, clorhidrato de clembuterol.
Abstract
This paper analyzes and evaluates information about the characteristics and risks of using Clenbuterol hydrochloride (CCL) for their potential toxic effects, due to its inclusion in animal food (cattle, pigs, sheep and poultry) to improve productive-reproductive parameters, but neglecting food safety. Therefore, it is necessary to reassess the potential dangers that may result when used in both human and veterinary medicine. The (β-adrenergic synthetic CCL, white powder, anhydrous, highly water soluble and highly stable at room temperature is used in a clandestine manner to fatten animals for human consumption. Therapeutically, it is used as a bronchodilator drug (asthma patients); its illegal use (doping) has been detected in sports competitions, and it is used for bodybuilding due to its anabolic effect. Its use in cattle for slaughter modifies and increases the growth of muscle mass and reduces fat accumulation, which accumulates in different organs. In people with a history of bovine liver consumption contaminated with CCL, there has been registration of: tremor, muscle pain, dizziness, headache, and tachycardia. In Mexico, in an illegal and clandestine manner, there is distribution, marketing and use of CCL; however, the work of livestock organizations in registering production units free of this substance will ensure the consumption of meat products. Moreover, to propose the use of other substances which so far have no signs of toxicity will lead to a sustainable, secure and safe productivity in livestock units.
Keywords: risk, safety, public health, animal health, clenbuterol hydrochloride.
Resumo
Neste trabalho se analisa e avalia a informação sobre as características e riscos do uso de cloridrato de clembuterol (CCL) pelo seu potencial efeito tóxico, devido à sua inclusão na alimentação animal (bovinos, cerdos, ovinos e aves) com a finalidade de melhorar parâmetros produtivo-reprodutivos, mas que descuidam a inocuidade alimentícia. Por isso é necessário reavaliar os perigos potenciais que pode ocasionar ao empregar-se tanto em medicina humana como veterinária. O CCL β-adrenérgico sintético, pó branco, anidro, muito solúvel em água e altamente estável a temperatura ambiente. É utilizado em forma clandestina em animais de corte destinados ao consumo humano. Terapeuticamente, se utiliza como um medicamento bronco dilatador (pacientes com asma); em competências esportivas tem sido detectado o seu uso ilegal (dopagem), e em físico culturismo é utilizado por seu efeito anabólico. Sua administração no gado para abasto modifica e incrementa o crescimento de massas musculares, e diminui a acumulação de gordura; acumulando-se em diferentes órgãos. Em pessoas com antecedente do consumo de fígado de bovino contaminado com CCL tem se registrado: tremor, dor muscular, tonturas, cefaleia e taquicardia. No México, de maneira ilegal e clandestina, há distribuição, comercialização e uso de CCL; contudo, o trabalho das organizações pecuaristas para o registro de unidades de produção livres desta substância garantirá o consumo dos produtos de carne. Assim como também, propor o uso de outras substâncias das quais até o momento não se tem indícios de toxicidade propiciará uma produtividade sustentável, segura e inócua nas unidades de produção pecuária.
Palavras chave: risco, inocuidade, saúde pública, saúde animal, cloridrato de clembuterol.
INTRODUCCIÓN
La seguridad alimentaria es muy importante en salud pública en los países desarrollados. En la actualidad, para incrementar la producción pecuaria, se recurre en forma constante a la utilización de moduladores del crecimiento. Dichas sustancias mejoran los parámetros productivos y culminan con la obtención de mayor cantidad de los productos (carne y leche). No obstante, los consumidores exigen productos cárnicos de mejor calidad en cuanto a textura, color, jugosidad y menor deposición de grasa, lo que en gran parte ha ocasionado que el productor utilice aditivos alimenticios para obtener estas características (1-3).
Así, la competencia en la producción intensiva de carne, la demanda por mayor producción, preferentemente al menor costo y en el menor tiempo posible, con cambios en la producción del ganado, es lo que ha presionado y orientado al uso ilegal de agentes farmacológicos, en especial compuestos anabólicos (3-5). Todo esto sucede sin considerar que los medicamentos que son administrados a los animales eventualmente pueden ser ingeridos por los humanos en forma de residuos. Esta exposición a sustancias a través de los alimentos es en la actualidad uno de los temas más importantes entre los consumidores y causa de preocupación en varios países, organizaciones europeas e internacionales, debido a las consecuencias que puede tener en la salud de la población (3,6-9).
En la producción animal se debe considerar a la seguridad alimentaria, pero a la vez procurar que los alimentos agropecuarios sean libres e inocuos, que garanticen la alimentación de todos los consumidores. En los diferentes sistemas de producción se hace uso de una gran cantidad de sustancias que son aplicadas o adicionadas en la alimentación de las diferentes especies productivas con el interés de mejorar los parámetros productivo-reproductivos, con descuido en gran medida del aspecto de inocuidad que implica la presentación de problemas en salud pública (1,3,9). Existe una gran variedad de moduladores de crecimiento; los más utilizados por los ganaderos en la alimentación animal son los β-agonistas, debido a que obtienen mayor ganancia de peso en menor tiempo. No obstante, el uso de clorhidrato de clembuterol (CCL) ha propiciado intoxicaciones masivas en los consumidores, lo que ha dado origen a un grave problema en salud pública (1-7).
El CCL constituye un miembro de las denominadas fenetanolaminas, medicamentos que, como grupo, requieren la presencia de un anillo aromático con un grupo hidroxilo en la posición b del grupo alifático para mostrar actividad. La presencia del grupo nitrogenado y la sustitución de R por un grupo voluminoso, a menudo cíclico, no alifático, hace más específica a la molécula por sus receptores β-adrenérgicos (subtipos: β1, β2 y β3), presentes en tejidos de todos los mamíferos, cuya distribución y proporción varían de un tejido a otro, y para cada especie animal. Sus diferentes sustituciones bioquímicas en un organismo propician una distinta característica farmacocinética; a su vez, su capacidad de distribución y permanencia en el organismo determinan la magnitud de su efecto y residualidad en los tejidos (2,10,11).
El CCL, anabólico sintético β-agonista suministrado en la alimentación del ganado, incrementa el peso de los animales por aumento en la masa muscular y un bajo contenido de grasa (12-15). En diferentes países, como Francia, Italia, Portugal, España y China, en los últimos años se han registrado intoxicaciones masivas por el consumo de productos cárnicos (principalmente de origen bovino) contaminados con CCL (12-14,16,17). En México se han emitido normas que prohíben el empleo del CCL en la alimentación de los animales domésticos, su importación, comercialización, transporte y suministro; sin embargo, su uso se continúa dando de manera clandestina (7,9,18,19). Con base en datos epidemiológicos, se ha referido que las intoxicaciones han ido incrementando. El registro para 2002 fue de 133 casos; en 2008, de 1663, y en 2009, 2130. Jalisco fue el estado con el mayor número de casos (32,25%), seguido del Distrito Federal (23,94%) (20).
La importancia de la inocuidad alimentaria en el proceso de producción y comercialización de productos pecuarios es actualmente un tema relevante. El objetivo del trabajo es considerar diferentes aspectos del CCL y el riesgo que representa el uso de esta sustancia tanto para la salud pública como animal, problema que es emergente; por eso se deben implementar y mantener programas de vigilancia epidemiológica para el control y la erradicación de su uso en la producción animal.
CLORHIDRATO DE CLEMBUTEROL
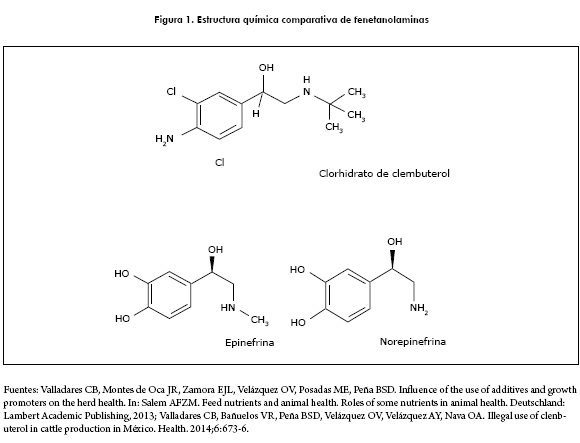
El CCL es un 4-amino-α-T-butilamino-metil 3, 5 diclorobenzil alcohol, polvo blanco, anhidro, muy soluble en agua, altamente estable a temperatura ambiente, con punto de fusión de 174-175,5°C. Es un aditivo sintético perteneciente a una clase de medicamentos fisiológicamente análogos a la adrenalina (5,7,21,22). Tiene una estructura química relacionada a las catecolaminas capaz de interactuar con receptores adrenérgicos, generalmente del tipo β2. Posee una vida media de acción prolongada (contenido de átomos de cloro), con la particularidad de poder almacenarse en músculo, hígado y riñón entre otros tejidos (4,5,17,23).
La epinefrina y la norepinefrina son agonistas fisiológicos β-adrenérgicos (figura 1). La primera constituye una catecolamina del grupo de las fenetanolaminas; también es considerada un neurotransmisor del sistema nervioso simpático, que se biosintetiza a partir de la tirosina y circula en el suero en concentraciones relativamente elevadas. La epinefrina se sintetiza y secreta en la médula adrenal; circula en menor concentración que la norepinefrina en la mayoría de los mamíferos, en situaciones de estrés responde en mayor proporción que la norepinefrina. Esta última es más selectiva de receptores a y la epinefrina actúa sobre ambos, con mayor selectividad por los receptores β, pero con un efecto a más dominante; las respuestas fisiológicas se producen cuando estos se unen a sus receptores específicos (24,25).
Los β-adrenérgicos son moléculas orgánicas que se unen al receptor β-adrenérgico sintético y dan lugar al complejo agonista-receptor que a su vez activa a la proteína Gs. La subunidad α de la proteína Gs activa a la adenilato-ciclasa, enzima que produce el monofosfato de adenosina cíclico (AMPc), una de las principales moléculas de señalización intracelular. Esta molécula produce sus efectos al unirse a la subunidad reguladora de la cinasa proteica A, para liberar la subunidad catalítica que fosforila a las proteínas intracelulares; estas proteínas tienen papeles funcionales vitales para una variada gama de acciones que van a permitir la entrada de Ca++ a la célula, hasta mediar la síntesis de proteínas clave para la actividad celular (24,25).
Los receptores β-adrenérgicos difieren en el largo de la cadena de aminoácidos: los β1 están constituidos de 477, los β2, de 413, y los β3, de 408 aminoácidos (26). La homología de los tres subtipos entre especies es de 45-60%; mientras la homología entre especies para cada subtipo es mayor al 70%; además, la localización de estos receptores está muy relacionada con los efectos que estos inducen. Los β1 predominan en el corazón al estimular su inotropismo (fuerza de contracción) y en el músculo liso intestinal inducen relajación, mientras que los β2 se localizan en los bronquios y músculo uterino, e inducen relajación en ambos casos. Evidentemente, la magnitud de la actividad fisiofarmacológica de un agonista o agonista parcial b-adrenérgico dependerá de su denominada actividad intrínseca en el receptor y distribución en los tejidos blancos (7,16,27,28).
Fisiológicamente, un aumento de la síntesis proteica muscular y una disminución en la degradación de proteína muscular o una combinación de ambas producen el crecimiento del músculo esquelético que lleva a hipertrofia. El CCL incrementa el flujo sanguíneo (sobre todo de los músculos de los cuartos traseros), lo cual permite el proceso de hipertrofia en el músculo esquelético al transportar mayores cantidades de sustratos y fuentes de energía para la síntesis de proteína. Otra de las principales acciones del CCL es la disminución en la cantidad de la grasa en la canal. Se ha demostrado in vitro la degradación de triacilgliceroles en adipocitos, la inhibición de la síntesis de ácidos grasos y de triacilglicerol; el tejido de los animales presenta una actividad lipolítica aumentada, una actividad lipogénica disminuida, o ambas. La elevación de la concentración plasmática de ácidos grasos no esterificados después de la administración del CCL confirma la actividad lipolítica que ocurre en los adipocitos (5,11,15,18).
En el músculo, además de la hipertrofia, ocurren cambios en el tipo de fibra muscular. También hay cambios en la proporción de ARN de transcripción para proteínas musculares como la miosina y actina. En ovinos y bovinos se ha observado que aumenta el peso muscular en 40%. La magnitud de la respuesta varía dependiendo del b adrenérgico suministrado, así como de la influencia de factores como son la especie, la raza, la edad, el sexo y la dieta (29-31).
El CCL anabólico no esteroideo es también utilizado en la actualidad durante competencias deportivas (dopaje). Induce hipertrofia del tejido músculo-esquelético; su efecto se produce a través de los receptores β2-adrenérgicos con regulación controlada de la expresión de los factores de crecimiento de la insulina (IGF), que desempeñan un papel esencial en el desarrollo, crecimiento y regeneración del tejido músculo-esquelético. Las células satélites de los músculos son mononucleadas y residen entre el sarcolema y la lámina basal de las miofibras adultas. En respuesta a los estímulos, como la carga mecánica, descarga, denervación y lesión son activadas a través de varios factores de crecimiento que contienen IGF. Esto permite que haya cambios adaptativos como son la hipertrofia, la alteración del tipo de fibras y la regeneración (4,22,27,32).
NORMATIVIDAD SOBRE EL USO DE CCL
Organismos internacionales como la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO); la Organización Mundial de la Salud (OMS); el Codex Alimentarais; la Administración de Drogas y Alimentos (FDA), y la Comunidad Europea, y nacionales como el Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria (Senasica); la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (Sagarpa), y la Secretaría de Salud, involucrados en la producción, proceso y supervisión del procesamiento de alimentos, tienen como instrucción la de procurar la fabricación de productos de alta calidad, seguros e inocuos (8,9,27,33). Deben incluir la vigilancia del grado "establecido" de residuos de sustancias acorde con estándares internacionales; deben valorar y reconsiderar medidas emergentes por el uso incorrecto del CCL como riesgo para la salud humana y animal.
En México, Sagarpa (34,35), tanto en el ámbito estatal como en el federal, para mantener operativos de vigilancia y control, para la erradicación del uso del CCL, emitió en 1999 la Norma Oficial Mexicana NOM-061-ZOO-1999 (34), que prohibió su utilización en todo el territorio nacional. Esta norma, en su capítulo cuatro, en las especificaciones zoosanitarias de los productos alimenticios para uso animal, indica que es imperante adoptar buenas prácticas en la producción animal, a través de una adecuada alimentación animal, lo cual puede minimizar los riesgos zoosanitarios, lo que a su vez redundará en un incremento de la productividad en las especies para abasto. Al mismo tiempo se hace hincapié en cuidar y salvaguardar la salud pública, evitando el uso de sustancias prohibidas como el CCL (34,35).
Asimismo, la Ley Federal de Sanidad Animal (9), en su título sexto, refiere que debe estar bajo control el uso y consumo de productos en los animales, establecimientos, actividades y servicios; esto implica su adecuada vigilancia y regulación sanitaria. Para establecer y registrar a todos aquellos productos para uso o consumo animal que por sus condiciones de inocuidad, eficacia y riesgo requieran de autorización, debe establecerse una solicitud del usuario, de la cual, después de pruebas de laboratorio y valoración por expertos de la Secretaría, se expedirá un número de registro y un oficio de autorización.
La Secretaría expedirá las disposiciones de sanidad animal en las que determinará las características y especificaciones zoosanitarias que debe reunir: la fabricación, la importación, el almacenamiento, la distribución, la comercialización y la aplicación de los productos para uso o consumo animal; la información zoosanitaria que deben contener las etiquetas, instructivos y recomendaciones sobre su aplicación, uso y manejo de productos; el tiempo de retiro de antibióticos, antimicrobianos, aditivos hormonales, químicos y plaguicidas, entre otros, en los animales vivos; los límites máximos de residuos en productos y subproductos de origen animal, así como un programa de monitoreo de residuos tóxicos (9). Se ha determinado que en el uso de productos alimenticios, alimentos balanceados, suplementos lácteos y todos aquellos alimentos que incluyan en su formulación antimicrobianos (36), cuya indicación sea como terapéutico o modulador del crecimiento en los animales, deben señalar en su etiqueta la leyenda de "alimento medicado"; esto garantizaría un adecuado uso en la productividad de las diferentes especies para abasto.
USOS Y REPERCUSIONES DEL CCL
En medicina humana el CCL es un medicamento broncodilatador para el tratamiento del asma y en físicoculturismo es utilizado por su efecto anabólico. Como broncodilatador, bajo supervisión y prescripción médica, la dosis es de 10, 20 y hasta 40 μg/adulto; y de 0,8 μg/kg en bovinos y equinos. Con fines terapéuticos es un potente simpaticomimético con gran afinidad por los receptores β2 de la zona bronquial, elimina el broncoespasmo, estimula la vibración de los cilios bronquiales, facilita la expectoración y aumenta la ventilación pulmonar con efecto prolongado. Para broncoespasmo, bronquitis, bronquiolitis, enfermedad pulmonar crónica obstructiva y afecciones pulmonares agudas y crónicas ha dado buenos resultados al ser administrado conjuntamente con antibióticos, y a su vez en la prevención de reacciones alérgicas respiratorias (13,37,38).
El uso clandestino de CCL a dosis diez veces o superiores a la terapéutica, sin respetar el periodo de retiro (40 a 60 días), antes del sacrificio de los animales para abasto, principalmente bovinos, ha sido confirmado por varios investigadores a través de procesos de laboratorio (ensayo inmunoenzimático, cromatografía de gases y cromatografía de líquidos de alta resolución), reconocidos internacionalmente como métodos analíticos para la detección de esta sustancia (2,4-7,19,23,33,39). Estrada-Montoya y colaboladores (18), en un monitoreo en carne de bovino a CCL, de un total de 50 muestras obtenidas del mercado y analizadas por prueba de Elisa (Enzyme Linked Immunosorbent Assay), detectaron 6 muestras (12%) con residuos de CCL en un rango de 3,06 a 6,12 μg/kg; trece (26%) en 0,5-1,82; 24 (48%) de 0,1 a 0,5, y siete muestras (14%) se encontraron por debajo del límite de detección (0,1 μg/kg). Las seis muestras con los valores más altos de CCL se confirmaron a través de cromatografía de gases acoplada a un detector selectivo de masas-masas (18).
El comité mixto FAO/OMS de Expertos en Aditivos Alimentarios, considerando el efecto residual y toxicidad del CCL, ha registrado que el límite máximo de residuos de CCL en bovinos, de 0,2 μg/kg en músculo y grasa, 0,6 μg/kg en el hígado y riñones y 0,05 μg/l de leche. A partir de estos valores, la ingesta diaria máxima sería de 0,235 µg, sobre una base de consumo diario de alimento de 300 g de músculo, 100 g de hígado, 50 g de riñón y grasa (8).
En el registro de dos casos de intoxicación por consumir hígado de res contaminado con CCL, los pacientes presentaron signos de tremor muscular, náuseas e incoordinación; tras la auscultación mostraron un incremento de la frecuencia cardiaca (90/ min) y aumento de la presión arterial (140/80 mmHg), y en el examen hematológico se halló leucocitosis 12,1-12,2 G/L, acompañados de neutrofilia (76,6-83,9%), hipercalemia (2,7-2,8 mmol/L) e hiperglucemia (172-218 mg/dL) (14).
Su uso a dosis elevadas puede provocar un depósito en diferentes órganos, principalmente en el hígado. Esta acumulación puede inducir intoxicación en las personas que consuman dicho tejido. El problema potencial en salud pública se debe a la concentración de este en los alimentos ingeridos. Los efectos derivados de la ingesta de productos contaminados con CCL son: adormecimiento de las manos, temblor, dolor muscular, nerviosismo y cefalea. En sobredosis agudas extremas, no derivadas de la ingesta de productos con residuos, sino resultado de una sobredosis (dopaje) accidental de productos farmacéuticos de la línea humana que contienen clembuterol, se acentúa la taquicardia, el adormecimiento, el nerviosismo, el temblor muscular, y puede haber necrosis del miocardio por disminución de la perfusión generada por el acortamiento de la diástole, etapa en la que se lleva a cabo la irrigación del miocardio por las coronarias (29,40). Además, puede originar un aumento en la presión sanguínea, enfermedades tiroideas, alergias, y puede provocar la muerte por falla cardiaca (infarto al miocardio) (3, 9,11-14,40,41).
En becerros, el grado inicial más alto después de una dosis de 5 μg/kg/día, considerada como promotora del rendimiento, fue de 0,5 ng/mL entre las dos y las siete horas luego de la aplicación. Después de 21 días, el grado pico llegó a 1,1 ng/mL, cuatro horas después de la dosificación, debido probablemente a que se alcanzó el denominado estado estable con un ligero grado de acumulación. En vacas lactantes dosificadas de manera periódica y continua a razón de 5 μg/kg cada 12 horas, se alcanzó un grado plasmático máximo de 5-5,5 ng/ mL de 5 a 7 días después de su administración (4,25).
En bovinos, a dosis bajas (consideradas como promotoras del rendimiento productivo), el CCL induce: aumento de la presión sanguínea, incremento transitorio de la frecuencia cardiaca durante 24 horas aproximadamente, incremento de la tasa metabólica, y se ha informado que aumenta la tasa de cojeras. No se tienen documentados los efectos de una sobredosis en esta especie, pero no deben diferir de lo anterior más que en su magnitud (23,25,31,41).
Al valorar el efecto nocivo en salud animal, en un estudio dirigido por Paz-Calderón y colaboradores (42), al realizar un diagnóstico de situación en bovinos para abasto (n = 150), determinaron la positividad del total de animales a clembuterol con niveles de 123,1 ± 0,25 ng/mL a 989,4 ± 12,8 ng/mL. En el mismo estudio obtuvieron los testículos de cada animal, con lo cual se detectó el crecimiento testicular en el 32,5% y atrofia en un 67,5% de los animales, así como edema del epidídimo; el peso de los testículos fluctuó entre 90,5 ± 4,7 g a 425,9 ± 8,9 g (valor normal: 200-300 g). Al realizar un corte testicular para realizar frotis, observaron ausencia de espermatozoides en el epidídimo (cabeza, cuerpo y cola) en un 92% de los animales, y detectaron solo líquido seminal. En los casos en los que se obtuvo semen, los espermatozoides presentaron anormalidades espermáticas: espermatozoides sin cola (60%) y poca cantidad de espermatozoides viables (42%). El trabajo de estos investigadores concluye que el CCL inhibe la maduración testicular posiblemente por aumento de la temperatura corporal y baja producción de la hormona testosterona en las células intersticiales de Leydig.
Además de lo anterior, es importante considerar que también en bovinos productores de leche es factible el uso de CCL. En el estudio de Stoffel y Meyer (43), para valorar las concentraciones contenidas en leche, al suministrar a vacas en producción 5 μg/kg de CCL, se determinó la eliminación de la sustancia a través de la leche entre el día 5 y 7, cuando alcanzo máxima concentración, después de iniciada la dosificación, con concentraciones de 5,5-22,5 ng/mL (promedio de 12,5 ng/mL). Estas concentraciones son altas, y por eso se debe valorar también en la inocuidad y seguridad de los consumidores de este producto.
CONCLUSIONES
Para los productores la inclusión de CCL en la dieta de bovinos genera importantes ganancias económicas. Sin embargo, los problemas en salud pública y animal requieren que especialistas del sector salud, médicos veterinarios y epidemiólogos trabajen en conjunto para salvaguardar la salud colectiva. Deben establecerse, instrumentarse y aplicarse sanciones penales severas a aquellos que utilicen CCL para fomentar la producción pecuaria. Es necesario realizar la valoración de los animales que llegan al rastro a través de la evaluación de CCL antes del sacrificio (en suero sanguíneo u orina) de los animales, o en sus productos finales a cero residuos que garanticen la calidad e inocuidad alimentaria.
En la actualidad, el registro de productor confiable por parte de la Sagarpa permite el registro de unidades de producción ganadera; con el trabajo, la evaluación y el monitoreo continuo se puede establecer la seguridad e inocuidad alimentaria. La Secretaría, a su vez, con la promoción del consumo de carne y productos de origen animal proveniente de unidades de producción pecuaria que cuenten con la certificación de hato libre de residuos de CCL, coadyuvara en la mejora de la salud pública.
REFERENCIAS
1. Organización Mundial de la Salud (OMS). Estrategia global de la OMS para la inocuidad de los alimentos: alimentos más sanos para una salud mejor. Ginebra, 2002. [ Links ]
2. García A. Alerta epidemiológica por la intoxicación en humanos con clenbuterol y su empleo en la alimentación del ganado. Rev Sanid Milit Méx. 2002;56(3):131-4. [ Links ]
3. Valladares CB, Montes de Oca JR, Zamora EJL, Velázquez OV, Posadas ME, Peña BSD. Influence of the use of additives and growth promoters on the herd health. In: Salem AFZM. Feed nutrients and animal health. Roles of some nutrients in animal health. Deutschland: Lambert Academic Publishing, 2013. [ Links ]
4. Boato G. Synthesis and characterization of new beta agonists of probable illicit use in animal productions. In: Van Ginkel LA, and Ruiter A, editors. Residues of veterinary drugs in food. Veldhoven, NL; 2000. p. 237-41. [ Links ]
5. Valladares CB, Velázquez OV, Zamora EJL, Avilés MJA, Zaragoza BA, Posadas SMA. Implications of the use of clenbuterol hydrochloride in beef cattle. In: Salem AFZM. nutritional strategies of animal feed additives. Nueva York: Nova Science Publishers, Inc., 2013. [ Links ]
6. Abraham G, Brodde OE, Ungemach FR. Pharmacological and biochemical characterization of the u-adrenergic signal transduction pathway in different segments of the respiratory tract. Biochem Pharmacol. 2003;66(6):1067-81. [ Links ]
7. Valladares CB, Bañuelos VR, Peña BSD, Velázquez OV, Velázquez AY, Nava OA. Illegal use of clenbuterol in cattle production in México. Health. 2014;6:673-676. [ Links ]
8. Codex Alimentarius. Límites máximos de residuos para clenbuterol. 34a Reunión de la Comisión del Codex Alimentarius FAO/OMS. Roma, 2011. p. 274. [ Links ]
9. Ley Federal de Sanidad Animal. México [internet]. 2007 (Diario Oficial de la Federación 25-7-2007). Disponible en: http://www.diputados.gob.mx/LeyesBiblio/pdf/LFSA.pdf [ Links ]
10. Zalco D, Bories G, Tulliez J. Metabolic fate of clenbuterol in calves. J Agric Food Chem. 1998;46(5):1935-43. [ Links ]
11. Valladares CB, Velázquez OV, Posadas ME, Peña BSD, Zamora EJL, Ortega SC, Alonso FU. Determinación de clorhidrato de clenbuterol en suero sanguíneo de bovinos para abasto del estado de Guerrero, México. En: Nava Moreno B. Seguridad alimentaria y producción ganadera en unidades campesinas. México: Universidad Autónoma de Chapingo, 2013. [ Links ]
12. Barbosa J, Cruz C, Martins J, Silva JM, Neves C, Alves C, et al. Food poisoning by clenbuterol in Portugal. Food Addit Contam. 2005;22(6):563-6. [ Links ]
13. Brambilla G, Cenci T, Franconi F, Galarini R, Macri A, Rondoni F, et al. Clinical and pharmacological profile in a clenbuterol epidemic poisoning of contaminated beef meat in Italy. Toxicol Lett. 2000;114(1-3):47-53. [ Links ]
14. Carrola P, Devesa N, Silva JM, Ramos F. Intoxicación por agonistas beta adrenérgicos. Acta Med Port. 2003;16:275-8. [ Links ]
15. Ramos F, Baeta ML, Reis J, Silveira MI. Evaluation of the illegal use of clenbuterol in portuguese cattle farms from drinking water, urine, hair and feed samples. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 2009;26(6):814-20. [ Links ]
16. Mitchell GA, Dunnavan G. Illegal use of u-adrenergic agonistic in the United States. J Anim Sci. 1998;76(1):208-11. [ Links ]
17. Dimaano JQ, Burda AM, Korah JE, Wahl M. Street drugs possibly tainted with clenbuterol. J Emerg Nurs. 2008;34(6):582-3. [ Links ]
18. Estrada-Montoya MC, González-Córdova A, Torrescano G, Camou J, Vallejo-Córdova B. Monitoreo y confirmación de la presencia de residuos de clenbuterol en carne de bovino comercializada en el Noroeste de México. Cienc Tecnol Aliment. 2008;6(2):130-6. [ Links ]
19. Morales-Trejo F, Vega y León S, Escobar-Medina A, Pérez-González JJ, Urbán-Carrillo G, Gutiérrez-Tolentino R. Desarrollo de un método de cromatografía líquida de alta resolución para la determinación y cuantificación de clenbuterol en hígado de bovino. Rev Salud Anim. 2013;35(1):38-44. [ Links ]
20. Jiménez SLA, Garza RJ, Sumano LH, Fragoso SH. Sanitary surveillance in illegal use of clenbuterol and its intersectoral coordination in two states of Mexico. Vet Méx. 2011;42(1):11-25. [ Links ]
21. Ishikawa C. Effects of clenbuterol, a u2-adrenergic agonist, on sizes of masseter, temporalis, digastric, and tongue muscles. Open Dent J. 2009;3:191-6. [ Links ]
22. Mersmann HJ. Overview of the effects of u-adrenergic receptor agonist on animal growth incluiding mechanims of action. J Anim Sci. 1998;76(1):160-72. [ Links ]
23. Choo JJ, Horan MA, Little RA, Rothwell NJ. Anabolic effects of clenbuterol on skeletal muscle are mediated by b2-adrenoreceptor activation. Am J Physiol. 1992;263(1 Pt 1):E50-6. [ Links ]
24. Badino P, Odore R, Re G. Are so many adrenergic receptor subtypes really present in domestic animal tissues? A pharmacological perspective. Vet J. 2005;170(2):163-74. [ Links ]
25. Mazzanti G, Daniele C, Boatto G, Manca G, Brambilla G, Loizzo A. New u-adrenergic agonists used ilicity as growth promoters in animal breeding: chemical and pharmacodynamic studies. Toxicol. 2003;187(2-3):91-99. [ Links ]
26. Strosberg AD. Structure, function, and regulation of adrenergic receptors. Protein Sci. 1993;2(8):1198-209. [ Links ]
27. Valladares CB, Bañuelos VR, Peña BSD, Velázquez OV, Zamora EJL. Biocinética y lesiones histológicas del clorhidrato de clenbuterol en modelo conejo [internet]. En: Ramos M, Aguilera V, editores. Ciencias Agropecuarias, Handbook [citado 2014 nov 15]. Valle de Santiago, Guanajuato: Ecorfan, 2014. p. 61-69. Disponible en http://www.ecorfan.org/handbooks_agro2.php. [ Links ]
28. Berdeaux R, Stewart R. cAMP signaling in skeletal muscle adaptation: hypertrophy, metabolism, and regeneration. Am J Physiol Endocrinol Metab. 2012;303(1):E1-17. [ Links ]
29. Barry AR, Graham MM. Case report and review of clenbuterol cardiac toxicity. J Cardiol Cases. 2013;8(4):131-3. [ Links ]
30. Meyer HD, Rinde LM. The pharmacokinetics and residues of clenbuterol in veal calves. J Anim Sci. 1999;69(11):4538-44. [ Links ]
31. Lynch GS, Ryall JG. Role of b-adrenoceptor signaling in skeletal muscle: implications for muscle wasting and disease. Physiol Rev. 2008;88(2):729-67. [ Links ]
32. Brett J, Dawson AH, Brown JA. Clenbuterol toxicity: a NSW poisons information centre experience. Med J Aust. 2014;200(4):219-21. [ Links ]
33. USDA. Screening and confirmation of beta-agonist by HPLC/MS/MS - CLG-AGON1.4. United States, Departament of Agriculture, Food Safety and Inspection Service, Office of Public Health Science, 2012. [ Links ]
34. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. NOM-061-ZOO-1999, Especificaciones zoosanitarias de los productos alimenticios para consumo animal. México: Diario Oficial de la Federación, 2000. [ Links ]
35. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. NOM-EM-015-Z00-2002. Especificaciones técnicas para el control de beta-agonistas en los animales. México: Diario Oficial de la Federación. 2002. [ Links ]
36. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. NOM-040-ZOO-1995. Especificaciones para la comercialización de sales puras antimicrobianas para uso en animales o consumo por éstos. México: Diario Oficial de la Federación, 1996. [ Links ]
37. Daubert GP, Mabasa VH, Leung VW, Aaron C. Acute clenbuterol overdose resulting in supraventricular tachycardia and atrial fibrillation. J Med Toxicol. 2007;3(2):56-60. [ Links ]
38. Laan TJ, Bull S, van Nieuwstadt RA, Fink-Gremmels J. The effect of aerosolized and intravenously administered clenbuterol and aerosolized fluticasone propionate on horses challenged with Aspergillus fumigatus antigen. Vet Res Commun. 2006;30(6):623-35. [ Links ]
39. Norma ISO/IEC 17025. Requisitos generales para la competencia de laboratorios de ensayo y calibración. Organización Internacional de Normalización (ISO), 2005. [ Links ]
40. Ke Y, Fu LL, Hong XF, Dong R, Xu TM, Gou JF, et al. Acute clenbuterol induces hypotension, atrioventricular block and cardiac asystole in the rabbit. Cardiovasc Toxicol. 2013;13(1):85-90. [ Links ]
41. Hoffman RJ, Hoffman RS, Freyberg CL, Poppenga RH, Nelson LS. Clenbuterol ingestion causing prolonged tachycardia, hypokalemia and hypophosphatemia whit confirmation by quantitative levels. J Toxicol Clin Toxicol. 2001;39(4):339-44. [ Links ]
42. Paz-Calderón NM, Caicedo-Rivas RE, Hernández-Pérez B. Effect of clenbuterol in the levels of acid phosphatase "Prostatic fraction" in cattle males. Actas Iberoam Conserv Anim. 2011;1:136-40. [ Links ]
43. Stoffel B, Meyer HHD. Effects of the b-adrenergic agonist clenbuterol in cows: Lipid metabolism, milk production, pharmacokinetics, and residues. J Anim Sci. 1993;71(7):1875-81. [ Links ]