Revista de Medicina Veterinaria
ISSN 0122-9354
https://doi.org/10.19052/mv.3852
Concentraciones de glucemia e insulinemia en pollos broilers machos y hembras de cuatro semanas de edad y su relación con el peso
Glycemia and insulinemia concentrations in four-weeks-old male and female broilers and their relationship to weight
Concentrações de glicemia e insulina em broilers machos e fêmeas de quatro semanas de idade e sua relação com o peso
José H. Osorio1 / Yoccner E. Quenán2 / Gines F. Ramírez3
1 Laboratorio de Bioquímica Clínica y Patología Molecular. Universidad de Caldas. Calle 65 n° 26-10, Manizales, Colombia. Laboratorio de Investigación en Metabolismo. Universidad de Manizales. Carrera 9a n.° 19-03, Manizales, Colombia.
jose.osorio_o@ucaldas.edu.co.
2 Laboratorio de Investigación en Metabolismo. Universidad de Manizales. Carrera 9a n° 19-03, Manizales, Colombia.
yoccnerquenan@gmail.com
3 Departamento de Salud Animal. Universidad de Caldas. Calle 65 n° 26-10, Manizales, Colombia.
gines.ramirez@ucaldas.edu.co
DOI: 10.19052/mv.3852
Recibido: 6 de mayo de 2015. Aceptado: 14 de septiembre de 2015
Cómo citar este artículo: Osorio JH, Quenán YE, Ramírez GF. Contraciones de glucemia e insulinemia en pollos broilers machos y hembras de cuatro semanas de edad y su relación con el peso. Rev Med Vet. 2016;(32):21-28. doi: http://dx.doi.org/10.19052/mv.3852
Resumen
Introducción: el metabolismo de la glucosa en aves se relaciona directamente con la secreción de insulina, ya que esta hormona ejerce una función anabólica y a la vez esa respuesta se refleja en el crecimiento de las aves. Es escasa la información que se tiene sobre variables como sexo, edad y peso y su incidencia en la secreción de insulina y su regulación sobre las concentraciones de glucosa. Objetivo: comparar las concentraciones de insulina, glucosa y peso en pollos broiler de cuatro semanas de edad analizando sus valores entre hembras y machos; establecer valores de referencia para los niveles de insulina, glucosa y peso en pollos broiler de cuatro semanas de edad. Materiales y métodos: muestras de sangre en ayunas de ochenta pollos de engorde de ambos sexos (línea Cobb 500 de cuatro semanas de edad). Se determinaron los niveles de insulina mediante inmunoensayo enzimático tipo sandwich, la glucemia mediante glucómetro; para el peso se utilizó una balanza. Los resultados fueron analizados a través del programa estadístico Stata; se acepta una diferencia estadísticamente significativa cuando p es < 0,05. Resultados: los valores de la insulina son de 0,60 ± 0,63 ng/ml; en relación con los niveles de glucemia los machos reportaron valores de 415,45 ± 40,52 mg/dl; las hembras reportaron valores de 350,72 ± 68,37 mg/dl y, finalmente, los valores de peso en machos fue de 963,73 g y en hembras de 865,64 g. Conclusiones: los machos tienen mayor peso que las hembras. Las concentraciones de glucemia en los machos es mayor que las hembras y se determina que los valores de referencia de acuerdo con el sexo son: hembras (mg/dl) 350,72 ± 68,37 y machos (mg/dl) 415 ± 40,52, y, finalmente, los niveles de insulina son mayores en las hembras que en los machos.
Palabras clave: insulina, peso, glucemia, pollos de engorde, metabolismo.
Abstract
Introduction: Glucose metabolism in birds is directly related to insulin secretion, given that this hormone exerts an anabolic function and this response is reflected in the growth of poultry. There is little information on variables such as sex, age and weight, and their effect on insulin secretion and the regulation of glucose concentrations. Objective: To compare concentrations of insulin, glucose, and weight in four-weeks-old male and female broiler chickens, in order to establish reference values for them. Materials and methods: Fasting blood samples were collected from 80 broilers of both sexes (four-weeks-old Cobb 500 line). Enzyme immunoassay (sandwich method) was used to determine levels of insulin, glucometer for glycemia levels, and scales for weight. Results were analyzed using the Stata statistical program; a statistically significant difference is accepted when p is <0.05. Results: Insulin values are 0.60 ± 0.63 ng/mL; regarding glucose levels, males reported values between 415.45 ± 40.52 mg/dL, and females between 350.72 ± 68.37 mg/dL; finally, weight values were 963.73 g in males and 865.64 g in females. Conclusions: Males are heavier than females. Glycemia concentrations are higher in males than in females; reference values according to sex are: in females (mg/dL) 350.72 ± 68.37, and in males (mg/dL) 415 ± 40.52; finally, insulin levels are higher in females than in males.
Keywords: insulin, weight, glycemia, broiler chickens, metabolism.
Resumo
Introdução: o metabolismo da glucose em aves se relaciona diretamente com a secreção de insulina, já que este hormona exerce uma função anabólica e ao mesmo tempo essa resposta se reflete no crescimento das aves. É escassa a informação que se tem sobre variáveis como sexo, idade e peso e sua incidência na secreção de insulina e sua regulação sobre as concentrações de glucose. Objetivo: comparar as concentrações de insulina, glucose e peso em frangos broiler de quatro semanas de idade analisando seus valores entre fêmeas e machos; estabelecer valores de referência para os níveis de insulina, glucose e peso em frangos broiler de quatro semanas de idade. Materiais e métodos: amostras de sangue em jejum de oitenta frangos de corte de ambos os sexos (linha Cobb 500 de quatro semanas de idade). Puderam-se determinar os níveis de insulina mediante imuno ensaio enzimático tipo sanduíche, a glicemia mediante glicômetro; para o peso se utilizou uma balança. Os resultados foram analisados através do programa estatístico Stata; se aceita uma diferença estatisticamente significativa quando p é < 0,05. Resultados: os valores da insulina são de 0,60 ± 0,63 ng/ml; em relação com os níveis de glicemia os machos reportaram valores de 415,45 ± 40,52 mg/dl; as fêmeas reportaram valores de 350,72 ± 68,37 mg/dl e, finalmente, os valores de peso em machos foi de 963,73 g e em fêmeas de 865,64 g. Conclusões: os machos têm maior peso que as fêmeas. As concentrações de glicemia nos machos são maiores que nas fêmeas e se determina que os valores de referência de acordo com o sexo são: fêmeas (mg/dl) 350,72 ± 68,37 e machos (mg/dl) 415 ± 40,52, e, finalmente, os níveis de insulina são maiores nas fêmeas que nos machos.
Palavras chave: insulina, peso, glicemia, frangos de corte, metabolismo.
INTRODUCCIÓN
En las aves, el páncreas realiza dos funciones: una exocrina y otra endocrina; en la primera segrega al duodeno enzimas digestivas y también iones y en la segunda realiza funciones por intermedio de los islotes de Langerhans (1). En las aves, los islotes se describen de acuerdo con la especie y el sitio lobar; sin embargo, de manera general los islotes están formados por cuatro tipo de células distintas: a, |3, 8 y F, productoras respectivamente de glucagón, insulina, somatostatina y polipéptido pancreático (2-5). La insulina es una hormona anabólica que regula el metabolismo de glucosa, lípidos, proteínas y factor de crecimiento (6). Estos efectos resultan de las cascadas de señalización y la unión al receptor de la insulina (7), lo que lleva a la producción de insulina para regular principalmente los índices de glucosa (8). Con relación a esta última, se puede establecer que es el principal combustible metabólico para las células de los animales, en especial para el sistema nervioso, puesto que es la única fuente de energía; además, la glucosa es utilizada por las aves para producir energía a través de la oxidación celular, la síntesis de glucógeno, la glucolisis, entre otros (9). La glucosa es una hexosa y es una aldosa, es un alimento que después de su metabolismo proporciona 3831 kcal/kg de energía neta (10). Para que la glucosa pueda generar energía debe ingresar al interior de la célula para acoplarse a la vía metabólica que predomine según las condiciones hormonales y energéticas del momento en el animal (11).
La glucosa no se puede difundir directamente en el interior de las células; por tanto, existen dos mecanismos de transporte: uno por difusión, facilitado a través de la membrana plasmática, que se realiza a través de proteínas transportadoras de glucosa conocidas como GLUT de las que se han descrito aproximadamente 140, y un sistema de cotransportador de sodio/glucosa, del que existen seis isoformas (12,13).
Los primeros se dividen en tres familias: clase I: GLUT del 1 al 4; clase II: GLUT 6, 8 y 10; y clase III: GLUT 5, 7, 9 y 11 (14). La glucosa se une al transportador, cambia su conformación y transporta la glucosa para ser transportada; en el hígado de los pollos de engorde se han reportado genes de las isoformas de transportadores de glucosa (GLUT 1 y 2); sin embargo, las concentraciones de proteína GLUT 1 son indetectables en el hígado de los pollos que sugieren que esto puede no ser un transportador importante para esta ave (15). El hígado aviar aporta de manera significativa a la producción de las cantidades circulantes de glucosa y es sensible a la disminución de la ingesta de alimentos, de tal manera que en un ayuno de 6 a 24 horas se disminuyen las concentraciones de glucógeno hepático y aumenta la gluconeogénesis (16,17). Para el caso del sistema cotransporte de glucosa acoplado al sodio, estos se encuentran ubicados en el epitelio intestinal y en el epitelio de los túbulos contorneados proximal y distal. La función consiste en que permiten la absorción rápida de la glucosa desde el íleo hacia el sistema portal y además de la reabsorción de la glucosa filtrada en el glomérulo nuevamente al torrente circulatorio. Este sistema se denomina sodium/glucose transporters (SGLT), del cual se conocen seis isoformas (SGTL1-6) que aprovechan el transporte del Na+ a favor de su gradiente de concentración para generar una corriente electroquímica que produce los cambios conformacionales necesarios para la traslocación de la glucosa a través de la membrana plasmática (18).
Con los dos sistemas se garantizan concentraciones de glucosa en el torrente sanguíneo que proporcionan energía en forma de trifosfato de adenosina (ATP) y otros productos intermedios para otras rutas metabólicas; esta energía producto del metabolismo de la glucosa tiene la capacidad de estimular la liberación de insulina (19). La síntesis de esta hormona se genera en las células Β del páncreas, a través de un precursor denominado preproinsulina. El fragmento N-terminal de 24 aminoácidos es eliminado enzimáticamente durante su paso por el retículo endoplasmático y así da lugar a la proinsulina. La proinsulina es una molécula formada por las cadenas A y B de la insulina madura que se encuentran unidas por un péptido C. Este enlaza el extremo carboxiterminal de la cadena B con el extremo N-terminal de la cadena A, y facilita la formación de los puentes disulfuro. Por eliminación proteolítica del péptido C, se genera la insulina madura, que tiene un peso molecular de 5600 Da aproximadamente (9,20).
Se ha descrito que el páncreas aviar contiene pequeñas cantidades de insulina, es decir, tiene poco potencial insulinogénico y su liberación es lenta en respuesta a la alta carga de glucosa. La liberación de insulina en las aves no se afecta por el ayuno, las hormonas y la estimulación vagal. En sistemas aviar in vitro, la insulina no tiene efectos antilipolíticos y es poco lipogénica; esta es una diferencia en relación con los mamíferos y humanos (4,9). Los receptores Β-adrenérgicos en pollos regulan la secreción adrenérgica de insulina (21). No se reportan trabajos de investigación que se orienten a estudiar sexo, edad y peso como incidencia en la secreción de insulina y su regulación sobre los niveles de glucosa, por el contrario, se observa que la tendencia de los últimos estudios se enfoca en receptores, cotransportadores de glucosa; entre otros, y no tienen en cuenta los factores mencionados, puesto que la fisiología de la insulina se ve afectada por las hormonas, el sexo y el peso. Por lo tanto, el objetivo del presente estudio fue comparar los niveles de insulina, glucosa y peso en pollos broiler de cuatro semanas de edad analizando su correlación entre hembras y machos; igualmente, se establecieron valores de referencia para los niveles de insulina, peso y glucemia en pollos broiler de cuatro semanas de edad.
MATERIALES Y MÉTODOS
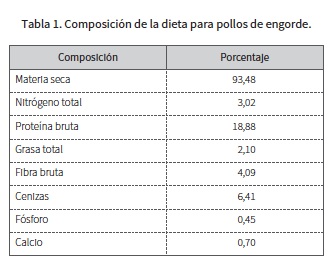
Se obtuvieron muestras de sangre en ayunas de 80 pollos de engorde de la línea Cobb 500 de cuatro semanas de edad (40 hembras y 40 machos) elegidos completamente al azar dentro de un lote de 300 animales, criados en ambiente controlado en la vereda Morrogordo, finca El Remanso, ubicada en el municipio de Manizales, Colombia (05°46'51" y 04°48'20" de latitud norte, y 74°38'01" y 75°55'45" de longitud oeste), a 1800 m s. n. m. y con una temperatura promedio de 23 °C, con 12 horas de luz y 12 de oscuridad. Fueron alimentados con una dieta comercial conocida para pollo de engorde, con la siguiente composición en términos de porcentaje: materia seca 93,48; nitrógeno total 3,02; proteína bruta 18,88; grasa total 2,1; fibra bruta 4,09; cenizas 6,41; fósforo 0,45; calcio 0,7 (tabla 1). El peso promedio en el momento de la toma de muestras (día 21) fue de 963,73 g en machos y en hembras de 865,64. Tuvieron un ayuno de 19 h y se tomaron 20 cm de sangre directamente de la yugular, durante el proceso de sacrificio. La sangre se centrifugó a 3000 r. p. m. por 15 min, y el suero se congeló a -30 °C hasta el momento de las determinaciones. Los reactivos que se usaron para la medición de la insulina en los pollos fueron de tipo humano, previa estandarización del uso de estos kits comerciales en las muestras de las aves. Se debe tener en cuenta, además, la alta homología del gen de la insulina, entre las distintas especies, ya que se sabe que los genes de insulina humana tienen homología con animales como: chimpancé, perro, ratón, rata, pollo, pez cebra y rana (22). Para la determinación de la insulina se utilizó la prueba de Elisa tipo sándwich en fase sólida (InvitrogenTM Human insulin Elisa kit); donde un anticuerpo monoclonal específico para la insulina humana ha sido revestido sobre los pocillos de las tiras de microtitulación proporcionadas. 50 de los estándares, controles y las muestras fueron pipeteadas en estos pocillos, seguido por la adición de 50 de un anticuerpo monoclonal secundario antiinsulina humana conjugado con biotina. Luego de 90 min de incubación a temperatura ambiente, se hace un lavado para liberar aquellas moléculas no unidas y se agregan 100 de la enzima estreptavidina-HRP. Después de una segunda incubación de 15 min y el lavado para eliminar toda la enzima no unida, se añaden 100 de una solución de sustrato formada por una mezcla de tetrametil bencidina (TMB) y peróxido de hidrógeno disuelto en buffer de acetato, que recibe la acción de la enzima unida para producir color. La intensidad de este producto coloreado es directamente proporcional a la concentración de insulina humana presente en la muestra original. Por último, se detiene la reacción al agregarle 100 de una solución de parada. La lectura se hace en un equipo lector de micro-Elisa (TitertekMultiscan™) a una absorbancia de 450 nm; las absorbancias obtenidas de los estándares se grafican junto con las concentraciones y de la curva de calibración se obtienen las concentraciones de insulina de las respectivas muestras. Para determinar la glucemia se utilizó un glucómetro marca Accu-Chek Sensor® (laboratorio Roche), con sangre venosa extraída de la vena yugular en tubos sin anticoagulante, midiéndose inmediatamente la glucemia en mg/dl (23). Las aves se pesaron en el momento del sacrificio, empleando una balanza con capacidad de 5 kg y precisión de 1 g.
Análisis estadístico. Los resultados fueron analizados a través del programa estadístico Stata versión 13 para Windows, en el se aceptaba la diferencia estadísticamente significativa cuando el valor de p es < 0,05.
El estudio fue aprobado por el Comité de Bioética Animal de la Universidad de Caldas.
RESULTADOS
De forma general, la insulina muestra valores expresados en ng/ml de: 0,60; 0,0092; 2,52 y 0,63 para promedio, rango mínimo, rango máximo y desviación estándar respectivamente.
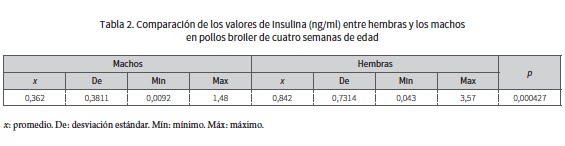
Al hacer las comparaciones entre grupos, las hembras reportaron valores (ng/ml) de promedio, mínimo, máximo y desviación estándar de 0,842; 0,043; 3,57 y 0,7314 respectivamente; los machos reportaron valores (ng/ml) de promedio mínimo, máximo y desviación estándar de 0,362; 0,009; 1,48 y 0,38 respectivamente, donde se encontró una diferencia estadísticamente significativa ya que el valor de p es menor 0,05 (0,000427), con una confiabilidad del 95 % (tabla 2) y se corrobora con una T de Student de 0,0004 donde los niveles de insulina son mayores en las hembras con un valor de 0,84 ng/ml.
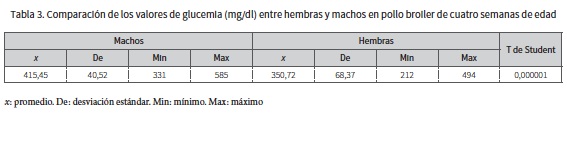
En relación con las concentraciones de glucemia se encontró que el grupo de los machos reportó valores (mg/dl) de promedio, mínimo, máximo y desviación estándar de: 415,45; 331; 585 y 40,52 respectivamente. Las hembras reportaron valores (mg/dl) de promedio mínimo, máximo y desviación estándar de: 350,72; 212; 494 y 68,37 respectivamente, donde se encontró diferencia estadísticamente significativa, ya que el valor de la T de Student es menor 0,05 (0,000001), con una confiabilidad del 95 % (tabla 3), donde los niveles de glucemia son mayores en los machos.
DISCUSIÓN
Los valores de insulina obtenidos de forma general sin discriminar sexo en el presente estudio son menores si se compara con los descritos por Hazelwood (2); los niveles en plasma de insulina en pollos y patos oscila entre 3 y 4 ng/ml; igualmente, él reporta valores por género y especies, mas no por sexo, concluyendo que los niveles plasmáticos de insulina no se ven afectados por el ayuno. Por el contrario, la liberación de insulina en aves es el resultado de procesos endocrinos, exocrinos, paracrinos, neurales y humorales; en este trabajo las concentraciones bajas de insulina, como es de esperarse, se relacionan con el estado de ayuno de los pollos.
En estudios similares se hicieron comparaciones para determinar las concentraciones de insulina con diferentes cargas de glucosa; allí se determinó que la elevación de la glucosa en medio de 200 a 500 mg/dl no afecta la liberación de insulina mientras que la elevación de 500 a 700 mg/dl de glucosa produce un aumento sostenido de la producción de insulina en pollos (24); en comparación con la liberación de insulina en mamíferos, en los pollos responde a altas concentraciones de glucosa y por periodos cortos (25).
En estudios similares, los niveles de insulina en plasma de águilas variaron ampliamente de 0,064 a 0,245 ng/ml, y fueron mayores en machos (26). En comparación con los resultados en pollos son similares; sin embargo, en el presente estudio los niveles de insulina fueron mayores en hembras en comparación con los machos.
También se encuentra que la concentración de insulina en el tejido pancreático de pollo y paloma se encuentra entre 20 y 80 ng/mg y entre 1,5 y 4 ng/mg, respectivamente (27).
En las aves adultas, la respuesta de la insulina a concentraciones normales de glucosa es disminuida, aunque en una misma especie la concentración de la insulina varía en función de las condiciones fisiológicas y ocasionalmente en función del origen de la sangre estudiada (vena porta o venas periféricas) (28-30).
Con respecto a la glucemia en estudios similares y con dieta rica en micronutrientes se ha determinado que los niveles de glucosa en el plasma sanguíneo de los pollos de engorde se encuentran en el rango de 152 a 182 mg/dL (31) sin discriminar por sexo. Estos resultados son menores si se compara con los encontrados en nuestro estudio; de igual manera se han reportado niveles de glucemia de acuerdo con la edad, determinando que en pollos jóvenes las concentraciones máximas de glucosa en sangre oscilan entre 200 y 250 mg/dl (32). Estudios realizados en aves silvestres (lora común: A. ochrocephala, A. aestiva, A. ochrocephala y A. amazónica), para determinar los niveles de glucemia, presentan valores de 293,76 ± 52,09 mg/dl, 136,5 ± 13,32 mg/dl, 140 ± 31, 172 ± 6 mg/dl y 185 ± 6 mg/dl (13). Con relación a los niveles encontrados en nuestro estudio, autores como Campbell sostienen que las concentraciones de glucosa en la sangre varían mucho dependiendo de la especies y, por tanto, la mayoría de las especies reportan valores entre 200 y 500 mg/dl (33) ; estos valores varían en función de la hora de extracción, edad o ayuno. Se relaciona la hipoglucemia con inanición, malnutrición, endocrinopatías, septicemia y enfermedad hepática. La hiperglucemia está asociada al periodo de cría, estrés, diabetes mellitus e hipertermia (34) . Se han reportado valores de glucosa en el plasma sanguíneo en pollos sometidos a diferentes condiciones de estrés, dentro del intervalo de 199,98 a 399,96 mg/dl y que se consideran fisiológicamente normales (35). Los niveles de glucemia tendientes a la hiperglucemia en este estudio pueden deberse al efecto excitatorio de la manipulación física, previo al sacrificio, la cual aumenta el estrés en los pollos, lo que desencadena el metabolismo de las reservas de glucógeno hepático y provoca una hiperglucemia transitoria (36), que para el presente trabajo se puede considerar normal.
Con relación al peso, el manual de crianza de pollos de la Gobernación del Valle del Cauca-Secretaría de Agricultura y Pesca establece (sin determinar sexo) que a la semana cuarta el peso promedio es de 1030 g (37); entre tanto el manual de crianza de la granja experimental de pollos de Avian Farms en Estados Unidos reporta promedios de peso a la cuarta semana teniendo en cuenta el sexo: machos 1311 g y hembras 1161 g (38). En el presente trabajo se encontraron los siguientes valores: en machos 963,73 g y en hembras de 865,64 g. Se debe tener en cuenta que factores como el medio ambiente y el manejo de la dieta interfieren en la ganancia de peso; en el presente estudio se determinó que existe diferencia significativa del nivel de peso entre machos y hembras, teniendo mayor peso los machos con una t-student de 0,000004 (menor a 0,05).
CONCLUSIONES
Existe diferencia estadísticamente significativa en el peso de machos y hembras, (p < 0,05), donde los machos tienen mayor peso que las hembras.
Con relación a los niveles de glucosa entre ambos sexos, se encontró diferencia estadísticamente significativa porque los valores de glucemia (mg/dl) en machos (415 ± 40,52) fueron superiores (p < 0,05) a los de hembras (350,72 ± 68,37); por tanto, al encontrarse influencia del sexo sobre las concentraciones de glucosa los valores de referencia para glucemia (mg/dl) de acuerdo con el sexo son: hembras (mg/dl) 350,72 ± 68,37 y machos (mg/dl) 415 ± 40,52, estos valores son mayores debidos al efecto de la manipulación física lo que estimula varias vías metabólicas.
También se evidencia una diferencia estadísticamente significativa en los niveles de insulina entre ambos sexos, porque los valores de insulina (ng/dl) en hembras (0,84 ± 0,73) fueron superiores (p < 0,05) a los de machos (0,38 ± 0,62).
CONFLICTOS DE INTERÉS
Los autores declaran la no existencia de conflicto de intereses de tipo económico o de otro tipo que pudiera suponer un sesgo del trabajo.
REFERENCIAS
1. Oglesbee BL, Orosz S, Dorrestein GM. The endocrine system. En Altman RB, Clubb SL, Dorrestein GM, editores. Avian medicine and surgery. Philadelphia: WB Saunders; 1997. p. 475-88. [ Links ]
2. Hazelwood RL. The avian endocrine pancreas. Am Zool. 1973;13:699-709. [ Links ]
3. Sitbon G, Mialhe P. The endocrine pancreas of birds. J Physiol. 1980;76:5-24. [ Links ]
4. Laurent F, Gross R, Lakili M et al. Effect of insulin on glucagon secretion mediated via glucose metabolism of pancreatic A cells in ducks. Diabetologia. 1981; 20:72-7. [ Links ]
5. Laurent F, Karmann H, Gross R et al. Glucagon and somatostatin secretion from the perfused splenic bulb of duck pancreas. Acta Endocrinol (Copenh). 1986;113:272-80. [ Links ]
6. Cheatham B, Kahn CR. Insulin action and the insulin signaling network. Endocr Rev. 1995; 16:117-42. [ Links ]
7. Sue Chan. Insulin Receptor. En Enna SJ y David B. Bylund, editores. xPharm: The Comprehensive Pharmacology Reference.Elsevier. 2007. p. 1-5. [ Links ]
8. Gallagher EJ, LeRoith D. Insulin Mechanisms/Metabolic Actions. En William J, Lennarz M, Daniel L, editores. Encyclopedia of Biological ChemistryWaltham: Academic Press; 2013. p. 602-7. [ Links ]
9. Klasing KC. Comparative Avian Nutrition. Londres: CAB International; 1998. [ Links ]
10. Rostagno HS, Albino LFT, Donzele JL, et al. Tabelas brasileiras de aves e suínos, composição de alimentos e exigências nutricionais. Viçosa: UFV, Impressão Universitária; 2000. p. 141. [ Links ]
11. Zierler K. Whole body glucose metabolism. Am J Physiol. 1999; 276:409-26. [ Links ]
12. Barrett MP, Walmsley AR, Gould GW. Structure and function of facilitative sugar transporters. Curr Opin Cell Biol. 1999; 11: 496-502. [ Links ]
13. Castañeda FE, Buriticá-Gaviria EF, Cruz LJ. Referential haematocrite, haemoglobin, glucose and electrolyte values for yellow-crowned amazon (Amazona ochrocephala (Gmelin, 1788)) kept in captivity in Ibagué. Orinoquia, Villavicencio. 2012;16(2):67-77. [ Links ]
14. Uldry M, Thorens B. The SLC2 family of facilitated hexose and polyoltransporters. Pflugers Arch Eur J Physiol. 2004;447:480-9. [ Links ]
15. Kono T, Nishida M, Nishiki Y, Seki Y et al. Characterisation of glucose transporter (GLUT) gene expression in broiler chickens. Brit Poult Sci. 2005;46:510-5. [ Links ]
16. Warriss PD, SC Kestin, SN Brown and EA Bevis. Depletion of glycogen reserves in fasting broiler chickens. Br Poult Sci. 1988;29:149-54. [ Links ]
17. Warriss PD, Knowles TG, Brown SN, Edwards JE, et al. Effects of lairage time on body temperature and glycogen reserves of broiler chickens held in transport modules. Vet Rec. 1999;145:218- 22. [ Links ]
18. Castrejón V, Carbó R, Martínez M. Mecanismos Moleculares que intervienen en el transporte de la glucosa. REB. 2007;26(2):49-57. [ Links ]
19. Johnson JH, Newgard CB, Milburn JL, Lodish HF, Thorens B. The high Km glucose transporter of islets of Langerhans is functionally similar to the low affinity transporter of liver and has an identical primary sequence. J Biol Chem. 1990; 265:6548-51. [ Links ]
20. Mommsen TP, Plisetskaya EM. Insulin in Fishes and Agnathans History, Structure, and Metabolic-Regulation. Rev Aquat Sci. 1991;4:225-59. [ Links ]
21. Meglasson M, Hazelwood RL. Adrenergic regulation of insulin secretion from the chicken pancreas in vitro. Gen Comp Endocr. 1984; 56(1):82-89. [ Links ]
22. Homology. Homologs of the INS gene. INS insulin [Homo sapiens (human)]. Gene ID: 3630, updated on 25-Jan-2015) [internet]. Disponible en: http://www.ncbi.nlm.nih.gov/gene/3630 [ Links ]
23. Dillon A, Menard M, Newman R, VanDorsten J. Glucometer analysis of one-hour glucose challenge sample. Am J Obstet Gynecol. 1997; 177 (5):1120-3. [ Links ]
24. Colca JR, Hazelwood RL. Insulin, pancreatic polypeptide, and glucagon release from the chicken pancreas in vitro: Responses to changes in medium glucose and free fatty acid content. Gen Comp Endocr. 1981;45(4):482-90. [ Links ]
25. Naber S, Hazelwood RL. In vitro insulin release from chicken pancreas. Gen Comp Endocr. 1977;32(4): 495-504. [ Links ]
26. Minick M, Duke G. Simultaneous determinations of plasma insulin, glucose and glucagon levels in fasting, previously stressed but convalescing bald eagles, Haliaeetus leucocephalus linnaeus. Comp Biochem Physiol Part A Physiology. 1991;99(3):307-11. [ Links ]
27. Rideau N. Insulin secretion in birds. En Leclercq B, Whitehead CC, editores. Leanness in Domestic Birds, capítulo 25. Butterworth-Heinemann; 1988. p. 269-94. [ Links ]
28. Mommsen TP, Plisetskaya EM. Insulin in fishes and agnathans: history, structure, and metabolic regulation. Rev Aquat Sci. 1991;(4):225-59. [ Links ]
29. Navarro I, Gutiérrez J. Fasting and starvation. En PW H, TP M, editores. Metabol IC biochemitry. Amsterdam: Elsevier Science BV; 1995. p. 393-434. [ Links ]
30. Dupont J, Tesseraud S, Simon J. Insulin signaling in chicken liver and muscle. Gen Comp Endocrinol. 2009;163:52-7. [ Links ]
31. Mitruka BM, Rawnsley HM, Vadehra BV. Clinical biochemical and hematological reference values in normal experimental animals. Philadelphia: Masson; 1977. p. 140-2. [ Links ]
32. Miranda-López S et al. Parámetros productivos y química sanguínea en pollos de engorde alimentados con tres niveles diéticos de harina de granos de fríjol (Vigna unguiculata Walp.) Durante la fase de crecimiento. Rev Cient. 2007; 17(2):150-60. [ Links ]
33. Campbell TW. Clinical Chemistry of Fish and Amphibians. En Thrall MA, Baker DC, Campbell TW, DeNi-cola D, Fettman MJ, Lassen ED et al, editores. Veterinary Hematology and Clinical Chemistry. Pennsylvania: Lippincott Williams & Wilkins; 2004. p. 499-517. [ Links ]
34. Grifols J, Molina R. Manual clínico de aves exóticas. 4a ed. Barcelona. Buenos Aires: Grass-Iatros; 1997. p. 62-7. [ Links ]
35. Noriega MLVC. Importância da hematologia no diagnóstico das aves. Procedente de IV Encontro Técnico Sobre Avicultura de Corte da Região de Descalvado; 2000. p. 1-11. [ Links ]
36. Willard MD, Tvedten H. Diagnóstico clínico-patológico práctico en los pequeños animales. 4a ed. Buenos Aires: Argentina Interamericana; 2004. p. 456. [ Links ]
37. Rentería Maglioni O. Manual práctico del pollo de engorde. Cali: Gobernación del Valle del Cauca/Secretaría de Agricultura y Pesca. [ Links ]
38. Avian Farms International. Granja experimental de pollos de Avian Farms en Estados Unidos. [ Links ]