Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.32 Bogotá July/Dec. 2016
https://doi.org/10.19052/mv.3859
Ligadura de ducto arterioso persistente en un cocker spaniel de dos meses de edad:
reporte de caso
Persistent ductus arteriosus ligation in a two-months-old cocker spaniel:
A case report
Ligadura de conduto arterioso persistente em um Cocker spaniel de dois meses de idade:
repórter de caso
Ximena Escobar Correa1 / Vladimir Galindo Zamora2
1 Médica veterinaria, Universidad Nacional de Colombia, Bogotá, Colombia.
xescobarc@unal.edu.co
2 Médico veterinario, MSc., PhD. Profesor asociado, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá, Colombia.
vgalindoz@unal.edu.co
DOI: 10.19052/mv.3859
Recibido: 15 de junio de 2015. Aceptado: 23 de julio de 2015
Cómo citar este artículo: Escobar Correa X, Galindo Zamora V. Ligadura de ducto arterioso persistente en un cocker spaniel de dos meses de edad: reporte de caso. Rev Med Vet. 2016;(32): 101-108. doi: http://dx.doi.org/10.19052/mv.3859
Resumen
El presente artículo reporta el caso de una hembra canina cocker spaniel entera de dos meses de edad, que fue llevada a la Clínica para Pequeños Animales de la Universidad Nacional de Colombia, con tos de seis días de evolución, poca ganancia de peso e historial de soplo cardiaco detectado con anterioridad en un centro veterinario. Tras realizar el examen médico, se perciben estertores en ambos campos pulmonares, aumento del reflejo tusígeno, pulso yugular positivo, un soplo cardiaco 6/6 y aumento del tiempo de llenado capilar. Se diagnostica la persistencia de ducto arterioso mediante ecocardiografía, por lo cual se plantea la ligadura del ducto como tratamiento definitivo. La paciente se recuperó satisfactoriamente del procedimiento quirúrgico sin tener ningún tipo de complicación; en el postoperatorio presentó tos que se resolvió a los pocos días con ayuda de un tratamiento con furosemida (2 mg/kg TID IM). Tres meses después de realizarse el procedimiento quirúrgico la paciente se encontraba clínicamente sana, sin ninguna manifestación de origen cardiaco.
Palabras clave: ducto arterioso persistente, canino, ligadura, poliéster trenzado.
Abstract
This article reports the case of a two-months-old female cocker spaniel, who was taken to the Clinic for Small Animals at the Universidad Nacional de Colombia, with a cough of six days of evolution, poor weight gain, and a history of heart murmur detected previously in a veterinary center. A medical examination evidenced crackles in both lung fields, increased cough reflex, positive jugular pulse, a 6/6 heart murmur, and increased capillary refill time. Persistent ductus arteriosus was diagnosed by echocardiography; for this reason, ductus ligation was suggested as definitive treatment. The patient satisfactorily recovered from the surgical procedure without any complications; she presented postoperative cough that resolved within a few days with the help of a treatment with furosemide (2 mg/kg IM TID). Three months after the surgical procedure, the patient was clinically healthy, without any symptom of cardiac origin.
Keywords: persistent ductus arteriosus, canine, ligation, braided polyester.
Resumo
O presente artigo reporta o caso de uma fêmea canina Cocker spaniel inteira de dois meses de idade, que foi levada à Clínica para Pequenos Animais da Universidade Nacional da Colômbia, com tosse de seis dias de evolução, pouco ganho de peso e historial de sopro cardíaco detectado com anterioridade em um centro veterinário. Após realizar o exame médico, se percebem estertores em ambos os campos pulmonares, aumento do reflexo da tosse, pulso jugular positivo, um sopro cardíaco 6/6 e aumento do tempo de enchimento capilar. Diagnostica-se a persistência de conduto arterioso mediante ecocardiografia, razão pela qual se cogita a ligadura do conduto como tratamento definitivo. A paciente se recuperou satisfatoriamente do procedimento cirúrgico sem ter nenhum tipo de complicação; no pós-operatório apresentou tosse que se resolveu aos poucos dias com ajuda de um tratamento com furosemida (2 mg/kg TID IM). Três meses após a realização do procedimento cirúrgico a paciente se encontrava clinicamente saudável, sem nenhuma manifestação de origem cardíaca.
Palavras chave: conduto arterioso persistente, canino, ligadura, poliéster trançado.
INTRODUCCIÓN
El ducto arterioso (DA) se forma a partir del sexto arco aórtico y persiste durante toda la vida fetal (1); es un componente esencial de la circulación fetal que permite la comunicación entre la arteria pulmonar y la aorta (2,3). En condiciones normales este ducto se cierra pocas semanas después del nacimiento (4), debido a un gradiente de presión entre la aorta y la arteria pulmonar para formar el ligamento arterioso (2).
El ducto arterioso persistente (DAP) es el defecto congénito cardiaco más común en caninos (5-7). Sin embargo, en un estudio retrospectivo realizado entre 1993 y 2008 en un centro veterinario de referencia en la localidad de Usaquén, Bogotá, el ducto arterioso persistente ocupó un tercer lugar después de la estenosis pulmonar y cuarto arco aórtico derecho persistente, al representar solo el 10,7 % del total de animales con enfermedad cardiaca congénita (8).
Razas de perros como maltés, pomerania, shetland, springer spaniel inglés, keeshond, caniche miniatura y toy, bichón frise, cocker spaniel, yorkshire terrier, border collie, setter irlandés y pastor alemán, tienen una mayor prevalencia en la presentación de la enfermedad. Aparece mayormente en hembras (9-11).
El diagnóstico del DAP se realiza por la historia y signos clínicos del paciente y mediante evaluación imagenológica del corazón. En la radiografía, en la vista lateral, se evidencia agrandamiento de la silueta cardiaca, el ventrículo izquierdo está aumentado de tamaño, la tráquea se eleva, la aorta está dilatada y sobresale cranealmente. Se aumenta la opacidad de los pulmones y el número de vasos pulmonares visibles y es posible evidenciar la presencia de edema. En la vista dorsoventral la dilatación de la aorta lleva a agrandamiento de la silueta cardiaca. En esta vista clásicamente se evidencian tres protuberancias que se pueden organizar según la analogía del reloj de la siguiente manera: de doce a una el arco aórtico dilatado, de una a dos el tronco pulmonar dilatado y de dos a tres el agrandamiento de la aurícula izquierda como resultado del agrandamiento atrial izquierdo. (4,12-15). Es posible que estas tres estructuras no estén presentes al mismo tiempo (15).
Los hallazgos al electrocardiograma incluyen ondas P de mayor duración, ondas R muy altas y ondas Qprofundas; si hay dilatación del ventrículo izquierdo pueden aparecer cambios en el segmento ST (12). El DAP puede ser difícil de identificar en la ultrasonografía, que confirma la dilatación del atrio y el ventrículo izquierdo debida a la hipertrofia excéntrica ventricular izquierda. Solo en raras ocasiones un perro con un DAP de poco tamaño puede presentar un examen ultrasonográfico normal (16).
El tratamiento puede ser médico o quirúrgico; sin embargo, se recomienda la ligadura del ducto para corregir por completo el defecto, pues la resolución completa de las manifestaciones clínicas puede ser difícil si solo se utiliza el manejo médico del paciente (17). El DAP es comúnmente tratado mediante ligadura llevada a cabo a través de una toracotomía en el cuarto espacio intercostal. Se ha descrito una variedad de técnicas de disección intrapericárdica y extrapericárdica (7,18). En un estudio retrospectivo se llevó a cabo exitosamente este procedimiento en 35 perros de diferentes edades y razas mediante una técnica intrapericárdica; no se presentaron complicaciones intraoperatorias o postoperatorias (7).
En este manuscrito se reporta el caso de un canino con persistencia del DA, su tratamiento médico, la corrección quirúrgica mediante la ligadura del ducto y su evolución clínica.
RESEÑA Y ANAMNESIS
A la Clínica para Pequeños Animales de la Universidad Nacional de Colombia es presentado un canino hembra, cocker spaniel de dos meses de edad, entero, procedente de Bogotá, debido a que presenta una tos de seis días de evolución que ha ido empeorando; adicionalmente, los propietarios reportan que desde que la adquirieron no ha subido de peso. Previamente le había sido diagnosticado un soplo cardiaco por un médico veterinario particular, el cual instauró un tratamiento con Tusivet®1 (dextrometorfano clorhidrato y guayacolato de glicerilo) 2 cm/6 h, Cardial®2 (maleato de enalapril y espironolactona) Vi de pastilla en 2 cm de agua y un diurético (producto y dosis desconocidas) por dos días. La paciente no había sido vacunada y fue vermifugada un mes antes de la consulta con un producto a base de Pamoato de Pirantel (Canisan® Puppy).
EXAMEN CLÍNICO
En el examen clínico se encontró una paciente de actitud alerta, temperamento dócil y con 1,3 kg de peso. La paciente se encontraba agitada, presentaba una tos constante no productiva y en la auscultación pulmonar se percibían estertores en ambos campos pulmonares. Adicionalmente, se observó aumento del reflejo tusígeno y dificultad respiratoria por episodios. A la evaluación del sistema cardiaco se encontró pulso yugular positivo y soplo cardiaco 6/6, así como aumento del tiempo de llenado capilar. Se inicia tratamiento con furosemida (2 mg/ kg TID [tres veces al día] PO [vía oral]), N-acetil cisteína (25 mg/kg BID [dos veces al día] PO).
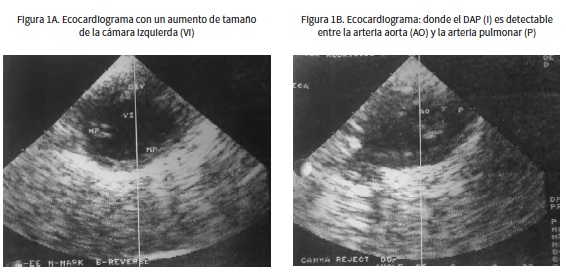
Como diagnóstico diferencial se lista DAP, por lo cual se realiza una ecocardiografía (figura 1) en la cual se encuentra un aumento evidente de la cámara ventricular izquierda con una medida de 16 mm en sístole (normal 7,7-12 mm) y 27 mm en diástole (normal 15,1-21,2 mm), un leve adelgazamiento del miocardio en el lado izquierdo, midiendo 5 mm en sístole (normal 6,6-8,9 mm) y 3 mm (normal 3,8-5,6 mm) (19) en diástole, y la pared de la arteria aorta interrumpida debida a una comunicación con la arteria pulmonar, lo cual confirma la presencia del DAP. El defecto fue fácilmente detectado durante la ecocardiografía y tenía una longitud promedio de 5 mm. Se planteó la ligadura quirúrgica del ducto, la cual se llevó a cabo diez días después del diagnóstico.
Se realizó un cuadro hemático prequirúrgico, en el cual se encontró anemia leve y eosinofilia; lo demás se encontró dentro de los parámetros normales para un cachorro de ocho semanas de edad (hematocrito 35 % [31-39 %], proteínas plasmáticas totales 4,6 g/dL [4,04-5,33 g/dL], eritrocitos 3.820.000 cel/μL [4.500.000-5.900.000 cel/ μL], leucocitos 13.700 cel/μL [12.700.000-17.300.000 cel/μL], plaquetas 354.000 cel/μL [240.000-435.000 cel/μL], neutrófilos 8220 cel/μL [6200-11.800 cel/ μL], linfocitos 5690 cel/μL [3100-6900 cel/μL], eosinófilos 274 cel/tiL [0-120 cel/tiL], monocitos 137 cel/μL [40-170 cel/μL]); así mismo, se hizo una medición de alanino aminotransferasa y creatinina, las cuales se encontraban dentro de los rangos normales (18 U/L [10,3-24,3 U/L]) y (0,6 mg/dL [0,26-0,66 mg/dL]), respectivamente (20).
PROCEDIMIENTO QUIRÚRGICO
Debido a la presencia del DAP, la paciente es clasificada como ASA III. El día de la cirugía la paciente presenta taquicardia (200 pulsaciones por minuto [ppm]), taquipnea (80 respiraciones por minuto [rpm]), membranas mucosas rosa pálido, tiempo de llenado capilar retardado (2-3 s), temperatura corporal de 38 °C y un peso de 1,6 kg.
Para la premedicación se administró fentanilo (Rotex-medica 50 tg/ml, 5 ig/kg IV), atropina (Atropina-Zoo® Colombia, 0,022 mg/kg IV), diazepam (5 mg/ml, 0,4 mg/kg IV) y para la inducción anestésica propofol (Biotoscana S. A.® Colombia, 5 mg/kg IV). El mantenimiento anestésico se realiza con isoflurano (Halocarbon Products Corp.® Colombia) administrado a dosis-efecto.
Pasados 20 min de la premedicación, la paciente estabiliza la frecuencia cardiaca y se mantiene entre 110 y 140 ppm. Durante el procedimiento se mantiene a la paciente con ventilación asistida con un volumen tidal de 10 ml/ kg, relación inspiración/espiración 1:2 y 12 respiraciones por minuto. Se realizó monitoreo electrocardiográfico, SO2 y presión arterial no invasiva.
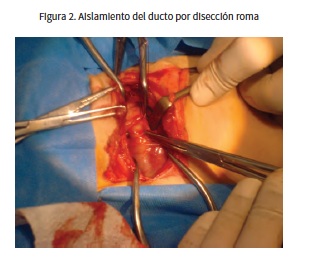
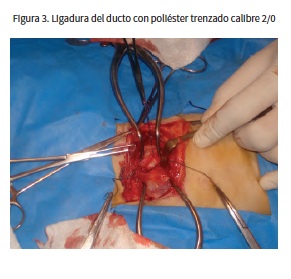
El procedimiento consistió en una toracotomía a nivel del cuarto espacio intercostal izquierdo, accediendo a la cavidad torácica por medio de la incisión de los músculos cutáneos del tronco, dorsal ancho y escaleno dorsal. Después de incidir los músculos intercostales y la pleura, se abrió el espacio con ayuda de separadores de Gelpi y se localizó el DA por inspección visual; se realizó disección roma y se aisló el ducto con ayuda de unas pinzas de cístico (figura 2). El ducto fue ligado con poliéster trenzado calibre 2/0 (Ethibond Excel®, de Ethicon) (figura 3). Adicionalmente, se ubicó un tubo de tórax en el séptimo espacio intercostal. Se procedió a cerrar la cavidad torácica.
Como medicamentos intraoperatorios se administraron meloxicam (MK® Colombia, 0,1 mg/kg IM), cefradina (Genfar® Colombia, 20 mg/kg IV).
POSTOPERATORIO
Durante el postoperatorio se manejaron tres dosis de hidromorfona (URE Fondo Nacional de Estupefacientes de Colombia, 0,1 mg/kg IV) y atropina (Atropina-Zoo® Colombia, 0,022 mg/kg IV) cada seis horas, cefradina y meloxicam a las dosis y vías anteriormente indicadas. Debido a que horas después de la cirugía la paciente presenta ronquidos se le instaura furosemida (Diurivet® N. F, 2 mg/ kg TID IM), tras la cual comienza a respirar normalmente. Por el tubo de tórax se obtienen 20 cm de aire y 2 ml de líquido serosanguinolento.
Debido a que la paciente presenta una evolución favorable, es dada de alta dos días después de la cirugía y mantiene los mismos medicamentos pero en administración oral, la cefradina se cambia a cefalexina (20 mg/kg BID PO) y se adiciona la limpieza de la herida y aplicación de crema cicatrizante.
EVOLUCIÓN CLÍNICA
La paciente fue presentada a la clínica cuatro días después de llevar a cabo el procedimiento quirúrgico. Ese día la paciente tenía tos y estertores en el pulmón derecho, por lo que se instaura un tratamiento con N-acetil-cisteína (25 mg/kg BID PO). En la auscultación cardiaca no se encuentra ningún tipo de anormalidad y la herida quirúrgica ha evolucionado favorablemente. En los controles subsiguientes a los 8, 15 y 30 días después de la cirugía se detecta que la tos y los estertores desaparecieron y que la paciente comenzó a aumentar de peso; en la auscultación cardiaca no se evidenció presencia de soplo.
Dos meses después, la paciente tiene un peso de 4,5 kg; como seguimiento del procedimiento quirúrgico la paciente fue evaluada examinando su sistema cardiovascular sin encontrar signos de alteraciones cardiacas.
La paciente no es presentada para el siguiente control médico y no es posible tener contacto con los propietarios, por lo cual es imposible continuar con el seguimiento de la evolución de la paciente y conocer su estado actual.
DISCUSIÓN
Como ya fue mencionado, el DAP es el defecto congénito cardiaco más común en caninos (5,6,7) y se manifiesta comúnmente en animales jóvenes (5).
La paciente descrita en este reporte era una hembra canina con DAP, la cual manifestaba signos clínicos usuales como tos de varios días de evolución, soplo 6/6 a la auscultación cardiaca y poca ganancia de peso. Aunque muchos pacientes son asintomáticos y el hallazgo del DAP se da de manera incidental, otros tienen historia de intolerancia al ejercicio, taquipnea o tos, debilidad de los miembros posteriores, pérdida de peso y episodios recurrentes de insuficiencia cardiaca congestiva. Los hallazgos clínicos característicos incluyen membranas mucosas rosadas, soplo cardiaco de maquinaria más auscultable en la base cardiaca del lado izquierdo, frémito precordial palpable sobre el tórax craneal, pulso arterial hiperquinético, pulso femoral fuerte o errático debido a la disminución en la presión del pulso arterial; en muchos casos, adicionalmente, se presenta un soplo sistólico asociado a regurgitación mitral (3,4,12,13).
El DAP se trata de un shunt de izquierda a derecha en el que las alteraciones clinicopatológicas son poco comunes (17) como sucede en este caso.
El DAP puede ser difícil de identificar en la ultrasonografía; sin embargo, en este caso su realización permitió evidenciar la dilatación del atrio y del ventrículo izquierdo debido a la hipertrofia excéntrica ventricular izquierda, lo cual es un signo característico del DAP (4,12,16,20) y permitió observar el defecto entre la arteria aorta y la pulmonar.
Otros métodos que se han reportado para el diagnóstico del DAP incluyen el examen radiológico donde se evidencia un aumento de la silueta cardiaca y, si ya existe una insuficiencia cardiaca congestiva, signos de edema pulmonar (4,13-15,20); otro método diagnóstico importante es la ecografía Doppler, que muestra un flujo continuo en la arteria pulmonar con un incremento de la velocidad cerca de la válvula pulmonar; esta se realiza mejor del lado derecho usando una vista transversal en la salida de la aorta (15).
Antes de llevar a cabo la ligadura quirúrgica del ducto, los animales deben ser estabilizados; se administra furosemida (4 mg/kg cada 12 h) a animales que presenten edema pulmonar. Si existe taquicardia supraventricular o fibrilación ventricular se manejan con digoxina (0,015 mg/kg cada doce horas) con o sin bloqueantes β-adrenérgicos o de los canales de calcio que interrumpen el tratamiento 24 h antes del procedimiento quirúrgico para evitar la presentación de arritmias intraoperatorias (17,21). La resolución completa de las manifestaciones clínicas puede ser difícil si solo se utiliza el manejo médico del paciente (17).
Como tratamiento de elección se plantea la ligadura del ducto; para esto se puede utilizar una sutura multifila-mento no absorbible; adicionalmente, es posible utilizar hemoclips, seccionar el ducto o implantar espirales (coils) mediante cateterización cardiaca a través de la arteria femoral (5,9,17).
La ligadura se realiza preferiblemente en pacientes cuya morfología del ducto no sea compatible con la cateterización y en animales de peso menor a 2,5 kg (7), como es el caso de la paciente descrita. Se accede al ducto mediante toracotomía en el cuarto espacio intercostal izquierdo ubicando el ducto entre la aorta y las arterias pulmonares principales, caudal a la arteria braquiocefálica y subclavia izquierda. Mediante disección roma se aísla el ducto y con ayuda de un fórceps de ángulo recto se realizan dos ligaduras, las cuales se ajustan lentamente comenzando por la que está ubicada más cercana a la aorta (17). En este caso se realizó la ligadura con poliéster trenzado calibre 2/0, un tipo de sutura no absorbible utilizada en cirugía cardiovascular que tiene buena fuerza tensil, presenta moderada reacción tisular, es de fácil manejo y tiene buena seguridad de nudo comparada con suturas como el nailon y la seda; adicionalmente, no pierde su fuerza cuando entra en contacto con fluidos corporales o agua (23).
Luego de la ligadura del ducto en la paciente la tos persistió unos días después de la intervención por lo que requirió mantener su medicación con furosemida (2 mg/kg BID PO), tras lo cual la tos desapareció; esto es debido a que la oclusión del DAP resulta en una disminución inmediata en la sobrecarga de volumen del lado izquierdo, seguido por la reversión a largo plazo de la hipertrofia excéntrica ventricular izquierda (10). La falla cardiaca se resuelve y la medicación puede ser retirada a los pocos días de la intervención o puede ser mantenida por un periodo mayor, dependiendo del grado de afectación cardiaca (12).
Los animales no tratados usualmente padecen de insuficiencia cardiaca congestiva izquierda y edema pulmonar y muere entre el 54 y el 70 % antes del primer año de vida (5,9,17,23), por esta razón se recomienda el cierre del ducto a temprana edad (9).
La ligadura del ducto es una técnica quirúrgica que se considera curativa cuando es realizada en pacientes jóvenes y se trata de un defecto de izquierda a derecha (17); su tasa de mortalidad se encuentra entre el 0 y el 2 % si es practicada por un cirujano experto (24). Un estudio retrospectivo de ligadura intrapericárdica del DA en 35 perros jóvenes de razas pequeñas o con DAP grandes, no reportó ningún tipo de complicación durante el tiempo intraoperatorio (7); en este estudio, durante el postoperatorio un perro presentó el signo de Branham (que se trata de una bradicardia fisiológica producto de una compresión o escisión de una fístula arteriovenosa [25]), el cual se resolvió en un periodo de 2 h después de la cirugía sin tratamiento alguno.
La paciente reportada en el presente escrito no presentó ningún tipo de complicación durante la cirugía ni después de ella. En manos de un cirujano experto las complicaciones de la ligadura del ducto se presentan en un porcentaje menor al 5 % (26). La principal complicación que puede aparecer es un desgarro del ducto debido a la excesiva manipulación del tejido o a un entrecruzamiento de las ligaduras y el exceso de tejido involucrado entre ellas, llevando a hemorragia fatal (21,27). También es posible observar bradicardia como reflejo del aumento de la presión arterial en el momento de realizar la ligadura, arritmias ventriculares, paro cardiaco y edema pulmonar (26).
La tasa de presentación de flujo residual por el ducto oscila entre un 21 y 53 % de los pacientes a los cuales se les ha practicado ligadura por disección extrapericárdica y no se presenta en aquellos cuya disección ha sido intrapericárdica; esto debido a que la cantidad de tejido que queda entre las ligaduras es menor permitiendo que estas queden bien apretadas (7). Estos porcentajes corresponden a pacientes cuyo seguimiento es realizado mediante ecocardiografía Doppler pues la auscultación solo permite detectar alrededor del 6 % de los pacientes con flujo residual. Este seguimiento ecocardiográfico con Doppler no fue realizado en la paciente, lo cual no permite descartar la presentación de flujo residual en ella. El flujo residual es mayor en pacientes con cierre por transcatéter (9). La recanalización del ducto oscila entre 1 a 3 % de los pacientes (7,9,25) y se desarrolla entre 6 semanas y 37 meses postoperatorio (7); a pesar de que la paciente se encontraba clínicamente sana, dos meses después de la cirugía, en este caso no fue posible evaluar la presencia de esta complicación u otras complicaciones debido a que la paciente no volvió a asistir a la clínica y no se logró entablar comunicación con sus propietarios.
1 Tusivet®: Pharmavet. Antitusivo y expectorante para perros y gatos, indicado en el tratamiento sintomático de toda clase de tos; descongestionante de las vías respiratorias, cuyo principio activo es guayacolato de glicerilo y dextrometorfano clorhidrato.
2 Cardial®: Holliday Scott. Vasodilatador mixto y protector cardiaco en comprimidos para perros, con base a Enalapril y Espironolactona.
REFERENCIAS
1. Sadler TW. Sistema cardiovascular. En: Langman: embriología médica. 9a. ed. Barcelona: Wolters Kluwer Health; 2004. p. 233-85. [ Links ]
2. Noden D, Lahunta A. Embriología de los animales domésticos, mecanismos de desarrollo y malformaciones. 1a reimp. Madrid: Acribia; 2001. p. 233-55. [ Links ]
3. Schaer M. Alteraciones cardiovasculares: enfermedades congénitas en el perro y el gato. En: Medicina clínica del perro y el gato. 1a ed. Barcelona: Masson; 2006. p. 134-6. [ Links ]
4. Dunn, J. Diseases of the cardiovascular system. En: Textbook of small animal medicine. s. l.: Saunders; 1999. p. 310-312. [ Links ]
5. Israél N, French A, Dukes-McEwan J, Welsh E. Patent Ductus arteriosus in the older dog. J Vet Cardiol [Internet], 2003 [Citado 2014 oct 2];5(1). Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19081353 [ Links ]
6. Miller M, Gordon S, Saunders A, Arsenault W, Meurs K, Lehmkuhl L et al. Angiographie classification of patent ductus arteriosus morphology in the dog. J Vet Cardiol [Internet]. 2006[Citado 2014 octubre 12];8(2):109-14. Disponible en http://www.ncbi.nlm.nih.gov/pubmed/19083344 [ Links ]
7. Selmic L, Nelson D, Saunders A, Hobson P, Saunders B. An Intrapericardial Technique for PDA Ligation: Surgical Description and Clinical Outcome in 35 Dogs. J Am Anim Hosp Assoc [Internet]. 2013 [Citado 2014 octubre 12];49:31-40. Disponible em: http://www.ncbi.nlm.nih.gov/pubmed/23148137 [ Links ]
8. Reyes KJ, Rodríguez JC. Epidemiología de la enfermedad cardiaca en caninos y felinos: estudio retrospectivo de 1993 a 2008 en una clínica veterinaria representativa de la localidad de Usaquén-Bogotá. Bogotá: Universidad de La Salle; 2009. [ Links ]
9. Stanley B, Luis-Fuentes V Darke P. comparison of the incidence of residual shunting between two surgical techniques used for ligation of patent ductus arteriosus in the dog. Veterinary Surgery [Internet]. 2003 [Citado 2014 octubre 12];32:231-7. Disponible en: http:// www.ncbi.nlm.nih.gov/pubmed/12784199 [ Links ]
10. Tobias A, Stauthammer C. Minimally invasive per-catheter occlusion and dilation procedures for congenital cardiovascular abnormalities in dogs. Vet Clin North Am Small Anim Pract. 2010;40(4):581-603. [ Links ]
11. Ware W. Cardiovascular deseases. En: Cardiovascular diseases in small animal medicine. Londres: Masson; 2007. p. 238-41. [ Links ]
12. Nelson R, Couto C. Trastornos del sistema cardiovascular. En: Manual de medicina interna de pequeños animales. Madrid: Elsevier; 2000. p. 90-3. [ Links ]
13. Kealy K, McAllister H. The torax. En: Diagnostic radiology and ultrasonography of the dog and cat. 3a ed. Philadelphia, Pennsylvania: Saunders Company; 2000. p. 233. [ Links ]
14. Burk R, Feeney D. The torax. En: Small animal radiology and ultrasonography: a diagnostic atlas and text. 3a ed. St. Louis, Missouri: Saunders; 2003. p. 137-40. [ Links ]
15. Farrown C. Congenital heart disease. En: Veterinary diagnostic imaging: The dog and cat. St. Louis, Missouri: Mosby; 2003. p. 505-7. [ Links ]
16. Nyland T, Mattoon J. Ecocardiografía. En: Diagnóstico ecográfico en pequeños animales. 2a ed. Madrid: Multimédica; 2004. p. 406-9. [ Links ]
17. Fossum TW. Surgery of the cardiovascular system. 3a ed. St. Louis (MO): Mosby Elsevier; 2007. p. 775-816. [ Links ]
18. Borenstein N, Behr L, Chetboul V, Tessier D, Nicole A, Jacquet J et al. Minimally invasive patent ductus arteriosus occlusion in 5 dogs. Vet Sur [Internet]. 2004 [Citado 2015 julio 15];33:309-13. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1532-950X.2004.04045.x/abstract [ Links ]
19. Boon J. Manual of veterinary echocardiography. Baltimore: Williams & Wilkins; 1998. [ Links ]
20. Dehn B. Pediatric clinical pathology. En: Pediatrics: Veterinary Clinics of North America: small animal practice; 2014. p. 205-19. [ Links ]
21. Jiménez J, Barneto A, Rey E. Conducto arterioso persistente: caso clínico. Clínica Veterinaria de Pequeños Animales (Avepa). [Internet]. 1999 [Citado 2014 octubre 22]; 19(3). Disponible en: http://ddd.uab.cat/pub/clivetpeqani/11307064v19n3/11307064v19n3p135.pdf [ Links ]
22. Tobias K, Johnston S. Veterinary surgery small Animal. St. Louis, Missouri: Elsevier; 2012. p. 193. [ Links ]
23. Glaus T, Martin M, Boller M, Johnson M, Kutter A, Flückiger M et al. Catheter closure of patent ductus arteriosus in dogs: variation in ductal size requires different techniques. J Vet Cardiol [Internet]. 2003. [Citado 2014 Octubre 2];5(1):7-12. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19081352 [ Links ]
24. Slatter D. Textbook of small animal surgery. 3a ed. Philadelphia: Saunders; 2003. p. 956-9. [ Links ]
25. Tranquilli W, Thurmon J, Grimm K. Lumb and Jones' veterinary anesthesia and analgesia. New York: Wiley; 2007. [ Links ]
26. MacDonald. Congenital heart diseases of puppies and kittens. Vet Clin North Am Small Anim Pract. 2006;36(3):503-53. [ Links ]
27. Nelson R, Couto C. Cardiopatías congénitas. En: Medicina interna de pequeños animales. 4a ed. Madrid: Elsevier; 2010. [ Links ]