Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Medicina Veterinaria
Print version ISSN 0122-9354
Rev. Med. Vet. no.32 Bogotá July/Dec. 2016
https://doi.org/10.19052/mv.3861
Prevalencia de fascioliasis en animales poligástricos de Perú, 1985-2015
Prevalence of fascioliosis in polygastric animals in Peru, 1985-2015
Prevalência de fasciolose em animais poli gástricos do Peru, 1985-2015
Aldo Alim Valderrama Pomé1
1 Médico veterinario y zootecnista. MSc en Salud Pública. Especialista en Ingeniería Ambiental, Universidad Nacional Micaela Bastidas de Apurímac, Abancay, Perú.
alimvalderrama@gmail.com
DOI: 10.19052/mv.3861
Recibido: 15 de julio de 2015. Aceptado: 29 de agosto de 2015
Cómo citar este artículo: Valderrama Pomé AA. Prevalencia de fascioliasis en animales poligástricos de Perú, 1985-2015. Rev Med Vet. 2016;(32):121-129. doi: http://dx.doi.org/10.19052/mv.3861
Resumen
El objetivo de la presente revisión literaria es recopilar publicaciones de 1985 a 2015 como artículos originales, comunicaciones cortas y reporte de casos sobre prevalencia de fasciola hepática en bovinos, ovinos y caprinos en el Perú. Así mismo, recolectar artículos científicos, resúmenes de congresos y tesis realizadas en universidades peruanas. Se realizó un estudio de tipo bibliométrico, descriptivo y transversal, con una estrategia de búsqueda en internet basada en la combinación de palabras clave y operadores booleanos usados en las bases de datos de Science Direct, Web of Knowledge, Scopus y Proquest. Perú presenta muchas zonas hiperendémicas de fascioliasis en bovinos y ovinos (> 50 %) y se encontraron dentro de las más elevadas del mundo. Los caprinos solo alcanzan índices mesoendémicos de infección (10-50 %). El grupo etario de boca llena presenta mayor prevalencia en las tres especies, pero el sexo no muestra diferencias significativas.
Palabras clave: fascioliasis, bovinos, ovinos, caprinos, Perú.
Abstract
This literature review aims to compile publications from 1985 to 2015, such as original articles, short communications and case reports, on the prevalence of liver fluke in cattle, sheep and goats in Peru; as well as to collect scientific articles, conference proceedings and theses carried out at Peruvian universities. A descriptive and transversal bibliometric study was performed, with an internet search strategy based on the combination of keywords and Boolean operators used in databases such as Science Direct, Web of Knowledge, Scopus, and Proquest. Peru has many hyperendemic areas of fascioliosis in cattle and sheep (>50 %), which are within the highest in the world. Goats only have mesoendemic infection rates (10-50 %). The age group of full mouth goats presents the most prevalence within all three species, but the variable of sex shows no significant difference.
Keywords: fascioliosis, cattle, sheep, goats, Peru.
Resumo
O objetivo da presente revisão literária é recopilar publicações de 1985 a 2015 como artigos originais, comunicações curtas e repórter de casos sobre prevalência de fascíola hepática em bovinos, ovinos e caprinos no Peru. Da mesma forma, coletar artigos científicos, resumos de congressos e teses realizadas em universidades peruanas. Realizou-se um estudo de tipo bibliométrico, descritivo e transversal, com uma estratégia de busca em internet baseada na combinação de palavras chave e operadores booleanos usados nas bases de dados de Science Direct, Web of Knowledge, Scopus e Proquest. Peru apresenta muitas zonas hiperendêmicas de fasciolose em bovinos e ovinos (> 50 %) e se encontraram dentro das mais elevadas do mundo. Os caprinos somente alcançam índices mesa endêmicos de infecção (10-50 %). O grupo etário de boca cheia apresenta maior prevalência nas três espécies, mas o sexo não mostra diferenças significativas.
Palavras chave: fasciolose, bovinos, ovinos, caprinos, Peru.
INTRODUCCIÓN
La fascioliasis es una enfermedad infecciosa parasitaria ocasionada por el tremátodo hermafrodita Fasciola hepática distribuida en Europa, Asia, Oriente Medio y Latinoamérica (1-4), descrita por primera vez en Francia por Jeande Brie, en 1379 (5). Es conocida también como fasciolosis, fasciolasis, distomatosis hepática, mal de botella (6,7,1), caquexia acuosa, podredumbre del hígado, comalía, papo, papuza, mal del hígado, etc.; y el parásito, por su parte, se conoce con los nombres de conchuelo del hígado, saguaype, gusano del hígado, alicuya, babosa, pinhuiny yuta, machilla, macha, jallo jallo, cucaracha del hígado, kcallutaca, duela del hígado, palomilla del hígado, dístoma, lenguasa, coscojo, caracolillo, galápago, gálamo, sapillo, distoma del hígado, entre otras denominaciones locales (8). Afecta a animales herbívoros, omnívoros y ocasionalmente al ser humano (9). Es considerada una enfermedad veterinaria debido a las pérdidas que genera en la producción y productividad ganadera particularmente vacuna, ovina y caprina (10,8). En Perú es la segunda infección parasitaria, con pérdidas de 10,5 millones de dólares anuales (11). La estimación del impacto negativo en la economía ganadera se basa en el número de hígados decomisados y eliminados registrados por el Servicio Nacional de Sanidad Agraria (12). La enfermedad se adquiere principalmente por consumir berros y otros vegetales o beber agua contaminada con metacer-carias (13). Es un problema de salud grave, pues el número de casos ha aumentado considerablemente desde 1980 y durante los últimos años ha sido reconocida como la enfermedad de transmisión vectorial con la más amplia distribución (2). Se la ha reportado en 17 de las 24 regiones peruanas (14). El objetivo de esta revisión es recopilar los reportes de la presencia de la fascioliasis en bovinos, ovinos y caprinos en el Perú, por ser los poligástricos más afectados.
CLASIFICACIÓN
Perteneciente al filo platelmintos, clase trematodes, orden Digenea y familia Fasciolidae (15). En Perú solamente se ha descrito Fasciola hepatica y no Fasciola gigantica (16). Los trematodos o dístomas son gusanos planos no segmentados de forma foliácea o alargada y con poro genital en la cara abdominal. A diferencia de los cestodos, tienen aparato digestivo. En los estadios juveniles poseen cilios y pueden tener sexos separados. Las especies que ocasionan patología humana pertenecen al orden Digenea, en el que la reproducción sexuada de los adultos va seguida de multiplicación asexuada, en las fases larvarias, dentro de caracoles (17).
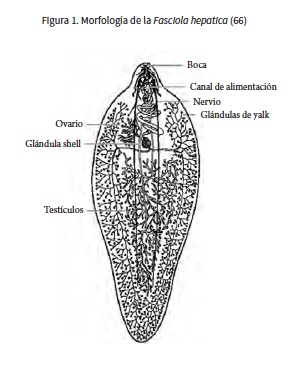
MORFOLOGÍA DEL PARÁSITO
La fasciola adulta es aplanada, de forma lanceolada, semejante a la hoja de laurel (18); mide alrededor de 20-40 mm de largo por 10-15 mm de ancho (1) (figura 1). La cutícula que la envuelve es lisa, cubierta de espinas, ganchos, escamas o canaladuras. A través de ella se absorben los carbohidratos y pueden secretarse metabolitos (17). El aparato digestivo comienza en la boca y la faringe, el esófago se comunica con dos ciegos ramificados, extendidos hasta la porción posterior; no tiene ano (18). El sistema nervioso consiste en un par de ganglios cerebroi-des interconectados de donde se desprenden tres pares de cordones longitudinales. El aparato excretor protone-fridial está constituido por los solenocitos, comunicados con los tubillos colectores, que se abren a su vez en la vesícula excretora (1). El aparato genital masculino ocupa la parte media del cuerpo; está formado por dos testículos ramificados, ambos desembocan a la bolsa del cirro situada al lado del acetábulo, y el poro genital se ubica en el borde acetabular anterior, sobre la línea media. El aparato genital femenino consta de un ovario muy ramificado situado al lado derecho del cuerpo, por delante de los testículos. El útero está en el tercio anterior; casi siempre se halla lleno de huevos pardos que miden 130-150 por 60-98 pm, operculados y de forma ovoide (18). Este parásito es hermafrodita (19). Microscópicamente, su estructura es un sincitio, una capa protoplasmática de entre 15-20 conectada a células tegumentales localizadas bajo las capas de músculo longitudinal y circular. La membrana apical está cubierta de un fino glucocáliz donde se producen los principales cambios morfofisiológicos durante la migración del trematodo hacia los conductos biliares (8).
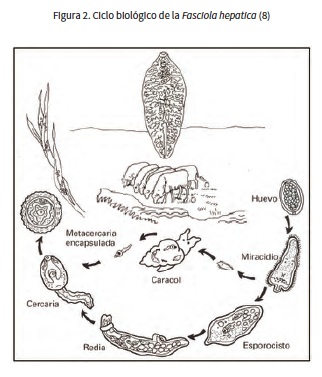
CICLO BIOLÓGICO DE Fasciola hepatica
Es de tipo heteroxénico, ya que requiere un huésped intermediario (19). El ciclo comprende dos etapas: la exógena, donde se da el desarrollo en el hospedador intermediario y el ambiente tras la excreción de los huevos por el hospedador definitivo, y la endógena, donde se dan los efectos tras ingresar en él (8) (figura 2). El proceso empieza cuando los animales infectados, generalmente bovinos u ovinos, defecan en fuentes de agua dulce. Los huevos salen con la bilis y la materia fecal (4). Al caer en la corriente de agua dulce, se embrionan en 10 a 15 días, dando salida a una larva ciliada o miracidio nadador que, en 8 h debe encontrar caracoles de agua dulce de la familia Lymnaeidae, principalmente L. truncatula, originario de Europa. Los huevos requieren temperaturas entre 10 a 30 °C. El embrión se divide a 22 °C y en 2 semanas forma la mórula (3). Cuando permanece en el ambiente sin sombra ni humedad mueren rápidamente (19). Los moluscos infectados pierden la fecundidad o son destruidos por la invasión de sus glándulas digestivas y los cambios metabólicos. Dentro del caracol, la larva pierde los cilios, transformándose en esporocisto, con reproducción asexual que produce dos generaciones, con varias docenas de redias.
Las cercarias miden 0,25-0,35 pm; poseen cola móvil no bifurcada de 0,5 pm, la cual pierden al cabo de pocas horas, secretando un material mucilaginoso que les permite adherirse a plantas acuáticas (18). Las cercarias se enquistan sobre estas plantas. Al perder la cola, aparecen las metacercarias que son muy sensibles a temperaturas altas y la desecación, pero soportan temperaturas muy bajas, lo cual posibilita la supervivencia invernal (20). De no encontrar al huésped intermediario muere en 6 h aproximadamente. El enquistamiento dura 15 min. Esta forma sigue siendo infecciosa durante 3 meses a 25-30 °C; a bajas temperaturas (5 °C) sigue siendo viable hasta por un año (19). Las metacercarias infectantes miden alrededor de 500 de diámetro. Se ha estimado que por cada miracidio salen más de 250 cercarias moderadamente resistentes a la sequía (18). El hombre y los rumiantes se infectan al beber agua o comer berros (Nasturtium officinale) con metacercarias (19). Otras plantas acuáticas como la lechuga (Lactuca sativa), el heno de pastura (Aira caryophylea) y el jugo de alfalfa (Medicago sativa) suelen servir como fuentes de la parasitación. En el tubo digestivo se disuelve la envoltura de la metacercaria, y así queda libre la forma juvenil que atraviesa la pared intestinal y permanece cerca de 15 días, hasta perforar la cápsula de Glisson para penetrar al hígado. El parásito adulto se localiza dentro de los conductos biliares 2 meses después de la infección, iniciando la puesta de huevos 8 a 10 semanas postinfección. El ciclo biológico tiene una duración promedio de 6 a 7 meses. La vida media de la fasciola en humanos es de 9 a 13,5 años (18).
MATERIALES Y MÉTODOS
Se realizó un estudio de tipo bibliométrico, descriptivo y transversal, con una estrategia de búsqueda en internet basada en la combinación de palabras clave y operadores booleanos (Fasciola hepatica, ruminants and prevalence y Perú) usados en las bases de datos de Science Direct, Web of Knowledge, Scopus y Proquest, que incluyeron publicaciones de los años 1985 al 2015 como artículos originales, comunicaciones cortas y reporte de casos sobre prevalencia de fasciola hepática en bovinos, ovinos y caprinos en Perú. Así mismo se recolectaron artículos científicos, resúmenes de congresos y tesis realizadas en universidades peruanas, para hacer una revisión bibliográfica de las prevalencias de estos animales poligástricos, los cuales muchas veces no son publicados en revistas indizadas. De acuerdo con las prevalencias, se definieron las zonas endémicas en tres grupos: hiperendémica (mayores a 50 %), mesoendémica (entre 10 y 50 %) e hipoendémica (menores a 10 %).
PREVALENCIA DE FASCIOLIASIS
Fascioliasis en bovinos
En Perú, la infección por Fasciola hepatica diagnosticada por evaluación post mortem, de acuerdo con el Reglamento de Faenado de Animales de Abasto (21), se ha extendido en los últimos 30 años, alcanzando niveles muy elevados en zonas hiperendémicas como en Tiabaya, con 90 %; Calca, con 84,1% (22); Cajamarca, con 80 % (23); Abancay y Andahuaylas, con 79,5 % (10); Huanta, con 71,3 % (24); Cotabambas, con 71 % (25), y 37-55,2 % en Cusco (26); por lo que se afirma que después de Lima, Apurímac es la región donde existe mayor decomiso de hígados (80,4 %) a causa de esta parasitosis (13).
En zonas mesoendémicas se reportan prevalencias de 47,6 % en Vilcashuamán (27), 23-43 % en Huancavelica, 42,6 % en llave (28), 10-42,2 % en Arequipa, 39 % en Junín, 38 % en Ancash, 17-30,9 % en Juliaca (29-30), 27 % en Ica, 22 % en Lambayeque, 21,6 % en Huánuco, 16 % en Amazonas, 10,2 % en Pasco (31,7,32), 38,2 % en Jauja (33), 24,6 % en Chalhuanca (34), 23 % en Asillo (35) y 10-13,4 % en Oxapampa (36).
Las zonas hipoendémicas se reportan prevalencias menores como 5,6-9,6 % en Pampacolca y Majes (7), 9 % en Huancabamba (36), 7 % en Moquegua y San Martín (6,7), 6,8% en Huancané (37), 5,4 % en Chontabamba (36), 5 % en Ucayali, 0,34-0,8 % en Piura y 0,34 % en La Libertad (6,7).
Perú presenta prevalencias muy superiores a las reportadas en otros países, como Chile: 31,5-32,4 % (38); Colombia: 3,7-25 % (39-40); Angola: 16,8 % (41); Brasil: 0,03-14,39 %, (42); España: 13 % (43), y Cuba: 3,6 % (44). Sin embargo, México también presenta zonas hiperendémicas, con 96,5 % (45), al igual que Argentina, con 4,8-95 % (46,47); Venezuela, con 45,3-71,21 % (48-50), y Bolivia, con 16,6-58 % (51).
La distomatosis se ha extendido en el país debido a la falta de programas de control y educación sanitaria de los criadores de ganado. A mayores altitudes, los periodos de lluvia coinciden con la estación de verano, donde la población de caracoles y la posibilidad de infección aumentan; por lo que la crianza extensiva favorece la presencia de la enfermedad, ya que los animales se ponen en contacto directo con la forma infectante del parásito (52). Las características húmedas con temperaturas superiores a 10 °C y la precipitación pluvial, son favorables para la fasciola, ya que a temperaturas de 20 °C las redias producen cercarias directamente, en tanto que a 16 °C las redias producen hijas o nietas. En factores adversos del ambiente, bajas condiciones de humedad o temperatura (0-14 °C) son capaces de sobrevivir hasta un año (6). La temperatura indispensable es entre 10-30 °C y presencia de agua 3 o más meses al año (53). La temperatura ambiental y la humedad determinan la estacionalidad de la enfermedad, así como la rigurosidad o gravedad con que esta se presenta (54). Por esto las características de las diversas regiones en el Perú son altamente favorables para la presencia del hospedero intermediario y el desarrollo de la fasciola.
La prevalencia de distomatosis suele ser mayor en bovinos adultos (10,34,37), debido a que la enfermedad puede durar de 6 meses a 2 años; así mismo, el tratamiento con antihelmínticos en animales jóvenes puede reducir notablemente la presencia de duelas. Sin embargo, las infecciones en adultos generalmente no muestran síntomas, aun en fases crónicas, desarrollando algún tipo de resistencia a reinfecciones (53). Por el contrario, no se observa diferencia de infección entre machos y hembras (10,23,34).
Los bovinos criollos suelen presentar mayor prevalencia que los mejorados (37-55). Los adultos presentan mayor prevalencia que los jóvenes (10,25,28,37,46). Existe mayor prevalencia en época seca que en época lluviosa (10,34,48). Esto ocurre debido a que los animales se alimentan de pastos cortos donde se concentra el parásito en su etapa infectiva (25). Además, las metacercarias son muy sensibles a las altas temperaturas y a la desecación, por lo que pueden sobrevivir durante todo el invierno (8).
Fascioliasis en ovinos
Las prevalencias de fascioliasis más elevadas en ovinos del Perú se encuentran en Yanque, con 88,6%; Chivay, con 88,6 % (7); Camacani, con 88,1 % (55); Cotabam-bas, con 74 % (25); Moquegua, con 56 % (56); Abancay, con 53 % (10); Ayacucho, con 52,1 % (57), y Cajamarca, con 43-97 % (55). Estos son muy superiores a reportes de países vecinos como Ecuador, con 7,7-12,2 % (58-60), y Chile, con 3,5-6,1 % (38,61); pero similar a Cuba, con 95 % (45); Argentina, con 82-100 % (47,59); España, con 57,6-59,5 % (62,8), y Arabia Saudita, con 30,2-60,3 % (63).
Así mismo, en otras zonas mesoendémicas peruanas se reportan prevalencias menores, como en Caylloma, con 17,7-50 % (7); Huanta, con 44,3 %; llave, con 27,9 % (28); Asillo, con 23 % (35); Vilcashuamán, con 16,3 % (64), y Huamanga, con 14,6 % (24). El sistema de crianza extensivo que predomina en las diferentes regiones del país es favorable para la presencia de la Fasciola hepatica, ya que existe mayor tiempo de exposición al parásito (10) y los animales se ponen en contacto directo con la forma infectante de él (6). A mayores altitudes los periodos de lluvia son más marcados y coinciden con la estación de verano, donde los caracoles y las posibilidades de infección aumentan.
La mayor prevalencia de fascioliasis es reportada en ovinos boca llena (10,25,55). Esto se debe a que la fasciola puede durar hasta seis años en los ovinos. Además, el tratamiento con antihelmínticos en jóvenes puede reducir notablemente la presencia de duelas, las infecciones en adultos generalmente no muestran síntomas aun en fases crónicas (53). Por otro lado, no existe diferencia de la infección entre sexos (10,34).
Fascioliasis en caprinos
En Perú existen pocos estudios de fascioliasis en caprinos; sin embargo, se han reportado prevalencias considerables en Huanta (24), con 31,7 %; Abancay, con 21 %; Andahuaylas, con 21 % (10); Huamanga, con 11,4 % (24), y Cajamarca, con 10 % (55), las cuales son similares a reportes de Chile, con 9,5-14,2 % (38,61), e inferiores a reportes de Ecuador, con 75,4-76,2 % (58), y Argentina, 100 % (47,59), a pesar de no desarrollar resistencia a la reinfección (65).
Los caprinos de boca llena son los que presentan mayor prevalencia de fascioliasis (10). Sin embargo, esta infección no está asociada al sexo del animal (10,34).
CONCLUSIONES
Con la presente revisión se propone una nueva clasificación de zonas endémicas debido a la elevada prevalencia de la Fasciola hepatica, de la siguiente manera: hiperendemicidad (> 50 %), mesoendemicidad (10-50 %) e hipoendemicidad (< 10 %).
Perú tiene zonas hiperendémicas de fascioliasis en bovinos y ovinos, que se encuentran dentro de las más elevadas del mundo. En caprinos solo se han reportado índices mesoendémicos de infección.
Los bovinos, los ovinos y los caprinos de boca llena son el grupo etario con mayor prevalencia. El sexo no muestra diferencias significativas en la prevalencia de ninguna de las tres especies.
REFERENCIAS
1. Staff PN, Acha B, Szyfres. Zoonoses and Communicable Diseases Common to Man and Animals: Parasitoses. 3a ed. Washington D. C.: PAHO; 2003. [ Links ]
2. Marcos LA. La infección por fasciola hepática en el Perú:una enfermedad emergente. Rev Gastroenterol Perú. 2007;389-96. [ Links ]
3. Carrada T. Fasciola hepatica: ciclo biológico y potencial biótico. Rev Mex Patol Clin. 2007;54(1):21-7. [ Links ]
4. World Health Organization. Foodborne trematode infections. WHO [Internet]; 2015 [citado 2012 jun 15]. Disponible en: http://www.who.int/foodborne_trema-tode_infections/fascioliasis/en/# [ Links ]
5. Marcos LA. An overview of fasciolosis: Epidemiology, clinical manifestations, diagnosis and treatment. Peruv J Parasitol. 2012;20(1). [ Links ]
6. Leguía G. Distomatosis hepática en el Perú: epidemiología y control. Lima: Hoechst; 1988. [ Links ]
7. Manrique J, Cuadro S. Fasciolosis buscando estrategias de control. Arequipa: Akuarella; 2002. [ Links ]
8. Martínez JM. Fasciolosis ovina: estudios clínicos y desarrollo de nuevos métodos de diagnóstico y control [tesis doctorado]. León: Universidad de León; 2014. [ Links ]
9. Natividad IS, Terashima A. Prevalencia de infección humana por Fasciola hepatica en pobladores del distrito de Caujul provincia de Oyon, región de Lima, Perú. Acta Med Per. 2008;25(2). [ Links ]
10. Valderrama AA, Carrión YP, Soncco JR. Enfermedades parasitarias en rumiantes y pérdida económica por condena de vísceras. Encuentro Científico Internacional ECIv; 2014; Lima, Perú [ Links ].
11. Jiménez J, Loja D, Ruiz E, Maco V, Marcos L, Avilés R. Fasciolasis hepática: un problema diagnóstico. Rev Gastroenterol Perú. 2001;21(2). [ Links ]
12. Marcos L, Maco V, Terashima A, Samalvides F, Espinoza JR, Gotuzzo E. Fascioliasis in relatives of patients with Fasciola hepatica infection in Peru. Rev Inst Med Trop S. Paulo. 2005;47(4). [ Links ]
13. Espinoza J, Terashima A, Herrera P, Marcos L. Fasciolosis humana y animal en el Perú:impacto en la economía de las zonas. Rev Perú Med Exp Salud Pública. 2010;27(4):604-12. [ Links ]
14. Marcos LA, Terashima A. Fascioliosis hepática en el Perú:una enfermedad emergente y desatendida. Peruvian Journal of Parasitology. 2010;18(1). [ Links ]
15. Vignau ML, Venturini LM, Romero JR, Eiras DF, Basso WU. Parasitología práctica y modelos de enfermedades parasitarias de los animales domésticos. Buenos Aires: UNLP; 2005. [ Links ]
16. Marcos L, Romani L, Florencio L, Terashima A, Canales M, Nestares M, et al. Zonas hiperendémicas y mesoendémicas de la Infección por fasciola hepática aledañas a la ciudad de Lima:¿una enfermedad emergente? Rev Gastroenterol Perú. 2007;(27):1. [ Links ]
17. Pumarola A, Rodríguez, García JA, Piedrola G. Microbiología y parasitología médica. 2a ed. Barcelona: Salvat; 1998. [ Links ]
18. Carrada T, Escamilla JR. Imágenes de patología clínica. Fasciolosis: revisión clínico-epidemiológica actualizada. Rev Mex Patol Clin. 2005;52(2):83-96. [ Links ]
19. Pereira D, Lane de Melo A, Marcos P, Almeida RW. Parasitología humana. 11a ed. Barcelona: Biblioteca Biomédica Ateneu; 2004. [ Links ]
20. Carrada T. Fascioliasis. Diagnóstico, epidemiología y tratamientos. Rev Gastroenterol Mex. 2003;68(2):135-42. [ Links ]
21. Ministerio de Agricultura y Riego. Reglamento Sanitario del Faenado de Animales de Abasto. Minagri [Internet]; 2015 [citado 2015 ago 15]. Disponible en: http://minagri.gob.pe/portal/download/pdf/marcolegal/normaslegales/decretossupremos/2012/reglam_ds015-2012.pdf [ Links ]
22. Flores OA. Prevalencia de distomatosis e hidatidosis en vacunos beneficiados en el camal municipal de Calca [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 2014. [ Links ]
23. Ortiz P. Estado actual de la infección por Fasciola hepatica en Cajamarca, Perú. Biomédica 2011;31(3):3-315. [ Links ]
24. Córdova AL, Pérez RA, Del Campo JC. Comparativo de decomisos por parásitos en Huanta y Huamanga (1979-1980). VIII Reunión Científica APPA; 1985: Huancayo. [ Links ]
25. Bárcena E. Distomatosis en bovinos y ovinos en zonas altas de Cotabambas Apurímac, Perú. Revista del Instituto de Investigación de Bovinos y Ovinos. 1994:78-83. [ Links ]
26. Turpo ID. Frecuencia de fasciolosis e hidatidosis en bovinos beneficiados en el camal de Sicuani-Cusco [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 2006. [ Links ]
27. Ticona D, Chávez A, Casas G, Chavera A, Li OE. Prevalencia de Fasciola hepatica en bovinos y ovinos de Vilcashuamán, Ayacucho. Rev Investig Vet Perú. 2010;21(2). [ Links ]
28. Condemayta Z, Marca U. Prevalencia de la distomatosis en la ganadería familiar de seis comunidades de la multi-comunal Tupac Katari-Ilave. Lima: Instituto de Investigación de Bovinos y Ovinos; 1993. p. 93-100. [ Links ]
29. Mamani W. Prevalencia de la fasciolosis bovina beneficiados en el camal municipal de Juliaca [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 2015. [ Links ]
30. Choque R. Prevalencia e influencia económica por decomiso de vísceras infestadas con fasciolosis e hidatidosis en vacunos beneficiados en el camal municipal de Juliaca [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 2007. [ Links ]
31. Cordero M, Rojo F. Parasitología veterinaria. Madrid: Interamericana-McGraw Hill; 1999. [ Links ]
32. Valencia N, Pariona A, Huamán M, Miranda F, Quintanilla S, Gonzales A. Seroprevalencia de fasciolosis en escolares y enganado vacuno en la provincia de Huancavelica, Perú. Rev Perú Med Exp Salud Pública. 2005;22(2):96-102. [ Links ]
33. Chávez A, Sánchez L, Arana C, Suárez F. Resistencia a antihelmínticos y prevalencia de fasciolosis bovina en la ganadería lechera de Jauj a, Perú. Rev Investig Vet Perú. 2012;23(1). [ Links ]
34. Valderrama AA, Merino K. Epidemiología de la distomatosis hepática bovina en Chalhuanca, Apurímac. XXXVII Reunión Científica Anual APPA; 2015; Abancay; Perú [ Links ].
35. Cama A, Sánchez C. Control integral de la distomatosis hepática en la irrigación Asillo. XI Congreso Nacional de Ciencias Veterinarias; 1990: Puno, Perú [ Links ].
36. Paucar S, Chávez A, Casas E, Suárez F. Prevalencia de fasciolasis y paramfistomiasis en el ganado lechero de Oxapampa, Pasco. Rev Investig Vet Perú. 2010;21(1). [ Links ]
37. Mamani A. Prevalencia y pérdida económica debido al decomiso de vísceras por fasciolosis e hidatidosis en vacunos beneficiados en el camal municipal de Huancané [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 2011. [ Links ]
38. Alcaíno CH, Apt BW. Algunos antecedentes sobre la fascioliasis animal y humana [internet]. 1989 [citado 2015 jun 30];11(1). Disponible en: http://www.revistas.uchile.cl/index.php/MMV/article/view/4929/4813. [ Links ]
39. Cabra A, Herrera C. Estudio de prevalencia de la Fasciola hepatica y caracol Lymnaea spp. en predios del municipio de Simijaca Cundinamarca [tesis pregrado]. Bogotá: Universidad de La Salle; 2007. [ Links ]
40. Recalde DP, Padilla L, Giraldo MI, Toro LJ, González MM, Castaño JC. Prevalencia de Fasciola hepatica, en humanos y bovinos en el departamento del Quindío-Colombia 2012-2013. Infectio. 2014;18(4):153-7. [ Links ]
41. Monteiro NKM, De Fontes AM, Castillo R, Fernández O, Fonseca O, Percedo MI. Prevalencia de hígados decomisados y pérdidas económicas por Fasciola sp. en Huambo, Angola. Rev Salud Anim. 2013;35(2):89-93. [ Links ]
42. Bennema SC, Scholte RGC, Molento MB, Medeiros C, Carvalho OS. Fasciola hepatica in bovines in Brazil:data availability and spatial distribution. Rev Inst Med Trop Sao Paulo. 2014;56(1):35-41. [ Links ]
43. Arias MS, Martínez C, León L, Paz A, Díez P, Morrondo P et al. Detection of antibodies in wild ruminants to evaluate exposure to liver trematodes. J Parasitol. 2012;98(4):754-9. [ Links ]
44. Godoy Y, Roque E, Doménech I, Rodríguez R. Diagnóstico coproparasitológico de Fasciola hepatica en ganado bovino en una empresa pecuaria cubana. Rev Inv Vet Perú. 2010;21 (2):175-9. [ Links ]
45. Castro MA. Realidad actual de la distomatosis hepática en animales domésticos del Perú: revisión de su epidemiologia y su frecuencia [tesis pregrado]. Lima: Universidad Nacional Mayor de San Marcos; 2008. [ Links ]
46. Moriena RA, Racioppi O, Alvarez JD. Fasciolosis en bovinos del nordeste argentino. Prevalencia según edad. Rev Vet. 2004;15(1):3-4. [ Links ]
47. Rubel D, Prepelitchi L, Kleiman F, Carnevale S, Wisnivesky C. Estudio del foco en un caso de fasciolosis humana en Neuquén. Medicina (Buenos Aires). 2005;65:207-12. [ Links ]
48. Fuenmayor A, Simoes D, González R, Chirinos A. Prevalencia de la Fasciola hepatica en los municipios de Mara y Páez del estado Zulia, Venezuela. Revista Científica, SCV-Luz. 1999;9(5):434-9. [ Links ]
49. Morales GA, Pino L. Fasciola hepatica y Distomatosis hepatica bovina en Venezuela. I: ciclo de vida, epidemiología y patogénesis. Revista Digital CENIAP HOY [internet]. 2004 [citado 2015 ago 20]. Disponible en: http://sian.inia.gob.ve/repositorio/revistas_tec/ceniaphoy/articulos/ne/arti/morales_g2/arti/morales_g2.htm [ Links ]
50. Arlett M, Pérez M. 2007. Fasciola hepática en Venezuela: revisión histórica. Rev Fac Cienc Vet. 2007;48(1). [ Links ]
51. Hillyer GV, Soler M, Buch P, Bjorland J. Herd evaluation by enzyme-linked immunosorbent assay for the determination of Fasciola hepatica infection in sheep and cattle from the Altiplano of Bolivia. Vet Parasitol. 1996;61:211-220. [ Links ]
52. Leguía G. Parasitismo gastrointestinal y pulmonar en vacunos, ovinos y alpacas. Lima: Hoechst; 1991. [ Links ]
53. Barriga O. Enfermedades parasitarias de los animales domésticos en América Latina. Santiago de Chile: Germinal; 2002. [ Links ]
54. Bendezuí P, Landa A. Epidemiología y control [internet]. 1973 [citado 2015 jun 15]. Disponible en: http://agris.fao.org/agris-search/search.do?recordID=US201300026042 [ Links ]
55. Cabanillas O. Fasciolosis y su impacto en la salud pública. [internet]. 2012 [citado 2014 jul 30]. Disponible en: http://es.scribd.com/doc/153315734/Conferencia-de-Fasciola-Cajamarca#scribd [ Links ]
56. Loayza F. Frecuencia de fasciolosis en ovinos de Camacani-Puno [tesis pregrado]. Puno: Universidad Nacional del Altiplano; 1985. [ Links ]
57. Quintanilla Y. Impacto económico por distomatosis hepática en bovinos beneficiados en el camal de Moquegua-2011 [tesis pregrado]. Lima: Universidad Alas Peruanas; 2006. [ Links ]
58. Samaniego SE. Evaluación cuantitativa de la distomatosis hepática y su influencia en la economía del introductor de ganado ovino-caprino en el camal frigorífico e Riobamba [tesis pregrado]. Riobamba: Escuela Superior Politécnica de Chimborazo; 2008. [ Links ]
59. Aguirre DH, Cafrune MM, Salatin AO, Abeyá AA. Fasciolosis clínica en cabras de Metán (Salta, Argentina). Revista FAVE-Ciencias Veterinarias. 2005;4:1-2. [ Links ]
60. Montesdeoca RH, Vinueza CV, Macías O, González R, Vasconez E. Incidencia de fasciolosis hepática en ovinos faenados en la EMR-Qen dos épocas [tesis doctorado]. Guayaquil: Universidad de Guayaquil; 2004. [ Links ]
61. Roco M. Beneficio y hallazgos patológicos en plantas faenadoras nacionales [internet]. Santiago de Chile: División de Protección Pecuaria; 2009 [citado 2015 jun 1]. Disponible en: http://www2.sag.gob.cl/Pecuaria/bvo/BVO_10_II_semestre_2009/PDF_articulos/decomisos_mataderos_2007-2008.pdf [ Links ]
62. Vara MP, Martínez M, Martínez A, Rojo FA. Prevalencia de la fasciolosis ovina y estudios de resistencias a fasciolicidas en la provincia de León [internet]; 2006 [citado 2015 jul 1]. Disponible en: http://www2.vet.unibo.it/staff/gentile/femesprum/Pdf%20Congressi/XIV%20congresso%20Lugo/PDFs/PostersS/00Vara_MP.pdf [ Links ]
63. Sanad MM, Al-Megrin WA. Fascioliasis among local and imported sheep in Saudi Arabia: parasitological and serological diagnosis. J Egypt Soc Parasitol. 2005;35(3):1121-34. [ Links ]
64. Bedriñana IF, Ango AH. Frecuencia de fasciolosis, hidatidosis y cisticercosis en animales beneficiados en el Camal San Juan Bautista (2750 msnm) Ayacucho. IV Congreso Peruano de Parasitología; 2000; Lima, Perú [ Links ].
65. Pérez J, Zafra R, Pérez RA, Buffoni L, Martínez FJ, Martínez A. Fasciolosis caprina: estudio comparativo de infecciones crónicas experimentales. Pequeños Rumiantes. 2006;7(2). [ Links ]
66. UNBiol2. School Science Lessons. Animals. [Internet]. 2015 [citado 2015 ago 16]. Disponible en: http://www.uq.edu.au/_School_Science_Lessons/UNBiol2.html [ Links ]