INTRODUCCIÓN
Las fluoroquinolonas desarrollan actividad bactericida en presencia de bacterias aeróbicas gramnegativas, algunas grampositivas y micoplasmas, mediante la interacción con las enzimas ADN-girasa y topoisomerasa IV1,2. En caninos, las infecciones urinarias asociadas a Escherichia coli, el uropatógeno más importante 3, demandan diversos antibacterianos, inclusive fluoroquinolonas 3-5, acorde con las significativas concentraciones urinarias provistas 1,6; sin embargo, la resistencia creciente de E. coli, cercana al 40 %, restringe su eficacia terapéutica 3,4,7,8.
La marbofloxacina es una fluoroquinolona de segunda generación que exhibe buen margen de seguridad en caninos, excepto por las posibles anormalidades en cartílagos en animales j óvenes 9,10. Es una molécula anfótera con mínima ionización en pH fisiológico, particularidad que asociada a su carácter lipofílico y la limitada unión a proteínas plasmáticas en caninos estimada de un 9 % favorece la distribución tisular 1,2,11.
Los cambios estructurales introducidos le confieren características cinéticas mejoradas: extenso tiempo medio de eliminación (t1/2β), amplio volumen de distribución (Vd) e incremento del espectro hacia bacterias grampositivas y anaerobios 12; la marbofloxacina exhibe la actividad bactericida, de concentración dependiente; la CMI frente E. coli se ubica entre 0,016 y 0,06 μg/ml 13,14, frente a enterobacterias y Pasteurella spp. en 0,02 μg/ml y sobre Pseudomonas spp. en 0,3-0,4 μg/ml 13.
En caninos, los antecedentes cinéticos de marbofloxacina indican completa biodisponibilidad tras la aplicación intramuscular. La máxima concentración plasmática (Cmáx) fue de 1,7 ± 0,09 μg/ml, y el tiempo máximo (Tmáx) en que se expresó fue de 0,47 ± 0,08 h 15. La aplicación oral e intramuscular de 2 mg/kg determinó valores del área bajo la curva (ABC) de 11,3 ± 3,07 μg/ml 15 y 13,07 ± 1,07 (16). El fármaco consigue apreciable distribución en tejidos, según el Vd reportado de 1,8 ± 0,9 15 hasta 2,2 ± 0,3 l/kg 17.
El t1/2β obtenido excede los hallados con enrofloxacina, difloxacina y orbifloxacina 11-16. Se informaron valores de t1/2β para la vía oral de 9,07 ± 1,9 h 16, de 10,89 ± 0,84 h 11 y de 14,0 ± 4,9 h 17; de 8,08 ± 6,25 h 15 y de 12,4 ± 2,6 h 17, para la vía endovenosa, y de 7,51 ± 3,7 15, para la aplicación intramuscular.
Por otro lado, la aplicación intramuscular determinó un tiempo medio de residencia (TMR) de 11,2 ± 6 h 15, mientras que por aplicación oral fue próximo a 13 h16,17, mayor al observado con orbifloxacina, enrofloxacina y difloxacina 16.
El clearence total (Clt) osciló entre 1,9 ± 0,5 (17 y 2,8 ± 0,6 ml/min/kg 15. El 35-40 % de fármaco se elimina por orina sin modificaciones 2,17; por aplicación oral de 2,75 mg/kg se detectaron niveles urinarios de 18,08 y 13,9 μg/ml a las 2 y 24 h, respectivamente 11.
Debido a que se desconoce la magnitud de la disposición plasmática y urinaria de este antimicrobiano por administración intramuscular en caninos, se realiza este estudio cinético, con el propósito de establecer la farmacocinética plasmática y su disposición urinaria para brindar información que propicie su aplicación terapéutica racional.
MATERIALES Y MÉTODOS
Animales
Se utilizaron caninos mestizos (n = 6), clínicamente sanos, de 4,5 ± 2,4 años de edad, de 26,4 ± 6,3 kg de peso corporal, con suministro de agua y alimento balanceado ad libitum, con su correspondiente plan sanitario y sin antecedentes de tratamientos recientes con antimicrobianos.
Toma de muestras
Aplicando un protocolo aprobado por el Comité de Ética de Investigación de la Universidad Nacional del Río Cuarto (UNRC) (Resolución CoEdi del 31/10/2014), cada animal recibió por vía intramuscular una dosis única de 2 mg/kg de marbofloxacina (Marbocyl 2 %, Vetoquinol, España). Posteriormente se colectaron muestras de sangre en los siguientes tiempos: 0,16-0,33-0,5; 0,75; 1; 2; 4; 6; 8; 2 y 24 h, centrifugadas durante 10 min a 1200 r. p. m., y solo en los perros machos (n = 4); muestras de orina a las 4; 6; 12 y 24 h, mediante un catéter urinario K33, conservadas a -70 °C hasta su análisis.
Tratamiento de las muestras
El ensayo preparativo consistió en la extracción líquido-líquido del analito. Cada muestra de plasma fue procesada según el método propuesto por Böttcher y colaboradores 18. En un tubo Eppendorf se incorporaron 200 μl de plasma u orina problema, 200 μl de agua deionizada, 20 μl de una solución de 20 μg/ml de enrofloxacina como estándar interno y 800 μl de metanol. El conjunto fue sometido a 30 s de vórtex; luego permaneció en reposo durante 30 min a temperatura ambiente y se centrifugó 20 min a 14.000 r. p. m. a 4 °C; del sobrenadante obtenido y filtrado, 50 μl fueron inyectados al HPLC.
Procedimiento de separación y cuantificación
Se utilizó un equipo de cromatografía líquida de alta presión Hewlett-Packard y columna octadecilsilano C-18. La separación y cuantificación se realizó a temperatura ambiente en una elusión isocrática en fase reversa con flujo de 0,8 ml/min, lectura en detector de fluorescencia establecido a 295 nm de excitación y 490 nm de emisión y fase móvil conformada por agua, acetonitrilo y trietilamina, 79:20:1 v/v/v ajustada a pH 3 con ácido ortofosfórico, según Böttcher y colaboradores 18. La elusión generó picos en cromatograma correspondientes a enrofloxacina (estándar interno) y al analito en estudio.
Cálculo de las concentraciones plasmáticas y urinarias de marbofloxacina
En cada una de las muestras problema de plasma u orina, con el cromatograma obtenido en la corrida de la muestra del ensayo cinético y con el patrón de concentración conocida, se obtuvo un cociente tomando el valor del área de pico de marbofloxacina y del estándar interno. A partir de este cociente se determinaron las concentraciones plasmáticas y urinarias por regresión lineal simple, según Nouws y Ziv 19, mediante la fórmula:
y = a + bx
Donde: y = índice de área, a = intercepto, b = pendiente y x = concentración, en cuya fórmula transformada:
x = (y - a)/b
se reemplazó y por los valores promedio correspondientes de los índices de área de las muestras, a y b por los valores indicados, para obtener valores de concentración x.
Análisis farmacocinético
Los datos individuales versus tiempo se aplicaron al software PK Solution 2.0 Non Compartimental Pharmacokinetics Data Analysis 20, con el propósito de establecer parámetros cinéticos robustos.
RESULTADOS
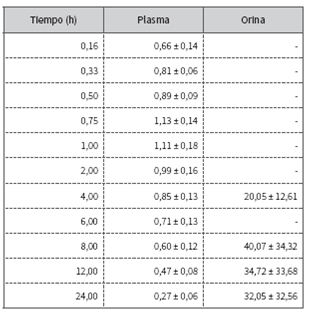
La aplicación intramuscular de 2 mg/kg de marbofloxacina en caninos determina rápida absorción y distribución a los tejidos, según expresan los reducidos valores hallados en los parámetros de vida media de absorción (t1/2 abs) y vida media de distribución (t1/2β), además de los otros parámetros cinéticos expresados en la tabla 1. El perfil plasmático generado se representa en la figura 1 y en la tabla 2.
Tabla 1 Parámetros farmacocinéticos determinados en caninos por aplicación de 2 mg/kg de marbofloxacina por vía intramuscular
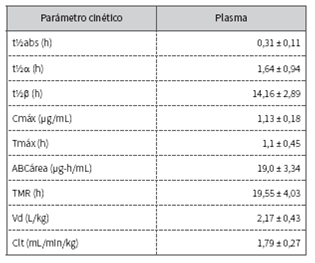
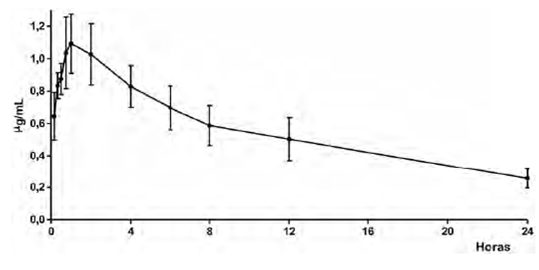
Figura 1 Concentraciones plasmáticas por aplicación intramuscular de 2 mg/kg de marbofloxacina en caninos
DISCUSIÓN
La aplicación intramuscular de 2 mg/kg de marbofloxacina genera concentraciones plasmáticas inmediatas que subsisten hasta las 24 h posaplicación y exceden la CMI requerida por los patógenos gramnegativos relevantes 13,14, excepto de Pseudomonas spp. 13; esto es similar a lo observado tras la aplicación de idéntica dosis intravenosa 9, oral o subcutánea 17.
El Cmáx hallado es inferior y el Tmáx es ligeramente posterior al registrado por vía intramuscular (15, posiblemente debido a la diferentes composición de la formulaciones farmacéuticas. El Vd encontrado insinúa notable distribución desde el compartimento central. Este valor es similar al expuesto por Schneider y colaboradores 17, producto de la escasa afinidad por las proteínas plasmáticas, el carácter anfótero y la liposolubilidad de marbofloxacina 1,21.
El t1/2β obtenido excede significativamente al registrado con este fármaco por vía oral 16 e intramuscular 15, y es similar al encontrado por Schneider y colaboradores17. El reducido Clt y la extensa permanencia plasmática tendrían relación con las propiedades físico-químicas; la configuración del ciclo oxadiazínico favorecería el extenso t1/2β y también el amplio Vd 12,22, y sustentan el uso clínico de este antimicrobiano por vía intramuscular, aplicado cada 24 h 1, similar a lo que sucede tras la administración oral o subcutánea 17.
Las características de persistencia y difusión tisular, sumadas a sus atributos microbiológicos 13,14, inclusive al efecto posantibiótico comprobado con las fluoroquinolonas 1,23 y al análisis del cociente predictor de eficacia establecido para fluoroquinolonas de ABC/CMI ≥ 125 h 24,25, sugieren la aplicación de este antimicrobiano en presencia de cepas patógenas que exhiben una CMI ≤ 0,15 μg/ml (13, 14). En contraste, el predictor ABC/CMI es insuficiente para tratar infecciones causadas por Pseudomonas spp., en coincidencia con Frazier y colaboradores 11, según la CMI encontrada frente a este patógeno 13.
Las concentraciones urinarias cuantificadas en los perros machos (tabla 2) son más significativas que las plasmáticas, conforme los antecedentes de marbofloxacina 1,2,17. Estas concentraciones muy superiores establecidas en experiencias realizadas con idénticas dosis por aplicación oral 16 serían suficientes para el tratamiento de infecciones urinarias no complicadas, por cuanto el éxito terapéutico depende de la dosis, el intervalo de aplicación, las concentraciones conseguidas (al menos cuatro veces la CMI), y que los microorganismos patógenos sean moderadamente susceptibles 26. Sin embargo, estos resultados son insuficientes para recomendar su aplicación a la dosis y por la vía ensayada, considerando la elevada manifestación de resistencia exhibida frente a las fluoroquinolonas 7,27, posiblemente por los valores de pH entre 5,5 y 7 dieta dependiente, de la orina de caninos 28, siendo menos eficaces las fluoroquinolonas en medio ácido 17,29,30. Por otro lado, la orina puede contener cantidades de magnesio, que reduce la actividad de las fluoroquinolonas, independientemente del pH 17,31.
Aun así, se recomiendan protocolos terapéuticos con aplicaciones diarias con dosis mayores durante tres o cuatro días para obtener un cociente predictor más favorable, reducir la exposición en el tiempo y restringir la manifestación de resistencia 5,8.
CONCLUSIONES
La técnica de extracción del analito y el método de HPLC implementado son adecuados para separar y cuantificar la marbofloxacina en plasma y orina de caninos.
La aplicación intramuscular de 2 mg/kg de marbofloxacina al 2% no ocasiona reacciones adversas locales ni generales, acorde con el perfil de seguridad que caracteriza al conjunto de fluoroquinolonas.
Los parámetros farmacocinéticos obtenidos en esta experiencia concuerdan con el perfil cinético exhibido por el conjunto de fluoroquinolonas por aplicación intramuscular. Los valores conseguidos en los parámetros t1/2abs, t1/2α y t1/2β indican inmediata absorción desde el sitio de aplicación, pronta distribución desde el compartimento central y extensa permanencia en el organismo, respectivamente, mientras el elevado Vd encontrado sugiere amplia distribución en los distintos compartimentos corporales.
Los resultados obtenidos permiten que este esquema posológico pueda adaptarse a la administración intramuscular, por cuanto el antimicrobiano persiste hasta las 24 h posteriores a su aplicación. No obstante, la variabilidad en las concentraciones urinarias establecidas en este estudio y la reducida cantidad de animales utilizados demanda nuevos estudios que avalen este procedimiento terapéutico en infecciones urinarias complicadas.