INTRODUÇÃO
A transferência de embriões (TE) é a técnica de reprodução assistida mais difundida na espécie equina. Segundo Hartman (1, o número de transferências realizadas nos equinos supera a implementação de inseminação artificial (IA). O Brasil e os Estados Unidos ocupam um lugar de destaque na utilização desta técnica, reportando 24.880 e 601 colheitas de embriões com 19.680 e 337 transferências, respectivamente, realizadas no ano 2014 2.
As demandas do meio pelo número de potros nascidos e as dificuldades existentes para sincronizar éguas doadoras e receptoras sem a aplicação de hormônios tornam imprescindível aperfeiçoar os conhecimentos sobre os processos fisiológicos reprodutivos 3 e o uso de protocolos hormonais nas éguas receptoras. Neste contexto, a manipulação do ciclo reprodutivo com hormônios exógenos permite aperfeiçoar a exploração equina uma vez que éguas em anestro, produto da sazonalidade, são aproveitadas.
Nos países mais distantes da linha do equador, éguas são consideradas poliéstricas estacionais 4 que apresentam ciclo reprodutivo dividido em quatro fases baseadas na dinâmica folicular, sendo fase de anestro, transição de primavera, ovulatória e transição de outono 5.
Sabe-se que o fotoperíodo é um dos fatores externos mais importantes que influencia o ciclo reprodutivo da égua. No hemisfério sul, a primavera e o verão se apresentam entre os meses de outubro e março e, no hemisfério norte, entre os meses de abril e setembro. Meados de primavera e verão caracterizam-se pela ocorrência de dias mais longos (mais horas-luz por dia), o que se traduz em maior estimulo reprodutivo e faz com que as éguas ativem a dinâmica ovárica 6. Porém, o início da estação reprodutiva depende também de outros fatores fisiológicos e ambientais, tais como idade, condição corporal, raça e alimentação (7. Todos estes fatores estão associados com a variação da ocorrência das ovulações no decorrer dos meses e limitam a utilização dos animais no aspecto reprodutivo durante todo o ano.
Tanto a qualidade como a disponibilidade de receptoras cíclicas durante a estação reprodutiva representam limitações nos programas de TE, devido à dificuldade na sincronização da doadora com a receptora 8 e a ocorrência de anestro estacional ou profundo. Desta forma, o aproveitamento das éguas acíclicas por meio da administração de estrógeno e progestágenos (progesterona ou altrenogest) para estabelecer e manter a gestação, torna a técnica de TE mais produtiva ao longo do ano 9.
Diversos estudos confirmam a eficácia de protocolos que utilizam estrógeno e progestágenos para o preparo e manutenção de éguas acíclicas como receptoras de embriões em programas de TE (8,10-12). A utilização destes protocolos aumenta as taxas de prenhez ao longo do ano, diminuindo os problemas ocasionados pelo fotoperíodo, número de palpações retais e aumentando o aproveitamento de animais acíclicos 13. Além disso, éguas acíclicas mantidas em protocolos hormonais apresentam taxas de gestação similares às de receptoras cíclicas (10,14.
Neste contexto, o objetivo desta revisão é discorrer sobre os principais aspectos do uso de protocolos hormonais, baseados em estrógeno e progestágenos nas éguas receptoras anovulatórias/acíclicas nos programas de TE.
REVISÃO DE LITERATURA
Estacionalidade reprodutiva e ciclo estral
A seleção evolutiva programou o cérebro da égua para reconhecer o comprimento do dia (luminosidade-fotoperíodo) e iniciar o ciclo estral apenas quando os dias estiverem suficientemente longos, ou seja, nos meses de primavera e verão. Porém, o comprimento do dia também é determinado pela latitude; assim, éguas que se encontram mais ao norte ou ao sul da linha do Equador iniciam a ciclicidade mais tarde na estação que aquelas que estão mais próximas da linha do Equador. Éguas próximas à linha do Equador terão pouca variação estacional quanto à extensão do ciclo estral 15.
Devido às suas características fotossensíveis, as éguas apresentam comportamento poliéstrico estacional 16, caracterizado pela ativação do sistema neuro-endócrino-gonadal. Tal sistema está inibido nos meses de outono e inverno pelo aumento na concentração plasmática de melatonina 17, que exerce efeito depressor ou antigonadal nos ovários através da inibição na liberação do hormônio liberador de gonadotrofinas (GnRH) pelo hipotálamo 7,18. Contrariamente, durante o estímulo luminoso (primavera e verão) a síntese de melatonina pela glândula pineal está diminuída, aumentando a liberação de GnRH pelo hipotálamo, que estimula a liberação dos hormônios folículo estimulante (FSH) e luteinizante (LH) pela hipófise anterior, desencadeando alterações fisiológicas nos ovários, tais como crescimento folicular, ovulação e formação de corpo lúteo (CL) (19,20).
O ciclo estral é definido como o intervalo entre duas ovulações consecutivas e sua duração é de aproximadamente 21 dias em éguas 21. O ciclo estral é dividido em duas fases: estro ou fase folicular e diestro ou fase luteal 7.
O estro é caracterizado pela presença de folículos pré-ovulatórios (aproximadamente 35 mm de diâmetro) e pelo aumento, principalmente, do estrógeno 17 β-estradiol 22. As altas concentrações de estrógenos secretadas pelo folículo pré-ovulatório induzem aos comportamentos típicos manifestados durante o estro 23. O estro tem duração média de 5 a 7 dias e se encerra com a ovulação quando as concentrações dos estrógenos retornam aos níveis basais 24. Durante o estro e sob influência dos estrógenos, o útero apresenta aumento na vascularização e extravasamento de líquido dos vasos para a área intersticial, causando o edema endometrial, que permite o recebimento e transporte do sêmen para a tuba uterina 21.
O diestro se inicia logo após a ovulação, por meio da formação do corpo lúteo primário (CLP), responsável pela síntese de progesterona (P4). Nesta fase ocorre a perda do edema uterino e a égua não é mais receptiva ao macho 22,23. A P4 é responsável pelo aumento do tônus uterino e estímulo à secreção histotrófica 25. A fase luteal tem duração aproximada de 14 a 15 dias e, na ausência de um concepto e do reconhecimento materno da gestação nos dias 13 a 16 pós-ovulação, há diminuição da síntese de P4 pelo CLP, fenômeno denominado luteólise funcional, sendo desencadeado pela Prostaglandina F2 alfa (PGF2α) de origem endometrial. Após a queda nas concentrações de P4 a estrutura do CLP sofre regressão, caracterizando a luteólise estrutural. Desta forma, com a luteólise funcional e estrutural, ocorre o início de uma nova fase folicular 26.
Embora exista uma estreita relação entre o aumento da duração da luminosidade diária durante os meses de primavera e verão e uma proporcional ativação dos mecanismos envolvidos na atividade reprodutiva em diferentes latitudes, a condição nutricional das fêmeas tem uma importante participação na manifestação e regularidade dos ciclos estrais 15.
Éguas com boa condição corporal e disponibilidade de alimento, criadas em regiões próximas à linha do Equador, tendem a ciclar durante todo o ano (poliéstricas anuais). Portanto, nestas regiões, o fator nutricional passa a ser relevante. Se estas mesmas éguas fossem transferidas para locais de maiores latitudes e, por conseguinte, com variações na duração do número de horas-luz nas diferentes estações do ano, provavelmente passariam a ter um comportamento reprodutivo sazonal (poliéstricas estacionais) 27.
A alta demanda por embriões equinos tem estimulado pesquisadores a desenvolverem métodos que antecipam a ciclicidade das éguas por meio da utilização de programas de luz artificial 6. Porém, estes métodos são pouco viáveis para as éguas receptoras, devido aos altos custos de manutenção, motivo pelo qual diversas pesquisas vêm sendo realizadas envolvendo o uso de receptoras acíclicas (anestro ou transição) tratadas com hormônios (estrógenos e progestágenos), permitindo maior aproveitamento dos animais que apresentam as limitações impostas pela sazonalidade reprodutiva 28.
Gestação e a produção de progesterona
Contrastando com muitos animais domésticos que tem a produção total de P4 durante a gestação devido à prolongação da funcionalidade do CL, a égua apresenta três fontes de P4 para manter a gestação, sendo o CLP, os corpos lúteos suplementares (CLS) e a placenta 29.
A P4 é o principal hormônio responsável pela manutenção da prenhez. A síntese constante de P4 e de seus metabólitos, como a 5α-dihidroprogesterona (5αDHP), é necessária para manter um adequado ambiente uterino e garantir um ótimo desenvolvimento embrionário e fetal 29. Imediatamente após a ovulação e até aproximadamente o dia 40 da gestação, o CLP é o responsável pela síntese de P4. Em éguas gestantes, o CLP persiste além da sua vida cíclica normal de 14 a 16 dias devido ao reconhecimento materno da gestação, período no qual o embrião, por meio da migração uterina, sensibiliza o útero, evitando a liberação de prostaglandinas 30.
Este mecanismo é possivelmente mediado por processos relacionados com o sistema imune, que permitem a continuidade da gestação (7,29. Ao longo dos 20 dias seguintes ao reconhecimento materno da gestação, o CLP persiste no ovário, mas a produção de P4 diminui de maneira constante até a formação da segunda fonte de P4 (29.
Ao redor dos 35 dias de gestação, células da cinta coriônica do embrião invadem o epitélio uterino adjacente e diferenciam-se para formar os cálices endometriais. Estes cálices são os responsáveis pela secreção da gonadotrofina coriônica equina (eCG), que além de gerar o estimulo necessário para a manutenção do CLP, fenômeno conhecido como ressurgimento do CLP 21, leva à formação dos CLS. No início da gestação, os ovários maternos apresentam ondas de crescimento folicular, assim como no ciclo estral, que são estimuladas pela contínua secreção de FSH pela pituitária 31,32. Nas éguas gestantes o efeito negativo da P4 sobre a secreção de LH da pituitária impede o amadurecimento destes folículos e sua ovulação 29.
No entanto, a partir dos 38 a 40 dias de gestação, com o início da secreção de eCG pelos cálices endometriais recentemente formados, se dá a formação dos CLS devido à ação luteinizante do eCG, que em éguas tem afinidade pelos receptores de LH 33. A formação dos CLS, seja pela ovulação de folículos pré-ovulatório (Corpo Lúteo Secundário ou CLs) ou pela luteinização dos folículos (Corpo Lúteo acessório ou CLa), complementa a produção de P4 produzida inicialmente pelo CLP, fenômeno que ajuda a manter a gestação nos primeiros cinco meses de prenhez (34.
Entre os dias 40 e 120 de gestação, o alantocório encontra-se em período de expansão e as células trofo-blásticas adquirem capacidade de sintetizar diversos hormônios 29. Dentre eles, destaca-se a P4 e os metabólitos 20α-5P (20a hidroxi-5-pregnane-3-ona), 5α-DHP (5α-dihidroprogesteronas) e 3ß-5P (3ß-hydroxi-5α-pregnane-20-ona), observados ao redor dos 70 dias de gestação, sendo produzidos pela utilização exclusiva de fontes maternas de colesterol 35.
Desta forma, entre os dias 70 e 150 de gestação, a concentração plasmática de P4 é composta principalmente pela síntese de P4 por parte dos CLP e CLS em processo de declínio e pelos progestágenos da placenta secretados pelo alantocório em crescimento 29.
Aproximadamente aos 180 dias de gestação, os CLS regridem e a produção de P4 até a fase final da gestação é realizada pelas estruturas placentárias 7.
Seleção da égua receptora acíclica
As limitações impostas pela sazonalidade reprodutiva e a dificuldade em manter os altos custos de programas de luz artificial para éguas receptoras estimularam o desenvolvimento de diversas pesquisas que envolvem o uso de éguas receptoras anovulatórias/acíclicas preparadas e mantidas em protocolos hormonais utilizando estrógenos e progestágenos, fazendo desta metodologia uma excelente alternativa (36.
Segundo Vanderwall 25, a seleção da receptora é um fator determinante para o sucesso do programa de TE. A receptora ideal deve ter boa fertilidade, ótimo escore corporal e desenvolvimento mamário 36, ser livre de anormalidades uterinas e ovarianas (25 e preferencialmente com idade entre quatro e 10 anos. Ball et al. 37) demonstraram que a taxa da perda embrionária após TE foi maior em éguas velhas entre os dias 15 e 50 de prenhez, possivelmente devido ao fato de que éguas velhas são mais susceptíveis a apresentar anormalidades no ambiente da tuba uterina e útero.
Receptoras acíclicas são caracterizadas por apresentarem pouca ou nenhuma atividade folicular detectável pela palpação retal, ovários pequenos, útero sem influência de estrógeno e ausência de acúmulo de líquido no lúmen uterino 20. Sabe-se que condições nutricionais inadequadas podem desencadear o anestro e levar o animal a apresentar as mesmas condições descritas previamente. Assim, estabelecer diferenças entre éguas acíclicas em anestro estacional ou anestro nutricional é um fator relevante no momento da escolha da receptora.
Éguas acíclicas dividem-se em transição ou anestro. Anestro são aquelas que apresentarem folículos com diâmetro menor que 15 mm e ausência de CL e transição aquelas com folículos entre 15 a 25 mm e ausência de CL, indicando a não ocorrência da primeira ovulação da estação 20.
Foi observado que éguas com condição corporal melhor apresentaram diferenças no tamanho do folículo pré-ovulatório no primeiro ciclo reprodutivo na época de acasalamento, quando comparado com éguas de baixa condição corporal (45 vs. 51 mm respectivamente). Além disso, deficiências nutricionais afetaram a fase de recrutamento e a seleção do folículo dominante, porém, não a fase de dominância 38.
Nos protocolos com éguas receptoras acíclicas é ideal ao menos preparar hormonalmente duas éguas receptoras para cada doadora, permitindo assim a escolha da égua que se encontra em melhor condição reprodutiva para receber o embrião no momento da TE 39. Além disso, na avaliação ultrassonográfica transretal, deve-se confirmar o status reprodutivo das éguas acíclicas.
Protocolos hormonais em receptoras acíclicas
O termo "progestágenos" se refere ao grupo dos esteroides naturais, como a progesterona (P4), ou sintéticos, como o altrenogest (alt), que possuem a habilidade de se ligar aos receptores de progesterona 40. O altrenogest é o único progestágeno eficaz e utilizado para os tratamentos hormonais em éguas (41.
Em receptoras anovulatórias, os protocolos hormonais são baseados primeiramente na administração de estrógeno, para simular a condição hormonal de estro e estimular a expressão de receptores uterinos para P4, semelhante ao que acontece no ciclo estral das éguas cíclicas previamente a ovulação 42-45.
Após 24 ou 48 horas, verifica-se a presença de edema uterino (causada pelo estrógeno) por meio de ultrassonografia. Confirmada a presença de edema, administra-se P4 ou altrenogest, que pode ser injetável ou oral. A TE é realizada aproximadamente de 4 a 8 dias após a aplicação do progestágeno (P4/altrenogest) 10,11.
Segundo os protocolos apresentados na tabela 1, nos anos 80, Hinrichs et al. 13,46,47, utilizavam éguas ovariectomizadas (OVH) como receptoras acíclicas ou anovulatórias. A técnica foi realizada com o objetivo de reduzir o manejo com rufiações e palpações retais normalmente realizadas em receptoras intactas. As cirurgias eram realizadas três semanas antes da TE e só o progestágeno foi aplicado, sem administração prévia de estrógeno.
Tabela 1 Protocolos de TE utilizados em éguas receptoras ovariectomizadas, em transição ou anestro
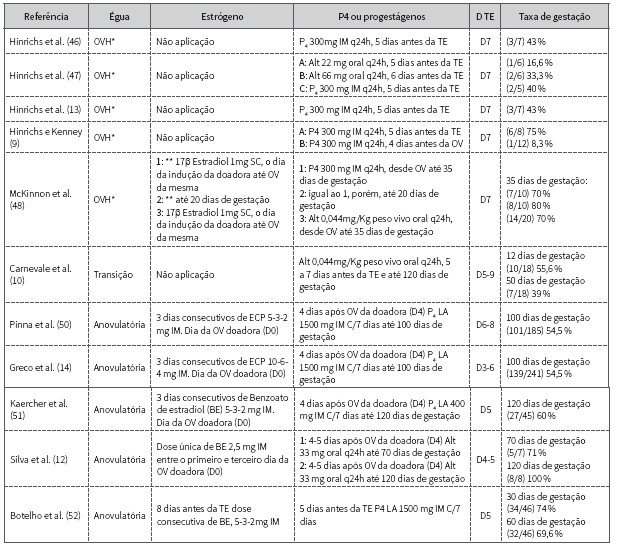
*Dia TE.
Mckinnon et al. 48 definiram três tratamentos para receptoras OVH onde o grupo 1 recebeu 1 mg de 17 β estradiol subcutâneo (SC) até o dia da ovulação (OV) da doadora e posteriormente foram aplicados 300 mg de P4 diariamente até o final do experimento (dia 35); o grupo 2 recebeu o mesmo tratamento do 1 com a diferença na frequência de 17 β estradiol, a qual foi continuada até o dia 20, concomitante a administração de P4; já no grupo 3 foi administrado 17 β estradiol semelhante ao grupo 1 e no dia da OV da doadora, administrou-se diariamente via oral (VO) 0,044 mg/kg de peso vivo de altrenogest até o dia 35. Ao realizar um paralelo entre os estudos de Hinrichs et al. 46 e Mckinnon et al. 48, foram observadas taxas de gestação de 43 % (3 gestações de 7 transferências) e 70 a 80 % entre os protocolos testados (7/10, 8/10, 14/20), respectivamente, demonstrando que éguas receptoras OVH mantidas com progestágenos são capazes de manter a gestação 46 e que independente do período de administração do estradiol, o requisito primário para o preparo e a manutenção da gestação é uma concentração adequada de progestágeno 48.
Além disso, Hinrichs e Kenney 9 buscaram identificar a necessidade de sincronizar a ovulação da doadora com o início da administração de P4 (sem aplicação prévia de estrógeno) nas receptoras OVH. No estudo, as éguas foram divididas em dois grupos: o grupo A recebeu 300 mg de P4 em óleo q24h IM (cada 24 horas-intramuscular) por cinco dias antes da TE, e o grupo B, o qual recebeu a mesma dose de P4, porém quatro dias antes da ovulação da doadora, obtendo taxas de prenhez de grupo A 6/8 e grupo B 1/12, demonstrando a importância da sincronia do ambiente uterino entre doadora e receptora.
No entanto, éguas OVH mostraram desvantagens quando comparadas com éguas acíclicas 8. Tais desvantagens referem-se à cirurgia irreversível com riscos associados, realizada pelo menos três semanas antes de serem utilizadas como receptoras. Além disso, nas éguas acíclicas é possível reduzir o período de tratamento com progestágenos 12 uma vez que ocorre a formação dos CLS, sem prejuízo para a taxa de prenhez, ao contrário das éguas OVH, nas quais esse tratamento deve se manter até por volta de 100 a 120 dias de gestação 48.
Um estudo comparou a taxa de gestação de receptoras acíclicas em transição tratadas com altrenogest 0,044 mg/kg, q24h, VO por 5 a 7 dias antes da TE, com a taxa de receptoras cíclicas. Os autores demonstraram que não houve diferença entre as taxas de gestação no 16° dia, 55,6 vs. 67,8 %, e taxas de morte embrionária, 14,5 vs. 30 % nos grupos, tratado e cíclico respectivamente 10.
Seguindo a mesma linha, Rocha-Filho et al. 11 realizaram um estudo com o objetivo de comparar a taxa de gestação em receptoras cíclicas (grupo controle) e acíclicas (éguas em anestro e transição) tratadas com quatro protocolos diferentes. Em todos os protocolos foi administrada inicialmente uma dose única de cipionato de estradiol (10 mg q24h IM) e cinco a oito dias antes da TE foi administrado o progestágeno, sendo no grupo 1 P4 LA 1500 mg IM a cada 7 dias no grupo 2, 1500 mg IM a cada 6 dias, no grupo 3, P4 de curta ação 200 mg/dia IM e no grupo 4, 400 mg IM a cada dois dias, não encontrando diferença e sugerindo que ambos os tipos de P4 foram eficazes na preparação de receptoras acíclicas. Além disso, não foi observada diferença na taxa de gestação entre as éguas cíclicas (75 %) e éguas acíclicas dos grupos tratados com P4 (75,9 %), demonstrando o sucesso na implementação do protocolo e corroborando os achados de Bringel et al. 49, os quais mostraram que o uso de 1500 mg de P4 LA a cada sete dias em éguas com nenhuma fonte endógena de P4 foi suficiente para manter a gestação, além de se evidenciar concentrações plasmáticas de P4 compatíveis com os níveis da fase lútea (3,41 a 4,33 ng/mL). Pinna et al. 50 e Greco et al. 14 fizeram um comparativo entre éguas cíclicas sem tratamento e éguas acíclicas tratadas uma vez ao dia, com doses decrescentes de cipionato de estradiol e 24 horas após a última aplicação do estrógeno, com a verificação do edema uterino, iniciaram o tratamento com 1500 mg de P4 LA semanais, alcançando bons índices de prenhez, sendo 49 % 50 e 57 % 14 nas cíclicas e 54,6 % e 57,6 % nas acíclicas, respectivamente.
O tratamento com progestágenos é comumente mantido até o período em que as estruturas placentárias assumem a manutenção da gestação, por meio da própria produção de progestágenos, aproximadamente dos 100 a 120 dias de gestação 35. Na tentativa de reduzir o tempo de tratamento com os hormônios, Lagneaux e Palmer 8) administraram extrato de pituitária (LH) às éguas em anestro com o objetivo de antecipar a secreção de progesterona ovariana por meio da formação dos CLS, de forma a reduzir a tempo de tratamento com progestágenos. No entanto, não foi observada diferença no aumento da concentração plasmática de P4 entre éguas tratadas e não tratadas com LH, e o tratamento não foi considerado eficiente.
Baseados na premissa de Greco et al. 14 que afirmam que a interrupção do tratamento pode ser realizada antes da maturação feto-placentária, a partir dos 40 dias de gestação quando os CLS surgem nos ovários, Silva et al. 12 avaliaram a interrupção do altrenogest oral aos 70 e 120 dias de gestação (grupo 1: 70 alt e grupo 2: 120 alt respectivamente), o período de formação dos CLS e o perfil endógeno de P4 durante os primeiros 120 dias de gestação em éguas receptoras acíclicas. O protocolo empregado nas receptoras acíclicas foi uma dose única de 2,5 mg de benzoato de estradiol e um dia pós-tratamento, confirmada a presença de edema uterino, 33 mg de altrenogest oral foram administrados, q24h, até o dia 70 ou 120 de gestação de acordo com o grupo. Neste estudo foi demonstrada a eficácia do altrenogest para a manutenção da gestação com taxas de gestação de 71 % no grupo 70 alt, 100 % no 120 alt em relação ao grupo controle 100 % (éguas receptoras cíclicas sem tratamento de esteroides). Além disso, foi observado que as éguas que se encontravam em transição no início do protocolo foram capazes de formar maior número de CLS e o aparecimento deles foi mais cedo do que nas éguas que se encontravam em anestro no início do protocolo. Esses resultados permitiram concluir que para manter a gestação nas receptoras acíclicas com interrupção do tratamento aos 70 dias é necessário que exista a formação de pelo menos um CLS com no mínimo 10 dias de formação antes da interrupção do altrenogest e a interrupção do hormônio aos 120 dias permite a manutenção da gestação em todas as éguas independentemente da formação ou não de CLS.
Adicionalmente, Kaercher et al. 51 demonstraram que taxas de gestação de éguas receptoras acíclicas (anestro ou transição) e cíclicas foram semelhantes, variando entre 60 e 71 % respectivamente. No protocolo implementado por este grupo foram administradas três doses consecutivas de benzoato de estradiol, nos dias D0 (ovulação da doadora), D1, D2 e uma dose inferior de P4 LA (D3) 400 mg IM c/7 dias nas receptoras acíclicas quando comparado aos grupos de Pinna et al. 50 e Greco et al. 14. Porém, Kaercher et al. 51 definiram éguas acíclicas como aquelas que em fase de anestro ou transição tiveram folículos < 10 mm. Além disso, foi observado que as éguas receptoras acíclicas um dia antes da ovulação da doadora exibiram concentrações plasmáticas de 2,8 ng/ mL quando, segundo Sharp 20, éguas acíclicas (seja em anestro ou transição) não desenvolvem CL. Esses achados permitem concluir que o estudo de Kaercher et al. 51 possui resultados confusos em relação às concentraçoes plasmáticas de P4 e que a definição de receptoras acíclicas só foi fundamentada para éguas em anestro.
Recentemente, Botelho et al. 52 replicaram o protocolo estabelecido por Pinna et al. 50 e obtiveram maior taxa de prenhez nas éguas receptoras acíclicas quando comparadas com as cíclicas: 73 % e 43,3 % no estudo de Botelho et al. 52 e 54 % e 49 % no de Pinna et al. 50) respectivamente. Porém, as éguas utilizadas pelo grupo de Botelho et al. 52 foram éguas em transição de outono, o que poderia explicar a alta taxa de gestação das éguas tratadas ou comparar com as não tratadas.
CONCLUSÕES
Os resultados favoráveis das pesquisas desenvolvidas nos permitem concluir que os tratamentos hormonais, que consistem na aplicação de estrógeno e posteriormente P4 de curta ou de longa ação ou o uso de altrenogest em éguas receptoras acíclicas, apresentam resultados adequados, disponibilizando assim um número superior de éguas para TE com o subsequente aumento da taxa de prenhez.
Embora, o uso de receptoras acíclicas para TE mantidas com protocolos hormonais tornou-se uma alternativa vantajosa, principalmente por permitir a antecipação da estação de monta e diminuir o número de palpações e avaliações reprodutivas diárias para verificar a ciclicidade entre doadora e receptora.














