Introducción
El presente artículo se refiere a la descripción de los hallazgos en exposición y presencia de Leptospira spp. de equinos criollos en criaderos de Cundinamarca (Colombia), a partir de muestras de semen, líquido preseminal y suero sanguíneo de reproductores. En los estudios realizados en equinos en Norteamérica la mayoría de los abortos son causados por la Leptospira interrogans, serovariedad Pomona, pero también se encuentran involucradas la Grippotyphosa y Hardjo en regiones enzoóticas (1-3). La característica principal de la leptospirosis es su manifestación como zoonosis, que es la más difundida en el ámbito mundial, y está presente en todos los continentes excepto en la Antártica (4). Al ser una enfermedad global, representa un gran riesgo para la salud pública y los sistemas de producción pecuarios (5). La prevalencia de leptospirosis en diferentes partes del mundo se debe principalmente a la infección renal crónica de una gran variedad de animales domésticos y mamíferos silvestres. La colonización de los túbulos renales proximales de los animales portadores lleva a la eliminación de la bacteria a través de la orina (5). Sin embargo, el hallazgo de ADN por PCR de Leptospira interrogans, serovariedades Bratislava y Pomona, en fluido vaginal de yeguas, sugiere la posibilidad de transmisión sexual (6-8). Solo se conocen dos registros de detección de ADN por PCR de Leptospira spp. en el semen de sementales (9,10).
En otras investigaciones se ha detectado la presencia de ADN de Leptospira spp. en semen de ganado bovino, pequeños rumiantes y porcinos, lo que demuestra una posible transmisión de leptospirosis por contacto sexual (7,8). En equinos, una manifestación común de leptospirosis crónica es la presentación de uveítis recurrente y disminución en el rendimiento atlético; también se presentan fallas reproductivas, abortos debido a la infección intrauterina y muerte fetal (5,11,12), nacidos muertos, mortalidad neonatal y potros débiles al nacimiento (13,11).
El semen contaminado de sementales puede representar una fuente importante de transmisión, por lo cual el propósito de este estudio se orientó a la detección molecular por PCR y serología mediante la técnica de microaglutinación (MAT) de Leptospira spp. en sangre, fluido preseminal y semen de caballos criollos colombianos destinados a la reproducción, en Cundinamarca (Colombia), durante 2015.
Materiales y métodos
Animales
Para este trabajo se seleccionaron 107 equinos por muestreo no aleatorio por conveniencia. Se trata de caballos criollos colombianos reproductores activos en monta directa y donantes de semen, ubicados en Cundinamarca (Colombia), provenientes de 44 criaderos en regiones geográficas que se encuentran entre los 1800 y los 2800 m s. n. m. A cada criadero se le realizó una encuesta estructurada para recopilar información de factores asociados al riesgo de infección o a la presencia de Leptospira spp. Todos los caballos estaban vacunados contra encefalitis equina venezolana e influenza, y todos estaban sanos, sin signos de enfermedad clínica. En cuanto a la aplicación de vacunas polivalentes contra la leptospirosis, en ninguno de los predios se realiza dicha vacunación.
Muestras
Se recolectaron muestras de sangre, fluido preseminal y semen de los 107 caballos.
Muestras de sangre. Las muestras de sangre (107) fueron tomadas por venopunción yugular en un volumen aproximado de 5 cm3 por animal, colectadas en tubos (Vacutainer®, BD Diagnostics, Franklin Lakes, USA).
Fluido preseminal. Las muestras de fluido preseminal (3-5 cm3 por animal) se colectaron antes de la toma de semen en tubos (BD Falcon Centrifuge Tubes, Franklin Lakes, USA) de 15 ml. Las muestras (107) fueron diluidas en medio SSAF 0.01 M, pH 7,2 en relación 1: 1, para la realización de microscopia de campo oscuro, intentos de aislamiento y PCR en el laboratorio.
Semen. Las muestras de semen (107) se colectaron utilizando una vagina artificial tipo Missouri con agua caliente a 50 °C y con presión interna de la vagina artificial, acorde a las necesidades del semental, con estimulación de yegua en celo y siguiendo un protocolo de asepsia adecuado. Se almacenaron 1,5 cm3 de semen en tubos Eppendorf de 2 ml para microcentrífuga. Las muestras fueron transportadas en refrigeración a 5 °C, en neveras de poliestireno expandido, del campo al Laboratorio de Cultivo Celular y Microbiología de la sede Norte de la Universidad de La Salle, en un lapso menor a 12 h, para posteriormente ser analizadas por PCR convencional solamente.
Las muestras de líquido preseminal se transportaron en cava a temperatura ambiente en un lapso de tiempo no mayor a 3 h para su procesamiento.
Serología
Para la detección de anticuerpos de la Leptospira spp. se utilizó la técnica de MAT en las distintas muestras de sangre (14,15). Las 107 muestras de suero sanguíneo fueron enfrentadas a los antígenos de Leptospira borgpetersenii serovariedad Hardjoprajitno, Leptospira interrogans serovariedad Canícola, Leptospira interrogans serovariedad Grippothyphosa, Leptospira interrogans serovariedad Icterohaemorrhagiae, Leptospira interrogans serovariedad Pomona y Leptospira interrogans serovariedad Bratislava. (14). La prueba se realizó en el Laboratorio de Microbiología y las muestras se consideraron positivas cuando los títulos fueron ≥ 1:200 según lo registrado por Hamond y colaboradores (10).
PCR convencional
Para la detección del genoma de la Leptospira spp. se utilizó la técnica de PCR convencional en las muestras de fluido preseminal y semen, para los genes hap 1 y rrl con 287 pb y 462 pb respectivamente (15). La extracción de material genético se hizo utilizando el Qiamp DNA Kit (Qiagen®), y la aplicación se realizó con Green Mix Master Tap polimerasa de Promegra®, la cual se visualizó en geles de agarosa al 1 % teñidos con EZ-vision® de Promega. La prueba se realizó en el mismo laboratorio (15).
Análisis estadístico
Los datos se analizaron por tablas de contingencia x2 y por OR con sus respectivos límites de confianza (EpiInfo 2000). El OR se ajustó por regresiones logísticas con las variables presencia o ausencia de Leptospira spp. en las muestras analizadas. También se establecieron posibles asociaciones por rangos de Spearman (16).
Resultados
Campo oscuro
La técnica de campo oscuro se ha utilizado desde hace muchos años como una herramienta diagnóstica importante en Leptospira spp. (1,17). Sin embargo, presenta problemas de especificidad por la presencia de artefactos con formas muy similares a la bacteria, las cuales pueden ser confundidas dando falsos positivos (12,16,18).
Se efectuó un análisis morfológico de las muestras de líquido preseminal, del cual se encontraron los resultados referentes al número de animales y a las fincas muestreadas. Dentro de los elementos encontrados, al visualizar particulados utilizando el campo oscuro a 450X, se observaron diferentes tipos de bacterias, seguidos de formas compatibles con leptospiras y cristales. Las muestras de líquido preseminal donde se encontraron formas compatibles con estructuras espirilares fueron procesadas posteriormente por la prueba de PCR convencional.
Serología
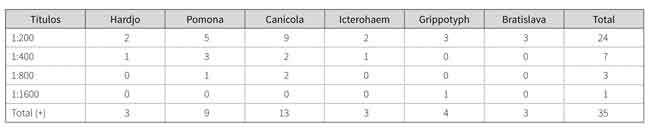
El 32,7 % de las muestras presentó serorreactividad; se destaca que las serovariedades Canícola, Pomona y Grippotyphosa representaron el 74,3 % de los resultados positivos. Los resultados de MAT se presentan en la tabla 1. Se resalta nuevamente que de las 35 muestras positivas fueron dominantes las serovariedades Canícola (13), Pomona (9) y Grippothyphosa (4).
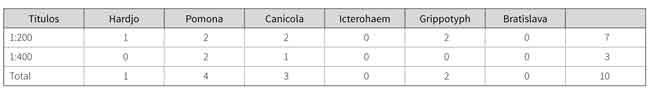
En la tabla 2 se observa que 10 de las muestras correspondieron a infecciones con un solo serotipo y en su orden de importancia: 4 correspondieron a la serovariedad Pomona, 3 a Canícola, 2 a Grippotyphosa y 1 a Hardjo.
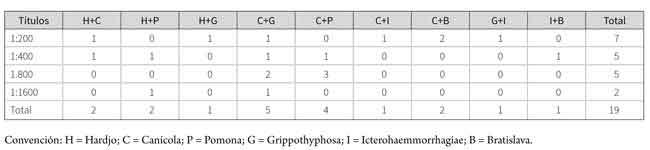
En la tabla 3 se describe que en 19 muestras se presentaron resultados positivos a dos serovariedades; lasdominantes fueron las infecciones mixtas de las serovariedades Canícola-Grippotyphosa en 5 casos y las serovariedades Canícola-Pomona en 4 casos.
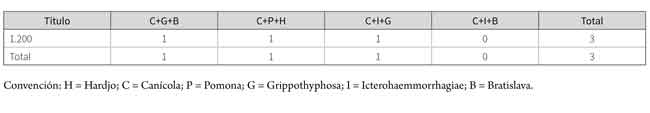
En la tabla 4 se describe que tres muestras de animales presentaron títulos positivos a tres serovariedades.
PCR convencional
En el proceso de detección del genoma de Leptospira spp. en el transiluminador de las muestras de fluido preseminal y semen, se encontró formación de bandas con el gen rrl y 462 pb mientras que con el gen hap 1 con 287 pb no se visualizaron (15).
Discusión
Los resultados serológicos encontrados sugieren la exposición de los sementales a Leptospira spp. sin que se manifieste condición clínica en ellos. Los resultados positivos de la PCR convencional en un 1,9 % del total de las muestras precisan la existencia del ADN bacterial. Sin embargo, generan la pregunta de si realmente ese material genético bacteriano procede del semen o se asocia a la presencia de leptospiras en el conducto uretral debido a que estos animales registraron serologías positivas. Estos resultados difieren de los hallados en otros estudios, en los que se encontró el 50 % de positivos por PCR en muestras de sementales (10).
Se registra en este estudio que la mayor presentación de infecciones corresponde a Leptospira interrogans serovariedades Canícola y Pomona en un 62,8 %. Pero llama la atención que en las tablas 1 a 4 siempre se presenta mayor reactividad a la serovariedad Canícola seguida por Pomona y Gryppotyphosa.
Considerando que la detección del genoma de leptospira mediante la utilización de la técnica de PCR convencional en el semen y el líquido preseminal fue muy baja en los predios muestreados, se ha estimado como una prueba en este caso de alto valor diagnóstico. Pero la presencia de anticuerpos contra este agente sugiere que los animales positivos han estado expuestos y su localización podría encontrarse en el riñón, lo cual coincide con los estudios sobre la patogénesis de las infecciones en las especies animales. Particularmente en un predio donde se encontraron títulos positivos por la técnica de MAT y positivos a PCR convencional se registraron casos de abortos, que fueron tratados como casos de leptospirosis.
Haciendo una aproximación anatómica de la uretra de los machos equinos donde puede existir la posibilidad de contaminación del semen, se sugiere la siguiente consideración: para establecer el análisis es importante describir la uretra intrapelviana del equino; se origina en la vejiga urinaria, a partir del orificio urinario interno, y termina en el istmo uretral a la altura del arco isquiático, cerca de las glándulas bulbo uretrales, para continuar con la uretra extrapelviana. En dicha porción pelviana de la uretra se abren los conductos de las glándulas genitales accesorias (próstata, vesículas seminales y bulbo uretrales) y los eyaculatorios; también es el punto que comunica la vejiga urinaria (meato urinario interno). El otro componente es el colículo seminal (Colliculus seminalis, utrículo prostático, Veru montanum), una estructura anatómica lisa, oval, que se proyecta dorsoventralmente a la luz de la uretra intrapelviana, caudal a la cresta uretral muy cerca al meato urinario interno. Consta de dos orificios eyaculatorios donde llegan los conductos de las vesículas seminales y ampollas de los conductos deferentes, donde drenan su secreción; a cada lado se abren los orificios prostáticos. Caudalmente cerca al arco isquiático el diámetro de la uretra disminuye ligeramente; craneal a esta se abren los conductos de las glándulas bulbouretrales a lado y lado de la pared uretral.
El aparato muscular se puede denominar de esta manera, dado que actúa sinérgicamente para el proceso de la micción desde la vejiga urinaria hasta la uretra, y en la eyaculación, con el bloqueo del meato urinario interno y el Veru montanum. Su acción final es bloquear el paso de la orina en el momento de la eyaculación y asegurar la mezcla de las secreciones de las glándulas genitales accesorias y los espermatozoides en la uretra pelviana. El contacto directo con la uretra e indirecto con la vejiga y el trígono vesical a través del poro urinario interno genera un factor de riesgo de infección ascendente o sistémica de las glándulas, como en el caso de las vesiculitis infecciosas. Adicionalmente, una disfunción neuromuscular podría alterar la acción eficiente de los orificios eyaculatorios y del cierre efectivo del meato urinario interno, el cual podría generar contaminación del semen con orina.
Aunque no existen informes de equinos particulares de estas presunciones anteriores, ofrece un buen campo y preguntas de investigación y particularmente en casos de infección por leptospira que son raros de presentación en semen. La exposición de reproductores a hembras infectadas con leptospira podría ser causa predisponente y determinante en encontrar genomas de leptospira y presencia de leptospira cualitativa en MAT (19).
La presentación de Leptospira spp. puede ser variada según la zona geográfica y tipo de sistema productivo equino. En el caso particular de la investigación no se encontró un índice alto de infección por la reproducción en las zonas de estudio donde fueron predominantes Leptospira interrogans, serovariedades Canícola, Pomona y Grippotyphosa. Esto es diferente a lo hallado por Divers y Chang (1), quienes describen que en Norteamérica la mayoría de los abortos son causados por el serovar Pomona, pero también se encuentran involucradas la Grippotyphosa y Hardjo en regiones enzooticas. En el caso del serovar Bratislava, registran que su aislamiento afecta en los equinos los casos de uveitis y abortos (5,20,21).
Conclusiones
Los resultados serológicos encontrados sugieren la exposición de los sementales a Leptospira spp. sin que se manifieste condición clínica en ellos. Los resultados positivos de la PCR convencional en un 1,9 % de total de las muestras precisan la existencia del ADN bacterial; sin embargo, generan la pregunta de si realmente ese material genético bacteriano procede del semen o se asocia a la presencia de leptospiras en el conducto
uretral, debido a que estos animales registraron serologías positivas. Estos resultados difieren de los hallados en otros estudios, en los que se ha encontrado el 50 % de positivos por PCR en muestras de sementales.
Se afirma en el presente estudio que en la mayor presentación de infecciones, de los casos positivos, el 74,3 % corresponde a la Leptospira interrogans, serovariedades Canícola, Pomona y Grippotyphosa. La alta tasa de animales con cultivos positivos a Leptospira spp., y con resultados negativos a PCR convencional del gen rrl, puede ser debido a:
Presencia de inhibidores de la Taq-polimerasa en las muestras purificadas de ADN.
Baja concentración de la bacteria, que no permite la amplificación por la técnica de PCR pero sí el crecimiento en cultivos en medio EMJH, pero con tiempos superiores a los dos meses de cultivo.
Teniendo en cuenta que la detección del genoma de leptospira mediante la utilización de la técnica de PCR en el semen y el líquido preseminal fue muy baja en los predios muestreados, se considera esta técnica como una prueba de alto valor diagnóstico para este caso. Pero la presencia de anticuerpos contra este agente sugiere que los animales positivos han estado expuestos y su localización podría encontrarse en el riñón, lo cual coincide con los estudios sobre la patogénesis de las infecciones en las especies animales. Particularmente en un predio donde se encontraron títulos positivos por la técnica de MAT y positivos a PCR, se registraron casos de abortos que fueron tratados como casos de leptospirosis.
La presentación de Leptospira spp. puede ser variada según la zona geográfica y el tipo de sistema productivo equino. En el caso particular de investigación no se encontró un índice alto de infección por medio de la reproducción, ni ocular (uveítis), en la zona de estudio donde fueron predominantes Leptospira interrogans, serovariedades Canícola, Pomona y Grippothyphosa.