INTRODUCCIÓN
La variación del color en el plumaje en las aves, dentro o entre las especies, ha atraído mucho la atención de los biólogos evolutivos y ecologistas, debido a su importancia potencial en cripsis, adaptación, selección sexual y especiación (1). Dentro de las especies, la variación del color del plumaje es también un ejemplo importante para estudiar los mecanismos selectivos que permiten el mantenimiento de polimorfismo en poblaciones naturales (2). Las palomas domésticas, o también llamadas palomas caseras (Columba livia), muestran alta variación de plumaje, que se originó a partir de la selección artificial, propio de animales domésticos y otros factores evolutivos poblacionales (2,3).
Aunque algunos autores indican que la especie es originaria de Europa, África y Asia (3), probablemente tiene sus orígenes en el sur de Asia, de un ancestro que vivió allí hace millones de años, de donde migró y colonizó África (Cabo Verde, Guinea, Mauritania y Senegambia); luego Europa (España, Gran Bretaña, Portugal, isla de Madeira, islas Azores); y finalmente Asia, Oriente Medio y Oceanía (4). Fue introducida en Norteamérica a principios del siglo XVII, cuando algunos individuos escaparon y formaron poblaciones ferales, y junto con las domésticas fueron colonizando el continente hasta formar una distribución discontinua en ciudades, pueblos y granjas. En el medio natural descansan y anidan en acantilados costeros o en tierras altas interiores. En las ciudades habitan en techos, repisas, ductos de desagüe, áticos, cuevas que sustituyen los acantilados y en los cuales construyen sus nidos. Se encuentran entre las aves que forman colonias de mayor éxito en las ciuda des, donde viven semidomésticas (3).
El tamaño y el color del plumaje de la paloma doméstica varían de modo notable. Típicamente las palomas tienen cuerpos grises con la rabadilla blanquecina, con dos franjas negras al final de las alas, una franja negra y ancha en la cola y las patas rojas. Sin embargo, el color del cuerpo puede variar de gris a blanco, bronce y negro. Por lo común, la cabeza es oscura y con frecuencia presenta una iridiscencia verde-púrpura. Es un ave de tamaño medio. El rango de longitud va de los 20 a los 36 cm; mientras que su peso fluctúa entre 340 y 360 g (3,5).
Varios autores han señalado las bases genéticas del color y diseño del plumaje que se presenta en las poblaciones de palomas (1,6-9). Sin embargo, el plumaje es muy variable entre individuos: pico oscuro con cera blanca en la base, patas rojizas y sin dimorfismo sexual (5). El tipo de coloración conocido como azul barra (plumaje azul grisáceo), con dos barras negras paralelas en cada ala, es considerado el fenotipo silvestre. Los colores del plumaje y patrones de alas observados en palomas son producidos por cuatro sistemas de alelos primarios: Checker, Ash-Red, Grizzle y Spread (6,10).
Los marcadores fenotípicos constituyen una valiosa herramienta a la hora de analizar la estructura genética de las poblaciones, debido a su gran contenido informativo, fácil manipulación e identificación en campo y bajo costo para su investigación, lo que permite realizar diversos análisis con base en parámetros estadísticos, para una obtención de resultados rápida y confiable (11).
Cabe señalar que este tipo de estudios son necesarios, puesto que confieren bases fundamentales previas para realizar investigaciones acerca de la estructura y dinámica de la ecología poblacional, la zoocría y la etología. Resaltan la importancia que tienen los genes que manifiestan los fenotipos responsables de la coloración, y establecen relaciones con factores como la viabilidad y variabilidad de las palomas domésticas, en distintos hábitats, de individuos que expresan, o no, los diferentes marcadores fenotípicos.
Por tal razón, el objetivo de este trabajo fue analizar la diversidad genética de la paloma doméstica (Columba livia) en Ciénaga de Oro (Córdoba, Colombia), mediante genes que codifican la coloración y diseño del plumaje.
MATERIALES Y MÉTODOS
Sitio de estudio
El estudio se realizó en la zona urbana de Ciénaga de Oro, ubicada a los 8° 52' 45" de latitud norte y 75° 37' 16" de longitud al oeste del meridiano de Greenwich (12). Se recolectaron muestras de cinco colonias: sector centro, parque principal, mercado público, Plaza del Martillo y Parque de los Músicos.
Obtención de datos
Se realizaron muestreos aleatorios entre junio y agosto de 2015. Mediante excursiones urbanas, observación directa y registros fotográficos, se realizó una clasificación fenotípica de cada uno de los individuos de las diferentes bandadas de palomas encontrados en Ciénaga de Oro (n = 325). Cada ruta se utilizó solo una vez, para evitar el remuestreo, atendiendo a la presencia o ausencia de los marcadores autosómicos; se siguió la metodología propuesta por Pardo y colaboradores (6); los marcadores son Grizzle (G), Spread (S), Checker (C) y el gen ligado al sexo Ash-Red (B).
Diseño estadístico
La estimación de las frecuencias alélicas de cada marcador en los ámbitos poblacional y global, así como las medidas de diversidad genética establecidas por Nei, correspondientes a la heterocigosidad esperada (He), heterocigosidad esperada de la población total (HT), coeficiente de diferenciación genética (G), flujo génico (Nm), equilibrio Hardy-Weinberg y distancia genética entre las poblaciones, se estimaron a través del programa PopGene 1.31 (13). La estructura genética de las poblaciones, de acuerdo con los índices de fijación propuestos por Wright (FIS, FIT y FST), se calculó mediante el programa FSTAT v. 2.9.3.2 (14). La elaboración del dendrograma que representa los valores estimados de distancia genética se realizó a través del método Unweighted Pair Group Methodwith Arithmetic Mean (UPGMA), utilizando el programa MEGA 5.2 (15).
RESULTADOS
Frecuencias alélicas
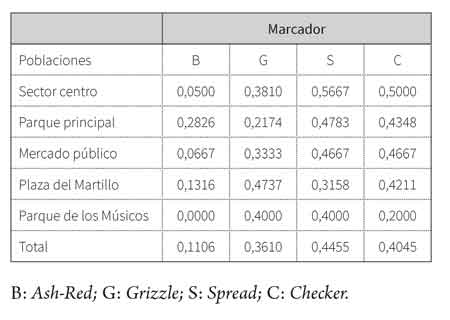
Las frecuencias alélicas para cada población (tabla 1) mostraron que el gen Spread fue el más frecuente, principalmente en las poblaciones del sector centro (p =0,5667), del parque principal (p = 0,4783) y del mercado público (p = 0,4667); en segundo lugar, respecto a la mayor frecuencia, se ubicó el marcador Checker en las colonias del sector centro (p = 0,500) y del mercado público (p = 0,4667). Por su parte, el marcador Ash-Red, responsable de la presencia de producir palomas de plumaje rojo, mostró las frecuencias menores y no se registró en la colonia del Parque de los Músicos. Por otro lado, la colonia sector centro fue la que presentó las mayores frecuencias para todos los marcadores.
En general, el gen Spread se ubicó como el marcador con la mayor frecuencia, seguido de Checker; en contraste, Grizzle y Ash-Red presentaron las menores frecuencias.
Diversidad genética
En cada marcador, el nivel medio de variabilidad genética fue relativamente alto. La heterocigosidad esperada más alta se encontró para el marcador Checker, con un valor de 0,5007, y la más baja para el marcador Ash-Red, con un valor de 0,2347 (tabla 2). Los valores de heterocigosidad observada oscilan entre un máximo de 0,4875 para el marcador Checker, y un mínimo de 0,2285 para Ash-Red.
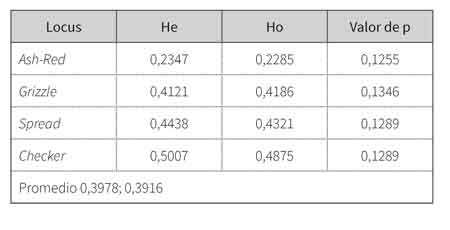
Tabla 2 Índice de diversidad genética de Nei (1973) en cada marcador a través de la heterocigosis esperada (He) heterocigosidad observada (Ho) y valor de p
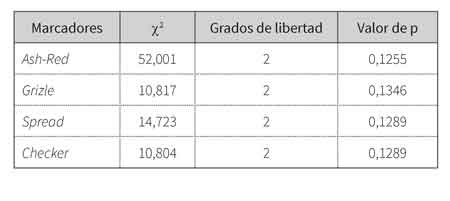
Los valores medios de He y Ho son 0,3978 y 0,3916, respectivamente. Con relación al test de equilibrio Hardy-Weinberg (tabla 3), en el ámbito global, las poblaciones mostraron ausencia de equilibrio.
Diferenciación genética y flujo génico
El nivel de diferenciación genética en la población de Ciénaga de Oro fue muy bajo (coeficiente de diferenciación genética [ G ] de 0,025; y flujo génico [Nm] de 3,98), lo que indica que aproximadamente el 2,5 % de la variación detectada se debe a diferencias entre las poblaciones. Por lo tanto, las cinco subpoblaciones no fueron significativamente diferentes para los marcadores estudiados, lo cual sugiere que todas ellas se comportan como una sola población.
El valor de flujo génico permite suponer que las poblaciones mantienen un grado de intercambio genético; en esta medida, se considera un total de aproximadamente 4 migrantes por generación. Además, la cifra obtenida resultó ser mayor que 1, lo que indica que las subpoblaciones se comportan como una sola población.
Estructura poblacional
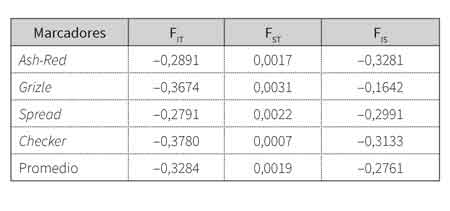
Los valores negativos de FIS para todos los marcadores (tabla 4) evidencian un exceso de heterocigotos de los individuos con respecto a cada población, y por lo tanto hay ausencia de consanguinidad, con valores que oscilan entre -0,1642, para el marcador Grizzle, y -0,2989, para el gen Ash-Red. Con relación al estadístico FIT, en promedio se obtuvo un exceso de heterocigotos de los individuos con respecto a la población total, lo cual abarca valores de -0,2791 a -0,3780 para los marcadores Spread y Checker, respectivamente. Por otro lado, el valor promedio de FST resultó ser bajo, lo que indica poca diferenciación génica existente entre las poblaciones; así mismo, esto se ha evidenciado en el coeficiente de diferenciación genética GST (tabla 4).
Distancia genética
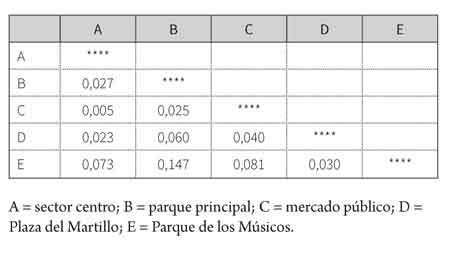
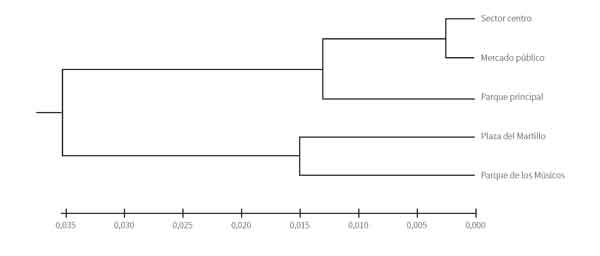
La distancia genética entre las poblaciones fue baja, siendo el sector centro y el mercado público las poblaciones más cercanas (tabla 5), mientras que las colonias parque principal y Parque de los Músicos resultaron ser las de mayor diferencia génica; cifra poco significativa, pues no superó el 15 %. En este contexto, la colonia Parque de los Músicos presentó los valores mayores de distancia genética en comparación con el resto de colonias.
El dendrograma (figura 1) evidencia la similaridad genética entre las colonias del sector centro y del mercado público a las cuales se asocia la colonia parque principal. Por otro lado, las colonias de Plaza del Martillo y Parque de los Músicos se mantuvieron alejadas de las demás, pero con un valor de distancia poco significativo, que permite deducir que las poblaciones en conjunto están muy relacionadas.
DISCUSIÓN
La elevada frecuencia de los marcadores melánicos Spread y Checker en esta investigación coinciden con los resultados de otros estudios, como el de Canády y Mosansky (16), quienes realizaron una investigación acerca de la distribución, el tamaño y los fenotipos del plumaje de la población de palomas en la ciudad de Kosice (Eslovaquia), en 2013; y encontraron que, de 654 palomas muestreadas, el 53 % fue de fenotipo melánicos, debido a una posible relación entre las palomas de color oscuro y de color claro que viven en el centro y periferia de la ciudad. Es decir, en ambientes urbanos las palomas oscuras tienen ventaja selectiva sobre las claras, y en ambientes suburbanos no hubo diferencia significativa entre dichos fenotipos. En Colombia, Pardo y colaboradores, quienes trabajaron acerca de la variabilidad genética de palomas domésticas en Bogotá, en 2015, encontraron que los marcadores más frecuentes fueron Checker (0,382) y Spread (0,250), debido a posibles ventajas selectivas sobre individuos que no expresan estos marcadores (6).
Las altas frecuencias de fenotipos melanóticos en este estudio podrían estar relacionadas con diversos factores. El primero tiene que ver con la probable asociación entre la coloración y el mantenimiento de masa corporal, la actividad reproductiva y la calidad de la descendencia en diferentes condiciones ambientales. Bajo la restricción de alimentos, las hembras de fenotipos más oscuros tienden a tener una producción más alta de huevos, pero los adultos más oscuros tienden a perder más masa corporal que los congéneres de fenotipos más claros. Por otra parte, las crías bajo condiciones limitadas de alimentos tienen una masa corporal superior al nacer cuando son descendientes de progenitores melánicos, lo que sugiere un efecto genético positivo de individuos más oscuros, en duras condiciones de alimentación. En contraste, cuando la comida es abundante, las hembras de fenotipos claros y oscuros tienen producciones similares de huevos, pero los adultos más oscuros pierden significativamente menos masa corporal que sus congéneres más claros (17). Dado que esta población estaría sometida a condiciones limitadas de alimentos, los individuos oscuros han podido tener ventaja selectiva sobre otros de fenotipos más claros.
Otro factor que estaría relacionado con la elevada frecuencia de los marcadores melánicos tiene que ver con la susceptibilidad a los parásitos. Los individuos melánicos reflejan menor susceptibilidad a endoparásitos y tienen una mayor respuesta inmune frente a ellos que los individuos de fenotipos más claros; es decir, existe un "vínculo genético" en el que individuos de diferentes colores pueden ser expuestos de manera similar a los parásitos, pero los más oscuros podrían tener una mayor capacidad para controlar la infección. Por ende, se considera que el parasitismo podría desempeñar un papel crucial en el mantenimiento del polimorfismo de color en las poblaciones naturales (18); por ello se sugiere que este hecho, la existencia de preferencia de las hembras por machos melánicos sobre machos no melánicos (15), junto con las condiciones limitadas de alimentos, mencionadas anteriormente, haya podido influir no solo en la densidad poblacional, sino también en el aumento de las frecuencias alélicas en la población de estudio.
La desviación del equilibrio de Hardy-Weinberg para los marcadores estudiados puede obedecer a diversas causas. Como los resultados arrojan un exceso de heterocigotos y déficit de homocigotos, podría atribuirse en este caso a algunos factores evolutivos como la selección natural, pues los individuos melánicos confieren una ventaja selectiva sobre los de fenotipos menos melánicos y la ausencia de endogamia, debido a la presencia de flujo genético diferencial para uno y otro sexo y al cruce rápido de hembras y machos migrantes con los individuos lugareños, lo que provocaría un exceso de heterocigotos (19). Por tal razón, hembras y machos tendrían genotipos pertenecientes a acervos genéticos altamente diferenciados. Otro aspecto que podría afectar esta desviación es la cercanía geográfica entre las subpoblaciones estudiadas, lo cual ocasiona un aumento sustancial del flujo génico que hay entre estas, dado que la existencia de un alto intercambio de genes previene eventos de endogamia entre las poblaciones (11), lo que lleva, por lo tanto, a un aumento de genotipos heterocigotos en la población.
El grado de flujo génico permite inferir que las subpoblaciones se encuentran muy relacionadas genéticamente y se comportan como una metapoblación, puesto que si Nm es mayor que 1, la deriva génica es despreciable y el flujo génico hace que todas poblaciones evolucionen de manera cohesiva como un conjunto. A esta situación se atribuye la aproximación de todas las poblaciones desde el punto de vista estructural (20), lo cual sugiere que debe analizarse como una sola población.
La evidencia del exceso de heterocigotos mediante índices de fijación (F y F) en cada una de las subpoblaciones estudiadas muestra que estas presentan una estructura bastante homogénea, pues un alto intercambio genético supera los efectos de la deriva génica y previene la distinción local, hecho que muestra los bajos índices de diversidad genética. Por tal razón, el grado de diferenciación genética entre las subpoblaciones fue bajo (GST = 0,025). Jacob y colaboradores, en 2015 (21), analizaron el ADN de las palomas salvajes procedentes de catorce localidades, de ocho áreas urbanas pertenecientes a Francia, España y Suiza. Revelaron que los grados de diferenciación genética se incrementan significativamente con la distancia geográfica que separa las ubicaciones de poblaciones en estudio. Por el contrario, los lugares vecinos dentro de las áreas urbanas por lo general no se diferencian genéticamente, lo cual sugiere que todas las palomas salvajes en una zona urbana constituyen una sola unidad. Esto no solo podría estar relacionado por la cercanía geográfica de las poblaciones, si no por factores evolutivos como la selección natural y por la densidad poblacional antrópica, pues existe una correlación entre las densidades poblacionales humanas y las densidades poblacionales de palomas (22). Está demostrado que las especies domésticas, hasta cierto grado de su diversidad genética, están condicionadas a criterios de selección artificial, debido a su interacción directa con poblaciones antrópicas (23).
El índice de distancias génicas pretende estimar el número de mutaciones que en la zona del nucleotídico se han acumulado en las secuencias de dos linajes, según el tiempo que ha transcurrido, desde su divergencia original (24), reflejada en las frecuencias alélicas de diferentes marcadores (la presencia o ausencia de los loci en el caso de marcadores fenotípicos). El alto flujo génico
podría justificar los bajos valores de las distancias genéticas encontradas en este estudio. También se podría explicar por las presiones de los eventos evolutivos que llevan a que los cambios en las frecuencias alélicas estén actuando de manera uniforme, debido a la cercanía geográfica y a las condiciones ambientales similares.
La gran cercanía genética entre las poblaciones del sector centro y del mercado público podría obedecer a que, en poblaciones naturales, la cercanía genética es directamente proporcional a la geográfica (24,25), pues estas poblaciones evidencian una gran cercanía geográfica. Por otra parte, es posible afirmar que los sitios ubicados hasta dos kilómetros de distancia, entre poblaciones, tendrán densidades demográficas similares en cuanto a la distribución de palomas domésticas (21); por dicha razón, el flujo génico aumenta y acorta así las distancias genéticas. Si hay una correlación significativa entre las distancias geográfica y genética, existe evidencia de aislamiento por distancia, lo que sugiere que las poblaciones más alejadas geográficamente podrían presentar diferencias genéticas bastante significativas.
CONCLUSIONES
El marcador con la mayor frecuencia fue Spread, debido a que podría estar siendo favorecido por las condiciones ecológicas y por factores pleiotrópicos que evidencian una posible selección natural. La diversidad genética total encontrada en la población de palomas domésticas de Ciénaga de Oro fue moderada. La mayor parte de la diversidad génica se encontró dentro de las poblaciones, hecho que podría explicar que las poblaciones locales comparten una gran proporción de la diversidad total, y por esa razón se comportan como una sola población. Se encontró, además, ausencia del equilibrio de Hardy-Weinberg para todos los marcadores. Esta desviación podría estar relacionada con una posible selección natural y con presiones del ambiente en la dinámica y ecología genética-poblacional.