INTRODUCCIÓN
El capitán de la sabana (Eremophilus mutisii) es el bagre nativo de mayor tamaño presente en aguas de baja temperatura en el país, y como especie endémica de zonas del altiplano central colombiano, tiene un carácter emblemático (1). Además de su importancia cultural y ambiental para la región, presenta características que presumen algún potencial para piscicultura (2). Se comercializa y consume en zonas aledañas a los cuerpos de agua en los que habita, donde se le reconoce por la calidad de su carne (3), en una oferta que exclusivamente se basa en la extracción por pesca. Los efectos asociados al deterioro de los sistemas se identifican como factores de riesgo para las poblaciones naturales, por lo que actualmente se la califica como especie vulnerable (4).
En general, la cantidad de referentes publicados sobre la especie es escasa (5), inferior a los disponibles para otros bagres nativos en el país, sobre los que se han realizado esfuerzos para desarrollar procedimientos orientados a manejo piscícola. Aun así, en los últimos años ha sido notorio un incremento en los registros que abordan aspectos reproductivos que, en complemento a aquellas descripciones de ciclo gonadal en áreas de distribución natural, incluyen los relacionados con el control artificial de la reproducción (6-9).
Si bien se registra la presencia permanente de ejemplares maduros a lo largo del año en ciertos sistemas (3), son varios los trabajos que confirman una marcada relación de los picos de actividad reproductiva con la época de lluvias (10,11), periodo en el que los cuerpos de agua se encuentran en máximos niveles. Está descrito el fenómeno de "rebote", en el que se presenta la afluencia masiva de ejemplares hacia las orillas para efectos reproductivos; es particularmente notorio en embalses; tiene una duración de pocos días y, por lo general, solo se presenta en horas nocturnas. Coincide cada año con los picos de lluvias, por lo que normalmente se registra dos veces en el año. El rebote no está documentado en sistemas naturales (como ríos, lagos o lagunas), y tampoco hay claridad sobre su manifestación en pequeños cuerpos de agua (vallados y acequias) (1,2). Estas circunstancias restringen la disponibilidad a ejemplares del medio, y dificulta la ejecución de programas experimentales de manejo en condiciones de cautiverio.
No obstante, la determinación de algunos elementos de respuesta al uso de inductores se constituye en un avance operativo que ha permitido estructurar pasos siguientes en la resolución de limitantes en el manejo de la reproducción de la especie. Entre estos, puntualizar sobre los periodos que demanda la aparición de eventos principales en el desarrollo embrionario en peces es una herramienta útil, en especial cuando se realiza el manejo de incubación y larvicultura con fines de producción (12). El tiempo en el que aparecen estructuras relevantes facilita establecer momentos de control y de cuantificación sobre la eficiencia de los procesos, particularmente en esquemas investigativos en los que se busca establecer condiciones óptimas para el manejo de estas fases, lo que para la especie aún requiere precisión experimental. Por tanto, el objetivo del presente trabajo es presentar la descripción global de los principales eventos que se identifican dentro del desarrollo embrionario del capitán de la sabana, en un esquema controlado de obtención de huevos y manejo en incubación.
MATERIALES Y MÉTODOS
Se utilizaron peces del medio, capturados mediante trasmallo en el embalse de Tominé, que se localiza a 2600 m s. n. m., en el nororiente del departamento de Cundinamarca (Colombia). El transporte desde el sitio de captura hasta las instalaciones de manejo en el municipio de Guasca (Cundinamarca) se realizó en bolsas plásticas de 20 L, con oxígeno a presión. Los ejemplares se ubicaron en un estanque de 15 m2, previamente encalado, protegido de forma parcial con polisombra y con un flujo constante de agua de 1 L s-1.
De los peces trasladados, se seleccionaron tres hembras y cinco machos, según evidencias externas de madurez sexual. Los criterios determinantes fueron: en hembras, la forma de la papila y el abultamiento del abdomen; en machos, la emisión de esperma. Se certificó el estado de los huevos mediante el aclaramiento de una muestra con líquido de Serra y determinación del porcentaje con núcleos migrando o periféricos. Cada ejemplar fue pesado en una balanza eléctrica OHAUS (con aproximación a 0,1 g), y fue medido en longitud total con un ictiómetro graduado en milímetros. La identificación individual se realizó con marcas plásticas de diferentes colores localizadas en la base de la aleta dorsal.
Para la reproducción se utilizó el protocolo hormonal con el que se obtuvo respuesta ovulatoria efectiva, de acuerdo con lo descrito en Rodríguez y Rosado (6) y González y Rosado (8), utilizando como inductor extracto de hipófisis de carpa (EHC). La dosis total para las hembras fue de 5,5 mg kg-1 aplicada en una preparatoria del 10 % y una definitiva del 90 %, separadas por un intervalo de 12 h. En machos se aplicó una sola dosis (4 mg kg-1) en el momento de la segunda inyección de las hembras. Las aplicaciones fueron intraperitoneales (IP) con jeringas de 1 ml. Durante el proceso, los peces fueron mantenidos en dos acuarios (de 40 L), provistos con aireación y cubiertos completamente con plástico oscuro. Comprobada la ovulación, las puestas fueron obtenidas por extrusión, recibidas en recipientes independientes y, por lote, se realizó una medición del diámetro oocitario de tres muestras de 50 huevos cada una. La seminación se hizo en seco, y, antes de la hidratación, cada puesta fue pesada con el fin de estimar la cantidad de huevos obtenidos. En la incubación se utilizaron frascos de vidrio de 3600 ml, con cada puesta en un recipiente independiente. La temperatura del agua se controló a través de calentadores con termostato, y fue medida cada hora durante el proceso. Los frascos fueron provistos de aireación permanente, y las limpiezas, registro de la mortalidad y renovación de agua (50 %) se realizaron diariamente.
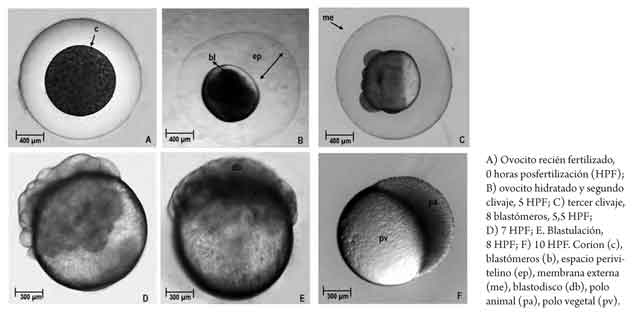
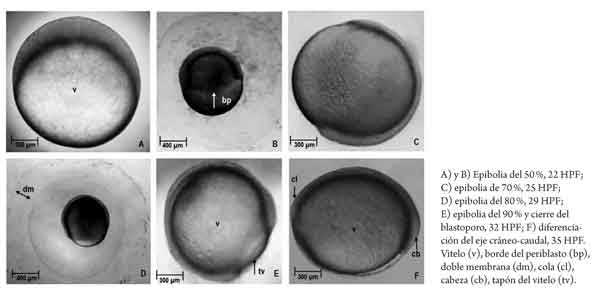
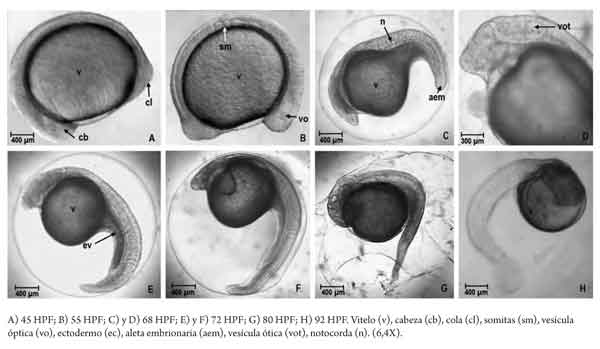
Con base en referencias previas sobre la duración de la etapa en el capitán, se determinó tomar muestras (n = 50) cada hora, desde el momento de la fertilización (hora 0) hasta que se determinó una eclosión superior al 90 %. La secuencia del desarrollo embrionario fue monitoreada y documentada con registros fotográficos de las muestras, utilizando una cámara digital acoplada a un microscopio (Nikon, SMZ800). Las descripciones morfológicas se basaron en la investigación de Clavijo y Arias (13), y los eventos se registraron en horas posfertilización (HPF), grados hora (grados h-1) y grados día (grados d-1). El seguimiento finalizó en eclosión, con los últimos registros correspondientes a la determina ción de la longitud de las larvas y el diámetro y volumen del saco vitelino.
RESULTADOS
Las hembras inducidas presentaron una longitud total promedio de 23,5 ± 3,01 cm y pesos entre 130 y 240,8 g. En machos, la talla media fue de 20,7 ± 2,47 cm en longitud total, y de 84,7 ± 25,11 g en peso. El protocolo utilizado fue efectivo en promover la ovulación y facilitar la extrusión de los huevos; esta se realizó entre las 22 y las 26 h después de la segunda dosis (a 13.2°C), lo que precisa el periodo de latencia en el rango de 290 a 345 grados h-1 (figura 1). Durante la incubación, la temperatura promedio fue de 16,15 ± 1,1 °C, y la concentración de oxígeno disuelto, de 7,2 ± 0,3 mg L-1. La cantidad de esperma adicionada fue suficiente para asegurar una fertilización que fue superior al 80 % en cada una de las tres hembras inducidas, estimada en el momento del cierre del blastoporo. Para efectos de seguimiento sobre el desarrollo, se utilizaron muestras provenientes de la puesta en la que se obtuvo el mayor porcentaje de fertilización (92,2 %).
Se trata de ovocitos esféricos, con una coloración que varía en diversas tonalidades de verde; son adherentes, por lo que se aplicó un baño en solución de carbamida antes del ingreso a incubación, lo que evitó la formación de masas aglutinadas dentro de los recipientes. El diámetro promedio fue 1052 ± 60,2 ^m, que se incrementó hasta 2890 ± 175 ^m, cuando la hidratación finaliza y se hace visible la doble membrana característica de silúridos (14). Son huevos telolecíticos, con segmentación meroblástica localizada en el polo animal.
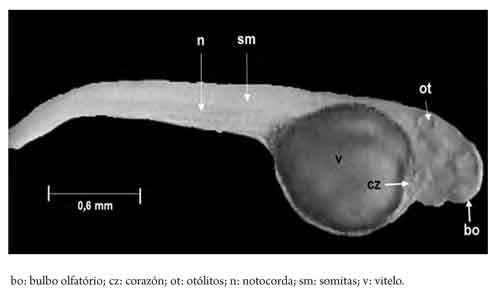
Del total de muestras obtenidas, el desarrollo embrionario fue finalmente descrito en 20 momentos que son representativos de los estadios desde ovocélula hasta eclosión. El 90 % de la eclosión se presentó a las 100 HPF (4,17 días) a 16,15 °C (que, tomada como temperatura de referencia, estandariza la duración del proceso en 1615 grados h-1 o 386,4 grados d-1). La tabla 1 resume la secuencia de desarrollo en los eventos definidos y en las figuras 2, 3 y 4 se presentan las imágenes que corresponden a los momentos identificados como representativos de los diferentes estadios. Finalmente, la figura 5 muestra las características de una larva recién eclosionada.
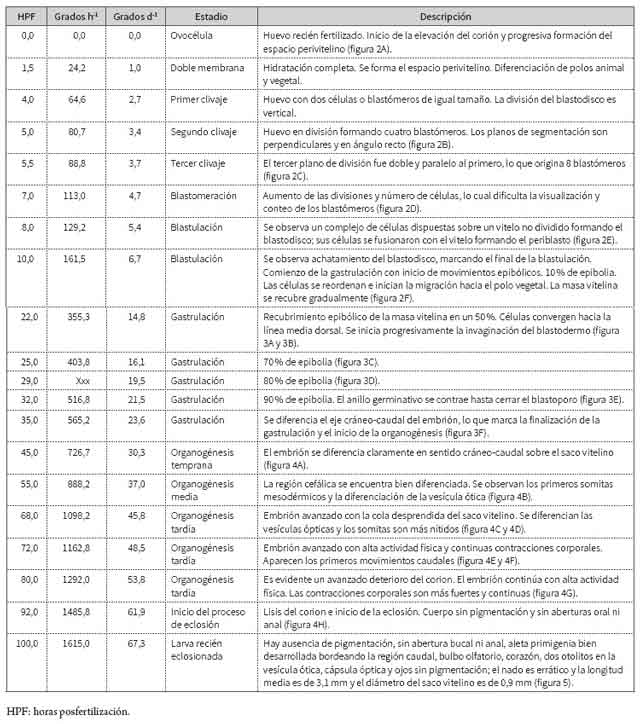
Tabla 1 Descripción cronológica de las principales etapas en el desarrollo embrionario de E. mutisii
DISCUSIÓN
El peso de la puesta finalmente utilizada para el seguimiento fue de 12,6 g, el cual, con el número de huevos g-1 en el rango de 1132 a 1473 que ha sido registrado (6, 8), representó alrededor de 16.400 ovocitos, cantidad que coincide con los referentes de fecundidad absoluta (10.000-50.000) que registra Amaya (15) para la especie.
Se trata de huevos pequeños (1052 ± 60,2 µm), comparables en diámetro con los de otros silúridos, como Rhamdia sebae, con 930 µm (16); Rhamdia quelen, con 963 µm (17); Sorubim cuspicaudus, con 1492 µm (18); Pseudoplatystomafasciatum, con 1625 ± 153 (19); Pimelodus grosskopfii, con 1200 ± 16 µm (20); Leiarius marmoratus, con 665 ± 3,11 (21), entre otros. La talla de la larva recién eclosionada fue de 3148 ± 176 µm, dato similar e intermedio dentro de los 3030 um para L. marmoratus (21) y los 3320 µm para S. cuspicaudus (18), que son los dos valores extremos entre las especies anteriormente mencionadas.
En el capitán, el desarrollo embrionario determinado en los estadios principales de ovocélula, clivaje —que finaliza con el establecimiento del blastodermo—, gastrulación —con epibolia progresiva hasta el cerramiento del blastoporo—, organogénesis —con diferenciación de regiones cefálica, caudal y aparición de somites— y, finalmente, la eclosión —con rompimiento del corion y salida de la larva—, se ajusta, en función de los detalles descriptivos para cada evento, a un patrón equivalente al que ha sido descrito para otros bagres (16-21). Estos ejemplos también muestran correspondencia entre sí con el esquema común que para bagres en general relacionan Adriaens y Vandewalle (22).
Independientemente de la similitud en el patrón global, el rasgo más notable dentro del desarrollo de E. mutisii radica en la duración del proceso. En general, es la temperatura el factor que explica el que la aparición de las estructuras en el capitán demande un tiempo mayor (en términos absolutos), cuando se compara con datos de otros bagres, aun cuando los referentes en el país corresponden solo a especies de clima cálido. En la actualidad no se dispone de datos que permitan una comparación con otras especies de aguas frías emparentadas con el capitán (por ejemplo, género Pygidium). Hasta eclosión, el registro de 100 HPF (1615 grados h-1) es notoriamen te superior a los periodos (siempre inferiores a 24 h en temperaturas entre 24 y 28 °C) que se registran para Pimelodus (20), Pseudoplatystoma (19,23), Leiarius (21), Sorubim (18), entre otros.
Para el caso del capitán, la extensión del periodo genera desafíos en cuanto a la producción, pues los sistemas de incubación para utilizar deben promover el mantenimiento de condiciones suficientes de calidad de agua durante varios días. Además, la manifestación de mortalidades diferenciales durante el proceso, con eventual asociación a alguno de los estadios descritos, es una cuestión por determinar para la especie, en tanto puede ofrecer un referente para la determinación de los sistemas de incubación más efectivos. Adelantar el proceso en recipientes, como los que se utilizaron en este caso, demanda rutinas de manejo permanentes que, por lo exigentes, dejan de ser prácticas bajo esquemas de mantenimiento de mayor escala en lo que respecta a cantidad de huevos, limitación que para el capitán ya ha sido mencionada (6,8).
Alrededor de los 1485 grados h-1 se observa la eclosión de las primeras larvas, que alcanzan más del 90 % cuando se completan los 1615 grados h-1, es decir, con unas 8 h de diferencia. Aunque este tiempo es aparentemente extenso, la comparación no procede con otros registros, debido a la temperatura en la que se adelantó la incubación. El efecto causal de este intervalo sobre la heterogeneidad de la talla inicial en las larvas, y su posible incidencia en la manifestación de conductas caníbales, en el sentido en el que lo refieren Díaz-Olarte y colaboradores (23), es un aspecto por precisar en el capitán. Tanto estos autores, para Pseudoplatystoma sp., como Valbuena y colaboradores (20), para P. grosskopfii, mencionan que la duración del proceso de eclosión puede explicar las pérdidas que por canibalismo se observó en las dos especies.
El deterioro progresivo del corion, a causa de la secreción de enzimas y de movimientos embrionarios de intensidad creciente, es un indicativo del inicio del proceso de eclosión y macroscópicamente es visible. Una vez eclosionan, su desplazamiento vertical es reducido, de poca intensidad y errático, y permanece la mayoría del tiempo en el fondo del contenedor, lo que podría ser indicio de un comportamiento fotofóbico, tal como indican Adriaens y Vandewalle (22) que se presenta en larvas de varias especies de bagres. La forma del saco vitelino es redondeada y el diámetro medio de 0,9 ± 0,08 mm (con un volumen de 0,382 mm3) confirma datos previos (8), y guarda correspondencia con el reducido volumen del saco vitelino registrado para bagre rayado (19), capaz (20) y yaque (21), especies en las que, en consecuencia, el periodo de reabsorción es relativamente rápido; tanto Rodríguez y Rosado (6) como González y Rosado (5) muestran que el tiempo de reabsorción se ubica en unos cuatro a seis días, pero se concluye que son datos aproximados que deben ser objeto de mayor precisión. Una descripción completa sobre el desarrollo larval en E. mutisii aún requiere ser adelantada.
CONCLUSIONES
El periodo de latencia en el capitán, cuando se aplican procedimientos de inducción, se precisa entre 290 y 345 grados h-1. El tamaño de los huevos se considera pequeño, similar en magnitud al descrito para otros bagres nativos del país; así mismo, el patrón de desarrollo embrionario es análogo al de varios de los géneros de silúridos referenciados en el contexto nacional. Desde la ovocélula hasta la eclosión, el proceso se describe completamente con base en 20 momentos representativos, con lo cual se identifica, no obstante, que la diferencia más notoria radica en que el tiempo que transcurre desde el estado de ovocélula hasta que la eclosión finaliza alcanza los 1615 grados h-1 (4,2 días, 100 HPF); este supera ampliamente el que se maneja en bagres de clima cálido, inferiores a las 24 h. Dado este tiempo, la precisión sobre la magnitud de las pérdidas en los diferentes estadios y trabajos dirigidos a la descripción del desarrollo larval se constituye en una necesidad investigativa para la especie.