INTRODUCCIÓN
Los procesos de congelación de semen son conocidos por producir un incremento en la generación de especies reactivas de oxígeno (ERO) (1), a causa del desacoplamiento del metabolismo oxidativo normal de los espermatozoides (2). Se ha descrito que la criopreservación del semen conduce a la pérdida de la actividad de defensa antioxidante, principalmente a causa de la alteración de las enzimas antioxidantes (3).
El plasma seminal equino posee actividades considerables de superóxido dismutasa (SOD) y de glutatión-peroxidasa (GPx) (4,5). Igualmente, la catalasa (CAT) se encuentra en grandes cantidades en el semen de los equinos, a excepción de la primera fracción del eyaculado, conocida como fluido preespermático, el cual se origina como secreción de las glándulas bulbouretrales (6). Vitaminas como el a-tocoferol y el ácido ascórbico, así como otras moléculas presentes en el plasma seminal equino como lactato, ácido úrico, taurina, hipotaurina, piruvato, ergotioneína y albumina han sido reconocidas por su funcionalidad como antioxidantes (7,8). Sin embargo, es común la extracción del plasma seminal durante los procesos de criopreservación del semen equino, por su posible relación con la incapacidad de los espermatozoides para sufrir reacción acrosómica y completar la fertilización (9,10). Adicionalmente, esto podría favorecer el estrés oxidativo del semen, ya que las moléculas antioxidantes presentes en el plasma seminal son descartadas (11). Además, el proceso de centrifugación por sí mismo es deletéreo para los espermatozoides, y se ha relacionado con un incremento en la producción de ERO (12,13).
Se conoce que los diluyentes para la congelación de semen equino tienen un efecto compensatorio de la capacidad antioxidante (14). Así mismo, la adición de SOD y otras moléculas antioxidantes pueden reducir las alteraciones espermáticas generadas por el estrés oxidativo (15,16). De tal forma, antioxidantes no evaluados aún en la criopreservación de semen equino podrían potenciar su actividad antioxidante. El timol (2-isopropil-5-metilfenol) es un antioxidante de origen natural, presente en aceites esenciales de tomillo (Thymus vulgare) y orégano (Origanum vulgare), que es conocido por su capacidad de inducir un incremento en la actividad de enzimas como la glutatión-S-transferasa y la alanina aminotransferasa (ALT) (17,18).
El isoespintanol (2-isopropil-3,6-dimetoxi-5-metilfenol) es un análogo biosintético del timol, extraído de las hojas de Oxandra cf xylopioides (Annonaceae), y es considerado mejor antioxidante que el timol, por su mayor capacidad de neutralización de radicales libres, evaluada experimentalmente mediante los ensayos FRAP (poder antioxidante reductor férrico) y DPPH (1,1-Difenil-2-picrilhidrazilo), al igual que por su mayor capacidad de transferencia de electrones y átomos de hidrógeno. Esta se evaluó teóricamente a través del poten cial de ionización y la entalpia de disociación del enlace O-H, respectivamente (19). El objetivo de esta investigación fue evaluar el efecto del isoespintanol y el timol en la actividad antioxidante total y enzimática de semen equino diluido con fines de congelación.
MATERIALES Y MÉTODOS
Localización y obtención de muestras
Se empleó el semen proveniente de cinco caballos criollos colombianos (Equus caballus), ubicados en el municipio de Girardota (Antioquia, Colombia), 6° 23' 41,50" latitud norte y 75° 25' 27,95" longitud oeste, con una altitud promedio de 1475 m s. n. m., una temperatura promedio de 22 °C y una pluviosidad cercana a los 2200 mm/año. Los animales estuvieron entre los 2 y 8 años de edad, todos en un régimen mínimo de una colecta semanal, con fertilidad comprobada con crías nacidas vivas y con una condición corporal entre 6 y 7 (escala 1 a 9). Se realizó la evaluación física de los genitales externos de cada reproductor, para descartar alteraciones anatómicas. Se sometieron a condiciones iguales de manejo en estabulación y alimentación a base de pasto estrella henificado (Cynodon nlemfuensis) suministrado a voluntad. Se colectaron dos eyaculados por animal, mediante una vagina artificial modelo Missouri (Minitube, Tiefenbach, Alemania), lubricada con gel no espermicida y sobre una yegua. La fracción en gel del eyaculado se removió por filtración. El semen se diluyó en proporción 1:1 en diluyente EquiPlus® (Minitube, Tiefenbach, Alemania), y se transportó a 5 °C en una caja de transporte aislante durante 2 h.
Evaluación seminal
La concentración de espermatozoides se evaluó por espectrofotometría (Spermacue®, Minitube, Tiefenbach, Alemania) con una gota de semen fresco. La movilidad espermática se evaluó por microscopía de contraste de fase (Eclipse E200®, Nikon Inc., Tokio, Japón), en mínimo cinco campos de observación (20). La morfología normal y la vitalidad espermática se evaluaron por la técnica de eosina-nigrosina modificada, para lo cual, sobre un portaobjetos, se mezclaron una gota de semen y una gota de eosina-nigrosina (Sigma-Aldrich, St. Louis, USA), y se realizó un extendido. En un microscopio de contraste de fase Eclipse E200 (Nikon Inc., Tokio, Japón), se realizó la evaluación individual de 200 espermatozoides (21). La integridad de la membrana plasmática de los espermatozoides se evaluó por la prueba hipoosmótica (HOS), de acuerdo con lo descrito por Neild y colaboradores (22). En un tubo se mezclaron 100 de semen con 500 de solución hipoosmótica de sacarosa 5,4 % (100 mOsmol/L). Dicha mezcla se incubó a 38,5 °C por 30 min, y luego se evaluó la integridad de membrana de 200 espermatozoides, mediante un microscopio de contraste de fase Eclipse E200 (Nikon Inc. Tokio, Japón).
Preparación de muestras
Con la finalidad de retirar la mayor proporción de plasma seminal, como se realiza de forma convencional, una muestra de semen diluido de 30 ml, se centrifugó por 15 min a 1200 x g, y se descartó un 90 % del sobrenadante. La muestra se resuspendió en un diluyente a base de leche semidescremada, caseinatos de sodio y azúcares, suplementado con 4 % de yema de huevo y 5 % de N,N-dimetilformamida (Sigma-Aldrich, St. Louis, USA), en cantidad suficiente para una concentración final de 100 x 106 espermatozoides/ml. Luego se dividió en tres alícuotas, las cuales se asignaron aleatoriamente a los tratamientos: isoespintanol (40 µM), timol (50 µM) o control (sin antioxidante), tomando como referencia un análisis preliminar de inhibición de la producción de ERO en semen equino. Con la finalidad de realizar la medición de la actividad antioxidante, se recuperó la fracción soluble de la muestra, para lo cual cada alícuota se centrifugó a 1200 x g durante 10 min. Se descartó el precipitado (células espermáticas) y se recuperó el sobrenadante (mínimo 5 ml), el cual se mantuvo en refrigeración a 5 °C durante máximo 1 h antes de su evaluación.
Evaluación de la capacidad antioxidante total (TAC)
La TAC se evaluó mediante los ensayos de la capacidad atrapadora de radical oxígeno (ORAC) y de la capacidad reductora férrica (FRAP). El método ORAC estuvo basado en estudios previos de Ou y colaboradores (23). Se utilizaron soluciones de fluoresceína 1 x 10-5 M en PBS (75 mM, pH 7,4) y de AAPH 0,6 M en PBS (75 mM, pH 7,4). Cada tubo de reacción se preparó con 21 de fluoresceína, 2,899 de PBS, 30 de muestra y 50 de AAPH. Se emplearon condiciones controladas de temperatura 37 °C, pH 7,4 y Trolox® (Merck, Darmstadt, Alemania) como antioxidante de referencia. Las lecturas se realizaron por duplicado en un espectrofluorímetro LS 55 (Perkin Elmer, Waltham, USA) a longitudes de excitación/emisión de 493/515 nm. El valor ORAC se calculó usando las diferencias de áreas bajo la curva de decaimiento de la fluoresceína entre un blanco y la muestra, lo cual se comparó contra una curva patrón con Trolox®. Para el método FRAP se adicionaron 50 de muestra a 900 de solución FRAP compuesta por buffer ácido acético-acetato de sodio (pH 3,4), TPTZ y FeCl3, en relación 10:1:1. Luego de 30 min de reacción, se midió por cuadriplicado la absorbancia a una longitud de onda de 593 nm en un espectrofotómetro 6405 UV/Vis (Jenway, Burlington, USA). El valor encontrado se comparó con una curva de referencia construida con ácido ascórbico (24).
Evaluación de la actividad antioxidante enzimática
La actividad de la GPx y la superóxido dismutasa (SOD) provenientes de la fracción conservada de plasma seminal se midieron mediante los kits Ransel® y Ransod® (Randox Laboratories, Crumlin, UK), respectivamente, de acuerdo con los procedimientos descritos por Tavilani y colaboradores (25). Para la GPx se preparó una solución de reacción con glutatión (4 mmol/L), NADPH (0,34 mmol/L) y glutatión reductasa (0,5 U/L). Dicha solución se mezcló con hidroperóxido de cumeno (0,18 mmol/L) y 0,05 mL de muestra. Se midió por cuadriplicado el descenso en la absorbancia por espectrofoto-metría a 340 nm. Para la SOD la muestra se diluyó en proporción 1:31 en buffer fosfato (10 mM, pH 7). Se empleó xantina (0,05 mmol/L) y la enzima xantina oxidasa (80 U/L) para generar radical superóxido, el cual reaccionó con INT (2-(4-yodofenol)-3-(4-nitrofenol)-5-fenil tetrazolium cloruro) (0,025 mmol/L), para generar formazán. Se definió una unidad de SOD como aquella que inhibió el 50 % de la producción de formazán. Las lecturas se realizaron por cuadriplicado mediante espectrofotometría a 505 nm. La actividad catalasa (CAT) se evaluó mediante la medición de la desaparición de peróxido de hidrógeno, de acuerdo con el pro cedimiento descrito por Aebi (26). Se mezclaron 30 µl de muestra con 720 ul de una solución de peróxido compuesta por buffer PBS (10 mM, pH 7,0), Tritón X-100 (0,1 %) y peróxido de hidrógeno (20 mM). Luego se midió por cuadriplicado el descenso de la absorbancia por espectrofotometría a 240 nm, durante 3 min. Una unidad de TAC se definió como 1 µmol de peróxido de hidrógeno consumido por minuto. Las lecturas para las tres enzimas se realizaron mediante un espectrofotómetro 6405 UV/Vis (Jenway, Burlington, Estados Unidos).
Análisis estadístico
Se realizó el ajuste de modelos mixtos completamente aleatorizados. En cada modelo se incluyó el efecto fijo del tratamiento y el efecto aleatorio anidado del eyaculado dentro del equino. Las covariables incluidas en cada modelo se definieron mediante un análisis de correlación de Pearson. Dado el uso de pruebas paramétricas, se evaluó la normalidad de los datos por la prueba de Shapiro-Wilk. La comparación de las medias entre los tratamientos se realizó mediante la prueba de Tukey. El nivel de significancia considerado para todas las evaluaciones fue p < 0,05. Todos los análisis se realizaron mediante el programa SAS 9.2 (SAS Inst. Inc., Cary, USA).
RESULTADOS
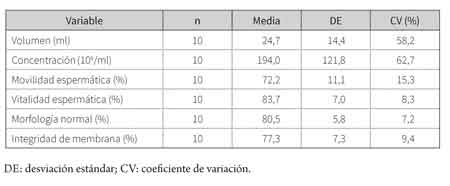
Un total de 10 muestras de semen (eyaculados) se procesaron bajo los diferentes tratamientos. Los resultados para los parámetros de calidad del semen fresco se presentan en la tabla 1.
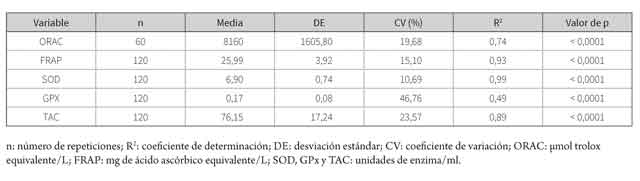
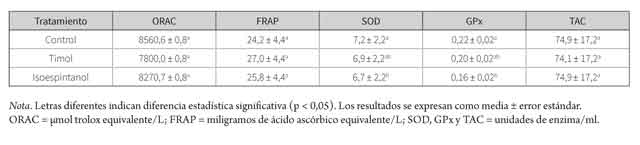
Los resultados de los modelos estadísticos ajustados para la TAC y la actividad de enzimas antioxidantes se presentan en la tabla 2. El efecto aleatorio anidado del eyaculado dentro del equino fue significativo para todas las variables (p < 0,05). Los resultados de la comparación de medias por tratamiento, para la TAC y la actividad de las enzimas antioxidantes se presentan en la tabla 3.
DISCUSIÓN
Los resultados de la evaluación seminal realizada en el presente estudio (tabla 1) permiten considerar las muestras obtenidas como de buena calidad, si se toman como referencia otras investigaciones en las que se ha evaluado el semen de caballos criollos colombianos. Mesa (27) halló resultados de concentración, movilidad total y vitalidad de 209,2 ± 49,1 x 106 espermatozoides/ml, 71,2 ± 11,2 % y 73,3 ± 6,0 %, respectivamente; mientras Ospitia y Gonzales (28) encontraron resultados de volumen, movilidad total y morfología normal de 25,6 ± 9,53 ml, 63 ± 7,8 % y 59,8 ± 7,7 %, respectivamente.
La criopreservación incrementa la producción de ERO y a su vez ocasiona un descenso en la actividad antioxidante del semen (29). Adicionalmente, la remoción del plasma seminal, produce la pérdida de diversos antioxidantes enzimáticos y no enzimáticos, que tendrían como función proteger los espermatozoides de los efectos nocivos de las ERO (8).
En algunas investigaciones se ha evaluado la TAC del plasma seminal equino (11,30); sin embargo, poco se conoce de dicha propiedad, en el semen diluido con fines de criopreservación. La evaluación de la TAC cobra mayor importancia cuando se pretende evaluar el aporte antioxidante de diferentes moléculas suplementadas a los diluyentes para semen. Yildiz y colaboradores (31) hallaron un incremento de la TAC del semen de carneros suplementado con ergotioneína.
De acuerdo con los resultados de esta investigación (tabla 2), FRAP y ORAC forman parte de los mecanismos antioxidantes del semen equino procesado con fines de criopreservación. El método FRAP se basa en la reducción de iones férricos (Fe2+) a iones ferrosos (Fe3+), por efecto del poder reductor de la muestra (32). Se ha observado la presencia de iones ferrosos en el semen, que podrían actuar como catalizadores (metales de transición) (33) y reaccionar con el peróxido de hidrógeno del semen equino (34), para producir el radical hidroxilo (OH•), capaz de desencadenar la peroxidación de los lípidos y otras alteraciones celulares (35,36). Por otro lado, el ensayo ORAC mide de la reacción de oxidación en cadena inducida por los radicales peroxilo (ROO•), los cuales son producidos por la peroxidación de los ácidos grasos poli-insaturados, presentes en la membrana plasmática de los espermatozoides (23,37).
En el plasma seminal equino se han encontrado valores FRAP y ORAC, cercanos o incluso inferiores a los hallados en este trabajo (30), lo cual podría indicar un efecto compensatorio de la capacidad antioxidante del semen, por la adición de los diluyentes de criopreservación (14). Otros estudios han encontrado valores FRAP y ORAC en plasma seminal y plasma sanguíneo humano, respectivamente (38,39).
El ensayo ORAC se basa en la detección de la actividad antioxidante debida a la transferencia de átomo de hidrógeno (HAT), igual mecanismo de acción antioxidante del timol y el isoespintanol (19). Por otro lado, mediante el método FRAP se ha demostrado la capacidad reductora férrica del timol (40). Sin embargo, la suplementación con timol e isoespintanol no generó diferencias estadísticas (p > 0,05) en la TAC del semen equino, evaluada por los métodos FRAP y ORAC (tabla 2). Lo anterior es contrario a lo observado por Rojano y colaboradores (41), quienes comprobaron la capacidad del isoespintanol para reducir el Fe3+ hasta Fe2+ en el ensayo FRAP, siendo considerado mejor reductor que el antioxidante sintético butilhidroxitolueno (BHT). Así mismo, se ha encontrado que la actividad antioxidante del isoespintanol se manifiesta en su capacidad para interactuar con radicales peroxilo y controlar la formación de hidroperóxidos, en modelos ricos en lípidos (42). Es probable que el semen diluido, por tratarse de un medio predominantemente acuoso y con una baja proporción de lípidos, no permita evidenciar dicho efecto.
Dado que no se tienen antecedentes de evaluación de la TAC del semen equino suplementado con timol e isoespintanol, es probable que otros métodos, como el de total de captura de radicales peroxilo (TRAP), el de la capacidad antioxidante reductora del ion cúprico (CUPRAC), el del radical libre DPPH•, o el de la decoloración del radical catiónico ABTS•+, puedan ser más adecuados para la evaluación de su actividad antioxidante en este medio. El método ABTS se ha utilizado para evaluar la TAC del plasma seminal equino (11), mientras que frente al radical DPPH se conoce que el isoespintanol reacciona con una velocidad similar al BHT (42). Por otro lado, el estudio de la propiedad de solubilidad del timol y el isoespintanol podría dirigir de mejor forma el análisis de su aporte a la TAC del semen. Esto mediante el uso de técnicas específicas como ORAC hidrofílico y ORAC lipofílico (43).
La actividad de enzimas antioxidantes como la CAT y la SOD se ha relacionado con la disminución del estrés oxidativo y el mejoramiento de la calidad del semen equino (15,35). Como se realiza convencionalmente, en este estudio se removió la mayor proporción del plasma seminal, antes de la dilución del semen en el medio de congelación. Sin embargo, dado que no se realizó la adición de enzimas antioxidantes en el diluyente utilizado, la actividad enzimática encontrada correspondería a la proporción conservada de plasma seminal. En consecuencia, la concentración encontrada para SOD, GPx y TAC (tabla 1) fue bastante inferior a los registros de enzimas en el plasma seminal completo (5,44).
Se encontraron concentraciones menores de actividad de SOD y GPx en el semen suplementado con isoespintanol (p < 0,05) (tabla 3). Como una hipótesis, este efecto podría ser explicado por la competencia por los sustratos entre el isoespintanol y las enzimas evaluadas. En un estudio se observó que el isoespintanol tiene capacidad de captura del radical superóxido (sustrato para la SOD). No obstante, lo hace en una baja proporción (19). Otra posible explicación estaría en la inhibición no competitiva de la SOD o la GPx por parte del isoespintanol, o en una interferencia de este en las reacciones de detección de dichas enzimas. Sin embargo, no se tienen antecedentes al respecto, por lo cual serían necesarios estudios más detallados. Por otro lado, no se observó efecto del timol sobre ninguna de las enzimas evaluadas (p > 0,05) (tabla 3), lo cual coincide con Al-Malki (18), quien no encontró efecto del timol sobre la actividad de SOD y GPx en tejido hepático normal de ratones. Sin embargo, en ratones intoxicados con cloruro de carbono (CCl4) y previamente tratados con timol, mejoró la actividad de ambas enzimas antioxidantes, en comparación con los ratones no tratados, lo cual fue atribuido a la capacidad del timol para reducir la formación de radicales libres, y por ende la iniciación de la peroxidación lipídica. Es probable que bajo condiciones de mayor estrés oxidativo pueda observarse el efecto del timol sobre la actividad de SOD y GPx del semen equino.