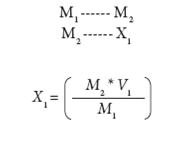INTRODUCCIÓN
La inocuidad alimentaria es una de las principales preocupaciones de los consumidores. Es por ello por lo que se requieren sistemas adecuados de conservación que permitan generar productos seguros y de calidad, además de incrementar la vida útil de los alimentos (1). Sin embargo, la implementación de prácticas de conservación ocasiona incrementos en los costos de producción, y no siempre son seguros, tanto en su efecto como en la salud pública, por lo cual es necesaria la búsqueda de nuevas alternativas de bioconservación (2). Entre los productos que necesitan mayor vigilancia en este aspecto, se encuentra la carne, considerada un alimento de alto valor nutricional en la dieta de los seres humanos (3).
Durante varios años, la tendencia hacia el consumo de alimentos saludables ha incrementado la investigación sobre nuevas técnicas de bioconservación. Esto ha constituido una alternativa a los preservantes en la industria alimentaria, ya que estos pueden constituir un riesgo para la salud pública (4). Los bioconservantes se caracterizan por la utilización de microorganismos vivos o sustancias producidas por estos (bacteriocinas, ácidos orgánicos, etc.) en la preservación de los alimentos. Los géneros más utilizados son las bacterias ácido-lácticas (BAL), calificadas como seguras en el consumo humano (GRAS). Dentro de este grupo se destacan las cepas de L. plantarum y L. lactis, que se han probado en diferentes procesos biotecnológicos, tanto en animales como en alimentos, bien sea como preservantes naturales, aceleradores en procesos fermentativos o como probióticos. Estas contribuyen al buen mantenimiento y mejora de la salud de los consumidores. La utilización de procesos biotecnológicos es una herramienta que busca evaluar su efectividad en los métodos de bioconservación, para elegir el mejor método de aplicación en carnes y productos cárnicos (5).
La carne de cerdo es una de las más apetecidas por los consumidores. En Colombia, se tiene un consumo per cápita de 6,75 kg/año, lo cual la convierte en la segunda carne más consumida del país, superada únicamente por la de pollo (6). Como todas las carnes, la vida en anaquel se encuentra restringida por los procesos microbianos, lo que disminuye de forma considerable el tiempo de conservación y afecta en forma decisiva las características físico-químicas de esta y, por lo tanto, su calidad. Todos estos factores han incrementado la investigación de métodos que mejoren su preservación, y se ha encontrado que algunos microorganismos como las BAL pueden ejercer esta función, sin alterar las propiedades de calidad del producto (7).
Por lo tanto, el objetivo de esta investigación fue determinar el efecto del sobrenadante de Lactobacillus plantarum y Lactobacillus lactis como método de bioconservación de lomo de cerdo (Longisimus dorsi).
METODOLOGÍA
El estudio se llevó a cabo en las instalaciones del Laboratorio de Investigación Fise-Probiotec, planta piloto de la Facultad de Ingeniería Agroindustrial, y en la sección de Laboratorios Especializados de la Universidad de Nariño, ubicados en la ciudad de San Juan de Pasto, departamento de Nariño (Colombia).
Para esta investigación se utilizaron dos cepas lácticas: Lactobacillus lactis (ATCC* 11454) y Lactobacillus plantarum (ATCC* 8014). La reconstitución se realizó de acuerdo con las instrucciones del fabricante, y se conservó mediante repique en medio sólido cada 5 días (agar MRS), y en medio líquido cada 8 días (caldo MRS). Las condiciones de incubación fueron de 24 h a 37 °C. Luego las cepas fueron refrigeradas (4 °C) hasta su utilización.
El inóculo de L. lactis y L. plantarum se obtuvo de la siguiente manera: para cada cepa se tomó un Erlenmeyer, y en cada uno se depositaron 40 ml de caldo MRS, y una alícuota de la cepa láctica. Finalmente, los Erlenmeyer fueron incubados a 35 °C durante 24 h. Al finalizar el periodo de incubación, se tomaron de cada Erlenmeyer 4 ml y se trasladaron a otro Erlenmeyer con 40 ml de medio MRS, y se incubaron en las condiciones mencionadas.
Para realizar el ajuste del inóculo, se tuvo en cuenta la metodología propuesta por Crueger y Crueger (8): se tomaron 90 ml de caldo MRS estéril, se adicionaron 10 ml de la bacteria láctica, de acuerdo con la regla. Al finalizar el periodo de incubación se tomó 1 ml de la muestra, y se hizo lectura directa mediante espectrofotómetro a 625 nm. En los casos en que hubo población superior a la establecida, se adicionó caldo estéril con base en lo formulado por Guerrero y ajustado por Jurado-Gámez y colaboradores (9):
M1 = población o densidad celular que se debe ajustar.
M2 = 0,125 densidad óptica equivalente a 1,50 x 108 bac/ ml. Densidad utilizada primera fermentación.
V1 = 1 ml volumen proveniente del inóculo total (10/90).
X1 = cantidad que contiene M2.
V2 = lo que se agrega a 1 ml para ajustar a 1,50 x 108 bac/ mL.
V3 = 100 ml cantidad total del inóculo.
X2 = cantidad de caldo MRS comercial estéril que se agrega a V3 para ajustar la población al valor de M2.
Se encuentra entonces X1:
Para determinar la cinética de crecimiento de las bacterias lácticas, se tomaron 2 Erlenmeyer, cada uno con 540 ml de medio MRS, y a cada uno se le adicionaron 60 ml de inóculo, según lo determinado por de la metodología de Guerrero y ajustada por Jurado-Gámez y colaboradores (9). Según lo anterior, los Erlenmeyer contenían: el primero, L. lactis, y el segundo, L. plantarum, y fueron incubados (incubadora Shaker®) con agitación constante a 32 °C y 100 r. p. m. No se controló el pH debido a la resistencia de las cepas a pH bajo. Las cepas fueron evaluadas durante 24 h, para lo cual se realizaron mediciones cada 2 h y 24 min. En cada medición se determinó el conteo de microorganismos viables en placa (UFC/ml), pH, porcentaje de acidez (10), consumo de azúcar (11) y consumo de proteína (12).
Para la determinación de microorganismos viables en placa (UFC/ml) se mezcló 1 ml de muestra en 9 ml de agua peptonada al 0,1 %. De esta preparación se realizaron diluciones decimales que fueron transferidas a cajas de Petri (100 µl), que contenían medio MRS con azul de anilina para siembra en superficie. Las cajas fueron incubadas a 32 °C y se observaron entre 24 y 48 h. Se tuvieron en cuenta únicamente las cajas de Petri con conteos entre 30 y 300 UFC/ml. El número de colonias fue multiplicado por el inverso de la dilución y por 10 para obtener UFC/ml (13).
Con el fin de evaluar el efecto bioconservante de las cepas lácticas sobre el lomo de cerdo (Longisimus dorsi), se obtuvo el sobrenadante de las BAL (L. plantarum y L. lactis), de acuerdo con la fase logarítmica de crecimiento encontrada durante la cinética de fermentación. El inóculo de las BAL se centrifugó a 12000 r. p. m., con una temperatura de 4 °C y un tiempo de 15 min. Posteriormente, se filtró por membrana 0,25 µ. Luego se llevó a un pH cercano a 6 mediante la neutralización con NaOH (0,1 N), y finalmente se calentó a una temperatura de 80 °C para mejorar la efectividad del sobrenadante (figura 1).
El sobrenadante se inyectó y asperjó a razón de 500 ul sobre cada pieza de lomo. Se utilizaron 50 g de lomo de cerdo para cada réplica, y se aplicó un tiempo de exposición de 24 h empacado al vacío. Luego los lomos fueron distribuidos a dos temperaturas: ambiente (20 °C) y refrigeración (4 °C), y se mantuvieron por un periodo de 15 días (14). Como tratamientos testigos, se utilizaron ácido láctico comercial al 2 % y suero fisiológico (sin aditivo). De esta manera, se evaluaron cuatro niveles de conservación: sin aditivo, con ácido láctico, con sobrenadante de L. lactis y L. plantarum.
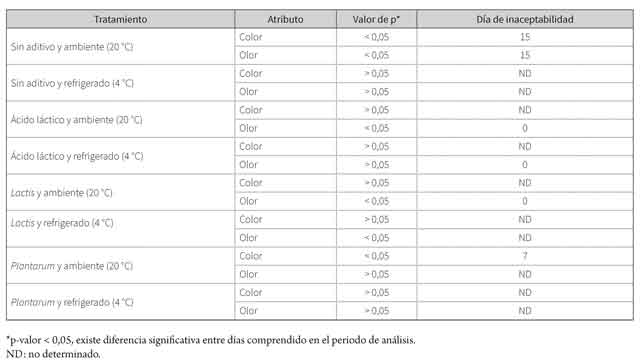
A los 0, 7 y 15 días se realizaron evaluaciones microbiológicas, físico-químicas y sensoriales sobre las porciones de lomo. Las microbiológicas fueron coliformes totales, coliformes fecales, Clostridium sulfito reductor, Listeria sp., mohos y levaduras. Estos análisis se realizaron según los protocolos del Laboratorio de Microbiología de la sección de Laboratorios Especializados de la Universidad de Nariño. Las físico-químicas fueron pH, acidez, CRA y antibióticos. Además, se evaluaron las características sensoriales color y olor.
El pH fue determinado con pH-metro (JENCO® VisionPlus). La acidez se determinó mediante la metodo logía propuesta por Zumbado (15); para ello se tomaron 10 g de muestra molida y se depositaron en un beaker previamente tarado (error máximo de 0,1 g). Se añadió 100 ml de agua destilada y se dejó en reposo durante 1 h. El contenido del beaker se transfirió a un Erlenmeyer y se adicionó agua hasta completar el volumen deseado (250 ml); luego se agitó y finalmente se filtró. De este filtrado, se tomaron 10 ml y se transfirieron a un Erlenmeyer; enseguida se adicionaron 3 gotas de solución indicadora de fenolftaleína. Por último, se añadió solución de NaOH (0,1 N), hasta adquirir una coloración rosada. Los resultados se expresaron en porcentaje de acidez en función del ácido láctico, y se calcularon empleando la siguiente fórmula:
Acidez (%) = a x N + meq + 100 / b
Donde
a = volumen en mililitros consumido de solución de NaOH 0,1 N
N = normalidad de la solución de NaOH
meq = masa molar expresada en g/mol. Para el ácido láctico, meq = 0,090 g/mol
b = masa en gramos de la muestra en la dosis valorada
Y b es igual a:
b = m + V / 100
Donde:
m = masa inicial de la muestra (g)
V = volumen de la dosis tomada (ml)
Para la CRA se tuvo en cuenta el procedimiento descrito por Zumbado (15). Para ello se picaron finamente 10 g de lomo, y se colocaron 5 g en un tubo de centrifuga (por duplicado). A cada tubo se le añadieron 8 ml de solución de NaCl (0,6 M) y se agitó. Los tubos se colocaron en baño de hielo durante 30 min con agitación constante. Luego se centrifugaron durante 30 min a 2500 r. p. m. Se decantó el sobrenadante en una probeta de 10 ml, se medió el volumen no retenido de los 8 ml de solución de NaCl, y se calculó la cantidad de solución retenida por 100 g de muestra.
CRA = (Va - Vs / peso muestra) x 100
Donde:
Va = volumen de solución salina añadida al tubo de centrífuga
Vs = volumen del sobrenadante
La presencia de antibióticos se determinó mediante KIS TEST (Charm Science Ind.) y se utilizó de acuerdo con las instrucciones de la casa del fabricante (16) y la determinación de Listeria sp. (kit Rapid Chek. Pathogen Screening Test Kit). Para el análisis sensorial, se utilizó un panel de 10 personas semientrenadas, las cuales realizaron la valoración de las muestras en cuanto a color y olor (17). Para ello utilizaron una escala hedónica de 9 puntos con un valor mínimo de aceptabilidad de 6,0 puntos. Las pruebas se realizaron a los días 0, 7 y 15 (18).
Análisis estadístico
Para analizar las variables coliformes totales, coliformes fecales, pH, acidez y CRA, se utilizó un diseño de bloques al azar con arreglo factorial 4 x 2 con cuatro repeticiones por tratamiento. Se utilizó como bloque los días de medición (0, 7 y 15), y como factores, aditivo y temperatura. El factor aditivo estuvo compuesto por cuatro niveles (sin aditivo, ácido láctico, L. lactis y L. plantarum), y el factor temperatura, por dos (ambiente 20 °C y refrigeración 4 °C). Para observar las diferencias entre los tratamientos se aplicaron comparaciones múltiples de medias con la prueba de Tukey (19).
La evaluación sensorial se realizó con un análisis de varianza con prueba de Fisher LSD (20) y la variable hogos y levaduras mediante una x2; esta última debido a la violación del supuesto de normalidad. Se usó análisis de regresión para determinar la influencia del crecimiento (LN UFC/mL) sobre los parámetros cinéticos azúcar, proteína, pH y acidez. Todos los análisis estadísticos se realizaron en el paquete S.A.S versión 9.1, con un nivel de confianza del 95 % (21).
RESULTADOS
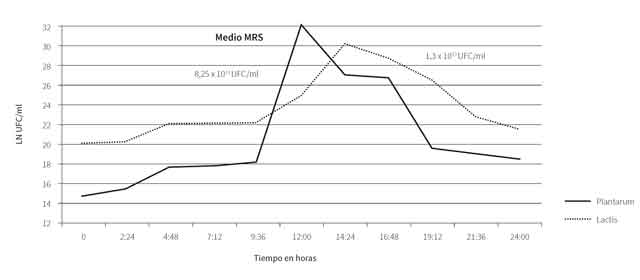
En la figura 1 se observa la cinética de fermentación de las BAL (L. plantarum y L. lactis). Se encontró la fase exponencial a las 12 h para L. plantarum y 14 h y 24 min para L. lactis. En este tiempo, se obtuvo un crecimiento de 8,25 x 1013 y 1,3 x 1013 UFC/ml, consumo de azúcar de 2,18 y 10,64 mg/l, consumo de proteína de 1,20 y 1,45 mg/l, pH de 4,28 y 6,96, y acidez del 0,79 y 0,63 %, para L. lactis y L. plantarum, respectivamente. El análisis de regresión registró pendientes de -0,3834 para azúcar (R2 = 0,530; p-value = 0,03849); -0,0050 para proteína (R2: 0,023; p-value: 0,741); -0,1936 para pH (R2 = 0,735; p-value = 0,0084), y 0,0339 para acidez (R2 = 0,794; p-value = 0,00437) con la cepa de L. lactis. De igual manera, para L. plantarum se obtuvieron valores de -0,4230 para azúcar (R2 = 0,452; p-value = 0,046); -0,029 para proteína (R2 = 0,382; p-value = 0,0481); -0,1845 para pH (R2 = 0,547; p-value = 0,0345), y 0,0221 para acidez (R2 = 0,7832; p-value = 0,0123). De esta manera, se observa que L. plantarum tiene un mayor consumo de azúcar y proteína durante la cinética de fermentación en comparación con L. lactis, pero una menor disminución de pH y menor aumento de acidez.
Los resultados de la prueba de listeria fueron negativos (figura 2, tabla 1).
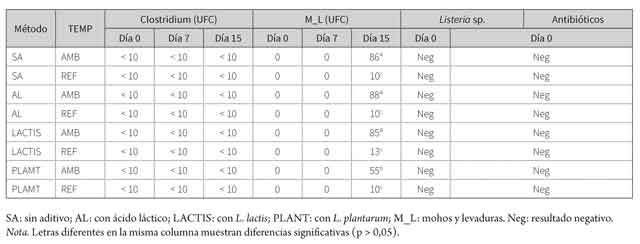
Tabla 1 Valores encontrados para la prueba de Clostridium sulfito reductor, mohos y levaduras, Listeria sp. y antibióticos
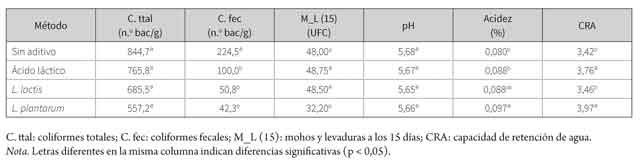
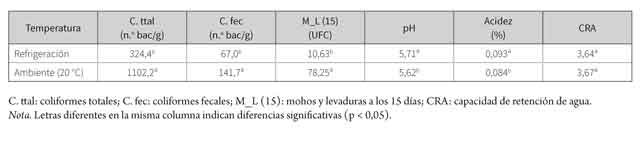
En las tablas 2 y 3 se observan los resultados obtenidos para las variables coliformes totales, coliformes fecales, Listeria sp., mohos y levaduras (15 días), pH, acidez y CRA. Se debe aclarar que no existió interacción entre los factores para ninguna de las variables (p > 0,05). De esta manera, únicamente se evaluaron los efectos principales: aditivo y temperatura. En la tabla 1 se observan los valores obtenidos para Clostridium sulfito reductor y hogos y levaduras.
Los resultados para coliformes totales en el factor aditivo (sin aditivo, ácido láctico, L. lactis y L. plantarum) no mostraron diferencias estadísticas significativas (p > 0,05; tabla 3), pero se observaron diferencias en el factor temperatura (ambiente 20 °C y refrigeración 4°C), con un mayor crecimiento en la porción de lomos sin refrigerar (p < 0,05; tabla 3). En el caso de coliformes fecales, hubo diferencias en ambos factores (aditivo y temperatura) (p < 0,05; tablas 2 y 3). Para la comparación del factor aditivo, el estadístico reveló un mayor crecimiento de coliformes fecales en los lomos sin aditivo, en comparación con los otros tres métodos (ácido láctico, lactis y plantarum); mientras que para la comparación de temperatura, se encontró mayor crecimiento en los lomos sin refrigerar.
Para el caso de Clostridium sulfito reductor, todos los resultados de la prueba mostraron un valor < 10 UFC, y se observó crecimiento de mohos y levaduras únicamente en el día 15 con un rango de 10 a 88 UFC (tabla 1). En este día se encontró un menor crecimiento con el sobrenadante de L.plantarum (500 µl) (p < 0,05; tabla 1); de igual manera, la temperatura disminuyó el crecimiento, debido a que se encontraron valores inferiores en los lomos refrigerados (p > 0,05).
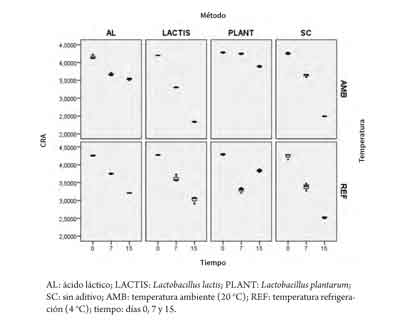
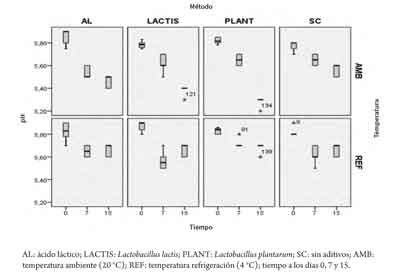
El pH no mostró diferencias significativas en el factor aditivo (p > 0,05). Sin embargo, la temperatura mostró diferencias estadísticas con mayores valores de pH para los lomos refrigerados (p < 0,05; tablas 2 y 3). Por otra parte, la acidez indicó diferencias en el factor aditivo (p < 0,05), con valores de acidez más altos para L. plantarum (0,097 %) en comparación con el ácido láctico (0,088 %) y el testigo (0,088 %). En cuanto a la temperatura de conservación, se encontraron menores valores en las muestras de lomo sin refrigerar (p < 0,05; 0,084 %, tabla 3). Los valores de CRA indicaron que L. plantarum (3,97) y ácido láctico (3,76) tuvieron mayor CRA que L. lactis (3,42) y el testigo (3,46) (p < 0,05). Sin embargo, la temperatura no tuvo un efecto significativo sobre la variable (p > 0,05).
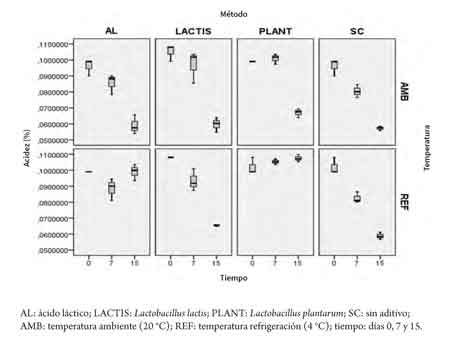
En las figuras 3, 4 y 5 se observa el comportamiento de las variables acidez, CRA y pH en los días 0, 7 y 15, teniendo en cuenta los factores aditivo y temperatura.
Se determinó una disminución de la acidez en el tiempo para los niveles L. lactis y sin aditivo del factor aditivo, con una disminución de 0,045 y 0,040 puntos porcentuales para L. lactis y sin aditivo, respectivamente. Sin embargo, para el caso de L.plantarum bajo refrigeración se observa un leve incremento de 0,005 puntos porcentuales entre los días 0 y 15, mientras que a temperatura ambiente se encontró un incremento hasta el día 7, seguido por un descenso de la acidez al día 15 (figura 4). La CRA mostró reducción en el tiempo para todas las muestras (figura 5).
Por otra parte, el pH disminuyó con el tiempo, con una mayor caída del pH en el tratamiento con L. plantarum sin refrigeración (figura 6).
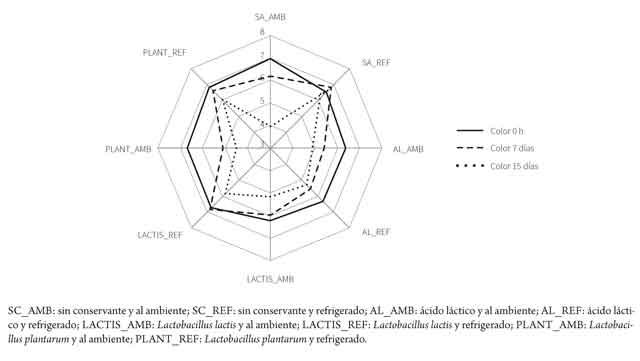
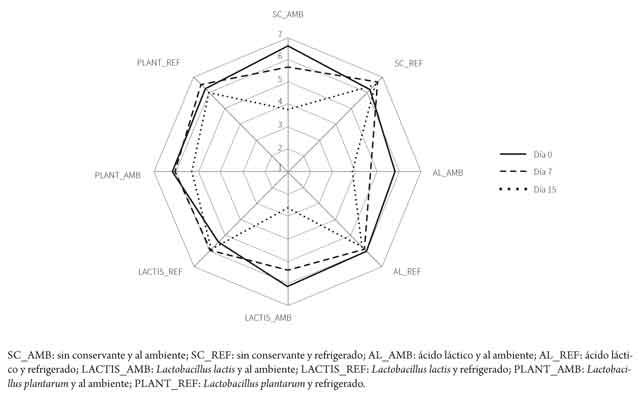
En cuanto al análisis sensorial, los resultados pueden observarse en la tabla 4 y en las figuras 6 y 7.
Los tratamientos tuvieron una mayor influencia sobre el olor que sobre el color. Se observó que la adición de ácido láctico afecta estadísticamente el olor desde el primer día (día 0). Igual resultado se observó con L. lactis sin refrigeración (tabla 4). Por otra parte, para la variable color, los lomos sin aditivo fueron inaceptables al día 15 y los lomos con L. plantarum, al día 7 (p < 0,05), ambos expuestos a temperatura ambiente.
En la figura 7 se observa que la aceptabilidad del parámetro organoléptico disminuye con el tiempo, siendo el tratamiento sin aditivo y sin refrigeración el que mayor efecto presentó. Por otra parte, el tratamiento con L. plantarum y con refrigeración mostró un menor efecto del tiempo sobre el color.
Sin embargo, el efecto de los tratamientos en la variable olor no mostró una tendencia. Se observa que el trata miento con la menor puntuación al día 15 fue la cepa de Lactobacillus lactis sin refrigeración, seguida por el tratamiento sin aditivo y sin refrigerar. También se observa en la figura 7 una tendencia particular para el tratamiento con Lacto bacillus lactis y refrigeración, ya que el grado de aceptabilidad del olor aumentó con los días de evaluación. Sin embargo, el efecto observado es pequeño y puede ser el resultado de factores aleatorios.
DISCUSIÓN
El conteo de coliformes totales permite evaluar la calidad higiénica de la carne (14). Los resultados mostraron que el factor aditivo está dentro de los parámetros de calidad sanitaria reglamentada por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos para carnes crudas (120-110 UFC/g) (22). A pesar de no contrarse diferencias significativas, se observa que las cepas lácticas disminuyen el número de bacterias por mililitro. Al respecto, Ghanbari y colaboradores (23) mencionan que las BAL reducen el crecimiento de coliformes y su acción se debe a la producción de varios compuestos antimicrobianos, entre los que se encuentran las bacteriocinas, los ácidos orgánicos y el peróxido de hidrógeno. Este tipo de compuestos afectan diferentes zonas de la bacteria como la pared celular (algunas bacteriocinas), y alteran sus procesos fisiológicos (ácidos orgánicos).
Las sustancias agregadas (ácido láctico, sobrenadantes) mostraron efectividad en la reducción del crecimiento de coliformes fecales. Sin embargo, los sobrenadantes tuvieron un efecto mayor, con valores de crecimiento 50 % menores a los observados con el ácido láctico. Las coliformes fecales son un buen indicador del manejo de los cárnicos, ya que se encuentran muy relacionadas con la calidad sanitaria del producto y un adecuado manejo de la carne (24). Reducir su crecimiento es importante debido a los problemas de toxiinfecciones que generan en animales y humanos.
En investigaciones realizadas por Jurado-Gámez y colaboradores (25,26) se encontró que las cepas lácticas poseen un efecto de inhibición sobre E. coli en condiciones in vitro. Se sabe que esta cepa patógena es una de las principales representantes de las coliformes fecales, ya que es un huésped natural del tracto gastrointestinal, y que su diseminación se observa como resultado de un inadecuado manejo de la carne. Los efectos del ácido láctico son buenos, pero los sobrenadantes de las bacterias lácticas ofrecen otro tipo de beneficio para el producto, como mejorar su terneza y olor, valores agregados que ponen a las BAL como alternativas importantes en la conservación de productos cárnicos.
Los valores para esporas de Clostridium sulfito reductor fueron < 10 UFC. Esto demuestra que no existió contaminación por este agente patógeno en la carne, y se evitó su proliferación. La importancia de este microorganismo radica en los problemas de intoxicación oral por la toxina botulínica, la cual afecta el sistema nervioso, y produce náuseas, vómito y, en los casos más severos, parálisis muscular. Los estudios demuestran que bacteriocinas como la nisina tienen efecto antagónico sobre el microorganismo (27). Al respecto, Jurado-Gámez y colaboradores (28) encontraron inhibición de L. plantarum sobre Clostrium perfringen, lo cual muestra efectividad de la cepa contra el microorganismo patógeno.
Los tipos de aditivo no alteraron el pH. Al parecer, el contenido de acidez del sobrenadante de las bacterias lácticas y el ácido láctico comercial no tuvieron un efecto significativo sobre la variable. El pH es importante en el crecimiento de bacterias patógenas como Escherichia coli, Clostridium ssp. y Listeria sp. Estos patógenos crecen adecuadamente a pH cercanos a la neutralidad (7,0-7,2). Sin embargo, especies como E. coli pueden crecer en pH cercanos a 4 (29). Los valores obtenidos están por debajo del pH adecuado para las bacterias, por lo cual se disminuye la probabilidad de contaminación de los productos cárnicos. Sin embargo, la refrigeración tuvo un efecto significativo sobre la variable pH.
En cuanto a la acidez, se encontró que L. plantarum incrementa las concentraciones de acidez presentes en la carne, y a su vez permite una disminución del pH. Este comportamiento se debe a la producción de ácido láctico por parte de la BAL, como consecuencia del metabolismo de los carbohidratos presentes en el medio. Ello es importante porque, como se mencionó, estas condiciones afectan el crecimiento de microorganismos perjudiciales para la salud del consumidor.
La CRA fue más baja en los lomos sin conservante y los lomos con adición de L. lactis. Sin embargo, la mayor CRA se encontró en L. plantarum. Esta característica es altamente deseable en los productos cárnicos como el lomo de cerdo, por cuanto permite una mayor palatabilidad y terneza, que aumentan las características organolépticas del producto, además de mejorar el rendimiento comercial de la carne.
Como era de esperarse, la prueba sensorial mostró que la carne sin conservación y al ambiente altera el color y olor de la carne. De igual manera, el ácido láctico afectó el olor del producto, aunque mantuvo su color. En cuanto a las BAL, demostraron conservar las características de color, pero L. lactis afectó el olor cuando no fue refrigerada. Lo anterior demuestra que los métodos convencionales de conservación de la carne afectan las condiciones sensoriales de los productos cárnicos. Sparo y colaboradores (30) indican que el uso de BAL como biopreservante de productos cárnicos permite una mayor conservación, además de mejorar la calidad organoléptica del producto. Esto concuerda con los resultados obtenidos en la presente investigación, ya que para el consumidor la parte sensorial del producto es importante; mejorar este aspecto permite una mejor aceptabilidad del producto por parte de comprador.
Se concluye que el sobrenadante de L. plantarum es una opción viable en la conservación del lomo de cerdo, guardando sus características organolépticas y evitando la proliferación de microorganismos patógenos. Para el caso se L. lactis, se observan resultados similares al ácido láctico, por lo cual también puede ser considerado con bioconservante en la carne de cerdo, aunque los valores de esta cepa fueron inferiores a los encontrados en L. plantarum. Finalmente se demuestra que la refrigeración es un método adecuado de conservación de la carne.