INTRODUCCIÓN
En 2016, la producción acuícola global llegó a 80 millones de toneladas de peces comestibles, lo que muestra un aumento en la producción de 24,3 millones de toneladas en los últimos años, mientras que la pesca extractiva se mantuvo estable con tendencia a disminuir (1). Este notorio crecimiento ha llevado a la implementación de sistemas de producción cada vez más intensivos, en los que son frecuentes los problemas de estrés ocasionados por las prácticas rutinarias de manejo como la captura, el empaque y el transporte, entre otras, en las cuales los peces se someten a exposición aérea, hecho que provoca alteraciones hormonales, metabólicas y electrolíticas en ellos (2).
Estas prácticas de manejo, frecuentes dentro del sistema productivo, aumentan la incidencia de enfermedades y, en casos más críticos, la mortalidad de individuos, con el consiguiente perjuicio económico para el productor. Por tal razón, es necesario crear alternativas que garanticen el bienestar y la productividad de los animales de cultivo, disminuyendo el impacto de los agentes estresantes.
Estudios realizados en diferentes especies de peces han demostrado los efectos benéficos de la inclusión de ácido ascórbico (AA) sobre las respuestas al estrés, lo que ha contribuido a mejorar la resistencia a enfermedades en Micropterus salmoides (3), Paralichthys olivaceus (4), Oreochromis niloticus (5), Arapaima gigas (6), Salmo trutta caspius (7), Oncorhynchus mykiss (8). Así mismo, varios autores afirman que el AA (vitamina C) es un componente esencial para el funcionamiento normal de los animales, incluyendo los peces (9,10,11,12).
Por otro lado, la cachama blanca (Piaractus brachypomus) es un carácido originario de las cuencas de los ríos Orinoco y Amazonas (13). Es una especie nativa ampliamente conocida en los países afluentes de la cuenca amazónica, como Colombia, Brasil, Venezuela y Perú. Se considera de gran importancia por la calidad de su carne. Además, presenta un alto potencial para la piscicultura suramericana por la adaptación a las condiciones de cultivo, por tener hábitos alimenticios omnívoros y por su crecimiento rápido, lo que la hace una especie muy eficiente dentro de un sistema productivo. En el caso específico de Colombia, la producción de la acuicultura nacional para 2011 fue de 82.733 t, de las cuales la especie nativa con mayor participación es la cachama, con una producción de 15.926,10 t. En este contexto, el departamento del Meta es el principal productor y distribuidor de alevinos para crecimiento y reproducción en estanques en diferentes regiones del país (14).
Con base en lo anterior, el propósito de este trabajo fue evaluar el efecto del ácido ascórbico (AA) sobre las respuestas fisiológicas de juveniles de cachama blanca sometidos a estrés agudo por hipoxia.
MATERIALES Y MÉTODOS
LOCALIZACIÓN DEL EXPERIMENTO
El experimento fue desarrollado en el Laboratorio de Ictiología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá.
ANIMALES EXPERIMENTALES
Se utilizaron 72 juveniles de cachama blanca Piaractus brachypomus, con peso promedio de 30 ± 4,76 g, los cuales se mantuvieron en 24 acuarios de 80 L a una densidad de 1,20 g/L (3 ejemplares por acuario y 4 acuarios por tratamiento). Se alimentaron ad libitum (consumo aproximado: 3,86 % de la biomasa/d) durante 30 d, con una dieta de 32 % de proteína y conformada por las siguientes seis cantidades diferentes de AA, mediante la forma de L-ascorbil-2-monofosfato (Rovimix Stay-C35®): T1 = 0 mg/kg; T2 = 100 mg/kg; T3 = 200 mg/kg; T4 = 400 mg/kg; T5 = 800 mg/kg; T6 = 1600 mg/kg.
DIETA EXPERIMENTAL
La dieta con 32 % de proteína fue formulada a través del software UFFDA®, sin adición de AA. Las materias primas seleccionadas y las dietas formuladas se sometieron a análisis proximal en el Laboratorio de Nutrición de la Facultad de Medicina Veterinaria y de Zootecnia, de acuerdo con los métodos oficiales de análisis de la Asociación de Química Analítica (AOAC) (15). La composición proximal de la dieta experimental se muestra en la tabla 1.
Tabla 1 Composición proximal de la dieta experimental
| MS* (%) | Proteína (%) | E. E.** (%) | Fibra (%) | Cenizas (%) | ENN*** (%) |
|---|---|---|---|---|---|
| 91,55 ± 0,03 | 32,28 ± 0,49 | 1,97 ± 0,37 | 2,27 ± 0,18 | 2,87 ± 0,01 | 55,29 ± 0,04 |
Nota: * = Materia seca; ** = Extracto etéreo; *** = Extracto no nitrogenado.
Fuente: elaboración propia
La mezcla formulada se dividió en seis porciones, a cada una de las cuales se le adicionó una de las seis cantidades diferentes de Rovimix Stay-C35®.
MUESTREOS
Finalizada la fase de alimentación, los peces fueron sometidos a hipoxia aguda, consistente en una exposición aérea durante 60 s y de inmediato se devolvieron al agua. Previa anestesia con metasulfonato de tricaína (75 ppm), se colectó sangre mediante punción en la vena caudal de tres individuos por tratamiento a los 5; 30; 60 y 360 min después de haber sido devueltos al agua. La sangre fue almacenada en viales con y sin EDTA (anticoagulante), según las recomendaciones para cada prueba que se iba a realizar. Las muestras de sangre extraídas se sometieron a centrífuga refrigerada (4 °C) a 3000 r. p. m. para obtener el plasma o suero. Todos los procedimientos mencionados fueron avalados por el Comité de Bioética de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia.
ANÁLISIS BIOQUÍMICOS
En el plasma obtenido se determinó la concentración de cortisol mediante prueba de Enzyme-Linked Immunosorbent Assay (ELISA), utilizando el kit comercial (Accu Bind Elisa Microwells Cortisol 3625-300 Monobind Inc®). La lectura se realizó usando los equipos Stat Fax® 303 y Microstrip Reader Awareness Technology Inc®. También se midió por colorimetría, utilizando el espectrofotómetro Stat Fax 3300®; para las concentraciones de glucosa se usó el kit comercial Trinder (GOD-POD Spinreact®); para el lactato, se empleó el kit comercial enzimático (LO-POD Spinreact®), y la proteína total se midió con el kit comercial colorimétrico (Biuret Spinreact®). En suero se midieron los iones Cl- y Na+, mediante espectrofotometría de luz ultravioleta.
ANÁLISIS ESTADÍSTICO
El experimento tuvo un diseño completamente al azar con arreglo de parcelas divididas en el tiempo. Para verificar la existencia de diferencias significativas entre los tratamientos se realizó un análisis de varianza (ANAVA), y en los casos que se encontraron diferencias significativas, las medias se compararon con la prueba de Tukey (5 %). Los análisis se realizaron con el software SAS System V9.0®.
RESULTADOS
CORTISOL
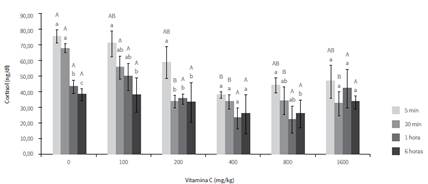
Los resultados obtenidos para esta variable se muestran en la figura 1. A los 30 min poshipoxia, los peces suplementados con concentraciones superiores a 200 mg/kg de vitamina C tuvieron menores cantidades de cortisol que los no suplementados y los suplementados con 100 mg/kg. Esto permite comprobar que la suplementación con AA podría mejorar la respuesta primaria de Piaractus brachypomus en condiciones de estrés agudo. Además de esto, se pudo observar que las cantidades de suplementación de 400 mg/kg son las más recomendables para mejorar dicho parámetro en la especie, pues los ejemplares suplementados con esta cantidad presentaron un grado significativamente menor tanto a los 5 como a los 30 min después de haber sido expuestos a hipoxia. Así mismo, fue evidente que los peces alimentados con la dieta sin AA presentaron el pico más alto de producción de la hormona.
GLUCOSA
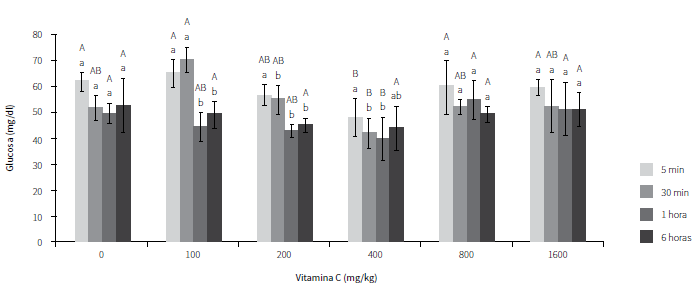
En la figura 2 se observan diferencias significativas a los 5, 30 y 60 min después de la exposición aérea. La mejor respuesta fue la de los peces suplementados con vitamina C, en especial con 400 mg/kg. Para el último tiempo de muestreo (360 min posestrés) no se observaron diferencias entre tratamientos. Fue posible observar que los animales suplementados con cantidades de 100, 200 y 400 mg/kg mostraron un proceso de recuperación (disminución) de las concentraciones de glucosa a través del tiempo (letras minúsculas).
LACTATO
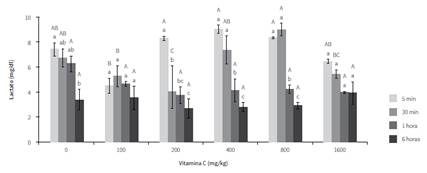
Se encontraron diferencias significativas para lactato entre los diferentes tratamientos (figura 3). En el minuto 30 posestrés los ejemplares suplementados con 200 mg/kg tuvieron menores concentraciones que los peces de los tratamientos con 0, 100, 400 y 800 mg/kg. También se observó que en este mismo tiempo de muestreo las concentraciones fueron menores en los suplementados con 100 mg/kg que en los no suplementados. Además, se observó que en los ejemplares de los tratamientos con 0, 100, 400 y 800 mg/kg las concentraciones de lactato disminuyeron a través del tiempo, lo que indica una recuperación del equilibrio osmótico.
PROTEÍNA TOTAL
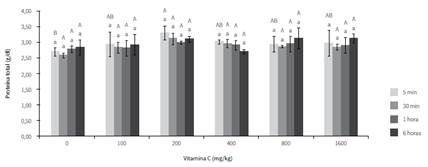
Los resultados para esta variable se muestran en la figura 4. Se puede observar que los ejemplares suplementados presentaron valores significativamente mayores en el primer tiempo de muestreo con respecto al grupo no suplementado, siendo mayores las concentraciones de proteínas circulantes en los peces suplementados con 200 mg/kg.
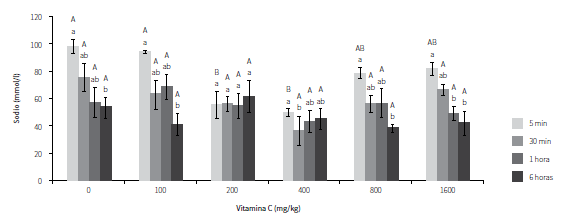
SODIO
Como se puede apreciar en la figura 5, se observaron fluctuaciones en las concentraciones de sodio de los peces después de ser estresados. Los ejemplares suplementados con 200 mg/kg presentaron concentraciones más estables de este ion a través del tiempo. También se observó que los peces suplementados con 200 y 400 mg/kg presentaron valores significativamente más bajos comparados con los obtenidos en los ejemplares no suplementados y los suplementados con 100 mg/kg en el primer tiempo de muestreo. Sin embargo, en los demás tiempos no se observaron diferencias significativas entre ninguno de los tratamientos.
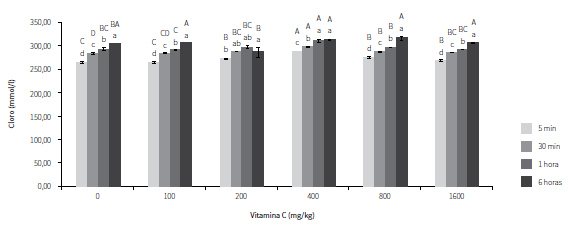
CLORURO
En cuanto al cloruro, los resultados se muestran en la figura 6. Se observó que con la suplementación de 200 mg/kg de AA las concentraciones de este ion se mantuvieron estables durante los cuatro tiempos de muestreo, mientras que en los demás tratamientos aumentaron a través del tiempo. Además, se evidenció que los ejemplares suplementados con 400 mg/kg presentaron mayores valores para los primeros tres tiempos de muestreo con respecto a los demás tratamientos, seguido por el tratamiento de 800 mg/kg. Mientras tanto, los ejemplares no suplementados y los suplementados con 100 mg/kg tuvieron los menores valores durante los mismos tiempos de muestreo.
DISCUSIÓN
Las variables medidas en este estudio involucraron aquellas que permiten observar los ajustes bioquímicos y metabólicos que forman parte de las respuestas más frecuentemente utilizadas para cuantificar el estrés en peces, como son la alteración en las concentraciones de cortisol, glucosa, lactato y proteínas plasmáticas y las de electrolitos (sodio y cloruro) presentes en el suero (12,16,17).
En el presente estudio, se observó un efecto benéfico significativo sobre las respuestas fisiológicas evaluadas, al utilizar AA en la dieta de los peces. Observaciones similares han sido reportadas en Micropterus salmoides (3), Paralichthys olivaceus (4), Oreochromis niloticus (5,18), Arapaima gigas (6), Salmo trutta caspius (7), Rachycentron canadum (19), Megalobrama amblycephala (20), Brycon amazonicus (21,22), Colossoma macropomum (23), Oncorhynchus mykiss (24,25), Rhamdia quelen (26), Rhizoprionodon terraenovae (27), Sparus aurata (28) y Cyprinus carpio (16,29), entre otras. No obstante, según Salinas et al. (30), no existe ningún efecto al suplementar la dieta con AA en Polyprion oxygeneios (30) ni en Oreochromis niloticus (31).
Como se pudo observar en la figura 1, los resultados mostraron que cuando los peces son alimentados con dieta sin contenido de AA, presentan un pico de producción de cortisol más alto que los peces alimentados con dieta que contiene vitamina C. Resultados similares fueron reportados en Arapaima gigas (6) y Megalobrama amblycephala (20). Estos resultados confirman lo reportado por Caldwell y Hinshaw (32), quienes observaron que los peces alimentados con dietas deficientes en vitamina C presentan un incremento notable en las concentraciones de cortisol circulante cuando se someten a condiciones estresantes. De igual manera, en Oncorhynchus mykiss (24) se comprobó que las concentraciones circulantes de cortisol son significativamente mayores en peces no suplementados 30 min después de ser expuestos al aire por espacio de 30 s.
Sin embargo, en contraste con lo anterior, en el estudio realizado por Abreu y Urbinati (21) no se observaron diferencias significativas en las concentraciones de cortisol de Brycon amazonicus alimentados con diferentes concentraciones de vitamina C y estresados por exposición aérea durante 2 min. Así mismo, en ejemplares de Cyprinus carpio, los autores concluyeron que los cambios en las concentraciones de cortisol cuando se aplicaba estrés no estaban relacionadas con las de vitamina C suministradas en la dieta (29).
Por otro lado, los peces alimentados con concentraciones de 100, 200 y 400 mg/kg mostraron un proceso de disminución de glucosa a través del tiempo, lo cual sugiere que la suplementación con estas cantidades de vitamina C contribuyó en el proceso de recuperación de los animales después de ser sometidos a estrés agudo por hipoxia. Resultados similares fueron reportados por Abreu y Urbinati (21), quienes encontraron en Brycon amazonicus que la glucosa sanguínea disminuye con diferentes cantidades de suplementación con AA a los 15 y 30 min posexposición aérea. Así mismo, Ming et al. (20) observaron en Megalobrama amblycephala que las concentraciones de glucosa sanguínea fueron menores en peces suplementados con vitamina C y expuestos a estrés calórico, comparados con un grupo de animales no suplementados. De la misma manera, Chagas y Val (23) evaluaron diferentes concentraciones de AA de 0, 100 y 500 mg/kg en ejemplares de Colossoma macropomum, en los cuales observaron que aquellos alimentados con dietas que poseían las cantidades más altas de vitamina C mostraron una mayor capacidad de reducir el efecto de la hipoxia, ya que en estos no se reflejaron cambios en las concentraciones de glucosa plasmática.
Resultados obtenidos en Piaractus mesopotamicus alimentados con una dieta no suplementada con vitamina C mostraron un aumento en las concentraciones circulantes de glucosa poscaptura, lo que sugiere que la deficiencia de la vitamina puede intensificar, a corto plazo, las repuestas al estrés en peces (32). Esta hipótesis fue corroborada en el presente estudio para esa variable.
Además de lo anterior, se observó que en los ejemplares de T1, T3, T4 y T5 las concentraciones de lactato disminuyeron a través del tiempo, lo cual sugiere un proceso de recuperación, explicado probablemente por el hecho de que en el momento de ser estresado el organismo se prepara para la huida, movilizando energía hacia sus músculos y produciendo ácido láctico (27,33). Por lo tanto, la disminución del lactato se puede interpretar como un proceso recuperación del animal, y por tanto de desactivación de este mecanismo fisiológico de huida, con el consiguiente proceso de recuperación del organismo a su estado normal. Este tipo de respuesta sugiere que la suplementación con cantidades de 200 mg/kg de vitamina C en la dieta de cachama blanca podría disminuir el impacto de la exposición aérea sobre la concentración de lactato; se observa incluso que la utilización de 100 mg/kg también contribuye en la disminución de dicho parámetro, aunque en menor medida.
Respecto a las proteínas, de acuerdo con Falcón et al. (18), la vitamina C estimula su síntesis en peces, tal como se observó en el presente estudio, en el cual los individuos suplementados tuvieron concentraciones circulantes mayores que los que no recibieron suplemento. Resultados similares resultados fueron encontrados por Ming et al. (20), quienes observaron que las concentraciones de proteína de los grupos suplementados con vitamina C fueron mayores que los peces de la dieta control, tanto antes como 2 y 6 h después de ser sometidos a estrés térmico. Lo anterior permite suponer que la suplementación estimuló la producción de proteína, o evitó su movilización como fuente de energía, afrontando de manera más eficiente la situación estresante a la que fue expuesto el animal. En ambos casos, se podría afirmar que la suplementación en la dieta con 200 mg/kg de vitamina C contribuyó a disminuir el efecto del estrés en juveniles de cachama blanca sometidos a hipoxia aguda. Sin embargo, contrario a lo descrito, Abreu y Urbinati (21) no observaron diferencias significativas para esta variable en ejemplares de Brycon amazonicus, suplementados con vitamina C y sometidos a hipoxia por exposición aérea.
Finalmente, con respecto al efecto del estrés sobre el equilibrio osmótico, Sloman et al. (25) afirman que la liberación de catecolaminas, principalmente adrenalina, causa aumento de la permeabilidad branquial, lo que afecta la osmorregulación y promueve el aumento del intercambio iónico. Esto fue comprobado por Abreu et al. (34), quienes observaron que en ejemplares de Brycon amozonicus, las concentraciones de sodio y cloruro disminuyeron después de ser sometidos a estrés por transporte y que las concentraciones se mantenían bajas aún 24 h después del estrés. Resultados similares se encontraron en Orechromis niloticus (18), en los que peces estresados por transporte mostraron dificultad para mantener las concentraciones de sodio y cloruro inmediatamente después del transporte; además, los peces alimentados con la dieta suplementada con vitamina C presentaron las menores concentraciones de estos iones. Los resultados de este estudio nos permiten afirmar que las concentraciones de suplementación de 200 mg/kg contribuyen a mantener estable el balance iónico de ejemplares estresados de Piaractus brachypomus. Estos resultados contrastan con los reportados por Abreu y Urbinati (21), quienes no encontraron diferencias significativas en las concentraciones de cloruro de Brycon amazonicus alimentados con diferentes cantidades de vitamina C y que fueron sometidos a exposición aérea por 2 min.
CONCLUSIONES
La suplementación con AA tuvo un efecto benéfico sobre las respuestas fisiológicas de los ejemplares de cachama blanca sometidos a exposición aérea.
La suplementación con 400 mg/kg de AA en la dieta de juveniles de Piaractus brachypomus mejoró la respuesta al estrés, lo que permitió disminuir parcialmente la liberación de cortisol y glucosa, principales variables utilizadas como indicadores de respuesta al estrés.
Las concentraciones de 200 mg/kg de AA en la dieta de cachama blanca disminuyeron el impacto del estrés agudo sobre la concentración de lactato y proteínas totales en el plasma, y les permitió a los ejemplares de cachama blanca mantener el balance iónico frente a condiciones estresantes.
La utilización de por lo menos 200 mg/kg de AA en la dieta de cachama blanca es indispensable para el mantenimiento de la homeostasis de los animales ante situaciones de estrés.
Se debe continuar investigando acerca de la utilización de AA en la dieta de otras especies nativas de peces para verificar su efecto protector ante situaciones de estrés.