INTRODUCCIÓN
Miastenia gravis adquirida (MGA) es una enfermedad inmunomediada no inflamatoria que se manifiesta en su forma generalizada con debilidad muscular (1,2). Se produce debido a una interferencia en la transmisión neuromuscular por una reducción en el número de colinorreceptores nicotínicos de la acetilcolina, ocasionada por anticuerpos bloqueantes (ACRA). En caninos, los valores séricos de ACRA superiores a los 0,6 nmol/l confirman esta patología (3-8).
La miositis de los músculos masticatorios (MMM) es una enfermedad inflamatoria de los músculos masticatorios (maseteros, temporales y pterigoideos), que puede presentar una fase aguda y una crónica. En la fase aguda, o también denominada inflamatoria, de aproximadamente dos semanas de duración, el paciente presenta dolor y edema de músculos masticatorios (9,10). También en algunas ocasiones cursa con hipertermia, aumento de tamaño de los linfonódulos submaxilares e incremento de la concentración de creatina fosfoquinasa (CPK) en suero, por el daño muscular producido (11,12). A medida que evoluciona la enfermedad progresa al estadio crónico, en el que se observa disminución bilateral del volumen muscular (atrofia y fibrosis) e incapacidad para abrir la boca, por lo que presentan dificultad en la aprehensión y masticación de los alimentos. En algunos pacientes se observan episodios de reagudizaciones (13,14). Si bien la patogénesis de esta enfermedad no es clara, se sospecha que los músculos masticatorios tienen un origen embriológico diferente a otros músculos estriados, y producen una miosina específica denominada 2M, causante de la reacción inmunomediada localizada en lo músculos de la cabeza, que manifiesta una respuesta favorable a la administración de corticoides e inmunosupresores. Los autoanticuerpos antifibras 2M se pueden detectar en suero y en los músculos afectados (11,12).
El objetivo del presente trabajo es describir casos clínicos en los que se observó concurrencia entre la MG y la MMM.
MATERIALES Y MÉTODOS
Se analizaron cinco caninos (tabla 1) de 4 a 9 años de edad, en la Unidad de Neurología del Hospital Escuela de la Facultad de Ciencias Veterinarias de Buenos Aires, durante el periodo 2013-2016, que presentaban debilidad episódica. Se realizó examen clínico y neurológico. Dentro de los 10 meses del inicio del signo descrito se observó dificultad para abrir la boca en la totalidad de los pacientes (trismus). Todos los pacientes estudiados presentaron diferentes grados de atrofia muscular de los músculos masticatorios (figura 1). Cabe destacar que, al momento de la consulta clínica, ninguno tenía traumatismo evidente en la zona de la cabeza.
Tabla 1 Resultados de ACRA, CPK, ANTI 2M y RX ATM de los 5 pacientes
| Raza | Edad y sexo | ACRA nmol/l | CPK UI | ANTI 2M | RX ATM |
|---|---|---|---|---|---|
| Ovejero alemán | 7 años hembra | 0,99 | 1566 | Positivo | Sin particularidades |
| Bretón | 5 años macho | 1,40 | 8770 | Positivo | Sin particularidades |
| Mestizo | 4 años hembra | 2,70 | 780 | Negativo | Sin particularidades |
| Mestizo | 7 años macho | 3,10 | 2570 | Positivo | Sin particularidades |
| Rottweiller | 9 años hembra | 6,20 | 4320 | Positivo | Sin particularidades |
Fuente: elaboración propia

Figura 1 Bretón con severa atrofia muscular bilateral y simétrica de los músculos temporales y maseteros
Se efectuaron estudios complementarios: hemograma, bioquímica sanguínea (incluyendo CPK), identificación de anticuerpos serológicos específicos a toxoplasmosis por aglutinación directa e inmunofluorescencia indirecta y frente a neosporosis por inmunofluorescencia indirecta, perfil tiroideo (T4 y TSH), radiografías simples de las articulaciones temporomandibulares (RX ATM), electromiografía de los músculos bíceps, semimembranosos, gastrocnemios y masticatorios, utilizando electrodos agujas y equipo ATI, prueba serológica de ACRA, medición de anticuerpos serológicos anti2M (inmunofluorescencia indirecta) y biopsia muscular de maseteros y temporales. Las muestras remitidas para histopatología fueron fijadas en formol al 10 %. Fueron procesadas por técnicas de rutina hasta su inclusión en parafina, de lo cual se obtuvieron cortes de 5 µm de espesor que fueron coloreados con hematoxilina y eosina (H/E), ácido periódico-reactivo de Schiff (PAS) y tricrómico de Mallory.
RESULTADOS
En los exámenes clínico y neurológico se observó dificultad para abrir la boca con condición corporal buena en todos los casos y aumento de los linfonódulos submaxilares solo en tres de ellos. El resto de los parámetros se hallaron normales. Los cinco pacientes mostraron un aumento significativo de la CPK con valores entre 477 y 8520 UI (valor de referencia hasta 200 UI). Las pruebas serológicas para las enfermedades parasitarias fueron negativas. El perfil tiroideo en todos los casos se encontró dentro de los valores normales (T4L y TSH). Las radiografías de las articulaciones temporomandibulares no mostraron anormalidades como osteoartritis, luxaciones o fracturas. Los cinco caninos arrojaron valores ACRA positivos y los anticuerpos anti2M fueron positivos en cuatro pacientes.
Las biopsias analizadas con tinción de rutina (H/E) revelaron cambios morfológicos degenerativos de las fibras musculares. Se describió una variación de sus diámetros en los cortes transversales, y algunas presentaban sarcoplasmas con hiperacidofilia, microvacuolización y pérdida de estriaciones. Se observó grado moderado de tejido fibrótico intermuscular y un infiltrado linfoplasmocítico multifocal a coalescente alrededor de los vasos sanguíneos, en endomisio y perimisio (figura 2). El diagnóstico histopatológico fue miositis linfoplasmocitaria crónica, con degeneración miofribilar y presencia de fibrosis moderada, compatible con una reacción inmunomediada. Cabe aclarar que en los cortes realizados no se observó la presencia de formas parasitarias de Toxoplasma gondii ni Neospora caninum. La técnica de PAS demostró más acidofilia en las células musculares degenerativas, mientras que el tricrómico de Mallory detectó colágeno maduro en las zonas de fibrosis.
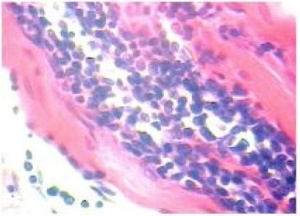
Fuente: elaboración propia
Figura 2 Infiltrado inflamatorio de leucocitos mononucleares principalmente de linfocitos y células plasmáticas entre las fibras musculares (H/E 40X)
Los hallazgos electromiográficos de los músculos masticatorios evaluados señalaron potenciales de fibrilación en reposo y descargas miotónicas compatibles con denervación en curso (figura 3). En el resto de los músculos los trazados estaban conservados, pero con estimulación repetitiva positiva (diagnóstico electromiográfico de MG).
DISCUSIÓN
Si bien en caninos se ha descrito la asociación entre MG y la miositis (10), la asociación debe tener en cuenta que la MMM agrava la condición del paciente miasténico, ya que no puede realizar la apertura de la boca para alimentarse. De los cinco casos estudiados, cuatro presentaron positividad a la medición de anticuerpos anti2M. El canino que resultó negativo para esta determinación pudo haber recibido tratamiento con corticoides previamente al estudio, debido a su acción inmunomodeladora (11,13).
La MG puede presentarse de manera generalizada y localizada (megaesófago y cambios de voz). El diagnóstico se basa en los signos clínicos-neurológicos, cambios electromiográficos, test de ACRA y respuesta al tratamiento con bromuro de piridostigmina. Se ha demostrado que algunos pacientes que presentan sintomatología de debilidad generalizada, que dan ACRA negativos, responden favorablemente a la piridostigmina (14). Otro diagnóstico utilizado es el test de Tensilon; sin embargo, no se pudo realizar, ya que no se consigue en la Argentina. Es importante considerar otras enfermedades diferenciales que producen atrofia de músculos masticatorios en los caninos como dermatomiositis, miopatías endócrinas o asociadas a enfermedades como la toxoplasmosis en una etapa crónica.
Se ha descrito la asociación de timoma y MG en humanos (13) y en caninos. Sin embargo, en los casos estudiados no se obtuvo evidencia radiológica de la neoplasia. Cabe aclarar que el Hospital Escuela no cuenta con tomógrafo y que los propietarios no contaban con los medios económicos para hacerlo en forma privada.
La asociación con MMM agrava la condición del paciente miasténico, ya que no puede realizar la apertura de la boca. Es por eso por lo que el pronóstico se considera de reservado a infausto, ya que más allá de la debilidad generalizada el animal no puede alimentarse correctamente. En este trabajo se quiso resaltar la importancia del diagnóstico y tratamiento temprano de estos pacientes.
CONCLUSIONES
Los resultados analíticos sanguíneos, así como la biopsia y la electromiografía de los casos evaluados, permitieron concluir que existe una clara asociación entre la MMM y la MGA. Por tal motivo, y debido a la gravedad de los signos clínicos de los pacientes, se decidió implementar la terapia combinada de bromuro de piridostigmina (0,5 mg/kg cada 12 h, vía oral) que inhibe la hidrólisis de acetilcolina por unión competitiva a la acetilcolinesterasa, en combinación con prednisolona (0,5 mg/kg día oral) (1,6). La mejoría de los pacientes, tanto en su marcha como en la apertura de su boca, fue evidente a los 15-20 días después de comenzar el tratamiento.
La evolución de los cinco casos fue favorable sin presentar cuadros de reagudización. Se realizaron controles clínicos cada 4-6 meses durante 2 años. Los pacientes presentaron deambulación efectiva y se alimentaron con normalidad. Es de destacar que se observó en la totalidad de los pacientes la persistencia de la atrofia de los músculos maseteros y temporales. El tratamiento para la MG y para la MMM es de por vida, por este motivo los controles médicos deben ser periódicos.