INTRODUCCIÓN
El jaguar (Panthera onca Linneaus, 1758) es el félido de mayor tamaño que existe en América; después del tigre (P. tigris) y el león (P. leo), es el tercero en tamaño del género Panthera. Esta especie ha sido albergada en parques y jardines zoológicos del mundo por más de un siglo. El registro conocido más antiguo lo constituye una hembra en el Zoológico de Filadelfia de 1875 (1,2). En 1995 el Libro de registro de cría regional para el jaguar (Studbook) incluyó 109 individuos en 67 instituciones en Norteamérica, mientras que en 1999 el Sistema Internacional de Información sobre Especies (ISIS) registró 239 individuos en 111 zoológicos alrededor del mundo, para lo cual señaló que 86,20 % de estos individuos habían nacido en cautiverio. De manera similar, el primer registro de un jaguar en un zoológico en Venezuela es de enero de 1946 (1,2), una hembra albergada en el Jardín Zoológico El Pinar, en Caracas. No obstante, por información anecdótica se sabe de un ejemplar macho llevado al zoológico privado del entonces presidente de Venezuela Juan Vicente Gómez, en la ciudad de Maracay, entre 1918 y 1935. Boher y Trebbau (3) señalan un total de 43 jaguares (22 machos y 21 hembras) en las diferentes colecciones zoológicas de Venezuela, lo que indica que en muchos de estos establecimientos la reproducción sucedía con relativa facilidad, pues llega incluso a producir excedentes. En 1998, la población cautiva consistía en 16 machos y 19 hembras de acuerdo con la base de datos de la Fundación Nacional de Parques Zoológicos y Acuarios (Funpza).
En los parques o jardines zoológicos, el plan de manejo integral incluye, con mayor o menor frecuencia, la captura y la inmovilización o anestesia de la fauna silvestre en cautiverio. El término inmovilización en realidad se refiere al uso de sustancias que paralizan un animal sin pérdida o bloqueo de la respuesta al dolor o de la conciencia (p. ej. succinilcolina y nicotina). Sin embargo, en este estudio la inmovilización debe ser entendida como el uso de drogas que producen sedación, analgesia y anestesia en el animal. Al inmovilizar un animal silvestre se debe estar consciente de la responsabilidad que se tiene, desde el momento en que se administra el fármaco hasta su recuperación, de la salud y la vida de ese animal. Es obligatorio que la persona responsable sepa cómo evaluar el animal anestesiado; que conozca los parámetros fisiológicos y cómo debe responder ante emergencias anestésicas. Aunque muchos agentes anestésicos son relativamente seguros, las emergencias pueden ocurrir, y ocurren, incluso en las circunstancias más favorables.
El uso de drogas tranquilizantes en esta especie solo debe realizarse mediante sistemas remotos o a distancia de administración, es decir, mediante el uso de dardos, cerbatanas, pistolas o rifles de aire comprimido. Aun cuando existe cierto grado de riesgos, el uso de equipos e instrumentos apropiados y de forma adecuada reduce substancialmente lesiones en el animal e incluso en las personas. Factores como errores en la selección del sitio de inoculación sobre el animal, el peso de los dardos, las agujas demasiado largas o gruesas, las agujas con collar y tipo anzuelo o de ganchos, la potencia del disparo, en caso del uso de pistolas o rifles de aire comprimido, pueden causar graves daños al momento del impacto (4,5). En consecuencia, el conocimiento, la pericia, la experiencia y la prudencia son aspectos vitales para el éxito de este tipo de procedimiento.
La recomendación general es la administración de un anestésico disociativo combinado con un sedante agonista α2 adrenérgico con propiedades de analgesia y relajación muscular y un agente anticolinérgico. Para el cálculo de la dosis correcta, el método de la escala alométrica es el más seguro y eficiente. El uso de anestésicos en jaguares tanto en cautiverio como en vida libre ha incluido drogas como la fenciclidina, la combinación tiletamina-zolazepam, medetomidina, xilacina y ketamina, todas con una alta variación en los protocolos y dosis empleadas (6-18).
Finalmente, la interpretación de cualquier hallazgo hematológico debe considerar la existencia de factores que pueden afectar los resultados y que involucran variables biológicas (intrínsecos) y no biológicas (extrínsecos). Variables biológicas como especie, edad, comportamiento, estrés, tipo de dieta (incluyendo la cantidad de alimento ingerido) y periodo de ayuno previo a la toma de la muestra tienden a arrojar valores que pueden ser interpretados como alteraciones desde el punto de vista clínico. El sitio de punción, el uso y tipo de anticoagulante, el tiempo de almacenamiento de la muestra y las técnicas o equipos empleados para el análisis constituyen las variables no biológicas más comunes que se deben tener en cuenta.
Los principales objetivos de este estudio fueron: evaluar el procedimiento y la dosis utilizada de xilacina y ketamina requerida para inducir sedación o anestesia; registrar los tiempos de aparición de los efectos iniciales y los de recumbencia lateral o esternal y de recuperación en jaguares; reportar los valores de hematología y química sanguínea, y compararlos con los de animales de vida libre, a fin de determinar si existen alteraciones de estas variables en cautiverio. Se espera que los datos de este trabajo sirvan como valores de referencia.
MATERIALES Y MÉTODOS
Animales
La evaluación se realizó entre 1996 y 2009 en 22 jaguares: 12 machos, con edad promedio de 9,1 años, y 10 hembras, con edad promedio de 6,6 años, albergados en nueve parques zoológicos: La Guaricha (PZLG), Generalísimo Francisco de Miranda (PGFM), El Pinar (PZEP), Caricuao (PZC), Las Delicias (PZLD), Bararida (PZBB), Chorros de Milla (PZChM), Paraguaná (PZP) y Metropolitano del Zulia (PZMZ), y una colección privada: la Asociación de Ganaderos de Valencia (AGV) (tabla 1).
Tabla 1 Localidades de los sitios de trabajo, tamaño de la muestra (n = 22)
| Localidad | Entidad federal | Número de animales | |
|---|---|---|---|
| Machos | Hembras | ||
| PZLG | Maturín, estado Monagas | 1 | |
| PGFM | Caracas, Distrito Metropolitano | 1 | |
| PZEP | Caracas, Distrito Metropolitano | 1 | 1 |
| PZC | Caracas, Distrito Metropolitano | 1 | 2 |
| PZLD | Maracay, Estado Aragüa | 3 | 2 |
| AGV | Valencia, Estado Carabobo | 1 | |
| PZBB | Barquisimeto, Estado Lara | 1 | 2 |
| PZChM | Mérida, Estado Mérida | 1 | |
| PZP | Punta Cardón, Estado Falcón | 1 | |
| PZMZ | Maracaibo, Estado Zulia | 2 | 2 |
PZLG = La Guaricha; PGFM = Generalísimo Francisco Miranda; PZEP = El Pinar; PZC = Caricuao; PZLD = Las Delicias; AGV = Asociación de Ganaderos de Valencia; PZBB = Bararida; PZChM = Chorros de Milla; PZP = Paraguaná; PZMZ = Metropolitano del Zulia.
Aspectos éticos
Para la ejecución de la investigación se obtuvo la aprobación por medio de un consentimiento informado leído y firmado por los representantes administrativos de cada uno de los parques zoológicos. Así mismo, para garantizar las buenas prácticas y los principios de bienestar animal en los procedimientos que se iban a realizar en los jaguares objeto de estudio, se respetaron las disposiciones expuestas en la Ley del Ejercicio de la Medicina Veterinaria Gaceta Oficial n.o 28.737, del 24 de septiembre de 1968, y de la Ley de Protección de la Fauna Silvestre Gaceta Oficial n.o 28.289, del 11 de agosto de 1970.
Inmovilización
Para cada procedimiento los animales fueron sometidos a privación de agua y alimento (ayuno) entre 8 y 12 h. El ayuno reduce la cantidad de alimento y los fluidos en el estómago, y ayuda a minimizar el vómito y la regurgitación durante la intervención. La duración del ayuno depende de la especie. En la mayoría de animales con estómago simple debe retirarse la comida de 12 a 24 h y el agua 12 h, antes de la intervención. El tiempo de privación de agua dependerá de las condiciones medioambientales y del estado general del animal.
Todos los animales fueron ubicados o se encontraban alojados en áreas de trabajo o cubículos fuera de la vista del público, excepto en el PZLG y AGV, ya que, al momento de la actividad, estos no contaban con este tipo de instalación. Siempre que sea posible, el anestésico deberá administrarse a un animal confinado en un recinto pequeño; esto suele disminuir la cantidad de droga necesaria y permite una anestesia más segura. Aislar el animal también mejora el acceso y minimiza el potencial de que otro ejemplar en el mismo recinto produzca daño durante las fases iniciales de la ataxia. Se empleó como indicador subjetivo de la actividad neurológica la postura corporal y el grado de sumisión o agresividad en cada uno de los ejemplares.
Se administró por vía intramuscular (IM) a cada animal en el tren posterior (muslos derecho o izquierdo) mediante el uso de dardos de 3,0 ml de capacidad con agujas sin collar de 1,5 × 30 mm (20 gauge × 1 - 1/4 in) y cerbatana de 1 m × 11 mm marca Telinject® (figura 1), una combinación a dosis constante de 4,0 mg/kg de ketamina (100 mg/ml) - 2,0 mg/kg de xilacina (100 mg/ml), siguiendo el criterio definido por Wiesner y von Kegel (19). Estos fármacos se clasifican como anestésico disociativo y sedante no narcótico, respectivamente.
El clorhidrato de ketamina es un anestésico disociativo seguro, de acción rápida y efectivo en un amplio número de especies; actúa en la corteza cerebral frontal y tiene propiedades analgésicas y amnésicas. La ruta de administración suele ser la intramuscular. Incluso en un plano de anestesia con una analgesia adecuada, los animales parecen estar parcialmente despiertos y mantienen los reflejos laríngeo y faríngeo. Cuando se utiliza sola, incluso a concentración elevada, requiere un volumen de inyección grande en algunas especies de gran tamaño, lo que puede causar problemas con los sistemas remotos o a distancia de administración de fármacos (20). Otra desventaja es que las inyecciones son dolorosas, producen poca relajación muscular, salivación excesiva, y el animal tiende a convulsionar (21). Para evitar algunos de estos problemas es frecuente combinar la ketamina con un tranquilizante o un sedante, lo que permite un episodio anestésico más suave con mejor relajación muscular, mínima convulsión y una disminución del volumen general de la sustancia; no obstante, el tiempo de recuperación de la anestesia puede verse prolongado.
La xilacina es el sedante/analgésico no narcótico más ampliamente utilizado en mamíferos domésticos y no domésticos. Es un agonista alfa-2-adrenérgico y puede ser parcialmente antagonizada por los alfa-2-antagonistas como la yohimbina. En carnívoros, la sedación inducida solo con xilacina puede ser revertida si el animal es estimulado externamente, y por ello su uso como único anestésico tiene efectividad limitada. Para que el efecto sea máximo debe administrarse a un animal encerrado y tranquilo. Una vez administrada vía IM, su efecto aparece a los 5-10 min, y el máximo a los 20 min. Cuando se utiliza en combinación con anestésicos disociativos o narcóticos profundiza el nivel de anestesia (20). Otros efectos incluyen relajación muscular, depresión respiratoria, disminución de la motilidad intestinal, disminución de la temperatura corporal y de la frecuencia cardiaca (21,22). La bradicardia inducida puede prevenirse mediante la administración de atropina sistémica. También provoca hiperglicemia con glucosuria secundaria y una disminución en la cantidad de glóbulos circulantes, como refleja el bajo hematocrito. Estos cambios alteran los datos clínico-patológicos del animal. La tabla 2 muestra el protocolo de administración de ketamina, xilacina, atropina y yohimbina en función del peso corporal adoptado para este trabajo.
Tabla 2 Protocolo para la administración de ketamina, xilacina, atropina y yohimbina en función del peso corporal
| Peso (Kg) | Ketamina (4 mg/kg) | Volumen (ml) | Xilacina (2 mg/kg) | Volumen (ml) | Atropina (0,02 mg/kg) | Volumen (ml) | Yohimbina (0,125 mg/kg) | Volumen (ml) |
|---|---|---|---|---|---|---|---|---|
| 40 | 160 | 1,60 | 80 | 0,80 | 0,80 | 1,60 | 5,00 | 2,50 |
| 50 | 200 | 2,00 | 100 | 1,00 | 1,00 | 2,00 | 6,25 | 3,13 |
| 60 | 240 | 2,40 | 120 | 1,20 | 1,20 | 2,40 | 7,50 | 3,75 |
| 70 | 280 | 2,80 | 140 | 1,40 | 1,40 | 2,80 | 8,75 | 4,38 |
| 80 | 320 | 3,20 | 160 | 1,60 | 1,60 | 3,20 | 10,00 | 5,00 |
| 90 | 360 | 3,60 | 180 | 1,80 | 1,80 | 3,60 | 11,25 | 5,63 |
| 100 | 400 | 4,00 | 200 | 2,00 | 2,00 | 4,00 | 12,50 | 6,25 |
Fuente: elaboración propia
Como indicadores de evaluación de la profundidad de sedación o plano de anestesia se observó inicialmente la reacción de levantamiento de cabeza, cuello o intento de reincorporación, acompañado de vocalización o gruñido, seguido por el uso del estímulo del reflejo palpebral y del movimiento de la oreja, utilizando cada 30 s a 1 min una vara o listón rígido de madera, una vez el animal estaba en posición decúbito esternal o lateral. En animales entre 40 y 50 kg de peso vivo se empleó un dardo. En animales mayores a 50 kg se emplearon hasta dos dardos para completar la dosis. Una vez el animal quedó sedado, se procedió a inocular mediante jeringa, vía intramuscular, sulfato de atropina a dosis constante de 0,02 mg/kg (0,5 mg/ml) como agente anticolinérgico. Finalizado el procedimiento, se empleó yohimbina a dosis constante de 0,125 mg/kg (2 mg/ml) como agente neutralizante de la xilacina (tabla 2). La temperatura rectal, la frecuencia respiratoria y la frecuencia cardíaca se revisaron durante la inmovilización cada 5 min. A fin de determinar diferencias significativas de estos parámetros entre sexos se utilizó la prueba T con un nivel de significancia α ≤ 0,05 (tabla 3).
Tabla 3 Valores de signos vitales posinducción en jaguares inmovilizados
| Signo vital | Machos (n=12) Promedio ± DE | Hembras (n=10) Promedio ± DE | ||
|---|---|---|---|---|
| Inicial* | Final** | Inicial* | Final** | |
| Temperatura rectal (°C) | 38,61 ± 0,63 | 38,91 ± 0,61 | 381,81 ± 0,81 | 38,92 ± 0,73 |
| Frecuencia cardiaca | 75,11 ± 23,54 | 76,00 ± 30,09 | 60,29 ± 23,84 | 78,40 ± 28,65 |
| Frecuecia respiratoria (respiraciones/min) | 25,42 ± 6,67 | 24,67 ± 5,00 | 24,00 ± 7,47 | 23,80 ± 6,29 |
DE = desviación estándar; * = Hubo diferencia estadísticamente significativa (P = 0,265; P = 0,118; P = 0,324), ** = Hubo diferencia estadísticamente significativa (P = 0,484; P = 0,444; P = 0,364).
Igualmente, se evaluó de forma irregular el tiempo de perfusión capilar y el pulso como indicadores del funcionamiento cardiorrespiratorio. Se registró la hora de inicio y de finalización para el cálculo de tiempo de inducción (tiempo que transcurre desde la administración del fármaco hasta que el animal adopta la posición decúbito lateral o esternal y es seguro aproximarse al animal), tiempo de recumbencia (tiempo de duración del efecto del fármaco) y tiempo de recuperación (tabla 4). Este último se cronometró desde el momento de la inoculación de la yohimbina hasta que el animal se mantuvo en pie. La regresión lineal fue utilizada para determinar la relación entre la dosis total (mg) de la mezcla ketamina-xilacina (mg) y el tiempo de inducción (min). Para determinar la existencia de diferencias entre el sexo y los tiempos de inducción y recumbencia se utilizó la prueba T con un nivel de significancia α ≤ 0,05.
Tabla 4 Peso, dosis de ketamina, xilacina, atropina y yohimbina, tiempo de inducción, tiempo de recumbencia y tiempo de recuperación para jaguares inmovilizados
| Variable | Machos (n = 12) Promedio ± DE | Hembras (n = 10) Promedio ± DE |
|---|---|---|
| Peso (Kg.) | 65,50 ± 11,33 | 52,30 ± 9,56 |
| Xilacina (mg/Kg.) | 126,67 ± 24,12 | 100,00 ± 21,08 |
| Ketamina (mg/Kg.) | 523,33 ± 48,24 | 200,00 ± 42,16 |
| Atropina (mg/Kg.) | 1,27 ± 0,24 | 1,00 ± 0,21 |
| Tiempo de inducción (min.) * | 16 ± 4,73 | 22,9 ± 13,72 |
| Tiempo de recumbencia (min.) ** | 56,92 ± 32,02 | 68,10 ± 46,13 |
| Yohimbina (mg/Kg.) | 7,92 ± 1,27 | 5,97 ± 1,04 |
| Tiempo de recuperación (min.) | 5 ± 1 | 7 ± 3 |
DE = desviación estándar; * = (P = 0,06) no hubo diferencia estadísticamente significativa; ** = (P = 0,263) hubo diferencia estadísticamente significativa.
HEMATOLOGÍA Y QUÍMICA SANGUÍNEA
Se recolectaron muestras de sangre entera de las venas yugular y cefálica con aguja 21G × 1½ in y Vacutainer™ en tubos con anticoagulante (ácido etilendiaminotetraacético [EDTA]) y sin este. Las muestras fueron refrigeradas en una hielera o contenedor portátil hasta su transporte al laboratorio. El tiempo entre la recolección de sangre y la entrega en el laboratorio varió entre 1 y 12 h. Mediante técnicas de laboratorio convencionales y automatizadas se determinaron los valores hematológicos y químicos del suero. Para todos los valores obtenidos se les determinó el promedio y la desviación estándar. A fin de determinar si existen diferencias significativas entre los parámetros hematológicos y de química sanguínea obtenidos en este estudio y los datos publicados para jaguares en cautiverio y en vida libre, se utilizó la prueba T con un nivel de significancia α ≤ 0,05.
RESULTADOS
Inmovilización
La respuesta neurológica que presentaron todos los ejemplares al inicio del procedimiento en cuanto a postura corporal varió de erguido sobre sus cuatro miembros a sentado-agachado; la actitud o temperamento se ajustó a la categoría de calmado-atento. Los signos vitales, que incluyen temperatura rectal, frecuencia respiratoria y frecuencia cardíaca, fueron revisados regularmente después de la inducción de la inmovilización hasta el primer signo de recuperación (tabla 3). Las dosis utilizadas y la duración de los efectos iniciales, de recumbencia lateral o esternal y de recuperación se muestran en la tabla 4. Todos los animales se inmovilizaron de forma individual.
En el diagrama de dispersión de la regresión lineal simple, correspondiente a la relación dosis versus tiempo de inducción, se aprecia una disposición de tipo no aleatoria de los datos con una línea de tendencia descendente positiva. La regresión lineal no fue significativa (P = 0,002) (figura 2).
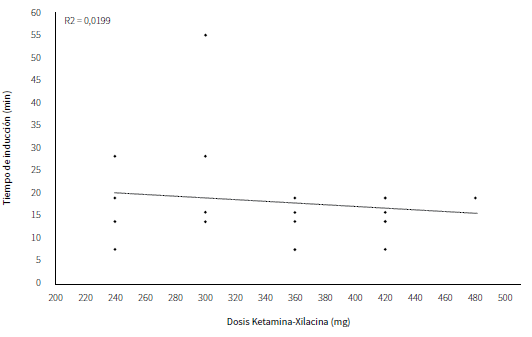
Fuente: elaboración propia
Figura 2 Tiempos de inducción para jaguares en cautiverio inmovilizados intramuscularmente con la mezcla ketamina-xilacina (4,00-2,00 mg/mg) (P = 0,002)
Con relación al coeficiente de determinación, este fue de 0,0199; es decir, 1,99 % de la variación en el tiempo de inducción puede atribuirse a la relación con la dosis total de la mezcla ketamina-xilacina, por lo que se considera que la relación entre estas variables es débil.
En respuesta a la combinación xilacina-ketamina, 9 de los animales presentaron salivación profusa acompañada de movimientos de la lengua y arqueos, y cuatro tuvieron vómito durante el tiempo de inducción. Aunque el tiempo de inducción fue variable, con un mínimo de nueve minutos hasta 55 min, este último en una hembra de 7,1 años y 60 kg de peso, los primeros efectos ocurrieron entre los 2 y los 6 min. Caracterizado por ataxia con incoordinación en los miembros y postura decúbito lateral o esternal entre 5 y 10 min. Pasado los 10 min los reflejos fueron más lentos con algún cabeceo. La administración adicional de la dosis de ketamina abolió totalmente los reflejos en 3 min, suficiente para acercarse al animal. La dosis total de xilacina y ketamina indujo respectivamente una inmovilización profunda suficientemente segura, lo que permitió la toma de muestras, la verificación de signos vitales y la realización de diferentes tipos de procedimientos. Durante el tiempo de recumbencia, la relajación muscular en general fue buena, los párpados permanecieron abiertos y las pupilas dilatadas, por lo que se tomó la precaución de proteger los ojos siguiendo los protocolos médico-veterinarios frecuentes para este tipo de situación.
Hematología y química sanguínea
Las tablas 5 y 6 muestran los valores obtenidos para las diferentes células sanguíneas del perfil hematológico y los metabolitos sanguíneos evaluados. Se reportan los valores combinados sin discriminar sexo y edad.
Tabla 5 Valores hematológicos de P. onca obtenidos en este estudio y los valores de referencia publicados por ISIS (23), Gomes de Oliveira et al. (12) y Widmer et al. (17)
| Parámetro | Promedio ± DE este estudio | Promedio ± DE jaguares en cautiverio (23) | Promedio ± DE jaguares en cautiverio (12) | Promedio ± DE jaguares en vida libre (17) | Lectura |
|---|---|---|---|---|---|
| Eritrocitos × 106/μL | 7,66 ± 2,20 | 7,26 ± 1,36 | 6,99 ± 1,02 | 7,20 ± 1,0 | ↑↑↑ |
| Hematocrito (Ht) % | 37,59 ± 7,03 | 34,80 ± 5,70 | 32,95 ± 4,90 | 35,40 ± 4,2 | ↑↑↑ |
| Hemoglobina (Hb) g/dL | 11,87 ± 2,52 | 11,80 ± 2,30 | 10,73 ± 1,56 | 10,68 ± 1,2 | -↑↑ |
| VCM fL | 52,67 ± 5,40 | 48,80 ± 9,30 | 47,20 ± 3,30 | 49,30 ± 2,8 | ↑↑↑ |
| CHCM g/dL | 29,87 ± 0,61 | 33,70 ± 3,30 | 32,61 ± 1,33 | 29,80 ± 1,3 | ↓↓- |
| HCM pg | 15,77 ± 1,92 | 16,60 ± 3,90 | 15,40 ± 1,12 | 14,70 ± 1,0 | ↓-↑ |
| Leucocitos × 103/μL | 12,13 ± 2,99 | 12,01 ± 4,09 | 10,86 ± 2,54 | 20,80 ± 4,8 | -↑↓ |
| Neutrófilos banda × 103/μL | 0,24 ± 0,00 | 0,813 ± 1,66 | s. i. | 1,40 ± 1,2 | ↓ ↓ |
| Neutrofilos segmentados × 103/μL | 7,76 ± 2,64 | 8,56 ± 3,92 | 8,39 ± 1,42 | 14,40 ± 3,0 | ↓↓↓ |
| Linfocitos × 103/μL | 2,56 ± 1,35 | 2,15 ± 2,09 | 1,69 ± 1,34 | 3,50 ± 1,7 | ↑↑↓ |
| Eosinófilos × 103/μL* | 0,87 ± 0,94 | 0,29 ± 0,30 | 0,51 ± 0,31 | 0,40 ± 0,3 | ↑↑↑ |
| Monocitos × 103/μL | 0,24 ± 0,19 | 0,35 ± 0,39 | 0,15 ± 0,15 | 0,90 ± 0,4 | ↓↑↓ |
| Plaquetas x103/μL | 305,67 ± 186,07 | 273,00 ± 107,00 | 353,34 ± 154,41 | 232,40 ± 81,3 | ↑↓↑ |
| Proteína total g/dL | 7,40 ± 0,14 | 7,30 ± 0,70 | s. i. | 7,50 ± 0,4 | ↑↓ |
| Albúmina g/dl | 3,55 ± 0,35 | 3,40 ± 0,30 | s. i. | 2,40 ± 0,2 | ↑↑ |
DE = desviación estándar; VCM = volumen corpuscular medio; CHCM = concentración de hemoglobina corpuscular media; HCM = Hemoglobina corpuscular media; ↑ = valor aumentado; ↓ = valor disminuido; - = valor aproximado (el triple flechado indica la comparación con los valores de referencia en cautiverio y en vida libre, respectivamente); * = prueba T: diferencia estadísticamente significativa (P = 0,03); s. i. = sin información
Tabla 6 Valores de la química sanguínea de P. onca obtenidos en este estudio y los valores de referencia publicados por ISIS (23) y Widmer et al. (17)
| Parámetro | Promedio ± DE este estudio | Promedio ± DE jaguares en cautiverio (23) | Promedio ± DE jaguares en vida libre (17) | Lectura |
|---|---|---|---|---|
| Glucosa mg/dl | 137,32 ± 39,67 | 139,00 ± 55,00 | s. i. | ↓ |
| BUN mg/dl | 18,15 ± 7,28 | 24,00 ± 9,00 | 106,40 ± 24,0 | ↓↓ |
| Creatinina mg/dl | 1,94 ± 0,65 | 1,90 ± 0,60 | 1,10 ± 0,3 | -↑ |
| ALT U/L* | 65,00 ± 22,63 | 59,00 ± 32,00 | 44,30 ± 14,7 | ↑↑ |
| AST U/L | 23,00 ± 12,73 | 35,00 ± 15,00 | 42,00 ± 10,4 | ↓↓ |
| LDH U/L | 111,00 ± 0,00 | 168,00 ± 170,00 | 91,10 ± 23,2 | ↓↑ |
| CK U/L | 174,00 ± 0,00 | 293,00 ± 235,00 | 299,20 ± 199,8 | ↓↓ |
| Colesterol mg/dl | 252,00 ± 22,63 | 245,00 ± 58,00 | 142,60 ± 22,0 | ↑↑ |
| Triglicéridos mg/dl | 19,00 ± 7,07 | 30,00 ± 14,00 | 42,70 ± 17,0 | ↓↓ |
| Bilirrubina total mg/dl | 0,31 ± 0,01 | 0,20 ± 0,10 | 0,50 ± 0,1 | ↑↓ |
| Bilirrubina directa mg/dl | 0,12 ± 0,00 | 0,00 ± 0,00 | 0,30 ± 0,1 | ↑↓ |
| Bilirrubina indirecta mg/dl* | 0,19 ± 0,00 | 0,10 ± 0,10 | 0,20 ± 0,0 | ↑↓ |
| Fosfatasa alcalina U/l | 52,00 ± 39,60 | 32,00 ± 32,00 | s. i. | ↑ |
DE = desviación estándar; ALT = alanina aminotransferasa; AST = aspartato aminotransferasa; BUN = nitrógeno ureico en sangre; LDH = lactato deshidrogenasa; CK = creatinina kinasa; s. i. = sin información; ↑ = valor aumentado; ↓ = valor disminuido; - = valor aproximado (el flechado doble indica la comparación con el valor de referencia en cautiverio y en vida libre, respectivamente); * = prueba T: diferencia estadísticamente significativa (P = 0,00002; P = 0,04)
DISCUSIÓN
Inmovilización o anestesia
En Venezuela, aspectos relacionados con la disponibilidad de mercado, los costos de adquisición y el amplio margen de seguridad o terapéutico de la xilacina (hasta 8 mg/kg) y de la ketamina (hasta 33 mg/kg) (20) han determinado que a la fecha sean las drogas de elección y uso frecuente en los zoológicos del país.
El éxito de la inoculación total de la droga está en la preparación correcta del dardo y en el sitio o lugar de impacto en el animal. En este sentido, el autor recomienda como primera opción el uso de agujas sin collar de 1,5 × 30 mm (20 gauge × 1¼ pulgada) y la masa muscular de los miembros traseros (muslos) en animales adultos. Las agujas simples causan menos trauma en los tejidos, aunque eventualmente puede no inyectar todo el fármaco, ya que no permanece fija en el animal; sin embargo, la piel gruesa de la zona ayuda a mantener el dardo en posición y el riego sanguíneo permite una rápida absorción. En comparación, las agujas con collar permanecen en el animal y aseguran la inyección total de fármaco; no obstante, si el animal no está inmovilizado apropiadamente y no puede ser manipulado, el dardo continuará en el animal y puede causar inconvenientes. En este estudio no se presentaron casos fatales.
El efecto inicial de la administración intramuscular de la mezcla ketamina-xilacina con una dosis total promedio de 343,64 ± 76,75 mg proporcionó tiempos de inducción satisfactorios de entre 16 ± 4,73 y 22,9 ± 13,72 min posinoculación, con buena relajación muscular. El rango de variaciones en la dosis efectiva se debe a las diferencias en el peso estimado para cada animal. El tiempo de inducción en este estudio es similar a los tiempos reportados para jaguares venezolanos en vida libre por Hoogesteijn y Boede (8) y mayor a lo reportado por Bharathidasan et al. (18) en India. En un estudio análogo realizado por Jiménez y Moreno (24) en animales de cinco especies de félidos, incluida P. onca, en tres zoológicos colombianos, se reportan intervalos generales de tiempo de inducción menores. Sin embargo, y considerando la altitud, las características ambientales, así como el protocolo de inmovilización en el que se administró por separado la xilacina y la ketamina, se puede señalar que la diferencia observada en el tiempo de inducción se encuentra dentro de lo esperado.
La aparición de los movimientos de la lengua acompañada del incremento en la salivación, arcadas y vómito, durante la fase inicial de la anestesia, fue suprimida una vez se adoptó la posición decúbito, y pudo ser controlada utilizando sulfato de atropina. El reflejo palpebral y del movimiento de la oreja pasado los 10 min fue más lento con algún cabeceo. La administración total de la dosis de ketamina en un lapso de 3 a 5 min abolió satisfactoriamente estos reflejos en forma suficiente para acercarse al animal sin complicaciones.
Debido a la variabilidad de los tiempos de inducción, el modelo lineal es un pobre predictor de la relación entre las variables dosis versus tiempo de inducción. De acuerdo con esto se puede afirmar que dosis bajas de la mezcla ketamina-xilacina dieron lugar a tiempos de inducción más largos; sin embargo, dosis más altas no mostraron un incremento substancial en la variable tiempo.
Aun cuando se obtuvieron diferencias significativas entre sexos para los parámetros fisiológicos de temperatura rectal, frecuencia cardíaca y frecuencia respiratoria durante el tiempo de recumbencia, estos se mantuvieron en valores promedios considerados como satisfactorios. Jiménez y Moreno (24) registran valores para estas constantes vitales dentro del rango considerado como normal para la especie, aunque reportan un mínimo de diez respiraciones por minuto, por debajo del mínimo reportado en el presente estudio. Se tienen como valores normales de temperatura rectal entre 37,0 y 39,5 °C, frecuencia cardíaca de 70 a 140 latidos/min, y una frecuencia respiratoria de 8 a 24 respiraciones/min (14).
Las pequeñas variaciones de temperatura pueden estar relacionadas con el estrés ocasionado por la captura, ya sea por correr, por la excitación y la agresividad previa a la administración de la droga o por la pérdida o transferencia de calor, bien sea por convección a través del suelo o a la temperatura del recinto en el momento de la captura, incluso temprano por la mañana, dependiendo del lugar de trabajo (tabla 1). Kreeger (9) reporta la aparición de arritmias con diversos protocolos de inmovilización. Sin embargo, en este estudio no se registraron arritmias con la dosis de ketamina-xilacina utilizadas, aunque sí se determinó variación en el ritmo cardíaco con un mínimo de 60,29 ± 23,84 hasta un máximo de 78,40 ± 28,65 latidos/min. Se sabe que los anestésicos disociativos y los sedantes no narcóticos son depresores respiratorios y sus efectos, en la mayoría de las especies, dependen de las dosis.
En el caso de este estudio no se presentó depresión respiratoria importante en ninguno de los jaguares después de la inyección de ketamina-xilacina. La respiración en general mantuvo un esquema de movimiento intercostal superficial al inicio, y movimientos respiratorios más profundos durante la recumbencia. Es posible que otros anestésicos inyectables puedan producir una depresión respiratoria severa en el jaguar; sin embargo, es necesario realizar estudios para esclarecerlo.
La duración de la inmovilización de jaguares con la combinación ketamina-xilacina fue variable y la recuperación completa fue rápida. El tiempo de recumbencia obtenido para ambos sexos presentó diferencias significativas en ambos casos (56,92 ± 32,02 min para machos y 68,10 ± 46,13 min para hembras). Jiménez y Moreno (24), por su parte, reportan un estimado de intervalos generales de tiempo de recumbencia de 45 a 60 min. Se puede señalar que la diferencia observada se encuentra dentro de lo esperado. En todos los jaguares el plano de sedación y anestesia alcanzado fue suficiente para realizar las maniobras requeridas, realizar traslados, pesaje, medición corporal, tatuajes, recolección de muestras (sangre, heces, orina, semen, biopsias), drenaje de hematomas o abscesos, tratamientos oftalmológicos, limpieza dental, lesiones podales, debridación y limpieza de tejido necrótico en heridas, tratamiento intravenoso o intramuscular, ecografías, radiografías, entre otros procedimientos poco invasivos.
Aun cuando la recuperación gradual de la anestesia a menudo es preferible en zoológicos, la recuperación rápida es más ventajosa, ya que reduce el riesgo de complicaciones posanestésicas. El uso de yohimbina como antagonista para la xilacina, sumado al hecho de que la ketamina es metabolizada con relativa rapidez, reduce de forma eficaz y rápida el tiempo de recuperación de los animales. La yohimbina actúa directamente en los receptores alfa-2 en el cerebro, desplazando y acelerando la excreción de las moléculas de xilacina, lo que permite que el animal despierte rápidamente. Todos los jaguares lograron reincorporarse entre los 6 y los 10 min después de la administración del antagonista, con poco riesgo de renarcotización.
Hematología y química sanguínea
Entre los 28 parámetros sanguíneos (13 hematológicos y 15 componentes químicos), tres presentaron diferencias estadísticamente significativas: el recuento de eosinófilos (P = 0,03), comparado con el valor publicado por ISIS (23), Gomes de Oliveira et al. (12) y Widmer et al. (17) respectivamente, así como las concentraciones de la enzima alanina-aminotransferasa (P = 0,00002) y la bilirrubina indirecta (P = 0,04), comparados con los valores publicados por ISIS (23) y Widmer et al. (17) respectivamente.
Con relación a la denominada serie roja se observan valores ligeramente altos en el recuento de eritrocitos, hematocrito, hemoglobina y volumen corpuscular medio (VCM), en comparación con los valores de referencia publicados por ISIS (23), Gomes de Oliveira et al. (12) y Widmer et al. (17), respectivamente. El incremento de forma simultánea en los tres primeros parámetros se denomina policitemia relativa, la cual aparece en casos de deshidratación o contracción esplénica. Este fenómeno puede ser explicado por el tiempo de privación de agua y alimento (ayuno) al que fueron sometidos los animales antes de la inmovilización química, sumado a la pérdida de agua mediante el jadeo generado por las condiciones climáticas de altitud, temperatura y humedad relativa de las localidades de muestreo (tabla 1) y al estrés que causa el primer impacto del dardo inmovilizador, respectivamente. En el caso particular del recuento de eritrocitos, Jiménez y Moreno (24) reportan valores de 9,11 ± 1,42 × 106/μL compatibles con una policitemia secundaria causada por el incremento natural en la producción de eritropoyetina, debido a deficiencia de oxígeno en la sangre, producto de una mayor exposición a grandes alturas, ya que los animales cautivos en su mayoría se encontraban entre los 1800 y los 2600 m de altura.
El incremento del VCM, es decir, en el tamaño del eritrocito, suele estar asociado con aumento de la actividad celular de la médula ósea o a deficiencias de los factores eritropoyéticos (25,26) en este caso. Esto puede ser en respuesta a posibles deficiencias de hierro en la dieta, en particular en aquellas localidades donde el suministro de carne blanca es mucho mayor que la carne roja, principal fuente de este mineral. Con respecto a la variación de la hemoglobina corpúscular media (HCM) y el valor ligeramente elevado de concentración de hemoglobina corpúscular media (CHCM) en comparación con los valores de referencia publicados por ISIS (23), Gomes de Oliveira et al. (12) y Widmer et al. (17), respectivamente, estas variaciones pueden ser consideradas como aceptables teniendo en cuenta las desviaciones reportadas y el hecho de que pueden deberse a alguno de los factores extrínsecos o no biológicos previamente señalados, y no a alteraciones propias de la concentración o la cantidad de hemoglobina en los eritrocitos.
Por su parte, la denominada serie blanca muestra valores en el recuento de leucocitos cercanos a lo reportado por ISIS (23) para jaguares en cautiverio. Al comparar este valor con lo señalado por Gomes de Oliveira et al. (12), se observa que los autores no reportan el número de neutrófilos segmentados, lo que produce un artefacto en la fórmula leucocitaria que puede ser en respuesta a algún factor extrínseco no determinado por ellos. Si se comparan los valores obtenidos en este estudio solo con el recuento de leucocitos reportado por Widmer et al. (17) sin analizar la fórmula leucocitaria completa, desde el punto de vista clínico, se estaría en presencia de una leucopenia; pero una vez revisados los demás recuentos celulares, se aprecia que Widmer et al. (17) señalan un incremento notable de neutrófilos segmentados o neutrofilia. La neutrofilia puede ser no inflamatoria relacionada con la liberación endógena de corticosteroides o inflamatoria donde existe una exigencia del tejido por neutrófilos, lo que estaría asociado a factores biológicos o intrínsecos (25,26). En consecuencia, los valores que se reportan en este trabajo correspondientes a neutrófilos segmentados y en banda pueden ser considerados como variaciones aceptables para jaguares en cautiverio.
En relación con linfocitos y monocitos, estas células son responsables de la respuesta inmunológica y de defensa celular, respectivamente. Los valores elevados de la cuenta linfocitaria (linfocitosis) indican que el incremento está asociado con estimulación antigénica en presencia de algún microorganismo, o es de tipo fisiológica vinculada al miedo, al estrés, a la excitación o a la manipulación, condiciones conocidas en felinos (25,26). Los trombocitos o plaquetas participan en la vía intrínseca y extrínseca de la coagulación sanguínea. Al comparar con los valores de referencia publicados, se aprecia una aproximación de los resultados de este estudio con lo indicado por Gomes de Oliveira et al. (12) y unos valores ligeramente mayores que ISIS (23) y Widmer et al. (17), respectivamente. Sin embargo, al observar las desviaciones correspondientes, estas variaciones pueden ser consideradas como aceptables.
Los resultados obtenidos en este estudio para eosinófilos indican valores superiores a los reportados previamente para jaguares en cautiverio (12,23) y en vida libre (17). Esta condición se denomina eosinofilia o incremento del número de eosinófilos circulantes en sangre. Los eosinófilos ayudan a controlar las reacciones alérgicas o de hipersensibilidad. Se encuentran en tejidos en los que abundan las células cebadas o mastocitos, como piel, pulmones, aparato gastrointestinal y tracto urinario, que desempeñan funciones de desactivación de la histamina, de fagocitosis y de detoxificación. La eosinofilia puede ser estimulada, entre otros, por procesos alérgicos, insuficiencia suprarrenal y parasitismo (25,26). Algunas de estas condiciones podrían haber estado presentes en los animales muestreados; no obstante, es difícil afirmarlo.
La concentración de las proteínas totales en sangre (albúmina y globulina) es el último aspecto para completar el recuento sanguíneo. Los valores altos indican deshidratación, mientras que los bajos se asocian a parasitismo gastrointestinal, fallo renal y hepático o en la alimentación (25,26). La concentración de albúmina resultante en este estudio comparada con lo reportado por ISIS (23) y Widmer et al. (17) presenta un valor algo mayor que puede asociarse a un cuadro de deshidratación leve, compatible con la policitemia relativa señalada previamente. Del mismo modo, permite especular que quizá la información publicada por Widmer et al. (17) para albúmina se corresponde con alguno de los fallos antes mencionados.
Los componentes químicos de la sangre (tabla 6) son indicadores directos o indirectos del funcionamiento de órganos o sistemas y son una ayuda invalorable en la identificación, diagnóstico y pronóstico de una enfermedad. Respecto a la glucosa, fuente principal de la energía del cuerpo, principalmente del sistema nervioso central, sus concentraciones en sangre dependen sobre todo de la ingesta de alimento, de la gluconeogenesis y la glucogenolisis hepática, de la excreción o absorción renal y del efecto de la insulina secretada por el páncreas (25,26).
El nitrógeno ureico en sangre (BUN) varía directamente con el consumo de proteínas e inversamente con la tasa de excreción renal de urea (25,26). Los triglicéridos son la principal forma en la cual se almacenan los lípidos en el tejido animal; su variabilidad depende completamente de la dieta. Al comparar los resultados de este estudio con los valores publicados por ISIS (23) y Widmer et al. (17), respectivamente, se observa una disminución que podría deberse al ayuno o a las deficiencias en el consumo de carne roja. Las enzimas aspartato aminotransferasa (AST) y creatinina quinasa (CK) se encuentran en tejido músculo esquelético, cardiaco y en el hígado; son de importancia clínica cuando se encuentran elevadas. Por su parte, Widmer et al. (17) justifican los altos valores reportados de BUN y CK como respuesta a la ingesta reciente de alimentos ricos en proteína; sin embargo, esta situación puede explicar por sí sola la incidencia del BUN, mas no la de la CK, la cual es un indicador directo de daño muscular, lo que permite especular que la información publicada para CK se corresponde con esta condición o puede ser una alteración del resultado que involucra alguno de los factores no biológicos o extrínsecos previamente señalados.
La creatinina es un compuesto de desecho creado de la degradación de la creatina muscular y se excreta normalmente por la orina, por lo que puede usarse como índice del funcionamiento renal. Los resultados obtenidos en este estudio se aproximan a lo indicado por ISIS (23). Al comparar con los valores de referencia publicados por Gomes de Oliveira et al. (12), es posible apreciar un incremento en la concentración en sangre. No se puede afirmar que la diferencia observada entre animales en cautiverio y en vida libre se deba a una insuficiencia renal, ya que podría ser consecuencia de una actividad muscular intensa previa o al traumatismo muscular provocado por el impacto del dardo. El colesterol es un lípido presente en los tejidos corporales especialmente en el hígado, la corteza suprarrenal, las gónadas y el epitelio intestinal. El incremento o hipercolesterolemia se asocia con frecuencia a hipotiroidismo, enfermedades hepáticas, diabetes e hiperadrenocorticismo, entre otras. Al comparar los resultados obtenidos en este estudio con los valores de referencia publicados por ISIS (23), se observa que la concentración de colesterol en sangre es ligeramente mayor, pero muy superior a lo reportado por Gomes de Oliveira et al. (12) en animales de vida libre. Esta diferencia podría ser atribuible a un artificio provocado por una dieta rica en grasa, a fallo en el cumplimiento del ayuno o a hiperadrenocorticismo secundario generado por el estrés del cautiverio.
La enzima alanina aminotransferasa (ALT) es específica del hígado en cánidos y félidos. Al comparar los resultados obtenidos en este estudio con los valores de referencia publicados por ISIS (23), se observa que la concentración de ALT en sangre es ligeramente mayor, pero muy superior a lo reportado por Gomes de Oliveira et al. (12) en animales de vida libre. El incremento en la concentración en sangre podría indicar algún tipo de trastorno gastrointestinal o un proceso inflamatorio.
La fosfatasa alcalina (FA) es una enzima que se encuentra en mayor concentración en hígado, mucosa gastrointestinal, corteza renal y medula ósea. Se observa que la concentración en sangre de FA en este estudio es superior a los valores de referencia publicados por ISIS (23). El incremento en la concentración o actividad en sangre de esta enzima hepática podría estar asociado a lipidosis hepática provocada por una dieta alta en grasa o a la presencia de FA ósea, procedente de los osteoblastos de animales jóvenes en crecimiento.
La enzima lactato deshidrogenasa (LDH) se encuentra distribuida ampliamente en todo el cuerpo, aunque no es específica de ningún órgano. Su incremento está asociado a hemólisis, ejercicio intenso, gestación y necrosis celular, y se ha observado en algunos tipos de neoplasias. Al comparar los resultados obtenidos en este estudio con los valores de referencia publicados por ISIS (23), se observa que la concentración de LDH en sangre es menor, pero ligeramente mayor a lo reportado por Gomes de Oliveira et al. (12) en animales de vida libre. El incremento en la concentración o actividad en sangre de esta enzima podría sugerir la presencia de hembras en gestación o a la reacción de hiperactividad inicial posterior al impacto del dardo en el cuerpo.
La bilirrubina es un producto final de la descomposición de la hemoglobina. En los mamíferos la mayor parte de esta se metaboliza en el hígado. Al comparar los resultados obtenidos en este estudio con los valores de referencia publicados por ISIS (23) se observa que la concentración en sangre de bilirrubina total, directa e indirecta en sangre es ligeramente mayor, pero menor a lo reportado por Gomes de Oliveira et al. (12) en animales de vida libre. El aumento de la bilirrubina sérica podría estar asociado a diferentes grados de hemolisis en las muestras de sangre obtenidas o a algún tipo de lesión hepática. En todos los casos, los valores bajos no tienen importancia clínica (25,26).
Los valores observados en este estudio presentan ligeras diferencias numéricas con lo señalado por ISIS (23) y Widmer et al. (17), respectivamente. Solo se observan variaciones estadísticamente significativas en la ALT y en la bilirrubina indirecta. Sin embargo, las desviaciones correspondientes a estas variaciones pueden ser consideradas como aceptables. Las diferencias observadas en las medias de algunos de los parámetros obtenidos podrían estar influenciadas con factores extrínsecos e intrínsecos.
Aun cuando los datos de hematología y química sanguínea reportados en este estudio corresponden con un tamaño de muestra relativamente pequeño y provienen de ejemplares mantenidos en cautiverio, se resalta su importancia, ya que constituyen el primer reporte acumulativo para P. onca en Venezuela. Sin embargo, es de señalar que los datos aportados por Gomes de Oliveira et al. (12) se muestran próximos a los indicados en este estudio, probablemente por las coincidencias en las condiciones o sistemas de manejo de los ejemplares trabajados por ellos. Por otra parte, el ISIS reporta parámetros hematológicos y químicos sanguíneos que son una recopilación de datos provenientes de varios zoológicos de Estados Unidos, los cuales combinan ambos sexos y todas las edades, obtenidos en diferentes estaciones, de diferentes regiones de ese país, con programas de alimentación que difieren de las condiciones locales.
CONCLUSIONES
Las dosis indicadas en este estudio proporcionaron anestesia adecuada y resultó ser un método de captura seguro y apropiado en jaguares en condiciones de cautiverio. De los 28 parámetros sanguíneos, solo el recuento de eosinófilos y las concentraciones de la ALT y la bilirrubina indirecta presentaron diferencias estadísticamente significativas, comparadas con los valores publicados para animales en cautiverio y en vida libre.
















