Introducción
Los parásitos sanguíneos o hemotrópicos son organismos que pueden ser transmitidos a los animales domésticos por vectores mecánicos y biológicos. Su presencia en los animales domésticos produce cuadros hemáticos, ya que tienen afinidad por el torrente sanguíneo, lo que trae un efecto negativo en la salud animal, y produce grandes pérdidas en las explotaciones bovinas (1). Estas se reflejan principalmente en deficiencias en la ganancia de peso, reducción de la producción láctea, altas inversiones en productos farmacéuticos, atención veterinaria y mortalidad. Este constituye un problema grave en más del 70 % de los países en desarrollo (2,3), pues se genera un detrimento económico que atenta contra los productores y la seguridad agroalimentaria.
La anaplasmosis, o fiebre de Texas, es una enfermedad causada por rickettsias del género Anaplasma (Anaplasma marginale y Anaplasma centrale). Se caracteriza por la presencia de fiebre, que puede permanecer elevada o fluctuar en periodos irregulares; anemia; ictericia; constipación, principalmente a nivel del omaso; anorexia; disminución de la producción; aumento de tono cardíaco, y, en ocasiones, abortos (4,5,6). Los rebaños de Venezuela, por ser un país ubicado en el trópico, están expuestos a los problemas que se puedan presentar por la presencia de este hemotrópico (7). Esta enfermedad se transmite a través de vectores hematófagos, tanto de manera biológica y mecánica como iatrogénica. Es importante destacar que la fuente infecciosa de este agente infeccioso la constituye casi siempre un animal infectado. Una vez que el animal se infecta puede permanecer como portador por años, e incluso por vida en algunos casos, aun cuando esta rickettsia no pueda ser demostrable en la sangre (8,9).
Durante los últimos años ha existido un gran progreso en el conocimiento del sistema inmune de los bovinos y su funcionamiento. Se sabe que los bovinos difieren del humano y de otros animales de laboratorio en la forma de transferencia de inmunidad materna, en el contenido y en la composición de inmunoglobulinas en calostro y leche. Por su estructura placentaria, no hay paso de las inmunoglobulinas a través de la placenta en la gestación (10).
La detección de este patógeno se hace a través del diagnóstico clínico, métodos directos e indirectos. Uno de los métodos directos es el frotis sanguíneo la identificación directa de Anaplasma marginale en la sangre periférica de animales infectados. Existe un grupo de técnicas de tipo indirecto que permiten la detección de anticuerpos específicos circulantes, para la identificación de bovinos portadores asintomáticos. Estas últimas son técnicas serológicas y se aplican a grupos de animales. Todas estas pruebas poseen fundamento inmunológico. Las más comunes utilizadas en la actualidad son: inmunofluorescencia indirecta (IFI) y el ensayo inmunoenzimático (prueba Elisa) (11).
El ganado debe ser protegido contra enfermedades infecciosas para lograr su óptimo rendimiento. Por esta razón, en las explotaciones bovinas debe tenerse muy presente en qué momento el animal está mayormente expuesto tanto a contraer Anaplasma como a padecer la enfermedad producida por esta y en qué momento el sistema inmune comienza a crear anticuerpos para poder defenderse; así, el productor puede tener en cuenta un mayor cuidado desde el nacimiento de la cría para combatir esta enfermedad. El desarrollo de vacunas efectivas y eficientes puede ser una de las estrategias más viables. En este sentido, nace la interrogante por el momento en que el bovino comienza a desarrollar esa inmunidad contra esta rickettsia y cómo se prolonga en su primera fase de crecimiento, para poder enfrentar con éxito este patógeno. En este estudio, se planteó como objetivo principal evaluar la dinámica de anticuerpos e infección activa de Anaplasma marginale en becerras de una unidad de producción del municipio Crespo del estado de Lara.
Materiales y métodos
Diseño de la investigación
El presente estudio se clasificó como de campo no experimental y longitudinal, ya que se trató de una recolección de datos a través del tiempo en puntos o periodos, para hacer inferencias respecto al cambio, sus determinantes y consecuencias (12).
Unidad de producción
El trabajo se realizó en una finca de ganado lechero ubicada en las afueras de la población de Duaca, en la carretera vía Los Chispes km 1, en el municipio Crespo del estado de Lara, Venezuela, latitud 10°16’ N, longitud 69°09’ O, altitud de 735 m s. n. m. con una precipitación media anual de 755,6 mm, temperatura media de 24 °C, una humedad relativa media de 75 %, y clasificada como una zona climática de semiárido templado (13).
Población y muestra
La población está representada por el número total de becerras en la explotación. Se tomó como criterio de inclusión para la selección de la muestra y el desarrollo del proyecto a las becerras con una edad de 0 a 7 días de nacidas en un periodo de 7 meses. De este criterio resultaron 35 becerras de la misma raza y edad.
Toma de muestras
Se realizaron con repeticiones cada 15 días hasta los primeros 5 meses de edad para un total de 12 muestras por animal a las 35 becerras durante todo el estudio (septiembre-abril). Las muestras consistieron en la extracción de 3 ml de sangre directamente de la vena yugular en tubos estériles Vacutainer® con anticoagulante etilendiaminotetracético (EDTA) y con ayuda de agujas estériles (Vacutainer Becton Dickinson), previa desinfección de la zona con alcohol isopropílico. Igualmente, se extrajo 3 ml de sangre de cada bovino, que fueron colocados en tubos estériles sin anticoagulante a fin de separar el suero sanguíneo, previa la realización del examen clínico.
Diagnóstico de la ocurrencia de infección activa de Anaplasma marginale en becerras mediante el examen microscópico de frotis de capa blanca
Se tomó una cantidad de sangre del tubo Vacutainer® con anticoagulante, en un tubo de microhematocrito y se centrifugó para separar los elementos formes de la sangre. Posteriormente se depositó una gota que contuviera plasma, glóbulos rojos y células blancas en un portaobjeto, y se realizó un extendido de sangre de forma rápida y firme; luego se secó al aire y posteriormente fue coloreada con Hemacolor®, para su posterior observación a través de microscopio óptico con objetivo de 100 y ocular de 10. Se examinaron 1000 a 5000 eritrocitos escogidos al azar en el frotis; esta técnica se realizó con la finalidad de diagnosticar parasitosis bajas, ya que permite concentrar las células de modo que las posibilidades de diagnóstico de infecciones activas a Anaplasma aumenten (14).
Cuantificación de la dinámica de anticuerpos anti-Anaplasma marginale mediante diluciones, con la prueba de inmunofluorescencia indirecta (IFI)
Esta cuantificación se realizó mediante diluciones a través la técnica de inmunofluorescencia (IFI). El suero que se extrajo de los tubos Vacutaniner® sin anticoagulante se utilizó para la detección de los anticuerpos contra A. marginale. La técnica de IFI se aplicó según el método descrito Basalo et al. (15), y se utilizaron como antígeno eritrocitos infectados con Anaplasma marginale. Las muestras fueron observadas en un cuarto oscuro. Para esto, se utilizó un microscopio de fluorescencia (Olympus BX51, Japón) con lámpara de mercurio. Los sueros positivos fueron aquellos en donde la Anaplasma presentó fluorescencia de color verde brillante, mientras lo sueros negativos no exhibieron fluorescencia. La determinación del hematocrito (Hm) se realizó a partir de las muestras de sangre con anticoagulante inmediatamente después de la llegada al laboratorio. Como indicadores del grado de anemia, el método empleado fue la técnica del microhematocrito (16). Con los microcapilares centrifugados se procedió a medir a través de la escala de lectura el porcentaje de Hm para cada bovino.
Resultados y discusión
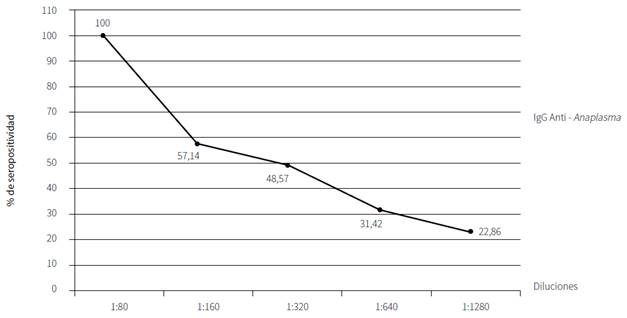
En cuanto a la dinámica de anticuerpos IgG (figuras 1 y 2), en la dilución 1:80 se observó un 100 % de animales positivos a la presencia de anticuerpos contra Anaplasma marginale; en la dilución 1:160, se presentó un 57,14 %; en la dilución 1:320, se presentó un 48,57 %; en la dilución 1:640, se presentó un 31,42 %; y en la dilución 1:1280, se presentó un 22,86 %. Los animales restantes en cada dilución resultaron negativos.
Fuente: elaboración propia
Figura 1 Dinámica de anticuerpos o porcentaje de bovinos seropositivos a la presencia de IgG anti-Anaplasma en las diluciones usadas por IFI
Fuente: elaboración propia
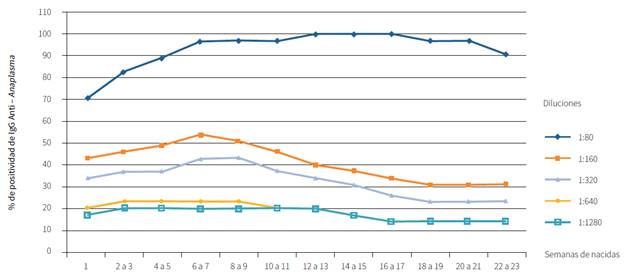
Figura 2 Porcentajes de bovinos positivos a la presencia de IgG anti-Anaplasma en todas las diluciones del IFI durante las 23 semanas.
Geográficamente, una zona se considera epidemiológicamente estable a anaplasmosis, cuando el 75 % de los bovinos en edades de 3 a 9 meses son seropositivos a la presencia de anticuerpos contra Anaplasma spp. (17). Los resultados obtenidos en este estudio permiten categorizar a esta unidad de producción como una zona de estabilidad enzoótica para A. marginale. Esta condición favorece mantener el equilibrio entre el parásito y los animales, condicionante para que no se presente la enfermedad en forma aguda en las becerras que serán el reemplazo de esta explotación. En cuanto a la comparación de las diferentes diluciones que se les realizaron a los sueros sanguíneos, estadísticamente la prueba de correlación de Pearson encontró diferencias significativas con un 95 % de confianza (p < 0,05), a excepción de la dilución 1:80.
Estos anticuerpos pudieron ser transferidos de la madre a través del calostro; en este caso, los anticuerpos se mantienen hasta 30 días de edad aproximadamente y luego declinan, lo que proporciona una inmunidad específica pasiva de manera natural. Los anticuerpos presentes en las becerras también pueden deberse a la respuesta inmune por infección activa ante la bacteria, bien sea que haya ocurrido transmisión transplacentaria de la bacteria o a través del vector. Estos resultados son muy similares a los reportados por James et al. (18), donde se demostró que los anticuerpos declinan aproximadamente a los 90 a 120 de edad. En anaplasmosis bovina los niveles de anticuerpos se elevan durante la etapa temprana y luego declinan durante el estado crónico de la infección; por lo tanto, los becerros que nacen en área endémicas son protegidos por los anticuerpos calostrales durante aproximadamente 2 a 4 meses de vida (19). Algunos estudios han demostrado que generalmente los becerros se infectan entre los 4 a 5 meses de edad con una buena respuesta inmunológica, que puede durar aproximadamente hasta 4 años (19).
Estos anticuerpos proporcionan una inmunidad específica activa de manera natural. La respuesta humoral está altamente relacionada con el desarrollo de resistencia. Sin embargo, existen antígenos claves de A. marginale que estimulan la producción de anticuerpos neutralizantes, por lo que la respuesta humoral juega un papel sumamente importante en el desarrollo de la inmunidad contra la anaplasmosis (20,21).
Los resultados encontrados en este estudio coinciden con los reportados por Guillen et al. (22), en cuyo estudio reportan seroprevalencia de 50,56 % de animales con reacción positiva, y con los de Díaz et al. (23), en donde se observó un 95,4 % de anticuerpos para A. marginale. Estudios realizados en el estado Zulia reflejan un alto porcentaje de positividad y advierten sobre el riesgo potencial que las infecciones subclínicas por A. marginale pudieran representar para los rebaños en producción, al demostrar la circulación del agente causal de la anaplasmosis en animales aparentemente sanos (24).
Los resultados que presenta esta investigación tienen concordancia con otra investigación realizada en Argentina en la provincia de Corrientes. Estudios demuestran seroprevalencia para A. marginale (26) entre un 97,5 % y un 100 %. Estos resultados también concuerdan con los reportados de Bella Vista, donde se encontró una seroprevalencia del 86,5 % (27), así como los reportados por Eleizalde (25), en una finca del estado de Guárico, donde se encontró una seroprevalencia de 97 %. Más adelante, Cipolini et al. (26) evaluaron la dinámica de anticuerpos contra A. marginale durante los primeros 6 meses de vida en 40 terneros, donde el índice más bajo reportado fue 58,94 % de positividad y el índice más alto fue de 75 % de positividad. Estos resultados son muy similares a los reportados en este estudio.
Por otra parte, los resultados que se observaron en el presente estudio no concuerdan con los reportados en Paraíba, Brasil, donde se evaluó la seroprevalencia de A. marginale en 509 vacas, con la técnica de diagnóstico indirecto inmunofluorescencia cuyo reporte dejó valores medios de seroprevalencia de 15,0 % (27); dicha diferencia pudiera deberse a que trabajaron con animales adultos. Por su parte, Barbosa et al. (28) reportaron una seroprevalencia de 25 % en 800 búfalos al norte de este país, resultados que tampoco concuerdan con los reportados en este estudio; dichas diferencias pueden atribuirse a la especie estudiada.
En la provincia Galápago se reportan resultados similares a los encontrados en este estudio, con seroprevalencia de 64,1 % en 184 bovinos adultos (29). En otra investigación realizada en búfalos por Lira-Amaya et al. (30), se reporta seroprevalencia de hasta un 25,4 % de positividad a Anaplasma marginale en 233 animales en Veracruz, México, resultados que difieren con los de esta investigación
Asociación del porcentaje del hematocrito, la infección activa de Anaplasma marginale con los niveles de anticuerpos detectados por IFI
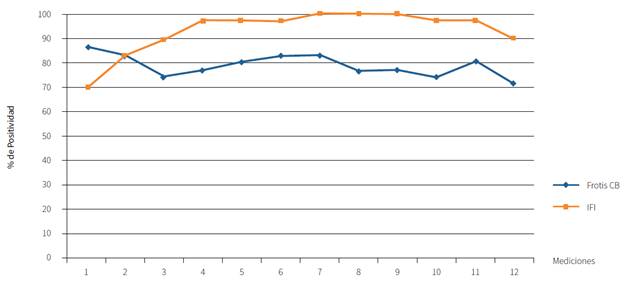
Para comparar la eficacia de las técnicas diagnósticas con IFI y frotis de CB, se realizó el método estadístico de X2. Se encontró que en todas las mediciones se comportaron igual salvo en la segunda medición, donde hubo diferencia significativa (p < 0,05). En el resto de las mediciones, la prueba no encontró diferencias porque la coincidencia entre ambas técnicas es alta. Se puede afirmar que ambas coinciden en el diagnóstico de la enfermedad.
En la presente investigación se reporta un alto porcentaje de muestras positivas al diagnóstico directo mediante el frotis de capa blanca (79,05 %) y un porcentaje aún mayor de positividad a la serología mediante el diagnóstico indirecto a través de la inmunofluorescencia indirecta; 100 % para la dilución 1:80; 57,14 % para la dilución 1:160; 48,57 % para la dilución 1:320; 31,42 % para la dilución 1:640; y 22,86 % para la dilución 1:1280 (figura 3). No obstante, no se evidencia sintomatología clínica ya que los animales jóvenes son resistentes a la enfermedad y por esa razón no hay disminución del porcentaje de hematocrito.
Fuente: elaboración propia
Figura 3 Comparación de las frecuencias promedio de infección activa y respuesta humoral.
Los altos valores obtenidos con las pruebas serológicas son indicativos de los animales con memoria inmunológica (anticuerpos específicos) por la exposición a los patógenos, lo que quiere decir que no necesariamente permanecían infectados al momento del muestreo (31). Asimismo, se confirma la capacidad de la especie bovina de crear un estado de premunición ante la anaplasmosis a edades tempranas y de mantenerla por un periodo prolongado, lo que le permite, en estas condiciones tropicales, desarrollar una inmunidad innata o adquirida cuando se expone a la presencia del vector y el agente infeccioso. El ganado puede contraer la enfermedad a cualquier edad; sin embargo, la mortalidad y severidad aumentan con esta. Los terneros de menos de 6 meses exhiben una resistencia natural, pues, aun cuando se infectan, raramente exhiben los signos clínicos (32). El ganado entre seis meses y tres años comienza a incrementar el padecimiento y ocurren más muertes con el avance de la edad. En general, la parasitemia y la anemia son menos graves en los animales jóvenes, posiblemente debido a que la respuesta inmune celular es mayor por la competencia del timo, el sistema hematopoyético es más activo y por el papel más activo de la hemoglobina fetal (20).
La A. marginale induce en el organismo respuesta humoral y celular; sin embargo, los anticuerpos al parecer juegan un papel menos importante (11). Los animales infectados desarrollan anticuerpos, fundamentalmente del tipo IgG e IgM, y exhiben durante las últimas etapas de la infección aguda una respuesta mediada por células, en la que aparecen los macrófagos activados segregando IFN-γ, que estimula fuertemente la proliferación de linfocitos de sangre periférica (33,34). La respuesta celular se correlaciona parcialmente con el desarrollo de la inmunidad. En contraste, la respuesta humoral se correlaciona pobremente con el desarrollo de resistencia. Sin embargo, existen antígenos claves de A. marginale que estimulan la producción de anticuerpos neutralizantes, por lo que la respuesta humoral juega algún papel en el desarrollo de la inmunidad contra la A. marginale. Los bovinos jóvenes tienen un nivel de resistencia natural, pues desarrollan infección y una inmunidad adecuada (inmunidad coinfecciosa) al alcanzar la edad adulta son resistentes a la presentación clínica de la enfermedad (20,21).
Conclusiones
Las 35 becerras presentaron infección activa de Anaplasma marginale, pero en ningún momento se presentó sintomatología clínica; por lo tanto, los animales estudiados mantienen una inmunización exitosa contra Anaplasma marginale, o estado de premunición. Esto confirma la capacidad de la especie bovina de crear dicho estado ante la anaplasmosis a edades tempranas y mantenerla por un periodo prolongado. El estado de premunición permite que los animales mantengan el hematocrito en valores normales y los valores obtenidos con las pruebas serológicas son indicativos de animales con memoria inmunológica, lo que quiere decir que no necesariamente permanecían infectados al momento del muestreo. Las becerras mantienen seropositividad mayor al 75 %; esto le permite a la unidad de producción encontrarse en estabilidad enzoótica para anaplasmosis.















